一种纤维蛋白溶解酶及其制备方法和应用
1.本发明属于蛋白酶制剂领域,具体涉及一种纤维蛋白溶解酶及其制备方法和应用。
背景技术:
2.血栓是血流在心血管系统血管内面剥落处或修补处的表面所形成的小块,血管内血栓形成是心脑血管疾病发病的一个主要原因。在可变的流体依赖型(variable flow dependent patterns)中,血栓由不溶性纤维蛋白,沉积的血小板,积聚的白细胞和陷入的红细胞组成。心血管内膜损伤、血流改变、血液性质改变都有可能造成血栓的形成。
3.目前针对血栓的治疗主要依靠抗血栓药,抗血栓药可分为抗凝血药、抗血小板聚集药和溶血栓药三大类,其中溶血栓药物可用于治疗急性血栓栓塞性疾病。第一代的溶栓药链激酶(sk)和尿激酶(uk)至今仍然是国内外使用最广泛的品种,其溶栓原理为凝血中形成的纤维蛋白,经纤维蛋白溶解酶作用从精氨酸
‑
赖氨酸键上分解成可溶性产物,使血栓溶解。纤维蛋白溶解酶的研究对于开发新的溶栓药物十分必要。
4.中国专利200510094753.4中公开了一种纤维蛋白溶解酶生产菌及生产纤维蛋白溶解酶的方法。该发明从发酵食品虾酱中筛选出一种能生产具有溶血栓能力酶的菌株并提供了用该菌株生产纤维蛋白溶解酶的方法,其育种工作量小,费用低,安全性能可靠,可以进行液体发酵生产,成本低,可用于大规模生产。发酵产品无毒,可以直接制成胶囊、冲剂、口服液或口服含片,或作为功能性食品配料用于保健食品或普通食品中。其酶活可达588.4u/ml以上,有进一步优化的空间。
5.中国专利201110054330.5中公开了一种编码纤维蛋白溶解酶的cdna序列和氨基酸序列及其应用。该发明以单环刺螠总rna为模板,克隆得到了单环刺螠纤维蛋白溶解酶基因全长cdna序列。由该纤维蛋白溶解酶基因的cdna原始编码序列,翻译得到单环刺螠纤维蛋白溶解酶的氨基酸序列。单环刺螠纤维蛋白溶解酶基因的cdna序列,可以通过构建不同的重组质粒载体,构建如大肠杆菌或酵母菌等不同受体的纤维蛋白溶解酶基因工程菌,使之在基因工程菌中进行表达,从而制备纤维蛋白溶解酶。制备的纤维蛋白溶解酶可应用于制备治疗心脑血管疾病的抗凝血药物或溶解血栓药物,具有很好的研究开发前景。但其体内作用效果不明确,且分离纯化方法较为复杂。
技术实现要素:
6.为了解决上述问题,本发明提供了一种纤维蛋白溶解酶。本发明提供的纤维蛋白酶制备方法简单,得到的纤维蛋白酶酶活性高,且在体内和体外均有较好的溶栓效果,并有很好的体外抗凝效果。
7.一方面,本发明提供了一种纤维蛋白溶解酶。
8.所述的纤维蛋白溶解酶的氨基酸序列为seq id no.1。
9.所述的纤维蛋白溶解酶的核苷酸编码序列为seq id no.2。
10.所述的纤维蛋白溶解酶包括前导肽和成熟肽两部分。
11.所述的前导肽部分为seq id no.5。
12.另一方面,本发明提供了一种纤维蛋白溶解酶的制备方法。
13.所述的制备方法包括以下步骤:(1)根据seq id no.2的序列进行包含前导肽和成熟肽部分扩增引物的设计并合成引物;(2)提取蛹虫草rna并进行反转录获得cdna;(3)以步骤(2)cdna为模板,使用步骤(1)得到的引物进行扩增;(4)将步骤(3)得到的扩增产物插入表达载体后转染细胞;(5)对步骤(4)获得的细胞进行培养,培养物分离纯化后即可获得纤维蛋白溶解酶。
14.优选地,所述的步骤(1)中的引物序列包括正向引物seq id no.3和反向引物seq id no.4。
15.所述的步骤(5)中的分离纯化包括以下步骤:a、培养得到的细胞超声破碎提取机进行破壁,离心取上清,4℃,10000rpm离心20min;b、镍柱亲和层析纯化得到纤维蛋白溶解酶:上样预先平衡好的ni
‑
nta(5ml)柱,流速5ml/min;c、上样结束继续冲洗20个柱体积,之后利用洗脱缓冲液线性洗脱10个柱体积;利用自动收集器进行收集,根据出峰位置进行酶活检测及电泳检测。
16.所述的步骤(4)中的表达载体包括原核表达载体或真核表达载体;所述的原核表达载体包括但不限于peasy
‑
blunt e2、pet
‑
5a(+);所述的真核表达载体包括但不限于pvax1、pyes3。
17.所述的步骤(4)中的转染用细胞包括但不限于大肠杆菌bl21(de3)、dh5α、hek293或293t。
18.再一方面,本发明提供了一种生物学载体。
19.所述的生物学载体可以是表达载体,所述的表达载体中包括前述的核苷酸编码序列。
20.所述的生物学载体还可以是细胞,所述的细胞中包括前述表达载体。
21.又一方面,本发明提供了前述的纤维蛋白溶解酶和/或前述的核苷酸编码序列和/或前述的制备方法和/或前述的生物学载体在制备溶栓药物和/或抗凝药物中的应用。
22.所述的药物包括但不限于注射液,口服药物。
23.所述的注射液中纤维蛋白溶解酶的含量为0.15mg/ml
‑
0.45mg/ml。
24.所述的纤维蛋白酶作为药物的成分在施用时的用量为0
‑
3mg/kg体重。
25.又一方面,本发明提供了一种溶栓药物。
26.所述的溶栓药物中包括前述的纤维蛋白溶解酶和/或前述的生物学载体。
27.所述的溶栓药物包括但不限于注射液,口服药物。
28.所述的注射液中纤维蛋白溶解酶的含量为0.15mg/ml
‑
0.45mg/ml。
29.所述的药物中还包括其他药学上可接受的载体。
30.又一方面,本发明提供了一种抗凝药物。
31.所述的抗凝药物中包括前述的纤维蛋白溶解酶和/或前述的生物学载体。
32.所述的抗凝药物包括但不限于注射液,口服药物。
33.注射液中纤维蛋白溶解酶的含量为0.15mg/ml
‑
0.45mg/ml。
34.所述的药物中还包括其他药学上可接受的载体。
35.本发明的有益效果:1、本发明提供的纤维蛋白溶解酶体外和体内的溶栓率更高,溶栓效果更好。中国专利201910170774 .1提供的一种纤维蛋白溶解酶体外溶栓效果在24h后为40%以上,体内溶栓效果单位酶活溶栓率83
‑
289 u/cm;中国专利201110054330.5提供的一种纤维蛋白溶解酶体外3h溶栓率76.4%;本申请提供的纤维蛋白溶解酶体外3h溶栓率在80%以上,体内溶栓效果单位酶活溶栓率62
‑
135.6 u/cm。
36.2、本发明提供的纤维蛋白酶制备方法简单,适于大量生产,成品表达量高,且酶活高。
37.3、本发明提供的纤维蛋白酶具有较好的体外抗凝效果。
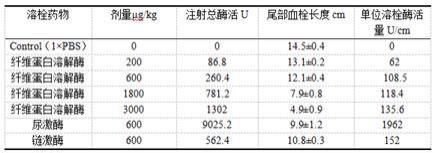
附图说明
38.图1为不同类型纤维蛋白溶解酶的体外溶栓率。
39.图2为体外抗凝血活性的检测实验结果。
具体实施方式
40.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
41.实施例1一种纤维蛋白酶的制备方法1、载体构建(1)pcr扩增seq id no.2:扩增正向引物序列为seq id no.3,反向序列为seq id no.4。模板为提取蛹虫草rna后逆转录得到的cdna。其中蛹虫草保藏号为cgmcc 3.14242;rna提取试剂盒购自天根生化科技(北京)有限公司,货号为dp430;逆转录试剂盒购自takara,货号为rr036a。扩增程序为:95℃,30s;94℃,30s,55℃,30s,72℃,90s,35cycles;72度5min。
42.(2)连接转化:pcr产物与peasy
‑
blunt e2载体进行连接,peasy
‑
blunt e2载体购自北京全式金生物技术有限公司,货号为ce211,反应温度25℃,反应时长5min,连接后,转入大肠杆菌bl21(de3),转化后提取质粒测序验证。
43.(3)细胞培养:对步骤(2)获得的转化后大肠杆菌细胞进行培养,培养条件为:含氨苄(50μg/ml)的lb液体培养基,摇瓶过夜。得到的培养物以5%接种量接种至相同条件继续培养,并监测菌液od
600
为0.1
‑
1时加入25μg/ml的iptg进行诱导。继续培养20h。
44.(4)分离提纯:培养得到的细胞超声破碎提取机进行破壁,离心取上清,4℃,10000rpm离心20min。镍柱亲和层析纯化得到纤维蛋白溶解酶:上样预先平衡好的ni
‑
nta
(5ml)柱,流速5ml/min。上样结束继续冲洗20个柱体积,之后利用洗脱缓冲液(50mm nah2po4,300mm nacl,10mm tris,500mm咪唑,ph8.0)线性洗脱10个柱体积。利用自动收集器进行收集,每管收集2ml,根据出峰位置进行酶活检测及电泳检测。
45.(5)纤溶酶酶活的测定方法:纤维蛋白平板的制作:称取0.02g纤维蛋白原(购自上海源叶生物科技有限公司,货号为s12023)用5 ml的1
×
pbs溶解后在45 ℃水浴中保温15 min,取10 ml降温至45 ℃左右的0.5 %琼脂糖溶液及50 u凝血酶(购自上海源叶生物科技有限公司,货号为s10117)溶液与纤维蛋白原溶液混合(所有溶液均用0.01 m pbs,ph7.4配制),迅速倒平板,室温放置待其凝固后放入4℃冰箱备用。
46.尿激酶标准曲线的制作:以1000、750、500、250、125、100、50 u/ml的尿激酶为标准,测定时,用内径6 mm打孔器在纤维蛋白平板上打孔,每孔注入20μl酶液,37℃培养22 h。测量透明圈直径,以透明圈面积对数lg(cm2)为x轴,纤溶酶活对数lg(u/ml)为y轴作图,得标准曲线。待测液37℃孵育22h后测定直径代入方程即为纤溶酶活力。
47.最终优化后的纤维蛋白溶解酶表达量为0.42g/l,单位酶活2900u/ml。
48.实施例2一种纤维蛋白酶的溶栓实验本实施例对实施例1获得的纤维蛋白溶解酶进行体外溶栓活性的测定,具体方法和步骤如下:健康sd大鼠(购自北京维通利华公司)取心脏血,分装每管0.6ml,离心管空管重记为m1。血液自然放置凝固后,3000rpm离心10min去除上清血清,用滤纸吸干液体,称取剩余血块及离心管质量,记为m2。
49.按照以下分组进行实验,每组3个平行:(1)1
×
pbs缓冲液200μl;(2)0.15g/l的尿激酶200μl;(3)0.15g/l的链激酶200μl;(4)0.15g/l纤维蛋白溶解酶200μl;(5)0.45g/l纤维蛋白溶解酶200μl。
50.其中,尿激酶购自上海源叶生物科技有限公司,货号为s10176;链激酶购自美国sigma
‑
aldrich公司,货号为s3134。
51.在37℃分别孵育3h,6h,9h,12h,24h后微型离心机简短离心取出上清到另一个干净的离心管中,称取剩余血块质量及空管质量,记为m3。称取完毕后再将液体重新加入血块中继续孵育。最后血块溶解率按照下式进行计算:血栓溶解率(%)=(m2
‑
m3)/(m2
‑
m1)
×
100%。
52.结果表明:在反应前3h内,重组纤维蛋白溶解酶高于尿激酶和链激酶的溶栓活性,在12h内,尿激酶和链激酶均达到他们最高的溶栓活性,尿激酶溶栓率达36%,链激酶只有25%,与24h后的溶栓率也并无明显差异。重组纤维蛋白溶解酶从反应3h到24h,表现出了较明显的溶栓活性,且较为稳定,溶栓率明显高于尿激酶和链激酶,两个剂量组溶栓率都达到80%以上。
53.实施例3一种纤维蛋白酶的溶栓实验重组酶的体内溶栓活性的测定(对大鼠尾静脉血栓的影响):
利用大鼠尾静脉血栓模型来研究实施例1获得的纤维蛋白溶解酶在大鼠体内溶栓活性。选择1.2 mg/kg浓度k
‑
角叉莱胶对大鼠尾静脉注射,24h后观察尾部血栓形成情况,测量形成的酒红色血栓长度。
54.将42只wistar雄性大鼠(购自北京维通利华公司)按以下分组等体积注射:a、注射1
×
pbs;b、注射200μg/kg纤维蛋白溶解酶;c、注射600μg/kg纤维蛋白溶解酶;d、注射1800μg/kg纤维蛋白溶解酶;e、注射3000μg/kg纤维蛋白溶解酶;f、注射600μg/kg尿激酶;g、注射600μg/kg链激酶。
55.以上纤维蛋白溶解酶使用1
×
pbs作为溶剂。
56.尿激酶购自上海源叶生物科技有限公司,货号为s10176;链激酶购自美国sigma
‑
aldrich公司,货号为s3134。
57.注射上述酶液30min后,结扎大鼠尾部静脉。
58.用1
×
pbs溶解k
‑
角叉莱胶至1.2mg/kg并注射大鼠尾静脉诱发血栓形成。
59.15min后移除结扎,24h后测量血栓形成长度并记录长度。按照注射的总酶活来计算单位长度血栓溶解所需要的溶栓酶活量来评价其溶栓效果,按照下式进行计算:单位长度酶活溶栓率(u/cm)=注射总酶活/(阴性对照组尾部血栓长度
‑
实验组尾部血栓长度)。
60.如表1所示,结果表明:以血栓单位长度酶活计,本方法纯化的重组纤溶酶不同剂量组单位酶活溶栓率从62
‑
135.6 u/cm不等,而尿激酶为1962u/cm,即溶解同等长度的尾静脉血栓需要更多的酶活,链激酶为152u/cm,因此本方法纯化的纤维蛋白溶解酶体内溶栓效果大于尿激酶和链激酶。
61.表1 不同类型纤溶酶体内溶栓活性比较实施例4 一种纤维蛋白溶解酶的体外抗凝活性本实施例对实施例1获得的纤维蛋白溶解酶进行体外抗凝活性的测定,具体方法和步骤如下:取大鼠全血并选用枸橼酸钠抗凝,1000 rpm离心10 min取上清为富血小板血浆(prp),余血3000 rpm离心20 min为贫血小板血浆(ppp)。利用ppp进行抗凝活性的测定,50μg纯化的纤维蛋白溶解酶加入到预先37℃孵育的300 μl的ppp中,混合后在37℃孵育2 min。之后添加150 μl的1000 u/ml的凝血酶(购自上海源叶生物科技有限公司,货号为s10117),
待反应5 min后微型离心机简短离心,倒置观察形成的结块情况,拍照留证,以1
×
pbs为阴性对照,50μg华法林钠(临床抗凝药物)为阳性对照。
62.结果如图2所示,阴性对照血浆基本全部凝固,而加入华法林钠组也有大部分血浆凝固,只有加入纤维蛋白溶解酶组,除底部少量的凝固结块出现,大部分血浆是保持液体状态的,表明本文纯化的纤溶酶也具有很好的抗凝血效果,具有很好的开发前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1