多能细胞的诱导的制作方法
多能细胞的诱导
1.本技术是申请日2010年10月15日,中国申请号201610220657.8,发明名称为“多能细胞的诱导”的专利申请的分案申请。
2.对相关申请的交叉引用
3.本技术根据35 u.s.c.
§
1.119(e)要求2009年10月16日提交的美国临时申请号61/252,548的权益,该美国临时申请的内容通过引用整体并入。
背景技术:
4.产生人诱导多能干细胞(ipsc)的最新进展(takahashi,k.等,cell 131,861
‑
72(2007);yu,j.等,science 318,1917
‑
20(2007);muller,l.u.w.,等,mol.ther.17,947
‑
53(2009)),已经唤起了它们在生物医学研究和临床应用中实用的希望。但是,ipsc产生仍然是非常慢的(约4周)且低效的(<0.01%(takahashi,k.等,cell 131,861
‑
72(2007);yu,j.等,science 318,1917
‑
20(2007))过程,该过程产生异质细胞群体。从这样的混合物中鉴别出完全重编程序的(reprogrammed)ipsc是使人厌烦的,且需要在人多能细胞培养方面的专门技能。
5.尽管正在克服外源性重编程序因子的基因组插入的危险,但是重编程序的低效率和缓慢动力学继续代表着人ipsc的最终应用的难克服的问题。例如,在重编程序过程中,可能发生遗传的或后生的异常的增加,其中肿瘤抑制因子可能被抑制,致癌途径可能被激活。尽管最近的研究已经报道,除了最初的4种因子以外,通过遗传操作来提高重编程序的效率(feng,b.等,cell stem cell 4,301
‑
12(2009)),但是这样的操作通常使得该过程甚至更复杂,并会增加遗传改变和致瘤性的风险。因而,仍然存在对更安全的、更容易的且更有效的人ipsc生产以及促进对重编程序的基本机理的鉴定和表征的方法的巨大需求。
技术实现要素:
6.本发明提供了混合物(例如,可用于诱导ipsc)。在一些实施方案中,所述混合物包含:
7.哺乳动物细胞;
8.tgfβ受体/alk5抑制剂;
9.mek抑制剂;和
10.rho gtp酶/rock途径抑制剂。
11.在一些实施方案中,至少99%的细胞是非多能细胞。在一些实施方案中,所有或基本上所有的细胞是非多能细胞。
12.在一些实施方案中,所述细胞是人细胞。
13.在一些实施方案中,所述tgfβ受体/alk5抑制剂是sb431542。
14.在一些实施方案中,所述mek抑制剂是pd0325901。
15.在一些实施方案中,所述rock抑制剂是具有下式的化合物:
[0016][0017]
环a是取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;
[0018]
环b是取代的或未取代的杂环烷基、或取代的或未取代的杂芳基;
[0019]
l1是
‑
c(o)
‑
nr2‑
或
‑
c(o)
‑
nr2‑
;
[0020]
l2是键、取代的或未取代的亚烷基、或取代的或未取代的杂亚烷基;和
[0021]
r1和r2独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0022]
在一些实施方案中,所述rock抑制剂具有下式:
[0023][0024]
其中,y是0
‑
3的整数;z是0
‑
5的整数;x是
‑
n=、
‑
ch=或
‑
cr5=;r3、r4和r5独立地是cn、s(o)
n
r6、nr7r8、c(o)r9、nr
10
‑
c(o)r
11
、nr
12
‑
c(o)
‑
or
13
、
‑
c(o)nr
14
r
15
、
‑
nr
16
s(o)2r
17
、
‑
or
18
、
‑
s(o)2nr
19
、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基,其中n是0
‑
2的整数,其中如果z大于1,则2个r3部分任选地连接到一起,以形成取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;且r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0025]
在一些实施方案中,所述rock抑制剂具有下式:
[0026][0027][0028]
在一些实施方案中,所述rock抑制剂是
[0029][0030]
在一些实施方案中,其中当使所述混合物处于足以诱导所述混合物中的非多能细胞转化成诱导多能干细胞的条件下时,所述抑制剂的浓度足以使将所述细胞诱导成诱导多能干细胞的效率提高至少10%。
[0031]
在一些实施方案中,所述混合物另外包含gsk3抑制剂和/或hdac抑制剂。
[0032]
在一些实施方案中,所述多肽选自:oct
‑
3/4,sox2,klf4和c
‑
myc。在一些实施方案中,所述细胞选自:人细胞、非人动物细胞、小鼠细胞、非人灵长类动物或其它动物细胞。
[0033]
本发明也提供了将非多能哺乳动物细胞诱导成诱导多能干细胞的方法。在一些实施方案中,所述方法包括,在足以诱导至少一些细胞变成多能干细胞的条件下,使非多能细胞接触:
[0034]
tgfβ受体/alk5抑制剂;
[0035]
mek抑制剂;和
[0036]
rock抑制剂。
[0037]
在一些实施方案中,所述条件包括:将至少一种外源性转录因子导入非多能细胞中。在一些实施方案中,所述至少一种外源性转录因子是oct多肽,且所述细胞进一步接触组蛋白脱乙酰酶(hdac)抑制剂。
[0038]
在一些实施方案中,所述转录因子选自:oct多肽、klf多肽、myc多肽和sox多肽。
[0039]
在一些实施方案中,所述方法包括:将至少2、3或4种外源性转录因子导入非多能细胞中,其中所述转录因子选自:oct多肽、klf多肽、myc多肽和sox多肽。在一些实施方案中,所述多肽选自:oct
‑
3/4、sox2、klf4和c
‑
myc。在一些实施方案中,所述细胞选自:人细胞、非人动物细胞、小鼠细胞、非人灵长类动物或其它动物细胞。
[0040]
在一些实施方案中,通过将多核苷酸导入非多能细胞中,导入所述至少一种转录因子,其中所述多核苷酸编码所述至少一种外源性转录因子,从而在所述细胞中表达一种或多种所述转录因子。
[0041]
在一些实施方案中,通过使外源性多肽接触非多能细胞来导入所述至少一种转录因子,其中所述多肽包含所述转录因子的氨基酸序列,其中在将所述多肽导入细胞中的条件下进行所述导入。在一些实施方案中,所述多肽包含增强跨细胞膜转运的氨基酸序列。
[0042]
在一些实施方案中,所述细胞是人细胞。
[0043]
在一些实施方案中,所述tgfβ受体/alk5抑制剂是sb431542。
[0044]
在一些实施方案中,所述mek抑制剂是pd0325901。
[0045]
在一些实施方案中,所述rock抑制剂是具有下式的化合物:
[0046][0047]
环a是取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;
[0048]
环b是取代的或未取代的杂环烷基、或取代的或未取代的杂芳基;
[0049]
l1是
‑
c(o)
‑
nr2‑
或
‑
c(o)
‑
nr2‑
;
[0050]
l2是键、取代的或未取代的亚烷基、或取代的或未取代的杂亚烷基;和
[0051]
r1和r2独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0052]
在一些实施方案中,所述rock抑制剂具有下式:
[0053][0054]
其中,y是0
‑
3的整数;z是0
‑
5的整数;x是
‑
n=、
‑
ch=或
‑
cr5=;r3、r4和r5独立地是
cn、s(o)
n
r6、nr7r8、c(o)r9、nr
10
‑
c(o)r
11
、nr
12
‑
c(o)
‑
or
13
、
‑
c(o)nr
14
r
15
、
‑
nr
16
s(o)2r
17
、
‑
or
18
、
‑
s(o)2nr
19
、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基,其中n是0
‑
2的整数,其中如果z大于1,则2个r3部分任选地连接到一起,以形成取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;且r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0055]
在一些实施方案中,所述rock抑制剂具有下式:
[0056][0057][0058]
在一些实施方案中,所述rock抑制剂是
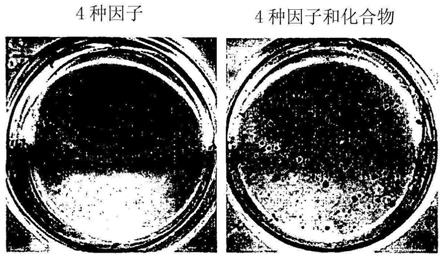
[0059][0060]
在一些实施方案中,当使所述混合物处于足以诱导所述混合物中的非多能细胞转化成诱导多能干细胞的条件下时,所述抑制剂的浓度足以使将所述细胞诱导成诱导多能干
细胞的效率提高至少10%。
[0061]
在一些实施方案中,所述混合物另外包含gsk3抑制剂。
[0062]
本发明也提供了用于诱导非多能哺乳动物细胞的多能性的试剂盒。在一些实施方案中,所述试剂盒包含,
[0063]
tgfβ受体/alk5抑制剂;
[0064]
mek抑制剂;和
[0065]
rock抑制剂。
[0066]
在一些实施方案中,所述tgfβ受体/alk5抑制剂是sb431542。
[0067]
在一些实施方案中,所述mek抑制剂是pd0325901。
[0068]
在一些实施方案中,所述rock抑制剂是具有下式的化合物:
[0069][0070]
环a是取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;
[0071]
环b是取代的或未取代的杂环烷基、或取代的或未取代的杂芳基;
[0072]
l1是
‑
c(o)
‑
nr2‑
或
‑
c(o)
‑
nr2‑
;
[0073]
l2是键、取代的或未取代的亚烷基、或取代的或未取代的杂亚烷基;和
[0074]
r1和r2独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0075]
在一些实施方案中,所述rock抑制剂具有下式:
[0076][0077]
其中,y是0
‑
3的整数;z是0
‑
5的整数;x是
‑
n=、
‑
ch=或
‑
cr5=;r3、r4和r5独立地是cn、s(o)
n
r6、nr7r8、c(o)r9、nr
10
‑
c(o)r
11
、nr
12
‑
c(o)
‑
or
13
、
‑
c(o)nr
14
r
15
、
‑
nr
16
s(o)2r
17
、
‑
or
18
、
‑
s(o)2nr
19
、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基,其中n是0
‑
2的整数,其中如果z大于1,则2个r3部分任选地连接到一起,以形成取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基;且r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0078]
在一些实施方案中,所述rock抑制剂具有下式:
[0079][0080][0081]
在一些实施方案中,所述rock抑制剂是
[0082][0083]
在一些实施方案中,所述试剂盒另外包含gsk3抑制剂和/或组蛋白脱乙酰酶(hdac)抑制剂。
[0084]
从本文公开内容的其它部分,其它实施方案将是清楚的。
[0085]
定义
[0086]“oct多肽”指octomer转录因子家族的任一天然存在的成员,或其保留与最接近的相关天然存在的家族成员相比类似的转录因子活性(在至少50%,80%,或90%活性范围之内)的变体,或至少包括天然存在的家族成员的dna结合结构域的多肽,并且可以进一步包括转录激活结构域。示范性的oct多肽包括,例如,oct
‑
1、oct
‑
2、oct
‑
3/4、oct
‑
6、oct
‑
7、oct
‑
8、oct
‑
9和oct
‑
11。oct3/4(本文中称为
″
oct4
″
),包含pou结构域,其为在pit
‑
l,oct
‑
1,oct
‑
2,和uric
‑
86之间保守的150个氨基酸序列。参见ryan,a.k.&rosenfeld,m.g.genes dev.(基因发育)11,1207
‑
1225(1997)。在一些实施方案中,与天然存在的oct多肽家族成员
相比,诸如与以上列出的那些或诸如genbank登记号np_002692.2(人oct4)或np_038661.1(小鼠oct4)列出的那些相比,变体在其整个序列上具有至少85%、90%或95%的氨基酸序列同一性。oct多肽(例如,oct3/4)可以来自于人、小鼠、大鼠、牛、猪、或其它动物。一般地,将使用与所操作的细胞物种相同的物种的蛋白。
[0087]“klf多肽”指以下中任一:kr
ü
ppel样因子(klfs)家族的天然存在的成员,含有与果蝇(drosophila)胚胎模式调节子kr
ü
ppel类似的氨基酸序列的锌指蛋白,或保留与最接近相关的天然存在的家族成员相比类似的转录因子活性(在至少50%,80%,或90%活性范围之内)的天然存在的成员的变体,或至少包括天然存在的家族成员的dna结合结构域的多肽,并且可以进一步包括转录激活结构域。参见,dang,d.t.,pevsner,j.&yang,v.w..cell biol.(细胞生物学)32,1103
‑
1121(2000)。示范性klf家族成员包括,klf1,klf2,klf3,klf
‑
4,klf5,klf6,klf7,klf8,klf9,klf10,klf11,klf12,klf13,klf14,klf15,klf16,和klf17。发现klf2和klf
‑
4是能够在小鼠中产生ips细胞的因子,并且相关的基因klf1和klf5也能够在小鼠中产生ips细胞,虽然效率降低。参见,nakagawa,等,nature biotechnology(自然生物技术)26:101
‑
106(2007)。在一些实施方案中,与天然存在klf多肽家族成员相比,诸如与以上列出的那些或诸如genbank登记号cax16088(小鼠klf4)或cax14962(人klf4)列出的那些相比,变体在其整个序列上具有至少85%、90%或95%的氨基酸序列同一性。klf多肽(例如,klf1,klf4,和klf5)可以来自于人、小鼠、大鼠、牛、猪、或其它动物。一般地,将使用与所操作的细胞物种相同的物种的蛋白。就本文中描述的klf多肽而言,其可以用雌激素
‑
相关受体β(essrb)多肽替换。因此,意欲对于本文所述的各种klf多肽实施方案,同等地描述使用essrb替代klf4多肽的相应的实施方案。
[0088]“myc多肽”指myc家族的任一天然存在的成员(参见,例如adhikary,s.&eilers,m.nat.rev.mol.cell biol.(自然分子细胞生物学综述)6:635
‑
645(2005)),或其保留与最接近相关的天然存在的家族成员相比类似的转录因子活性(在至少50%、80%或90%活性范围之内)的变体,或至少包括天然存在的家族成员的dna结合结构域的多肽,并且可以进一步包括转录激活结构域。示范性myc多肽包括,例如,c
‑
myc,n
‑
myc和l
‑
myc。在一些实施方案中,与天然存在myc多肽家族成员相比,诸如与以上列出的那些或诸如genbank登记号caa25015(人myc)列出的那些相比,变体在其整个序列上具有至少85%、90%或95%的氨基酸序列同一性。myc多肽(例如,c
‑
myc)可以来自于人、小鼠、大鼠、牛、猪、或其它动物。一般地,将使用与所操作的细胞物种相同的物种的蛋白。
[0089]“sox多肽”指sry
‑
相关的hmg
‑
box(sox)转录因子的任一天然存在的成员,其特征在于存在高速泳动族(high
‑
mobility group)(hmg)结构域,或其保留与最接近相关的天然存在的家族成员相比类似的转录因子活性(在至少50%,80%,或90%活性范围之内)的变体,或至少包括天然存在的家族成员的dna结合结构域的多肽,并且可以进一步包括转录激活结构域。参见,例如,dang,d.t.,等int.j.biochem.cell biol.(国际生物化学细胞生物学杂志)32:1103
‑
1121(2000)。示范性sox多肽包括,例如sox1、sox
‑
2、sox3、sox4、sox5、sox6、sox7、sox8、sox9、sox10、sox11、sox12、sox13、sox14、sox15、sox17、sox18、sox
‑
21和sox30。已经表明sox1以与sox2相似的效率产生ips细胞,并且还已经表明基因sox3,sox15和sox18也产生ips细胞,虽然其效率略低于sox2。参见,nakagawa,等,nature biotechnology(自然生物技术)26:101
‑
106(2007)。在一些实施方案中,与天然存在sox多
肽家族成员相比,诸如与以上列出的那些或诸如genbank登记号caa83435(人sox2)列出的那些相比,变体在其整个序列上具有至少85%、90%或95%的氨基酸序列同一性。sox多肽(例如,sox1,sox2,sox3,sox15,或sox18)可以来自于人、小鼠、大鼠、牛、猪、或其它动物。一般地,将使用与所操作的细胞物种相同的物种的蛋白。
[0090]“h3k9”指组蛋白h3赖氨酸9。与基因活性有关的h3k9修饰包括h3k9乙酰化,与异染色质有关的h3k9修饰包括h3k9二甲基化或三甲基化。参见,例如,kubicek,等,mol.cell473
‑
481(2007)。
[0091]
术语“多能”或“多能性”指具有产生这样的后代细胞的能力的细胞,所述后代细胞能够在适当条件下经历分化成为共同展示与来自全部三个胚层(内胚层、中胚层和外胚层)的细胞谱系相关的特征的细胞类型。多能干细胞可以促成出生前、出生后或成年动物的所有胚胎衍生出的组织。标准的本领域公认测试,诸如在8
‑
12周龄scid小鼠中形成畸胎瘤的能力,可以用于确定细胞群的多能性,然而,不同多能干细胞特征的鉴定也可以用于检测多能细胞。
[0092]“多能干细胞特征”意指将多能干细胞与其它细胞相区别的细胞特征。产生能够在适当条件下经历分化成为共同展示与来自全部三胚层(内胚层、中胚层和外胚层)的细胞谱系相关的特征的细胞类型的后代的能力是多能干细胞特征。表达或不表达某些分子标志物的组合也是多能干细胞特征。例如,人多能干细胞表达至少一些(且在一些实施方案中,全部)来自以下非限制性列表的标志物:ssea
‑
3、ssea
‑
4、tra
‑1‑
60、tra
‑1‑
81、tra
‑2‑
49/6e、alp、sox2、e
‑
钙黏着蛋白、utf
‑
1、oct4、rex1和nanog。与多能干细胞相关的细胞形态学也是多能干细胞的特征。
[0093]
本文使用的“非多能细胞”指不是多能细胞的哺乳动物细胞。这样的细胞的实例包括分化的细胞以及祖细胞。分化的细胞的实例包括、但不限于:来自选自骨髓、皮肤、骨骼肌、脂肪组织和外周血的组织的细胞。示例性的细胞类型包括、但不限于:成纤维细胞、肝细胞、成肌细胞、神经元、成骨细胞、破骨细胞和t
‑
细胞。
[0094]
在使用由此产生的多能细胞处理个体的一些实施方案中,根据本发明的方法,使用个体本身的非多能细胞来产生多能细胞。
[0095]
细胞可以来自,例如,人或非人哺乳动物。示例性的非人哺乳动物包括、但不限于:小鼠、大鼠、猫、狗、兔、豚鼠、仓鼠、羊、猪、马、牛和非人灵长类动物(例如,黑猩猩、猕猴和猿类)。
[0096]“重组”多核苷酸是不以其天然状态存在的多核苷酸,例如,所述多核苷酸包括自然界中不存在的核苷酸序列,或所述多核苷酸处于不同于其天然存在的背景的背景中,例如,与其在自然界中典型接近的核苷酸序列分开,或与其典型不接近的核苷酸序列相邻(或相连)。例如,可以将研究的序列克隆至载体中,或否则与一种或多种另外的核酸重组。
[0097]“表达盒”指包括与编码蛋白的序列可操作相连的启动子或其它调节序列的多核苷酸。
[0098]
术语“启动子”和“表达控制序列”在本文中用于指一组(an array of)指导核酸转录的核酸控制序列。用于本文中时,启动子包括接近转录起始点的必需核酸序列,诸如在聚合酶ii型启动子的情形中,包括tata元件。启动子还任选地包括远端增强子或阻抑子元件,其可以位于距转录起始点多至数千碱基对处。启动子包括组成型和诱导型启动子。“组成
型”启动子是在大部分环境和发育条件下有活性的启动子。“诱导型”启动子是在环境或发育调节下有活性的启动子。术语“可操作相连”指核酸表达控制序列(诸如启动子、或一组转录因子结合位点)和第二核酸序列之间的功能性连接,其中所述表达控制序列指导对应于所述第二序列的核酸转录。
[0099]“异源序列”或“异源核酸”,用于本文中时,是来源于与特定宿主细胞异源的来源的序列或核酸,或如果来自相同来源,则由其初始形式进行修饰。因此,例如通过与来自表达载体的核酸序列而非染色体dna相连,与异源启动子相连,与报道基因相连等,细胞中的异源表达盒不是特定宿主细胞内源的表达盒。
[0100]
术语“核酸”和“多核苷酸”在本文中可互换地用于指采用单链或双链形式的脱氧核糖核苷酸或核糖核苷酸及其聚合物。该术语包括包含已知的核苷酸类似物或修饰的主链残基或连接的核酸,其是合成的、天然存在的、和非天然存在的,其具有与参照核酸类似的结合特性,且其以与参照核苷酸类似的方式代谢。所述类似物的实例包括,但不仅限于,硫代磷酸酯、氨基磷酸酯、甲基膦酸酯(methyl phosphonates)、手性
‑
甲基膦酸酯、2
‑
o
‑
甲基核糖核酸、肽
‑
核酸(pnas)。
[0101]
除非另有说明,特定核酸序列还包括其保守修饰变体(例如,简并密码子置换)和互补序列,以及明确指出的序列。特别地,简并密码子置换可以通过产生这样的序列来获得,在所述序列中,一个或多个所选(或全部)密码子的第三个位置被混合碱基和/或脱氧肌苷残基替换(batzer等,nucleic acid res.(核酸研究)19:5081(1991);ohtsuka等,j.biol.chem.(生物化学杂志)260:2605
‑
2608(1985);rossolini等,mol.cell.probes(分子细胞探针)8:91
‑
98(1994))。
[0102]
表达或活性的“抑制剂”、“活化剂”和“调节剂”分别用来指利用关于所述靶蛋白(或编码多核苷酸)表达或活性的体外和体内测定所鉴定的抑制分子、活化分子或调节分子,例如,配体、激动剂、拮抗剂、及其同系物和模拟物。术语“调节剂”包括抑制剂和活化剂。抑制剂是,例如,抑制所述靶蛋白表达或与之结合,部分或全部阻断刺激或蛋白酶抑制剂活性,减少、降低、防止、延迟活化,钝化,脱敏,或下调所述靶蛋白活性的试剂,例如拮抗剂。活化剂是例如,诱导或活化所述靶蛋白表达或与之结合,刺激、增加、开放、活化、促进、增强活化或蛋白酶抑制剂活性,致敏或上调所述靶蛋白(或编码多核苷酸)的活性,例如,激动剂。调节剂包括天然存在的和合成的配体,拮抗剂和激动剂(例如,起激动剂或拮抗剂功能的小化学分子、抗体等)。所述关于抑制剂和活化剂的测定包括,例如,将推定的调节剂化合物应用到表达所述靶蛋白的细胞,然后确定对所述靶蛋白活性的功能性作用,如上所述。将用潜在的活化剂、抑制剂、或调节剂处理的包括所述靶蛋白的样品或测定与无抑制剂、活化剂、或调节剂的对照样品进行比较,以检验作用程度。对照样品(未用调节剂处理)被赋予100%的相对活性值。当活性值相对于对照为约80%、任选50%或25、10%、5%或1%时,实现所述靶蛋白的抑制。当活性值相对于对照为约110%、任选150%、任选200、300%、400%、500%或1000
‑
3000%或更高时,实现所述靶蛋白的活化。
[0103]
在用它们的从左向右书写的常规化学式指定化学取代基的情况下,它们同样包括从右向左书写所述结构产生的化学上相同的取代基,例如,
‑
ch2o
‑
等同于
‑
och2‑
。
[0104]
除非另有说明,术语“烷基”自身或作为另一个取代基的一部分,是指直链(即,无支链)或支链或它们的组合,其可以是完全饱和的、单不饱和的或多不饱和的,且可以包括
二价基团和多价基团,并具有指定的碳原子数目(即,c1‑
c
10
是指1
‑
10个碳)。饱和烃基的实例包括、但不限于下述基团:诸如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、环己基、(环己基)甲基、环丙基甲基,诸如正戊基、正己基、正庚基、正辛基等的同系物和异构体。不饱和的烷基是具有一个或多个双键或三键的烷基。不饱和的烷基的实例包括、但不限于:乙烯基、2
‑
丙烯基、巴豆基、2
‑
异戊烯基、2
‑
(丁二烯基)、2,4
‑
戊二烯基、3
‑
(1,4
‑
戊二烯基)、乙炔基、1
‑
和3
‑
丙炔基、3
‑
丁炔基和更高的同系物和异构体。
[0105]
术语“亚烷基”自身或作为另一个取代基的一部分,是指源自烷基的二价基团,其实例包括、但不限于:
‑
ch2ch2ch2ch2‑
。通常,烷基(或亚烷基)具有1
‑
24个碳原子,具有10个或更少的碳原子的那些基团是在本发明中的实例。“低级烷基”或“低级亚烷基”是更短链的烷基或亚烷基,通常具有8个或更少的碳原子。
[0106]
除非另有说明,术语“杂烷基”自身或与另一个术语相组合,是指稳定的直链或支链或环状烃基或它们的组合,其由至少一个碳原子和至少一个选自o、n、p、si和s的杂原子组成,且其中所述氮和硫原子可以任选地被氧化,所述氮杂原子可以任选地被季铵化。杂原子o、n、p和s和si可以位于杂烷基的任意内部位置处,或在所述烷基与分子的其它部分相连的位置处。实例包括、但不限于:
‑
ch2‑
ch2‑
o
‑
ch3、
‑
ch2‑
ch2‑
nh
‑
ch3、
‑
ch2‑
ch2‑
n(ch3)
‑
ch3、
‑
ch2‑
s
‑
ch2‑
ch3、
‑
ch2‑
ch2、
‑
s(o)
‑
ch3、
‑
ch2‑
ch2‑
s(o)2‑
ch3、
‑
ch=ch
‑
o
‑
ch3、
‑
si(ch3)3、
‑
ch2‑
ch=n
‑
och3、
‑
ch=ch
‑
n(ch3)
‑
ch3、o
‑
ch3、
‑
o
‑
ch2‑
ch3和
‑
cn。最多2个杂原子可以是相邻的,例如,
‑
ch2‑
nh
‑
och3和
‑
ch2‑
o
‑
si(ch3)3。类似地,术语“杂亚烷基”自身或作为另一个取代基的一部分,是指由杂烷基衍生出的二价基团,其实例包括、但不限于
‑
ch2‑
ch2‑
s
‑
ch2‑
ch2‑
和
‑
ch2‑
s
‑
ch2‑
ch2‑
nh
‑
ch2‑
。对于杂亚烷基,杂原子也可以占据任一个或两个链末端(例如,亚烷氧基、亚烷二氧基、亚烷基氨基、亚烷基二氨基等)。更进一步,对于亚烷基和杂亚烷基连接基团,所述连接基团的通式的书写方向并不暗示该连接基团的朝向。例如,式
‑
c(o)2r
′‑
代表
‑
c(o)2r
′‑
和
‑
r
′
c(o)2‑
两者。如上所述,本文使用的杂烷基包括通过杂原子与分子的其它部分相连的那些基团,诸如
‑
c(o)r
′
、
‑
c(o)nr
′
、
‑
nr
′
r
″
、
‑
or
′
、
‑
sr
′
和/或
‑
so2r
′
。在列举“杂烷基”并随之列举特定杂烷基(诸如
‑
nr
′
r
″
等)的情况下,应该理解,术语杂烷基和
‑
nr
′
r
″
不是多余的或相互排斥的。相反,为了清楚而列举特定杂烷基。因而,术语“杂烷基”在本文中不应当解释为排除特定杂烷基,诸如
‑
nr
′
r
″
等。
[0107]
除非另有说明,术语“环烷基”和“杂环烷基”自身或与其它术语相组合,分别代表环状形式的“烷基”和“杂烷基”。另外,对于杂环烷基,杂原子可以占据杂环与分子的其它部分相连的位置。环烷基的实例包括、但不限于:环戊基、环己基、1
‑
环己烯基、3
‑
环己烯基、环庚基等。杂环烷基的实例包括、但不限于:1
‑
(1,2,5,6
‑
四氢吡啶基)、1
‑
哌啶基、2
‑
哌啶基、3
‑
哌啶基、4
‑
吗啉基、3
‑
吗啉基、四氢呋喃
‑2‑
基、四氢呋喃
‑3‑
基、四氢噻吩
‑2‑
基、四氢噻吩
‑3‑
基、1
‑
哌嗪基、2
‑
哌嗪基等。“亚环烷基”和“亚杂环烷基”分别指由环烷基和杂环烷基衍生出的二价基团。
[0108]
除非另有说明,术语“卤代”或“卤素”自身或作为另一个取代基的一部分,是指氟、氯、溴或碘原子。另外,诸如“卤代烷基”等术语意在包括单卤代烷基和多卤代烷基。例如,术语“卤代(c1‑
c4)烷基意在包括、但不限于:三氟甲基、2,2,2
‑
三氟乙基、4
‑
氯丁基、3
‑
溴丙基等。
[0109]
除非另有说明,术语“芳基”是指多不饱和的芳族烃取代基,其可以是单个环或多
个环(优选地1
‑
3个环),所述多个环稠合到一起或共价地连接。术语“杂芳基”指含有1
‑
4个选自n、o和s的杂原子的芳基(或环),其中所述氮和硫原子任选地被氧化,所述氮原子任选地被季铵化。杂芳基可以通过碳或杂原子与分子的其它部分相连。芳基和杂芳基的非限制性实例包括:苯基、1
‑
萘基、2
‑
萘基、4
‑
联苯基、1
‑
吡咯基、2
‑
吡咯基、3
‑
吡咯基、3
‑
吡唑基、2
‑
咪唑基、4
‑
咪唑基、吡嗪基、2
‑
唑基、4
‑
唑基、2
‑
苯基
‑4‑
唑基、5
‑
唑基、3
‑
异唑基、4
‑
异唑基、5
‑
异唑基、2
‑
噻唑基、4
‑
噻唑基、5
‑
噻唑基、2
‑
呋喃基、3
‑
呋喃基、2
‑
噻吩基、3
‑
噻吩基、2
‑
吡啶基、3
‑
吡啶基、4
‑
吡啶基、2
‑
嘧啶基、4
‑
嘧啶基、5
‑
苯并噻唑基、嘌呤基、2
‑
苯并咪唑基、5
‑
吲哚基、1
‑
异喹啉基、5
‑
异喹啉基、2
‑
喹喔啉基、5
‑
喹喔啉基、3
‑
喹啉基和6
‑
喹啉基。每个上面指出的芳基和杂芳基环系的取代基选自下述的可接受的取代基。“亚芳基”和“亚杂芳基”分别指由芳基和杂芳基衍生出的二价基团。
[0110]
为简洁起见,当与其它术语组合使用时(例如,芳氧基、芳硫氧基、芳烷基),术语“芳基”包括上面定义的芳基和杂芳基环。因而,术语“芳基烷基”意在包括这样的基团:其中芳基与烷基相连(例如,苄基、苯乙基、吡啶基甲基等),所述烷基包括其中碳原子(例如,亚甲基)已经被例如氧原子替换的那些烷基(例如,苯氧基甲基、2
‑
吡啶基氧基甲基、3
‑
(1
‑
萘基氧基)丙基等)。
[0111]
本文使用的术语“氧代”是指与碳原子形成双键的氧。
[0112]
本文使用的术语“烷基磺酰基”是指具有式
‑
s(o2)
‑
r
′
的部分,其中r
′
是如上定义的烷基。r
′
可以具有指定数目的碳(例如“c1
‑
c4烷基磺酰基”)。
[0113]
每个上述的术语(例如,“烷基”、“杂烷基”、“芳基”和“杂芳基”)意在包括指出的基团的取代的和未取代的形式。下面提供了每类基团的示例性的取代基。
[0114]
烷基和杂烷基(包括经常称作亚烷基、烯基、杂亚烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团)的取代基可以是选自、但不限于下述多种基团中的一个或多个:
‑
or
′
、=o、=nr
′
、=n
‑
or
′
、
‑
nr
′
r
″
、
‑
sr
′
、
‑
卤素、
‑
sir
′
r
″
r
″′
、
‑
oc(o)r
′
、
‑
c(o)r
′
、
‑
co2r
′
、
‑
conr
′
r
″
、
‑
oc(o)nr
′
r
″
、
‑
nr
″
c(o)r
′
、
‑
nr
′‑
c(o)nr
″
r
″′
、
‑
nr
″
c(o)2r
′
、
‑
nr
‑
c(nr
′
r
″
r
″′
)=nr
″″
、
‑
nr
‑
c(nr
′
r
″
)=nr
″′
、
‑
s(o)r
′
、
‑
s(o)2r
′
、
‑
s(o)2nr
′
r
″
、
‑
nrso2r
′
、
‑
cn和
‑
no2,其数目为0至(2m
′
+1)个,其中m
′
是这样的基团中的碳原子的总数。r
′
、r
″
、r
″′
和r
″″
每个优选地独立地指氢、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基(例如,被1
‑
3个卤素取代的芳基)、取代的或未取代的烷基、烷氧基或硫代烷氧基或芳基烷基。当本发明的化合物包括超过一个r基团时,例如,独立地选择每个r基团为每个r
′
、r
″
、r
″′
和r
″″
(当存在超过一个这样的基团时)。当r
′
和r
″
与同一个氮原子相连时,它们可以与所述氮原子组合,形成4
‑
、5
‑
、6
‑
或7
‑
元环。例如,
‑
nr
′
r”意在包括、但不限于1
‑
吡咯烷基和4
‑
吗啉基。从取代基的上述讨论,本领域技术人员会理解,术语“烷基”意在包括这样的基团:所述基团包含与氢基以外的基团相连的碳原子,诸如卤代烷基(例如,
‑
cf3和
‑
ch2cf3)和酰基(例如,
‑
c(o)ch3、
‑
c(o)cf3、
‑
c(o)ch2och3等)。
[0115]
与关于烷基所述的取代基类似地,芳基和杂芳基的取代基是多样的,且选自:例如,卤素、
‑
or
′
、
‑
nr
′
r
″
、
‑
sr
′
、
‑
卤素、
‑
sir
′
r
″
r
″′
、
‑
oc(o)r
′
、
‑
c(o)r
′
、
‑
co2r
′
、
‑
conr
′
r
″
、
‑
oc(o)nr
′
r
″
、
‑
nr
″
c(o)r
′
、
‑
nr
′‑
c(o)nr
″
r
″′
、
‑
nr
″
c(o)2r
′
、
‑
nr
‑
c(nr
′
r
″
r
″′
)=nr
″″
、
‑
nr
‑
c(nr
′
r
″
)=nr
″′
、
‑
s(o)r
′
、
‑
s(o)2r
′
、
‑
s(o)2nr
′
r
″
、
‑
nrso2r
′
、
‑
cn和
–
no2、
‑
r
′
、
‑
n3、
‑
ch(ph)2、
氟代(c1‑
c4)烷氧基和氟代(c1‑
c4)烷基,其数目范围是0至芳族环系上的开放化合价的总数;且其中r
′
、r
″
、r
″′
和r
″″
优选地独立地选自:氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基和取代的或未取代的杂芳基。当本发明的化合物包括超过一个r基团时,例如,独立地选择每个r基团为每个r
′
、r
″
、r
″′
和r
″″
基团(当存在超过一个这样的基团时)。
[0116]
芳基或杂芳基环的相邻原子上的2个取代基可以任选地形成式
‑
t
‑
c(o)
‑
(crr
′
)
q
‑
u
‑
的环,其中t和u独立地是
‑
nr
‑
、
‑
o
‑
、
‑
crr
′‑
或单键,且q是0
‑
3的整数。或者,芳基或杂芳基环的相邻原子上的2个取代基可以任选地被式
‑
a
‑
(ch2)
r
‑
b
‑
的取代基替换,其中a和b独立地是
‑
crr
′‑
、
‑
o
‑
、
‑
nr
‑
、
‑
s
‑
、
‑
s(o)
‑
、
‑
s(o)2‑
、
‑
s(o)2nr
′‑
或单键,且r是1
‑
4的整数。如此形式的新环的单键之一可以任选地被双键替换。或者,芳基或杂芳基环的相邻原子上的2个取代基可以任选地被式
‑
(crr
′
)
s
‑
x
′‑
(c
″
r
″′
)
d
‑
的取代基替换,其中s和d独立地是0
‑
3的整数,且x
′
是
‑
o
‑
、
‑
nr
′‑
、
‑
s
‑
、
‑
s(o)
‑
、
‑
s(o)2‑
或
‑
s(o)2nr
′‑
。取代基r、r
′
、r
″
和r
″′
优选地独立地选自:氢、取代的或未取代的烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基和取代的或未取代的杂芳基。
[0117]
本文使用的术语“杂原子”或“环杂原子”意在包括氧(o)、氮(n)、硫(s)、磷(p)和硅(si)。
[0118]
本文使用的“取代基”是指选自下述部分的基团:
[0119]
(a)
‑
oh、
‑
nh2、
‑
sh、
‑
cn、
‑
cf3、
‑
no2、氧代、卤素、未取代的烷基、未取代的杂烷基、未取代的环烷基、未取代的杂环烷基、未取代的芳基、未取代的杂芳基,和
[0120]
(b)烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基,其被至少一个选自下述的取代基取代:
[0121]
(i)氧代、
‑
oh、
‑
nh2、
‑
sh、
‑
cn、
‑
cf3、
‑
no2、卤素、未取代的烷基、未取代的杂烷基、未取代的环烷基、未取代的杂环烷基、未取代的芳基、未取代的杂芳基,和
[0122]
(ii)烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基,其被至少一个选自下述的取代基取代:
[0123]
(a)氧代、
‑
oh、
‑
nh2、
‑
sh、
‑
cn、
‑
cf3、
‑
no2、卤素、未取代的烷基、未取代的杂烷基、未取代的环烷基、未取代的杂环烷基、未取代的芳基、未取代的杂芳基,和
[0124]
(b)烷基、杂烷基、环烷基、杂环烷基、芳基或杂芳基,其被至少一个选自下述的取代基取代:氧代、
‑
oh、
‑
nh2、
‑
sh、
‑
cn、
‑
cf3、
‑
no2、卤素、未取代的烷基、未取代的杂烷基、未取代的环烷基、未取代的杂环烷基、未取代的芳基和未取代的杂芳基。
[0125]
本文使用的“大小受限的取代基”或“大小受限的取代基团”是指,选自上面关于“取代基”所述的所有取代基的基团,其中每个取代的或未取代的烷基是取代的或未取代的c1‑
c
20
烷基,每个取代的或未取代的杂烷基是取代的或未取代的2
‑
20元杂烷基,每个取代的或未取代的环烷基是取代的或未取代的c4‑
c8环烷基,且每个取代的或未取代的杂环烷基是取代的或未取代的4
‑
8元杂环烷基。
[0126]
本文使用的“低级取代基”或“低级取代基团”是指,选自上面关于“取代基”所述的所有取代基的基团,其中每个取代的或未取代的烷基是取代的或未取代的c1‑
c8烷基,每个取代的或未取代的杂烷基是取代的或未取代的2
‑
8元杂烷基,每个取代的或未取代的环烷基是取代的或未取代的c5‑
c7环烷基,且每个取代的或未取代的杂环烷基是取代的或未取代
的5
‑
7元杂环烷基。
[0127]
术语“药学上可接受的盐”意在包括,根据在本文所述化合物上存在的具体取代基,用相对非毒性的酸或碱制成的活性化合物的盐。当本发明的化合物含有相对酸性的官能团时,通过以纯化合物的方式或在合适的惰性溶剂中,使这样的化合物的中性形式接触足够量的所需要的碱,可以得到碱加成盐。药学上可接受的碱加成盐的实例包括钠、钾、钙、铵、有机氨基或镁盐或类似的盐。当本发明的化合物含有相对碱性的官能团时,通过以纯化合物的方式或在合适的惰性溶剂中,使这样的化合物的中性形式接触足够量的所需要的酸,可以得到酸加成盐。药学上可接受的酸加成盐的实例包括:源自无机酸的盐,所述无机酸例如盐酸、氢溴酸、硝酸、碳酸、单氢碳酸、磷酸、单氢磷酸、二氢磷酸、硫酸、单氢硫酸、氢碘酸或亚磷酸等,以及源自相对非毒性的有机酸的盐,所述有机酸例如醋酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、酞酸、苯磺酸、对甲苯基磺酸、柠檬酸、酒石酸、甲磺酸等。也包括:氨基酸的盐诸如精氨酸盐等;和有机酸(如葡糖醛酸或半乳糖醛酸)的盐等(参见,例如,berge等,“pharmaceutical salts”,journal of pharmaceutical science,1977,66,1
‑
19)。本发明的某些具体化合物含有碱性和酸性官能团两者,它们允许将所述化合物转化成碱或酸加成盐。
[0128]
因而,本发明的化合物可以作为与药学上可接受的酸形成的盐存在。本发明包括这样的盐。这样的盐的实例包括盐酸盐、氢溴酸盐、硫酸盐、甲磺酸盐、硝酸盐、马来酸盐、乙酸盐、柠檬酸盐、富马酸盐、酒石酸盐(例如(+)
‑
酒石酸盐、(
‑
)
‑
酒石酸盐或它们的混合物,包括外消旋的混合物)、琥珀酸盐、苯甲酸盐,和与诸如谷氨酸的氨基酸形成的盐。通过本领域技术人员已知的方法,可以制备这些盐。
[0129]
优选地如下再生所述化合物的中性形式:使所述盐接触碱或酸,并以常规方式分离母体化合物。化合物的母体形式与不同的盐形式的差别在于某些物理性质,诸如在极性溶剂中的溶解度。
[0130]
除了盐形式以外,本发明还提供了化合物,它们是前体药物形式。本文所述化合物的前体药物是这样的化合物:所述化合物在生理条件下会容易地经历化学变化,以提供本发明的化合物。另外,通过在离体环境中的化学或生化方法,可以将前体药物转化成本发明的化合物。例如,当置于含有合适的酶或化学试剂的透皮贴剂蓄池中时,前体药物可以缓慢地转化成本发明的化合物。
[0131]
本发明的某些化合物可以以非溶剂化形式以及溶剂化形式(包括水合形式)存在。一般而言,溶剂化形式与非溶剂化形式是等效的,都被包括在本发明的范围内。本发明的某些化合物可以以多种结晶形式或无定形形式存在。一般而言,所有物理形式对于本发明预见到的用途而言是等效的,且意图落入本发明的范围内。
[0132]
本发明的某些化合物具有不对称的碳原子(光学中心)或双键;在本发明的范围内包括外消旋物、非对映异构体、互变异构体、几何异构体和单个异构体。本发明的化合物不包括本领域已知的太不稳定而难以合成和/或分离的那些。
[0133]
本发明的化合物还可以在构成这样的化合物的一个或多个原子处含有非天然比例的原子同位素。例如,可以用放射性同位素(例如氚(3h)、碘
‑
125(
125
i)或碳
‑
14(
14
c))放射性标记所述化合物。本发明的化合物的所有同位素变体(放射性的或非放射性的)都被包括在本发明的范围内。
附图说明
[0134]
图1.化合物处理7天足以从用4种重编程序因子转导的人成纤维细胞中诱导多能干细胞。(a)使用组合的sb431542和pd0325901处理连同4tf一起进行人ipsc诱导的时间表。处理从4tf转导后第7天时的细胞重新接种开始,并维持7天。(b)在7天内在未处理的培养物(左)或2种化合物处理过的培养物(右)中出现的alp
+
集落的染色。(c)rt
‑
pcr显示出在2种化合物处理过的培养物中多能性标志物oct4和nanog的升高的内源mrna表达。(d)在没有(左)或有(右)2种化合物处理下在第14天时的tra
‑1‑
81染色。(e)绘制了在不同的处理条件下在第14天时的nanog
+
集落的数目。(f)由第14天ipsc表现出的hesc
‑
特异性的标志物(nanog和ssea4)的典型染色。比例尺条,50μm(d和f)。
[0135]
图2.延长的化合物处理和细胞传代急剧地增加重编程序的集落的数目。(a)使用sb431542、pd0325901和thiazovivin进行人ipsc诱导的时间表。(b)第30天ipsc表达多能性标志物nanog、ssea4和tra
‑1‑
81。比例尺条,50μm。(c)有(上图)或没有(下图)3种化合物处理的第30天的培养物的alp染色。左图中的带框区域在右图中放大。比例尺条,200μm。(d)在没有分割(splitting)下,在不同的处理条件下,在第30天的nanog
+
集落的数目。(e)按照指示用胰蛋白酶消化的3种化合物处理过的培养物在第30天时的nanog
+
集落的数目。(f)用3种化合物处理得到的ipsc集落的rt
‑
pcr显示出内源性多能性标志物的再活化表达。hdf:人真皮成纤维细胞。
[0136]
图3.用3种化合物处理产生的ipsc的体外和体内分化。(a)显微照片显示出从ipsc产生的胚状体(eb)和体外分化成外胚层(βiii微管蛋白)、中胚层(brachyury)和内胚层(pdx1)细胞类型。比例尺条,eb:100μm;其它10μm。(b)rt
‑
pcr显示代表性的谱系标志物的表达和oct4mrna表达在分化细胞中的缺失。u
‑
未分化的,d
‑
分化的。(c)从ipsc在裸鼠中产生的畸胎瘤(测试3个独立的集落)由来自所有3个胚层的组织组成。左图:1
‑
肌肉,2
‑
神经上皮;中图:1
‑
皮肤,2
‑
肠上皮;右图:1
‑
骨,2
‑
软骨。比例尺条,20μm。
[0137]
图4.化合物处理以剂量依赖性的方式增强ips细胞产生。
[0138]
图5.thiazovivin的化学结构。
[0139]
图6.转基因表达和沉默与化合物处理无关。
[0140]
图7.通过化合物处理产生的稳定扩展的ips细胞集落表现出正常核型。
[0141]
图8.通过单基因、oct4和小分子从原代角质形成细胞产生人诱导多能干细胞。(a)用0.5μm pd0325901(pd)和0.5μm a
‑
83
‑
01(a83)处理显著改善从用4tf(4f,oksm)或3tf(3f,oks)转导的原代人角质形成细胞中产生ipsc。以100,000转导细胞/10cm皿的密度,接种nhek。(b)进一步化学筛选鉴别出ps48、nab和它们的组合,它们可以实质上增强用2tf(ok)转导的原代人角质形成细胞的重编程序。以100,000转导细胞/10cm皿的密度,接种nhek。(c)用于从单个重编程序基因oct4转导的原代人角质形成细胞产生人ipsc的实验方案。kcm,角质形成细胞培养基;hescm,人esc培养基。(d)从在挑取集落之前用2tf/ok或1tf/oct4转导的原代人角质形成细胞产生的ipsc集落的tra
‑1‑
81活免疫染色。(e)建立的人ipsc
‑
ok和ipsc
‑
o细胞表达典型的多能性标志物,包括alp(碱性磷酸酶)、oct4、sox2、nanog、ssea
‑
4和tra
‑1‑
81。用dapi进行核染色。
[0142]
图9.人ipsc
‑
ok和ipsc
‑
o细胞的深入表征。(a)内源性的多能性基因和外源性的oct4和klf4的rt
‑
pcr表达分析。使用gapdh作为输入对照。(b)通过硫酸氢盐基因组测序对
oct4和nanog启动子的甲基化分析。空心圆圈和实心圆圈分别指示在启动子区域中的未甲基化的和甲基化的cpg。(c)对比ipsc
‑
o细胞和nhek和hesc之间的总基因表达模式的散布图。用箭头显示多能性基因oct4、nanog和sox2的位置。黑色线指示样品之间的基因表达水平的线性等价和两倍变化。(d)使用eb方法,人ipsc
‑
ok和ipsc
‑
o可以在3个胚层中有效地在体外分化成细胞:包括神经外胚层细胞(βiii微管蛋白)、中胚层细胞(sma)和内胚层细胞(afp)。(e)使用eb方法,来自分化的人ipsc的3个胚层标志物的定量pcr检测:外胚层(pax6,βiii微管蛋白)、中胚层(foxf1,hand1)和内胚层(afp,gata6)。数据指示与未分化的亲代人ipsc相比gapdh
‑
标准化的倍数变化。(f)人ipsc
‑
ok和ipsc
‑
o可以有效地在scid小鼠中产生完整的畸胎瘤,其含有在3个胚层中的分化的细胞。
[0143]
图10.通过单基因、oct4和小分子,产生和表征来自人脐静脉内皮细胞的人诱导多能干细胞。(a)用于从oct4转导的huvec产生人ipsc的实验方案。hcm,huvec培养基;hescm,人esc培养基。(b)从表达典型的多能性标志物(包括nanog和ssea
‑
4)的huvec产生的hipsc
‑
o细胞。用dapi进行核染色。(c)通过内源多能性基因的rt
‑
pcr进行表达分析。gapdh用作输入对照。(d)通过硫酸氢盐基因组测序对oct4和nanog启动子的甲基化分析。空心圆圈和实心圆圈分别指示在启动子区域中的未甲基化的和甲基化的cpg。(e)使用eb方法,来自huvec的hipsc
‑
o细胞可以在3个胚层中有效地在体外分化成细胞:包括神经外胚层细胞(βiii微管蛋白)、中胚层细胞(sma)和内胚层细胞(afp)。(f)hipsc
‑
o细胞可以有效地在scid小鼠中产生完整的畸胎瘤,其含有在3个胚层中的分化的细胞。
[0144]
图11.来自ahek的人ipsc
‑
o细胞的表征。(a)从成年角质形成细胞建立的hipsc
‑
o细胞表达典型的多能性标志物,包括nanog、sox2和ssea
‑
4。用dapi进行核染色。(b)使用eb方法,这些hipsc
‑
o细胞可以在3个胚层中有效地在体外分化成细胞:包括神经外胚层细胞(βiii微管蛋白)、中胚层细胞(sma)和内胚层细胞(afp)。
[0145]
图12.来自afdc的人ipsc
‑
o细胞的表征。(a)从羊水获得的细胞建立的hipsc
‑
o细胞表达典型的多能性标志物,包括nanog、sox2和ssea
‑
4。用dapi进行核染色。(b)使用eb方法,这些hipsc
‑
o细胞可以在3个胚层中有效地在体外分化成细胞:包括神经外胚层细胞(βiii微管蛋白)、中胚层细胞(sma)和内胚层细胞(afp)。
[0146]
图13.其它的hipsc细胞系表达典型的多能性标志物。其它建立的hipsc
‑
o细胞系表达典型的多能性标志物,包括nanog和ssea
‑
4。用dapi进行核染色。
[0147]
图14.hipsc细胞系的无饲养细胞(feeder free)培养物。将hipsc分到基质胶(matrigel)/ecm
‑
包被的平板上的以前报道的化学成分确知的hesc培养基中。可以在无饲养细胞环境中维持和扩展这些hipsc。icc表明多能性标志物oct4和ssea4的表达。用dapi进行核染色。
[0148]
图15.hipsc的基因分型。使用基因组dna的rt
‑
pcr分析表明,仅oct4转基因整合进hipsc
‑
o系(hipsc
‑
o#1、hipsc
‑
o#3、hipsc
‑
o#21、hipsc
‑
o#26和hipsc
‑
o#31)的基因组中。将nhek(a)和huvec(b)用作阴性对照,而将载体用作阳性对照。
[0149]
图16.oct4转基因在hipsc中的整合。用ecori消化基因组dna(10μg),并用oct4 cdna探针(psin
‑
ef2
‑
oct4
‑
pur的ecori/spei片段)杂交。检测到多个转基因整合。
[0150]
图17.hipsc细胞系的核型分析。hipsc
‑
o#1(a)和hipsc
‑
o#21(b)的中期染色体涂片(metaphase spread)在第15代以后显示正常核型。
具体实施方式
[0151]
i.绪论
[0152]
本发明是基于下述令人惊奇的发现,即alk5抑制剂、mek抑制剂和rock抑制剂的组合会极大地提高用4种转录因子转化的非多能哺乳动物细胞中多能性的诱导效率。因此,本发明提供了在非多能哺乳动物细胞中诱导多能性的方法,其中所述方法包括:使所述非多能细胞接触至少tgfβ受体/alk5抑制剂,所述抑制剂优选地与mek/erk途径抑制剂相组合,在具体实施方案中,与rho gtp酶/rock抑制剂相组合。
[0153]
ii.tgfβ受体/alk5抑制剂
[0154]
激活素受体样激酶5(alk
‑
5)是介导对tgf
‑
β的细胞应答的主要tgfβ受体(massague j.annu rev biochem 67:753
–
791(1998);massague j,chen yg.genes dev 14:627
–
644(2000);franzen p,等.cell 75:681
–
692(1993))。在配体结合后,组成型活性的tβrii激酶会磷酸化alk
‑
5,后者又活化下游的信号转导级联。alk
‑5‑
活化的smad2和smad3磷酸化是最突出的途径(massague j,chen yg.genes dev 14:627
‑
644(2000))。一旦被活化,smad2/3与smad4结合,并转移至细胞核,在这里复合物转录调节靶基因表达。
[0155]
tgfβ受体(即,alk5)抑制剂可以包括针对tgfβ受体(例如,alk5)的抗体、tgfβ受体(例如,alk5)的显性失活突变体和抑制tgfβ受体(例如,alk5)的表达的sirna、微小rna、反义核酸和其它多核苷酸。示例性的tgfβ受体/alk5抑制剂包括、但不限于:sb431542(参见,例如,inman,等,molecular pharmacology(分子药理学)62(1):65
‑
74(2002)),a
‑
83
‑
01,也已知为3
‑
(6
‑
甲基
‑2‑
吡啶基)
‑
n
‑
苯基
‑4‑
(4
‑
喹啉基)
‑
1h
‑
吡唑
‑1‑
硫代酰胺(参见,例如,tojo,等,cancer science(癌症科学)96(11):791
‑
800(2005),并且例如可从toicris bioscience(toicris生物科学)商购获得);2
‑
(3
‑
(6
‑
甲基吡啶
‑2‑
基)
‑
1h
‑
吡唑
‑4‑
基)
‑
1,5
‑
二氮杂萘,wnt3a/bio(参见,例如,dalton,等,wo2008/094597,通过引用并入本文),bmp4(参见,dalton,同前所述),gw788388(
‑
{4
‑
[3
‑
(吡啶
‑2‑
基)
‑
1h
‑
吡唑
‑4‑
基]吡啶
‑2‑
基}
‑
n
‑
(四氢
‑
2h
‑
吡喃
‑4‑
基)苯甲酰胺)(参见,例如,gellibert,等,journal of medicinal chemistry(医学化学杂志)49(7):2210
‑
2221(2006)),sm16(参见,例如,suzuki,等,cancer research(癌症研究)67(5):2351
‑
2359(2007)),in
‑
1130(3
‑
((5
‑
(6
‑
甲基吡啶
‑2‑
基)
‑4‑
(喹喔啉
‑6‑
基)
‑
1h
‑
咪唑
‑2‑
基)甲基)苯甲酰胺)(参见,例如,kim,等,xenobiotica 38(3):325
‑
339(2008)),gw6604(2
‑
苯基
‑4‑
(3
‑
吡啶
‑2‑
基
‑
1h
‑
吡唑
‑4‑
基)吡啶)(参见,例如,de gouville,等,drug news perspective(药物信息观点)19(2):85
‑
90(2006)),sb
‑
505124(2
‑
(5
‑
苯并[1,3]间二氧杂环戊烯
‑5‑
基
‑2‑
叔
‑
丁基
‑
3h
‑
咪唑
‑4‑
基)
‑6‑
甲基吡啶盐酸盐)(参见,例如,dacosta,等,molecular pharmacology(分子药理学)65(3):744
‑
752(2004))和嘧啶衍生物(参见,例如,在stiefl,等,wo2008/006583中列出的那些,其通过引用并入本文)。此外,虽然“alk5抑制剂”不意欲包括非特异性激酶抑制剂,但是“alk5抑制剂”应该理解为包括除alk5外还抑制alk4和/或alk7的抑制剂,诸如,例如,sb
‑
431542(参见,例如,inman,等,j mol.phamacol.(分子药理学杂志)62(1):65
‑
74(2002)。
[0156]
考虑到本文中显示抑制alk5的作用的数据,据信tgfβ/活化素途径的抑制将具有相似的作用。因此,tgfβ/活化素途径(例如,上游或下游)的任何抑制剂可以与本文每段中所述的alk5抑制剂组合使用或替代alk5抑制剂使用。示例性的tgfβ/活化素途径抑制剂包括,但不限于:tgfβ受体抑制剂,smad 2/3磷酸化抑制剂,smad 2/3和smad 4相互作用抑制
剂,以及smad 6和smad 7的激活剂/激动剂。此外,下文所述的分类仅是为了组织目的,并且本领域技术人员将知晓化合物可以影响途径中的一个点或多个点,并且因此化合物可以在多于一种所定义的分类中起作用。
[0157]
tgfβ受体抑制剂可以包括针对tgfβ受体的抗体、tgfβ受体的显性失活突变体和靶向tgfβ受体的sirna或反义核酸。抑制剂的具体实例包括、但不限于:su5416;2
‑
(5
‑
苯并[1,3]二氧杂环戊烯
‑5‑
基
‑2‑
叔丁基
‑
3h
‑
咪唑
‑4‑
基)
‑6‑
甲基吡啶盐酸盐(sb
‑
505124);乐地单抗(lerdelimumb)(cat
‑
152);美替木单抗(metelimumab)(cat
‑
192);gc
‑
1008;id11;ap
‑
12009;ap
‑
11014;ly550410;ly580276;ly364947;ly2109761;sb
‑
505124;sb
‑
431542;sd
‑
208;sm16;npc
‑
30345;ki26894;sb
‑
203580;sd
‑
093;格列卫(gleevec);3,5,7,2
′
,4
′‑
五羟黄酮(3,5,7,2
′
,4
′‑
pentahydroxyflavone)(桑色素(morin));活化素
‑
m108a;p144;可溶tbr2
‑
fc;和靶向tgfβ受体的反义转染的肿瘤细胞。(参见,例如,wrzesinski,等,clinical cancer research(临床癌症研究)13(18):5262
‑
5270(2007);kaminska,等,acta biochimica polonica 52(2):329
‑
337(2005);和chang,等,frontiers in bioscience(生物科学前沿)12:4393
‑
4401(2007))。另外,发明人已经发现,tgfβ抑制剂bmp
‑
4和bmp
‑
7具有与在实施例中描述的alk5抑制剂类似的细胞重编程序效应,从而提供了tgfβ抑制剂可以用于重编程序(例如,与mek/erk途径抑制剂和rho gtp酶/rock抑制剂相组合)的其它证据。示例性的人bmp
‑
4和bmp
‑
7蛋白序列阐述在例如美国专利号7,405,192中。
[0158]
smad 2/3磷酸化的抑制剂可以包括针对smad2或smad3的抗体、smad2或smad3的显性失活突变体和靶向smad2或smad3的反义核酸。抑制剂的具体实例包括pd169316;sb203580;sb
‑
431542;ly364947;a77
‑
01;和3,5,7,2
′
,4
′‑
五羟黄酮(桑色素(morin))。(参见,例如,wrzesinski,同前所述;kaminska,同前所述;shimanuki,等,oncogene(癌基因)26:3311
‑
3320(2007);和kataoka,等,ep1992360,其通过引用并入本文。)
[0159]
smad 2/3和smad4的相互作用的抑制剂可以包括针对smad2、smad3和/或smad4的抗体,smad2、smad3和/或smad4的显性失活突变体和靶向smad2、smad3和/或smad4的反义核酸。smad 2/3和smad4的相互作用的抑制剂的具体实例包括、但不限于:trx
‑
sara、trx
‑
xfoxh1b和trx
‑
lef1(参见,例如,cui,等,oncogene(癌基因)24:3864
‑
3874(2005)和zhao,等,molecular biology of the cell(分子分子生物学),17:3819
‑
3831(2006))。
[0160]
smad 6和smad 7的活化剂/激动剂包括、但不限于:针对smad 6或smad 7的抗体,smad 6或smad 7的显性失活突变体和靶向smad6或smad 7的反义核酸。抑制剂的具体实例包括、但不限于:smad7
‑
as pto
‑
寡核苷酸。参见,例如,miyazono,等,us6534476,和steinbrecher,等,us2005119203,两者均通过引用并入本文。
[0161]
技术人员会明白,tgfβ受体/alk5抑制剂的浓度将取决于使用的具体抑制剂。通常,细胞培养物中的tgfβ受体/alk5抑制剂的浓度是在ic20
‑
ic100(即,实现细胞的20%抑制至100%抑制的浓度)的范围内。例如,sb432542可以在0.5
‑
10μm使用,最佳地在约1
‑
5μm使用。在某些实施方案中,可以使用2种或更多种不同的tgfβ受体/alk5抑制剂的组合。
[0162]
iii.mek/erk途径抑制剂
[0163]
mek/erk途径指构成信号转导途径的一部分的mek和erk丝氨酸/苏氨酸激酶。通常,活化的ras会激活raf激酶的蛋白激酶活性。raf激酶会磷酸化和活化mek,后者又磷酸化和活化促分裂原活化蛋白激酶(mapk)。mapk最初被称作“胞外信号调节的激酶”(erk)和微
管相关的蛋白激酶(mapk)。因而,“erk”和“mapk”同义地使用。
[0164]
mek/erk途径抑制剂指作为raf/mek/erk途径的一部分的mek或erk的抑制剂。因为发明人已经发现,mek抑制剂可有效地改善ipsc的诱导,且因为mek直接地控制erk活性,所述据信,关于本发明描述的mek抑制剂可以根据需要被erk抑制剂替换。
[0165]
mek(即,mek1(也称作促分裂原活化蛋白激酶激酶1)和/或mek2(也称作促分裂原活化蛋白激酶激酶2))的抑制剂可以包括针对mek的抗体,mek的显性失活突变体和抑制mek的表达的sirna和sirna、微小rna、反义核酸和其它多核苷酸。mek抑制剂的具体实例包括,但不限于:pd0325901,(参见,例如,rinehart,等,journal of clinical oncology(临床肿瘤学杂志)22:4456
‑
4462(2004)),pd98059(例如,可从cell signaling technology(细胞信号传导技术)获得),u0126(例如,可从cell signaling technology(细胞信号传导技术)获得),sl 327(例如,可从sigma
‑
aldrich(西格玛
‑
奥地里奇)获得),arry
‑
162(例如,可从array biopharma获得),pd184161(参见,例如klein,等,neoplasia(瘤形成)8:1
–
8(2006)),pd184352(ci
‑
1040)(参见,例如,mattingly,等,the journal of pharmacology and experimental therapeutics(药理学和实验治疗学杂志)316:456
–
465(2006)),舒尼替尼(sunitinib)(参见,例如,voss,等,us2008004287,其通过引用并入本文),索拉非尼(sorafenib)(参见,voss同前所述),凡德他尼(vandetanib)(参见,voss同前所述),帕唑帕尼(pazopanib)(参见,例如,voss同前所述),阿昔替尼(axitinib)(参见,voss同前所述)和ptk787(参见,voss同前所述)。
[0166]
目前,一些mek抑制剂正在进行临床实验评估。ci
‑
1040已经在i期和ii期癌症临床实验中进行评估(参见,例如,rinehart,等,journal of clinical oncology(临床肿瘤学杂志)22(22):4456
‑
4462(2004))。临床实验中评估的其它mek抑制剂包括pd184352(参见,例如,english,等,trends in pharmaceutical sciences(制药科学趋势)23(1):40
‑
45(2002)),bay 43
‑
9006(参见,例如,chow,等,cytometry(血细胞计数)(communications in clinical cytometry(临床血细胞技术通讯))46:72
‑
78(2001))、pd
‑
325901(也为pd0325901)、gsk1120212、arry
‑
438162、rdea119、azd6244(也为arry
‑
142886或arry
‑
886)、ro5126766、xl518和azd8330(也为arry
‑
704)。(参见,例如,来自全国卫生研究所(national institutes of health)位于万维网www.clinicaltrials.gov的信息以及来自全国癌症研究所(nation cancer institute)位于万维网www.cancer.gov/clinicaltrials的信息。
[0167]
示例性的erk(即,erk1(也称作mapk3)和/或erk2(也称作mapk1))抑制剂包括pd98059(参见,例如,zhu,等,oncogene 23:4984
‑
4992(2004))、u0126(参见,zhu,同前所述)、fr180204(参见,例如,ohori,drug news perspective 21(5):245
‑
250(2008))、舒尼替尼(参见,例如,us2008004287通过引用并入本文)、索拉非尼、凡德他尼(vandetanib)、帕唑帕尼(pazopanib)、阿昔替尼(axitinib)和ptk787。
[0168]
技术人员会明白,mek/erk途径抑制剂的浓度将取决于使用哪种具体的抑制剂。在具体实施方案中,可以使用2种或更多种不同的mek/erk途径抑制剂的组合。
[0169]
iv.rho gtp酶/rock抑制剂
[0170]
本发明提供了rho
‑
gtp酶/rock途径的抑制剂的用途和包含所述抑制剂的组合物。所述途径包括下游蛋白肌球蛋白ii,后者进一步是rock(rho
‑
rock
‑
肌球蛋白ii形成该途径/轴)的下游。因而,可以使用rho gtp酶抑制剂、rock抑制剂或肌球蛋白ii抑制剂中的任
一种或全部来实现本文所述的效果。技术人员会明白,rho
‑
gtp酶/rock途径抑制剂的浓度将取决于使用哪种具体的抑制剂。在其它的实施方案中,可以使用2种或更多种不同的rho
‑
gtp酶/rock途径抑制剂的组合。
[0171]
任意rho gtp酶将在本发明的方法和组合物中是有效的。rho gtp酶的抑制剂可以包括结合rho gtp酶的抗体,rho gtp酶的显性失活突变体和靶向rho gtp酶的sirna、微小rna、反义核酸和其它多核苷酸。一种示例性的rho gtp酶抑制剂是肉毒梭菌(clostridium botulinum)c3毒素。
[0172]
任意肌球蛋白ii抑制剂将在本发明的方法和组合物中是有效的。肌球蛋白ii的抑制剂可以包括结合肌球蛋白ii的抗体,肌球蛋白ii的显性失活突变体和靶向肌球蛋白ii的sirna、微小rna、反义核酸和其它多核苷酸。一种示例性的肌球蛋白ii抑制剂是blebbistatin。发明人已经发现,blebbistatin可以替代在实施例部分中描述的混合物和方法中的sb431542(一种alk5抑制剂),尽管具有降低的效果。其它抑制剂包括、但不限于在美国专利号7,585,844中描述的那些。
[0173]
在本文中使用的“rock”指在rho的下游起作用的丝氨酸/苏氨酸激酶。rock i(也称作rokβ或p160rock)和rock ii(也称作rokα或rho激酶)都受rhoa调节。参见例如,riento,k.和ridley,a.j.,nat.rev.mol.cell.biol.,4,446
‑
456(2003)。“rock抑制剂”指抑制两种或任一种rock的试剂。rock的抑制剂可以包括结合rock的抗体,rock的显性失活突变体和靶向rock的sirna、微小rna、反义核酸和其它多核苷酸。一些示例性的rock抑制剂包括、但不限于在下述文献中描述的那些:国际公开号wo98/06433、wo00/78351、wo01/17562、wo02/076976、wo02/076977、wo2003/062227、wo2003/059913、wo2003/062225、wo2002/076976、wo2004/039796、wo03/082808、wo05/035506、wo05/074643和美国专利申请号2005/0209261、2005/0192304、2004/0014755、2004/0002508、2004/0002507、2003/0125344和2003/0087919。rock抑制剂包括,例如,(+)
‑
(r)
‑
反式
‑4‑
(1
‑
氨基乙基)
‑
n
‑
(4
‑
吡啶基)环己烷羧酰胺二盐酸盐或wf536;4
‑
[(1r)
‑1‑
氨基乙基]
‑
n
‑
(4
‑
吡啶基)苯甲酰胺一盐酸盐或法舒地尔;5
‑
(六氢
‑
1h
‑
1,4
‑
二氮杂
‑1‑
基磺酰基)异喹啉盐酸盐或化合物1;4
‑
[(反式
‑4‑
氨基环己基)氨基]
‑
2,5
‑
二氟苯甲酰胺或化合物2;4
‑
[(反式
‑4‑
氨基环己基)氨基]
‑5‑
氯
‑2‑
氟苯甲酰胺或化合物3;2
‑
[4
‑
(1h
‑
吲唑
‑5‑
基)苯基]
‑2‑
丙胺二盐酸盐或化合物4;n
‑
(3
‑
甲氧基苄基)
‑4‑
(4
‑
吡啶基)苯甲酰胺、y
‑
27632(参见,例如,ishizaki等,mol.pharmacol.57,976
‑
983(2000);narumiya等,methods enzymol.325,273
‑
284(2000))、法舒地尔(也称作ha1077)(例如,参考uenata等,nature 389:990
‑
994(1997))、sc
‑
3536(参见,例如,darenfed,h.,等cell motil.cytoskeleton.64:97
‑
109,2007)、h
‑
1152(例如,参考sasaki等,pharmacol.ther.93:225
‑
232(2002))、wf
‑
536(例如,参考nakajima等,cancer chemother pharmacol.52(4):319
‑
324(2003))、y
‑
30141(描述在美国专利号5,478,838中)和它们的衍生物以及rock的反义核酸、诱导rna干扰的核酸(例如,sirna)、竞争肽、拮抗剂肽、抑制性的抗体、抗体
‑
scfv片段、它们的显性失活突变体和表达载体。
[0174]
根据需要,上述化合物可以用药学上可接受的无机酸或有机酸制成酸加成盐。酸加成盐的实例包括:含有无机酸(诸如盐酸、氢溴酸、硫酸、磷酸等)的盐;含有有机羧酸(诸如甲酸、醋酸、富马酸、马来酸、草酸、柠檬酸、苹果酸、酒石酸、天冬氨酸和谷氨酸)的盐;和含有磺酸(诸如甲磺酸、苯磺酸、对甲苯磺酸、羟基苯磺酸、二羟基苯磺酸等)的盐。
[0175]
化合物和其酸加成盐可以是其酸酐、水合物或溶剂化物。
[0176]
为了实践本发明,rock抑制剂通常是合适的,但不限于此,只要抑制剂可以抑制rho
‑
激酶(rock)的功能,合适的抑制剂包括y
‑
27632(例如,参考ishizaki等,mol.pharmacol.57,976
‑
983(2000);narumiya等,methods enzymol.325,273
‑
284(2000))、sc
‑
3536(参见,例如,darenfed,h.,等cell motil.cytoskeleton.64:97
‑
109,2007)、法舒地尔(也称作ha1077)(例如,参考uenata等,nature 389:990
‑
994(1997))、h
‑
1152(例如,参考sasaki等,pharmacol.ther.93:225
‑
232(2002))、wf
‑
536(例如,参考nakajima等,cancer chemother pharmacol.52(4):319
‑
324(2003))、y
‑
30141(描述在美国专利号5,478,838)和它们的衍生物和rock的反义核酸、诱导rna干扰的核酸(例如,sirna)、竞争肽、拮抗剂肽、抑制性的抗体、抗体
‑
scfv片段、它们的显性失活突变体和表达载体。此外,由于其它低分子化合物已知是rock抑制剂,这样的化合物或其衍生物也可以用于本发明中(例如,参考美国专利申请号20050209261、20050192304、20040014755、20040002508、20040002507、20030125344和20030087919和国际专利公开号2003/062227、2003/059913、2003/062225、2002/076976和2004/039796)。在本发明中,也可以使用一种或两种或更多种rock抑制剂的组合。
[0177]
其它的rock抑制剂包括,例如,ha1100、3
‑
(4
‑
吡啶基)
‑
1h
‑
吲哚和n
‑
(4
‑
吡啶基)
‑
n
’‑
(2,4,6
‑
三氯苯基)脲,它们每种是可商购的(例如,从alexis biochemicals(plymouth meeting,pa))。
[0178]
在一些实施方案中,rock抑制剂具有下式:
[0179][0180]
在式(i)中,环a是取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。环b是取代的或未取代的杂环烷基、或取代的或未取代的杂芳基。
[0181]
l1是
‑
c(o)
‑
nr2‑
或
‑
nr2‑
c(o)
‑
。l2是键、取代的或未取代的亚烷基、或取代的或未取代的杂亚烷基。
[0182]
r1和r2独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0183]
在一些实施方案中,环a是取代的或未取代的芳基。环a还可以是取代的或未取代的苯基。
[0184]
在其它实施方案中,环b是取代的或未取代的杂环烷基、或取代的或未取代的杂芳基。环b还可以是取代的或未取代的杂芳基。在其它实施方案中,环b是取代的或未取代的吡唑基、取代的或未取代的呋喃基、取代的或未取代的咪唑基、取代的或未取代的异唑基、取代的或未取代的二唑基、取代的或未取代的唑基、取代的或未取代的吡咯基、取代
的或未取代的吡啶基、取代的或未取代的嘧啶基、取代的或未取代的哒嗪基、取代的或未取代的噻唑基、取代的或未取代的三唑基、取代的或未取代的噻吩基、取代的或未取代的二氢噻吩并
‑
吡唑基、取代的或未取代的硫茚基、取代的或未取代的咔唑基、取代的或未取代的苯并噻吩基、取代的或未取代的苯并呋喃基、取代的或未取代的吲哚基、取代的或未取代的喹啉基、取代的或未取代的苯并三唑基、取代的或未取代的苯并噻唑基、取代的或未取代的苯并唑基、取代的或未取代的苯并咪唑基、取代的或未取代的异喹啉基、取代的或未取代的异吲哚基、取代的或未取代的吖啶基、取代的或未取代的苯并异唑基(benzoisazolyl)、或取代的或未取代的二甲基乙内酰脲。
[0185]
l2可以是取代的或未取代的c1‑
c
10
烷基。在一些实施方案中,l2是未取代的c1‑
c
10
烷基。l2还可以是取代的或未取代的亚甲基(例如未取代的亚甲基)。
[0186]
r2可以是氢。r1可以是氢或未取代的c1‑
c
10
烷基。在一些实施方案中,r1简单地是氢。
[0187]
在式(i)的一些实施方案中,环a是取代的或未取代的芳基,环b是取代的或未取代的杂芳基,r1是氢,且l2是未取代的c1‑
c
10
烷基。
[0188]
在另一个实施方案中,所述rock抑制剂具有下式:
[0189][0190]
在式(ii)中,y是0
‑
3的整数,且z是0
‑
5的整数。x是
‑
n=、
‑
ch=或
‑
cr4=。r1和l2如上面在式(i)的定义中所定义。
[0191]
r3、r4和r5独立地是
‑
cn、
‑
s(o)
n
r6、
‑
nr7r8、
‑
c(o)r9、
‑
nr
10
‑
c(o)r
11
、
‑
nr
12
‑
c(o)
‑
or
13
、
‑
c(o)nr
14
r
15
、
‑
nr
16
s(o)2r
17
、
‑
or
18
、
‑
s(o)2nr
19
、取代的或未取代的烷基、取代的或未取代的杂烷基、取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基,其中n是0
‑
2的整数,其中如果z大于1,则2个r3部分任选地连接到一起,以形成取代的或未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0192]
r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
独立地是氢、取代的或未取代的烷基、取代的或未取代的杂烷基、未取代的环烷基、取代的或未取代的杂环烷基、取代的或未取代的芳基、或取代的或未取代的杂芳基。
[0193]
在一些实施方案中,l2是取代的或未取代的c1‑
c
10
烷基。l2还可以是未取代的c1‑
c
10
烷基。或者,l2是取代的或未取代的亚甲基(例如未取代的亚甲基)。
[0194]
在其它实施方案中,x是
‑
n=或
‑
ch=。符号z可以是2。在其它实施方案中,在相邻顶点处的2个r3部分连接到一起形成取代的或未取代的杂环烷基。符号z还可以是1。符号y可以是0或1。
[0195]
r3可以是
‑
or
18
。r
18
可以是氢或未取代的c1‑
c
10
烷基。
[0196]
在一些实施方案中,l2是取代的或未取代的亚甲基(例如取代的亚甲基),x是
‑
n=
journal(生物化学杂志)359:1
‑
16(2001))和tdzd
‑
8(参见,例如,chin,等,molecular brain research(分子脑研究),137(1
‑
2):193
‑
201(2005))。可获自calbiochem的其它示例性gsk3抑制剂(参见,例如,dalton,等,wo2008/094597,其通过引用并入本文),包括、但不限于:bio(2
′
z,3
′
£)
‑6‑
溴靛玉红
‑3′‑
肟(gsk3抑制剂ix);bio
‑
丙酮肟(2
′
z,3
′
e)
‑6‑
溴靛玉红
‑3′‑
丙酮肟(gsk3抑制剂x);(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
(2
‑
苯基喹唑啉
‑4‑
基)胺(gsk3
‑
抑制xiii);吡啶并咔唑
‑
环戊二烯合钌复合物(gsk3抑制剂xv);tdzd
‑
8 4
‑
苄基
‑2‑
甲基
‑
1,2,4
‑
噻二唑
‑
3,5
‑
二酮(gsk3β抑制剂i);2
‑
硫代(3
‑
碘苄基)
‑5‑
(1
‑
吡啶基)
‑
[1,3,4]
‑
二唑(gsk3β抑制剂ii);otdzt 2,4
‑
二苄基
‑5‑
氧代噻二唑烷
‑3‑
硫酮(gsk3β抑制剂iii);α
‑4‑
二溴乙酰苯(gsk3β抑制剂vii);ar
‑
ao 14418n
‑
(4
‑
甲氧基苄基)
‑
n
′‑
(5
‑
硝基
‑
1,3
‑
噻唑
‑2‑
基)脲(gsk
‑
3β抑制剂viii);3
‑
(1
‑
(3
‑
羟丙基)
‑
1h
‑
吡咯并[2,3
‑
b]吡啶
‑3‑
基]
‑4‑
吡嗪
‑2‑
基
‑
吡咯
‑
2,5
‑
二酮(gsk
‑
3β抑制剂xi);twsl 19吡咯并嘧啶化合物(gsk3β抑制剂xii);l803 h
‑
keappappqspp
‑
nh2或其肉豆蔻酰化形式(gsk3β抑制剂xiii);2
‑
氯
‑1‑
(4,5
‑
二溴
‑
噻吩
‑2‑
基)
‑
乙酮(gsk3β抑制剂vi);ar
‑
ao144
‑
18;sb216763;和sb415286。已经鉴定了与抑制剂相互作用的gsk3b残基。参见,例如,bertrand等,j.mol biol.(分子生物学杂志)333(2):393
‑
407(2003)。gsk3抑制剂可以活化例如wnt/β
‑
连环蛋白途径。许多β
‑
连环蛋白下游基因共调节多能性基因网络。例如,gsk抑制剂会活化cmyc表达,以及增强它的蛋白稳定性和转录活性。因而,在一些实施方案中,gsk3抑制剂可以用于刺激细胞中的内源myc多肽表达,从而消除诱导多能性对myc表达的需要。
[0204]
技术人员会明白,gsk3抑制剂的浓度将取决于使用哪种具体的抑制剂。在某些实施方案中,可以使用2种或更多种不同的gsk3抑制剂的组合。
[0205]
vi.诱导多能性的方法
[0206]
迄今为止,已经确立了大量用于将非多能哺乳动物细胞诱导成诱导多能干细胞(ipsc)的不同方法和方案。据信,本文所述的试剂可以与用于产生ipsc的基本上任意方案相组合,并从而提高所述方案的效率。因而,本发明提供了用至少tgfβ受体/alk5抑制剂温育非多能细胞,所述抑制剂优选地与mek/erk途径抑制剂相组合,在具体实施方案中,rho gtp酶/rock抑制剂与用于产生ipsc的任意方案相组合。方案的选择如下面所述,相信每个方案可与本发明的试剂相组合以提高所述方案的效率。
[0207]
ipsc生产方案的效率的提高将取决于所述方案和使用本发明的哪种试剂。在一些实施方案中,与没有包含本发明的试剂(即,tgfβ受体/alk5抑制剂、mek/erk途径抑制剂和rho gtp酶/rock抑制剂)的相同方案相比,所述效率提高了至少10%、20%、50%、75%、100%、150%、200%、300%或更多。关于在一个特定时间范围内产生的ipsc的数目或产生ipsc的速率的提高,测量效率。
[0208]
研究已经证实,用在esc中高度表达的4种转录因子(oct
‑
3/4、sox2、klf4和c
‑
myc)对小鼠成纤维细胞进行反转录病毒转导,会产生诱导多能干(ips)细胞。参见,takahashi,k.&yamanaka,s.cell 126,663
‑
676(2006);okita,k.,ichisaka,t.&yamanaka,s.nature 448,313
‑
317(2007);wernig,m.等nature 448,318
‑
324(2007);maherali,n.等cell stem cell 1,55
‑
70(2007);meissner,a.,wernig,m.&jaenisch,r.nature biotechnol.25,1177
‑
1181(2007);takahashi,k.等cell 131,861
‑
872(2007);yu,j.等science 318,1917
‑
1920(2007);nakagawa,m.等nature biotechnol.26,101
‑
106(2007);wernig,m.,
meissner,a.,cassady,j.p.&jaenisch,r.cell stem cell.2,10
‑
12(2008)。通过畸胎瘤形成和嵌合体贡献来判断,ips细胞在形态学、增殖和多能性方面与esc类似。
[0209]
如上面所指出的,尽管最初的方案包含将4种转录因子导入非多能细胞中,更近地已经发现,可以省略有些转录因子。因而,在一些实施方案中,所述方案包含:在允许非多能细胞变成ipsc的条件下,将oct多肽、klf多肽、myc多肽和sox多肽中的一种、两种或三种导入非多能细胞中。例如,maherali和konrad hochedlinger,“tgfβsignal inhibition cooperates in the induction of ipscs and replaces sox2 and cmyc”current biology(2009)和wo/2009/117439各自描述了不需要所有4种转录因子来诱导多能性的方案。此外,发明人已经发现,可以如下产生ipsc:将单独的oct4导入细胞中,并用tgfβ受体/alk5抑制剂、mek/erk途径抑制剂、rho gtp酶/rock抑制剂和组蛋白脱乙酰酶(hdac)抑制剂温育所述细胞。例如,在足够量的sb431542、pd0325901、tzv和丙戊酸或丁酸钠存在下,将外源性的oct4导入哺乳动物细胞中,成功地产生ipsc细胞。
[0210]
示例性hdac抑制剂可以包括结合一种或多种hdac的抗体,一种或多种hdac的显性失活突变体,和靶向一种或多种hdac的sirna和反义核酸。hdac抑制剂包括、但不限于:tsa(制滴菌素a(trichostatin a))(参见,例如,adcock,british journal of pharmacology(英国药理学杂志)150:829
‑
831(2007))、vpa(丙戊酸)(参见,例如,munster,等,journal of clinical oncology(临床肿瘤学杂志)25:18s(2007):1065)、丁酸钠(nabu)(参见,例如,han,等,immunology letters(免疫学通讯)108:143
‑
150(2007))、saha(辛二酰苯胺异羟肟酸或伏林司他(vorinostat))(参见,例如,kelly,等,nature clinical practice oncology(自然临床实践肿瘤学)2:150
‑
157(2005))、苯基丁酸钠(参见,例如,gore,等,cancer research(癌症研究)66:6361
‑
6369(2006))、酯肽(depsipeptide)(fr901228,fk228)(参见,例如,zhu,等,current medicinal chemistry(当前医学化学)3(3):187
‑
199(2003))、trapoxin(tpx)(参见,例如,furumai,等,pnas 98(1):87
‑
92(2001))、含环异羟肟酸的肽1(chap1)(参见,furumai同前所述)、ms
‑
275(参见,例如,carninci,等,wo2008/126932,通过引用并入本文))、lbh589(参见,例如,goh,等,通过引用并入本文的wo2008/108741)和pxd101(参见,goh,同前所述)。一般而言,在整体水平上,多能细胞具有更多的组蛋白乙酰化作用,而分化的细胞具有更少的组蛋白乙酰化作用。组蛋白乙酰化作用也参与组蛋白和dna甲基化的调节。在一些实施方案中,hdac抑制剂促进沉默的多能性基因的活化。
[0211]
为了解决由携带整合的外源序列的靶细胞基因组产生的安全性问题,已经进一步开发了许多改进的遗传方案。这些方案会产生具有潜在地降低的风险的ips细胞,并包括非整合型腺病毒来递送重编程序基因(stadtfeld,m.,等(2008)science 322,945
‑
949)、瞬时转染重编程序质粒(okita,k.,等(2008)science 322,949
‑
953)、piggybac转座系统(woltjen,k.,等(2009).nature 458,766
‑
770,kaji,k.,等(2009)nature 458,771
‑
775)、cre
‑
可切割的病毒(soldner,f.,等(2009)cell 136,964
‑
977)和基于orip/ebna1的附加型表达系统(yu,j.,等(2009)science doi:10.1126)。此外,在某些细胞类型中利用内源基因表达的策略也允许更容易地重编程序和/或对外源性基因的需求更少(shi,y.,等(2008b).cell stem cell 2,525
‑
528;aasen,t.,等(2008)nat biotechnol 26,1276
‑
1284;kim,j.b.,等(2008).nature 454,646
‑
650)。此外,已经鉴别出增强重编程序效率和替代某些重
编程序因子的小分子(shi,y.,等(2008)cell stem cell 2,525
‑
528,shi,y.,等.(2008)cell stem cell 3,568
‑
574,li,w.,等(2009)cell stem cell 4,16
‑
19;huangfu,d.,等(2008)nat biotechnol 26,1269
‑
1275,huangfu,d.,等(2008)nat biotechnol 26,795
‑
797)。
[0212]
此外,最近已经证实,转录因子可以作为外源蛋白递送至非多能细胞,以产生ipsc。参见,例如,wo/2009/117439;zhou等,cell stem cell 4:381
‑
384(2009)。通过许多不包括导入编码多肽的多核苷酸的不同方法,可以将外源性多肽(即,从细胞外面提供的和/或不是由细胞生产的蛋白)导入细胞中。因而,在一些实施方案中,使非多能细胞接触tgfβ受体/alk5抑制剂,所述抑制剂优选地与mek/erk途径抑制剂相组合,在具体实施方案中,与rho gtp酶/rock抑制剂和一种或更多种外源性转录因子蛋白(例如,oct多肽、klf多肽、myc多肽和sox多肽中的1种、2种、3种或所有4种)相组合。
[0213]
已经描述了将有关的蛋白因子导入靶细胞中的多种方法。在一个实施方案中,将多肽导入至细胞可以包括:将包含一个或多个表达盒的多核苷酸导入细胞中,并诱导表达,由此通过所述表达盒的转录和翻译,将所述多肽导入细胞中。
[0214]
或者,可以在允许将蛋白导入细胞中的条件下,在有靶细胞存在下,简单地培养一种或多种蛋白。参见,例如,zhou h等,generation of induced pluripotent stem cells using recombinant proteins.cell stem cell.2009年5月8日;4(5):381
‑
4。在一些实施方案中,所述外源蛋白包含目标转录因子多肽,后者与增强该转录因子进入细胞(和在一些实施方案中,细胞核)的能力的多肽相连(例如,连接成为融合蛋白,或以其它方式共价地或非共价地相连)。
[0215]
增强跨膜转运的多肽序列的实例包括、但不限于:果蝇同源异型蛋白触角足转录蛋白(anthd)(joliot等,new biol.(新生物学)3:1121
‑
34,1991;joliot等,proc.natl.acad.sci.usa(美国国家科学院学报),88:1864
‑
8,1991;le roux等,proc.natl.acad.sci.usa(美国国家科学院学报),90:9120
‑
4,1993)、单纯疱疹病毒结构蛋白vp22(elliott和o’hare,cell(细胞)88:223
‑
33,1997);hiv
‑
1转录激活剂tat蛋白(green和loewenstein,cell(细胞)55:1179
‑
1188,1988;frankel和pabo,cell(细胞)55:1 289
‑
1193,1988);递送增强转运蛋白诸如在美国专利号6,730,293中描述的(包括但不限于包括至少7
‑
25个连续精氨酸的肽序列);和可商购的penetratin
tm 1肽,和可获自法国巴黎的daitos s.a.的平台的diatos肽载体(“dpvs”)。还参见,wo/2005/084158和wo/2007/123667和其中描述的其它转运蛋白。不仅这些蛋白可以穿过质膜,而且其它蛋白(诸如本文所述的转录因子)的附着足以刺激细胞摄取这些复合物。
[0216]
在一些实施方案中,本文所述的转录因子多肽作为脂质体或液体混合液(诸如可商购的fugene6和lipofectamine)的一部分外源性地导入。在另一个备选方案中,转录因子蛋白可以通过显微注射或以其它方式直接导入到靶细胞中。
[0217]
如在wo/2009/117439的实施例中所讨论地,用本发明的转录因子多肽温育细胞一段延长的时期对该细胞有毒。因此,本发明用klf多肽、oct多肽、myc多肽和/或sox多肽中的一种或多种间歇性温育非多能哺乳动物细胞,在细胞温育的间隔期间缺乏所述一种或多种多肽。在一些实施方案中,使用和不用所述多肽的温育周期可以重复2、3、4、5、6或更多次,且进行足够长的时间(即,使用和不用所述蛋白的温育),从而实现多能细胞的形成。可以包
括不同试剂(例如,mek/erk途径抑制剂和/或gsk3抑制剂和/或tgfβ/alk5抑制剂和/或rho gtp酶/rock途径抑制剂),以提高本方法的效率。
[0218]
可以在递送程序化转录因子(例如,通过表达盒或作为蛋白递送)之前、同时或之后,使不同的抑制剂(例如,tgfβ受体/alk5抑制剂、mek/erk途径抑制剂,在具体实施方案中,与rho gtp酶/rock抑制剂和/或gsk3抑制剂等相组合)接触非多能细胞。为了方便,将递送重编程序因子的当天命名为“第1天”。在一些实施方案中,在第3
‑
7天左右使所述抑制剂接触聚集的(即,作为“混合物”)细胞,并持续7
‑
14天。或者,在一些实施方案中,在第0天(即,在预先程序化因子前一天)使所述混合物接触细胞,并温育约14
‑
30天。
[0219]
在其它实施方案中,在不同的时间加入不同的抑制剂。在一些实施方案中,在递送重编程序因子以后1
‑
7天,使细胞接触tgfβ受体/alk5抑制剂(例如,sb431542)和rock抑制剂的化合物组合1
‑
8天,随后使所述细胞接触tgfβ受体/alk5抑制剂、rock抑制剂和mek/erk途径抑制剂(例如,pd0325901)1
‑
8天。这可以任选地继之以,与tgfβ受体/alk5抑制剂和mek/erk途径抑制剂(但是不一定rock抑制剂)接触1
‑
4天,随后接触mek/erk途径抑制剂(但不是tgfβ受体/alk5抑制剂或rock抑制剂),并任选地最后接触不含有抑制剂的基础的(例如,基础的人)es培养基1
‑
4天。也可以采用其它组合。
[0220]
iv.转化
[0221]
本发明采用重组遗传学领域中的常规技术。公开本发明中使用的一般方法的基础教科书包括sambrook等.molecular cloning,a laboratory manual(分子克隆,实验室手册)(第3版,2001);kriegler,gene transfer and expression:a laboratory manual(基因转移和表达:实验室手册)(1990);和current protocols in molecular biology(现代分子生物学方法)(ausubel等,编,1994))。
[0222]
在一些实施方案中,细胞的物种和待表达的蛋白的物种是相同的。例如,如果使用小鼠细胞,则将小鼠直向同源物引入到小鼠中。如果使用人细胞,则将人直向同源物引入到细胞中。
[0223]
应当理解,当要在细胞中表达两种或更多蛋白时,可以使用一个或多个表达盒。例如,当一个表达盒用于表达多种多肽时,可以使用多顺反子表达盒。
[0224]
a.质粒载体
[0225]
在某些实施方案中,考虑质粒载体用于转化宿主细胞。通常,包含复制子和源自与宿主细胞相容物种的控制序列的质粒载体可以连同这些宿主一起使用。载体可以携带复制位点,以及能够在转化细胞中提供表型选择的标记序列。
[0226]
b.病毒载体
[0227]
某些病毒通过受体介导的胞吞作用感染细胞或进入细胞、并且整合进入宿主细胞基因组并稳定且有效表达病毒基因的能力已经使其成为将外源核酸转移至细胞(例如,哺乳动物细胞)中的具有吸引力的候选者。可以用于递送本发明的核酸的病毒载体的非限制性实例记述如下。
[0228]
i.腺病毒载体
[0229]
一种用于递送核酸的具体方法涉及使用腺病毒表达载体。尽管已知腺病毒载体具有低的整合进入基因组dna的能力,但是该特性被这些载体提供的高基因转移效率所弥补。“腺病毒表达载体”意欲包括含有这样的腺病毒序列的那些构建体,所述腺病毒序列足以
(a)支持所述构建体的包装和(b)最终表达已经克隆在其中的组织或细胞特异性构建体。关于遗传组织或腺病毒(即一种~36kb线性双链dna病毒)的知识容许用至多7kb的外源序列来置换腺病毒dna的大片段(grunhaus等,seminar in virology(病毒学研究会),200(2):535
‑
546,1992))。
[0230]
ii.aav载体
[0231]
核酸可以利用腺病毒辅助的转染引入细胞中。已经在利用腺病毒偶联系统的细胞系统中报告了增加的转染效率(kelleher和vos,biotechniques(生物技术),17(6):1110
‑
7,1994;cotten等,proc natl acad sci usa(美国国家科学院学报),89(13):6094
‑
6098,1992;curiel,nat immun(自然免疫学),13(2
‑
3):141
‑
64,1994.)。腺伴随病毒(aav)是有吸引力的载体系统,因为其具有整合的高频率并且其可以感染未分裂细胞,由此使其有效用于将基因递送至哺乳动物细胞中,例如,在组织培养中(muzyczka,curr top microbiol immunol(当前顶尖微生物免疫学),158:97
‑
129,1992)或体内进行。关于产生和使用raav载体的详细信息记述在美国专利号5,139,941和4,797,368中,它们分别通过引用并入本文。
[0232]
iii.反转录病毒载体
[0233]
反转录病毒有希望作为基因递送载体,这归因于其将它们的基因整合进入宿主基因组、转移大量外源遗传物质、感染广谱物种和细胞类型和被包装在特定细胞系中的能力(miller等,am.j.clin.oncol(美国临床肿瘤学杂志),15(3):216
‑
221,1992)。
[0234]
为了构建反转录病毒载体,将核酸(例如,编码目的基因的核酸)插入病毒基因组中替代某些病毒序列,从而生成复制缺陷型病毒。为了生成毒粒,构建含有gag、pol、和env基因但无ltr和包装元件的包装细胞系(mann等,cell(细胞),33:153
‑
159,1983)。当将含有cdna,以及反转录病毒ltr和包装序列的重组质粒引入特定细胞系(例如,通过例如磷酸钙沉淀)时,包装序列容许重组质粒的rna转录物包装在病毒颗粒中,所述病毒颗粒随后分泌到培养基中(nicolas和rubinstein,在:vectors:a survey of molecular cloning vectors and their uses(载体:分子克隆载体及其应用的调查)中,rodriguez和denhardt,编,stoneham:butterworth,第494
‑
513页,1988;temin,在:gene transfer(基因转移),kucherlapati(编),纽约:plenum press,第149
‑
188页,1986;mann等,cell(细胞),33:153
‑
159,1983)。然后收集含有重组反转录病毒的培养基,任选地浓缩,并用于基因转移。反转录病毒载体能够感染广泛多样的细胞类型。然而,整合和稳定表达典型地涉及宿主细胞的分裂(paskind等,virology(病毒学),67:242
‑
248,1975)。
[0235]
慢病毒是复杂的反转录病毒,其除普通的反转录病毒基因gag、pol、和env外,还包含其它具有调节或结构功能的基因。慢病毒载体是本领域中公知的(参见,例如,naldini等,science(科学),272(5259):263
‑
267,1996;zufferey等,nat biotechnol(自然生物技术),15(9):871
‑
875,1997;blomer等,j virol(病毒学杂志),71(9):6641
‑
6649,1997;美国专利号6,013,516和5,994,136)。慢病毒的一些实例包括人免疫缺陷病毒:hiv
‑
1,hiv
‑
2和猿猴免疫缺陷病毒:siv。慢病毒载体已经通过加强地减弱hiv毒力基因来产生,例如,缺失基因env、vif、vpr、vpu和nef,以使载体是生物学安全的。
[0236]
重组慢病毒载体能够感染未分裂细胞并可以用于核酸序列的体内(in vivo)和先体外后体内(ex vivo)基因转移和表达。例如,能够感染未分裂细胞的重组慢病毒,其中用两种或更多种携带包装功能的载体,即gag,pol和env,以及rev和tat转染合适的宿主细胞,
记述在美国专利号5,994,136中,其通过引用并入本文。人们可以通过使包膜蛋白与靶向特殊细胞类型的受体的抗体或特殊配体相连接来靶向重组病毒。通过将目的序列(包括调节区),以及例如编码特异性靶细胞上受体的配体的另一种基因插入病毒载体中,所述载体现在是靶标特异性的。
[0237]
iv.利用修饰的病毒递送
[0238]
待递送的核酸可以居于传染性病毒中,所述传染性病毒已经被改造为表达特异性结合配体。病毒颗粒应该因此特异性结合靶细胞的相关受体并将内容物递送至细胞。基于通过向病毒包膜化学添加乳糖残基进行的反转录病毒化学修饰,开发了一种设计用于容许特异性靶向反转录病毒载体的新方法。该修饰可以允许通过唾液酸糖蛋白受体来特异性感染肝细胞。
[0239]
设计另一种靶向重组反转录病毒的方法,其中使用生物素化的抗反转录病毒包膜蛋白的抗体和抗特异性细胞受体的抗体。所述抗体通过利用链霉抗生物素经由生物素组件偶联(roux等,proc.nat
′
l acad.sci.usa(美国国家科学院学报),86:9079
‑
9083,1989)。利用抗主要组织相容性复合物i类和ii类抗原的抗体,它们证明多种具有那些表面抗原的人细胞在体外被亲嗜性病毒感染(roux等,1989)。
[0240]
c.载体递送和细胞转化
[0241]
认为核酸递送以转化细胞、组织或生物体从而用于本发明的合适方法实质上包括任何这样的方法,通过该方法可以将核酸(例如,dna)引入至细胞、组织或生物体,如本文中所述或本领域中普通技术人员应该已知的那样。所述方法包括,但不限于:直接递送dna,诸如通过先体外后体内转染(wilson等,science(科学),244:1344
‑
1346,1989,nabel和baltimore,nature(自然)326:711
‑
713,1987),其中任选地使用fugene6(roche(罗氏))或脂质转染胺(lipofecyamine)(invitrogen),通过注射(美国专利号5,994,624,5,981,274,5,945,100,5,780,448,5,736,524,5,702,932,5,656,610,5,589,466和5,580,859,每个通过引用并入本文),包括显微注射(harland和weintraub,j.cell biol.(细胞生物学杂志),101:1094
‑
1099,1985;美国专利号5,789,215,通过引用并入本文);通过电穿孔(美国专利号5,384,253,通过引用并入本文;tur
‑
kaspa等,mol.cell biol.(分子细胞生物学),6:716
‑
718,1986;potter等,proc.nat
′
l acad.sci.usa(美国国家科学院学报),81:7161
‑
7165,1984);通过磷酸钙沉淀(graham和van der eb,virology(病毒学),52:456
‑
467,1973;chen和okayama,mol.cell biol.(分子细胞生物学),7(8):2745
‑
2752,1987;rippe等,mol.cell biol.(分子细胞生物学),10:689
‑
695,1990);通过使用deae
‑
葡聚糖及随后使用聚乙二醇(gopal,mol.cell biol.(分子细胞生物学),5:1188
‑
1190,1985);通过直接超声加样(sonic loading)(fechheimer等,proc.nat
′
l acad.sci.usa(美国国家科学院学报),84:8463
‑
8467,1987);通过脂质体介导的转染(nicolau和sene,biochim.biophys.acta(生物化学生物物理学报),721:185
‑
190,1982;fraley等,proc.nat
′
l acad.sci.usa(美国国家科学院学报),76:3348
‑
3352,1979;nicolau等,methods enzymol(酶学方法),149:157
‑
176,1987;wong等,gene(基因),10:87
‑
94,1980;kaneda等,science(科学),243:375
‑
378,1989;kato等,j biol chem.(生物化学杂志),266:3361
‑
3364,1991)和受体
‑
介导的转染(wu和wu,biochemistry(生物化学),27:887
‑
892,1988;wu和wu,j.biol.chem.(生物化学杂志),262:4429
‑
4432,1987);和所述方法的任
意组合,每个通过引用并入本文。
[0242]
vii.混合物
[0243]
本发明提供了提高ipsc的产生效率的混合物。例如,本发明提供了tgfβ受体/alk5抑制剂、mek/erk途径抑制剂、rho gtp酶/rock抑制剂的混合物,在具体实施方案中,提供了它们与哺乳动物细胞的混合物。例如,所述混合物可以被包括在含有或没有细胞的细胞培养基中。细胞培养基的内容物通常是本领域已知的。在实施例中详细地描述了示例性的细胞培养基。通常,包含哺乳动物细胞和本发明的试剂(tgfβ受体/alk5抑制剂、mek/erk途径抑制剂和rho gtp酶/rock抑制剂)的细胞培养物最初含有所有或基本上所有的非多能细胞。但是,随着时间度过,特别是在本文所述的方案的条件下,一部分细胞会变成多能的(即,ipsc)。
[0244]
将被诱导多能性的细胞可以按照本领域中已知的任何方法来培养。用于产生ipsc的培养条件的一般性指导可见于,例如,maherali,等,cell stem cell(细胞干细胞)3:595
‑
605(2008)。
[0245]
在一些实施方案中,所述细胞通过与饲养细胞相接触来培养。示例性饲养细胞包括,但不限于:成纤维细胞,例如,小鼠胚胎成纤维细胞(mef)细胞。在饲养细胞上培养细胞的方法是本领域中已知的。
[0246]
在一些实施方案中,细胞在缺乏饲养细胞的条件下培养。细胞,例如,可以例如,通过分子粘连,直接附着于固体培养物表面(例如,培养板)。本发明人已经发现,与在饲养细胞上培养的在其它方面相同处理的细胞的效率相比,当细胞直接附着于固体培养物表面时,培养诱导多能性的细胞的诱导多能性的效率要高得多(即,更大部分的细胞获得多能性)。示例性分子粘连物包括,但不限于:细胞外基质(ecm)、ecm类似物、层粘连蛋白、纤连蛋白,或胶原蛋白。然而,本领域中技术人员会认识到,这是非限制性列表,且可以使用其它分子使细胞附着于固体表面。将该粘连物最初附着于固体表面的方法是本领域中已知的。
[0247]
如在本文中所述,在一些实施方案中,本发明的混合物可以包括或不包括哺乳动物细胞(包括多能细胞或非多能细胞)和下述物质中的一种或多种:hdac抑制剂、gsk3抑制剂或l
‑
型钙通道激动剂;camp途径的活化剂;dna甲基转移酶(dnmt)抑制剂;核受体配体,例如,如在pct wo/2009/117439中所述。
[0248]
viii.试剂盒
[0249]
本发明也提供了试剂盒,例如,其用于产生诱导多能干细胞。这样的试剂盒可以包含任意或所有本文所述的试剂,包括、但不限于:本文所述的tgfβ受体/alk5抑制剂、mek/erk途径抑制剂和/或rho gtp酶/rock抑制剂。这3种试剂或其子集可以存在于试剂盒内的分开的瓶子中,或一起作为混合物存在。本发明的试剂盒也可以包括下述的一种或多种:hdac抑制剂、gsk3抑制剂或l
‑
型钙通道激动剂;camp途径的活化剂;dna甲基转移酶(dnmt)抑制剂;和核受体配体。
[0250]
在一个实施方案中,本发明的试剂盒包括一类或更多类型的哺乳动物(例如,人、小鼠、大鼠等)细胞和/或细胞培养基。
[0251]
在一个具体实施方案中,本发明的试剂盒包括一种或多种多核苷酸,所述多核苷酸包含用于表达oct多肽、klf多肽、myc多肽和sox多肽中的一种或多种的表达盒。额外地或
替代地,所述试剂盒可以包含一种或多种分离的转录因子蛋白,例如,oct多肽、klf多肽、myc多肽和sox多肽中的1、2、3或所有4种。在另一个具体的实施方案中,所述转录因子蛋白可以与用于增强转录因子蛋白的跨细胞膜转运的多肽序列相融合。
[0252]
vi.多能细胞的应用
[0253]
本发明容许进一步研究和开发干细胞技术,包括但不限于,预防性的或治疗性的应用。例如,在一些实施方案中,将本发明的细胞(多能细胞或诱导成沿着理想的细胞命运分化的细胞)引入有此需要的个体中,包括但不限于,需要再生器官、组织、或细胞类型的个体。在一些实施方案中,细胞最初以活组织检查方式由个体获得;如本文所述诱导多能性,任选地诱导分化(例如分化为特别理想的祖细胞),然后移植回该个体中。在一些实施方案中,细胞在其引入个体前进行遗传修饰。
[0254]
在一些实施方案中,按照本发明的方法产生的多能细胞随后被诱导,以形成例如造血(干/祖)细胞、神经(干/祖)细胞(和任选地更加分化的细胞,诸如亚型特异性的神经元、少突胶质细胞等)、胰腺细胞(例如,内分泌祖细胞或胰腺激素表达细胞)、肝细胞、心血管(干/祖)细胞(例如、心肌细胞、内皮细胞、平滑肌细胞)、视网膜细胞等。
[0255]
已知多种诱导多能干细胞分化为需要的细胞类型的方法。描述诱导干细胞分化为不同细胞命运的方法的近期专利出版物的非限制列表如下:美国专利公开号2007/0281355;2007/0269412;2007/0264709;2007/0259423;2007/0254359;2007/0196919;2007/0172946;2007/0141703;2007/0134215。
[0256]
通过将本发明的多能细胞引入、并任选地靶向特定的受伤组织,可以改善许多疾病。由组织损伤引起的疾病实例包括,但不限于:神经变性疾病(neurodegeneration disease)、脑梗死(cerebral infarction)、阻塞性血管病(obstructive vascular disease)、心肌梗死(myocardial infarction)、心力衰竭(cardiac failure)、慢性阻塞性肺病(chronic obstructive lung disease)、肺气肿(pulmonary emphysema)、支气管炎(bronchitis)、间质肺病(interstitial pulmonary disease)、哮喘(asthma)、乙型肝炎(hepatitis b)(肝损伤)、丙型肝炎(hepatitis c)(肝损伤)、酒精性肝炎(alcoholic hepatitis)(肝损伤)、肝硬化(hepatic cirrhosis)(肝损伤)、肝功能不全(hepatic insufficiency)(肝损伤)、胰腺炎(pancreatitis)、糖尿病(diabetes mellitus)、局限性回肠炎(crohn disease)、炎性结肠炎(inflammatory colitis)、iga肾小球肾炎(iga glomerulonephritis)、肾小球肾炎(glomerulonephritis)、肾功能不全(renal insufficiency)、褥疮(decubitus)、烧伤、缝合伤口(sutural wound)、撕裂(laceration)、切伤伤口、咬伤伤口、皮炎(dermatitis)、瘢痕性瘢痕疙瘩(cicatricial keloid)、瘢痕疙瘩(keloid)、糖尿病性溃疡(diabetic ulcer)、动脉溃疡(arterial ulcer)和静脉溃疡(venous ulcer)。
[0257]
在一个实施方案中,可以在不同的试验中使用ipsc,并筛选,以鉴别调节它们的功能(包括、但不限于促进ipsc存活和/或分化)的分子。
[0258]
实施例
[0259]
提供下面的实施例来例证、但非限制要求保护的本发明。
[0260]
实施例1:用于提高人ipsc的诱导的化学平台
[0261]
用“4种因子”(oct4、sox2、klf4和c
‑
myc;下文称作4tf)重编程序的间充质成纤维
细胞经历急剧的形态学变化,所述变化产生具有独特的细胞极性、边界和细胞
‑
细胞相互作用的ipsc。重编程序的细胞表达e
‑
钙黏着蛋白,即上皮细胞的一种标志物(hay,e.d.,acta anat.(basel)154,8
‑
20(1995)),其也在人胚胎干细胞(hesc)中高度表达。我们推论,促进间充质向上皮转换(met)的因子(诸如tgfβ途径拮抗剂)对重编程序过程具有直接影响。另外,以前显示,mek
‑
erk途径抑制在重编程序的不同步骤中起重要作用(chen,s.等,proc.natl.acad.sci.u s a 104,10482
‑
87(2007);shi,y.等,cell stem cell 2,525
‑
8(2008))。此外,促进细胞存活的因子在提高重编程序效率方面也是有益的。因此,我们聚焦于可以调节这3个过程和途径的小分子,因为小分子在研究生物学过程中具有许多优点(feng,b.等,cell stem cell 4,301
‑
12(2009);shi,y.等,cell stem cell 2,525
‑
8(2008);xu,y.等,nature 453,338
‑
44(2008)),且是比遗传操作更安全的选择。在这里,我们描述了简单的化学平台,其通过远远更快的且更有效的过程,实质上增加了完全重编程序的人ipsc从成纤维细胞的产生。
[0262]
我们在1x104个(feng,b.等,cell stem cell 4,301
‑
12(2009))被4tf反转录病毒转导的人原代成纤维细胞(crl2097或bj)上测试了tgfβ受体和mek的已知抑制剂它们对重编程序动力学和效率的影响(细节参见图1a)。在感染后第7天(d7),加入单独的或组合的所述化合物,并在接下来的1
‑
3周内检查培养物的ipsc。
[0263]
在处理后第7天(d14),我们在用alk5抑制剂sb431542(2μm)和mek抑制剂pd0325901(0.5μm)的组合处理的培养物中观察到最强的效应,所述组合产生约45个具有特征性的hesc
‑
样形态的大的alp
+
集落(图1b),其中超过24个集落是tra
‑1‑
81
+
(图1d),约6
‑
10个集落是ssea4和nanog(没有异位导入的成熟的多能性因子)染色阳性的(图1e和1f)。此外,处理过的培养物表现出多能性基因的内源mrna的高水平表达(图1c)。相比而言,在未处理的对照培养物中(图1e和图4a),或在用单独的pd0325901处理的培养物中,没有观察到nanog
+
集落(图4a)。但是,在仅用sb431542处理的培养物中,我们仍然观察到1
‑
2个alp
+
hesc
‑
样集落(图4a)。重要的是,两种抑制剂的组合作用(图4b和4c),以及sb431542的单独作用,是剂量依赖性的。
[0264]
当我们在没有分割下维持sb431542+pd0325901处理的培养物30天时,我们得到约135个ipsc集落/孔(图2d),这比常规方法的效率提高了>100倍。与以前的报道(takahashi,k.等,cell 131,861
‑
72(2007))相一致地,在携带4tf的未处理的对照中,我们观察到1
‑
2个ipsc集落以及几个颗粒状集落(图2c)。已经提示,这些颗粒状结构是部分地重编程序的集落(takahashi,k.等,cell 131,861
‑
72(2007))。我们也在sb431542处理过的培养物中观察到颗粒状集落,它们在数目上超过罕见的hesc
‑
样集落数倍。令人感兴趣地,在组合的sb431542和pd0325901的处理中,颗粒状集落的数目急剧减少,这导致hesc
‑
样集落的数目的伴随增加。这提示,alk5和mek的组合抑制可能引导部分地重编程序的集落成为完全重编程序的状态,并从而改善整个重编程序过程。此外,我们在早至处理后7天就观察到ipsc的改善的诱导的事实,提示用这些小分子处理不仅会改善重编程序过程的效率,而且也可能已经加速它的动力学(图1a)。需要其它实验来确定重编程序的细胞在该阶段是否真正地比在未处理的培养物中更早地变成完全独立于外源性重编程序因子。
[0265]
尽管挑选和扩增了ipsc集落,但是象在hesc培养物中一样,通过胰蛋白酶消化进行的培养物分割导致差的存活。从在我们实验室中进行的最近筛选中,我们鉴别出一种新
颖的小分子,thiazovivin(图5),其在胰蛋白酶消化后显著提高hesc的存活。thiazovivin向我们的sb431542和pd0325901的混合物中的加入,也极大地提高了在通过胰蛋白酶消化进行的分割以后的ipsc的存活(图2a),并得到大量重编程序的集落。从最初接种的10,000个细胞中,在第14天的单次1:4分割在第30天产生约1,000个hesc
‑
样集落(图2e),而两轮分割(在第14天和第21天(1:10))在第30天产生约11,000个hesc
‑
样集落(图2c和2e)。这些集落表现出多能性标志物的高水平的内源mrna(图2f)和蛋白表达(图2b和2c),而4种转基因的表达几乎不能检出(图2f)。相比而言,从胰蛋白酶消化的未处理的或2种化合物处理过的样品中,没有得到ipsc集落(表1)。
[0266]
表1:在未处理的、2种化合物处理的和3种化合物处理的培养物中在第30天时观察到的ipsc集落的数目的比较。
[0267][0268]
为了检查thiazovivin的积极作用是否仅仅是由于在分割以后的集落存活,或是否它也增强组合的sb431542和pd0325901处理的重编程序作用,我们在没有进行分割的4tf
‑
转导的细胞上测试了3种化合物的混合物。在这些培养物中,在第14天之前,我们观察到约25个大集落,它们都表达nanog(图1e)。在第30天之前,我们观察到约205个非常大的nanog
+
集落(图2d),它们也是tra
‑1‑
81
+
和ssea4
+
(数据未显示),相对于没有化合物处理,它们说明效率提高了超过200倍,相对于2种化合物处理,效率增加了2倍。
[0269]
当使用慢病毒系统而不是反转录病毒系统导入重编程序因子时,与未处理的对照相比,2种化合物处理也产生了更大量的碱性磷酸酶阳性的集落(图6a)。此外,3种化合物混合物没有表现出影响来自反转录病毒载体的重编程序因子表达(图6b
‑
f)。
[0270]
使用3种化合物混合物产生的ipsc集落在常规hesc培养条件下可容易地且稳定的长期扩增(超过20代),它们在形态学、典型的多能性标志物表达和分化潜力方面非常类似于hesc。它们表现出正常的核型(图7),且可以在体外(图3a和3b)和在体内(图3c)分化成所有3个胚层的衍生物。这些结果也提示,不存在与远远更方便的胰蛋白酶消化操作有关的短期副作用。
[0271]
证实tgfβ和mek
‑
erk途径抑制改进成纤维细胞重编程序,这提示这2个信号传导途径和met机制在所述过程中的关键作用。一致地,tgfβ的加入具有对4种因子介导的成纤维细胞的重编程序具有抑制作用(数据未显示)。tgfβ和它的家族成员在esc的自我更新和分化中起重要的与背景有关的作用(contextual role)(watabe,t.和miyazono,k.,cell res.19,103
‑
15(2009))。此外,tgfβ是用于诱导上皮间充质转换(emt)和维持间充质状态的原型细胞因子(willis,b.c.和borok,z.,am.j.physiol.lung cell mol.physiol.293,l525
‑
34(2007))。在该背景下,该信号传导的主要终点是e
‑
钙黏着蛋白的减量调节(thiery,j.p.和sleeman,j.p.,nat.rev.mol.cell biol.,7,131
‑
42(2006))。已经证实,e
‑
钙黏着蛋白对于esc的多能性的维持而言是重要的,且最近已经提示是nanog表达的调节剂
(chou,y.f.等,cell 135,449
‑
61(2008))。因此,tgfβ信号传导的抑制(其导致上皮命运的去抑制)可以在多个途径中有益于重编程序过程。erk信号传导也会促进emt(thiery,j.p.和sleeman,j.p.,nat.rev.mol.cell biol.7,131
‑
42(2006)),且在所述过程中是在tgfβ的下游(chou,y.f.等,cell 135,449
‑
61(2008))。我们以前已经证实,reversine(一种可以重编程序成肌细胞至多能状态的小分子)的作用部分地通过mek
‑
erk的抑制来介导(chen,s.等,proc.natl.acad.sci.u s a 104,10482
‑
87(2007))。这可以解释当它与tgfβ抑制相组合时在重编程序中观察到的作用。
[0272]
这里描述的化学平台是独特的,因为它调节上游信号传导途径,且可以根本上改善对一般的细胞类型(如成纤维细胞)的重编程序。这里描述的化学条件为基于非病毒的且非
‑
dna的(zhou,h.等,cell stem cell 4,381
‑
84,(2009))、更有效的且更安全的重编程序方法提供了基础平台,其可以产生用于不同应用的安全的人ipsc的无限供给。
[0273]
方法
[0274]
细胞培养
[0275]
原代皮肤成纤维细胞crl2097和bj(新生儿包皮)购自atcc。所有细胞培养基试剂购自invitrogen corporation,ca。在含有10%fbs(10439
‑
024)、1x mem非必需氨基酸(11140
‑
050)、1x glutamax(35050
‑
061)、10mm hepes(15630
‑
080)和0.11mm 2
‑
巯基乙醇(21985
‑
023)的dmem(10313
‑
021)中,维持细胞。使用0.05%(1x)胰蛋白酶
‑
edta(25300
‑
054),以1:5将细胞传代。
[0276]
质粒
[0277]
从addgene,得到编码前述(takahashi,k.等,cell 131,861
‑
72(2007))的oct4、sox2、c
‑
myc和klf4的人cdna的pmx载体。如以前所述(takahashi,k.等,cell 131,861
‑
72(2007)),将小鼠slc7a1 orf克隆到pwpxld(addgene)中。
[0278]
反转录病毒感染和ips细胞产生
[0279]
如以前所述(yu,j.等,science 318,1917
‑
20(2007)),生产携带oct4、nanog、sox2和lin28的慢病毒。对于反转录病毒生产,以1x106细胞/孔,将plat
‑
e包装细胞接种至6
‑
孔板上。在24小时以后,根据生产商的说明书,使用fugene 6转染试剂(roche),用携带oct4、sox2、c
‑
myc和klf4 cdna的pmxs载体转染细胞。在转染后24小时,用新鲜培养基替换培养基,并将所述平板转移至32℃,进行反转录病毒生产。在48小时和72小时,收集病毒,并用0.45μm过滤器过滤,然后转导。
[0280]
在第1天,以1x105细胞/孔,用表达slc7a1的人成纤维细胞接种6孔板。在第2天,在有6μg/ml 1,5
‑
二甲基
‑
1,5
‑
二氮十一亚甲基聚甲溴化物(polybrene)存在下,将0.25ml的每种反转录病毒上清液加至细胞。在第3天,进行第2轮转导。通过荧光显微术,在用携带gfp或rfp基因的反转录病毒平行地转导的细胞上估测感染效率。在初步转导后7天,通过胰蛋白酶消化,收获成纤维细胞,并以1x104细胞/孔,重新接种被基质胶包被的6孔板(1:50稀释度,目录号354234,bd biosciences)。对于化合物处理,在人重编程序培养基(dmem/f12、20%敲除的血清替换物、1xmem非必需氨基酸、1x glutamax、0.11mm 2
‑
巯基乙醇、20ng/ml bfgf和1,000u/ml lif)中培养细胞,并用2μm sb431542(stemgent)、0.5μm pd0325901(stemgent)、0.5μm thiazovivin或所述化合物的组合进行处理。根据细胞密度,每2
‑
3天更换培养基。在化合物处理后7天,要么将平板固定并进行碱性磷酸酶(alp)活性染色或蛋白
标志物染色,要么在有或没有通过胰蛋白酶消化进行的指示的分割下,继续培养直到第30天。对于分割培养物,将细胞分割(1:4),并重新接种到在6孔板的每个孔中辐照过的cf
‑
1mef饲养层(2.5x 105细胞/孔)上,并在第21天再次分割(1:10)。将所述细胞维持在上述的相同的培养基和化合物混合物中,但是pd0325901(在第14天0.5μm,在第21天1μm)和sb431542(在第14天以后0.5
‑
1μm)的浓度除外。随后在没有上述化合物存在下,在常规hesc培养基中维持ipsc集落。
[0281]
碱性磷酸酶染色和免疫细胞化学
[0282]
根据产品说明书,使用alp检测试剂盒(目录号:scr004,chemicon),进行碱性磷酸酶染色。对于免疫细胞化学,在4%低聚甲醛(10min,rt)中固定细胞,用pbs洗涤2次,使用5%正常驴血清(chemicon)和0.1%tritonx
‑
100封闭(15min,rt),然后用第一抗体在4℃处理过夜。使用的第一抗体是:抗
‑
nanog(目录号:ab9220,chemicon,1:1,000);抗
‑
oct4(目录号:sc
‑
5279,santa cruz biotech,1:200),抗
‑
ssea 4(目录号:mab4304,chemicon,1:500),抗
‑
tra
‑1‑
81(目录号560123,bd biosciences,1:100),抗
‑
tra
‑1‑
81(mab 4381,chemicon,1:500),抗
‑
βiii微管蛋白(目录号:mms
‑
435p,covance research products inc,1:1000),抗
‑
pdx 1(1:500)(c.wright博士友情赠送),抗
‑
brachyury(目录号:af2085,r&d,终浓度0.2μg/ml)。用pbs洗涤细胞2次,然后用第二抗体在室温处理1小时。使用的第二抗体是alexa fluor 488驴抗
‑
兔或抗
‑
小鼠igg(invitrogen,1:1,000)和alexa fluor 555驴抗
‑
兔或抗
‑
小鼠igg(invitrogen,1:1,000)。用0.5μg/ml dapi(sigma)对细胞核染色。使用具有测定光度的coolsnap hq2照相机的nikon eclipse te2000
‑
u/x
‑
cite 120exfo显微镜,捕获图像。
[0283]
体外分化和畸胎瘤试验
[0284]
如别处所述,进行胚状体的建立和体外分化(takahashi,k.等,cell 131,861
‑
72(2007))。对于畸胎瘤试验,将300
‑
500万细胞注射在scid小鼠的肾囊下。31天以后,切除肿瘤,并在4%低聚甲醛中固定,在tsri组织学核心机构中进行组织学分析。scid小鼠的使用得到ucsd动物研究委员会的批准。
[0285]
rt
‑
pcr
[0286]
使用rneasy微型试剂盒(qiagen),从细胞提取总rna。使用superscript iii第一链合成试剂盒(invitrogen),根据产品说明书,合成cdna。使用各种引物,将2微升反应产物用于24
‑
28个pcr循环。引物的序列如别处所述(takahashi,k.等,cell 131,861
‑
72(2007))。
[0287]
流式细胞术
[0288]
对于流式细胞术分析,用胰蛋白酶温和地消化培养物,并从6孔板收获。洗涤细胞,重新悬浮于facs缓冲液(pbs、2mm edta、2mm hepes、1%fbs)中,并使用cellquest程序在facs calibur细胞计数器(becton dickinson,san jose,ca)上进行分析。
[0289]
实施例2:n
‑
(环丙基甲基)
‑4‑
(4
‑
(6
‑
羟基
‑
3,4
‑
二氢喹啉
‑
1(2h)
‑
基)嘧啶
‑2‑
基氨基)苯磺酰胺(thiazovivin)的合成
[0290]
将含有在正丁醇(10ml)中的2,4
‑
二氯嘧啶(372mg,2.5mmol)、6
‑
甲氧基
‑
1,2,3,4
‑
四氢喹啉(489mg,3mmol)和二异丙基乙胺(0.52ml,3mmol)的反应烧瓶在40℃加热过夜。蒸发溶剂,通过快速柱色谱法纯化残余物,得到2
‑
氯
‑4‑
(6
‑
甲氧基
‑
3,4
‑
二氢喹啉
‑
1(2h)
‑
基)
嘧啶(551mg,80%)。然后将该中间体(250mg,0.91mmol)溶解在二氯甲烷中,并用bbr3(1m,在二氯甲烷中)(1ml,1mmol)在
‑
78℃处理。将该反应混合物缓慢地温热至室温,并搅拌1小时,倒入水中,用二氯甲烷萃取。将合并的有机相经无水na2so4干燥,并浓缩。通过快速柱色谱法纯化残余物,得到2
‑
氯
‑4‑
(6
‑
羟基
‑
3,4
‑
二氢喹啉
‑
1(2h)
‑
基)嘧啶(154mg,65%)。向搅拌的2
‑
氯
‑4‑
(6
‑
羟基
‑
3,4
‑
二氢喹啉
‑
1(2h)
‑
基)嘧啶(29mg,0.11mmol)和4
‑
氨基
‑
n
‑
(环丙基甲基)苯磺酰胺(27mg,0.12mmol)在dmf(0.5ml)中的溶液中,加入对甲苯磺酸(2m,在二烷中)(55μl,0.11mmol)。将反应混合物在90℃搅拌过夜,然后通过hplc纯化,得到标题化合物(27mg,56%)。
[0291][0292]
实施例3:oct4和化合物对人原代体细胞的重编程序
[0293]
我们在这里报道了一种新颖的小分子混合物,其能够将人原代体细胞重编程序成仅外源性表达oct4的ipsc。
[0294]
在几种可容易地得到的原代人的体细胞类型中,可以从人皮肤或毛囊容易地分离出的角质形成细胞代表用于重编程序的有吸引力的细胞来源,因为它们内源地表达klf4和cmyc,且据报道,使用常规的4种tf或3种tf(没有myc)可以更有效地被重编程序(aasen,t.等,nat biotechnol 26:1276
‑
1284(2008);maherali,n.等,cell stem cell 3,340
‑
345(2008))。更近地,我们报道了,使用小分子(即分别是sb431542和pd0325901)对tgfβ和mapk/erk途径的双抑制会提供4种外源性的tf(即oskm)对人成纤维细胞的重编程序的显著增强的条件(lin,t.等,nat methods 6:805
‑
808(2009))。此外,我们已经证实,使用2种小分子,硫酸反苯环丙胺(parnate)(赖氨酸
‑
特异性的脱甲基酶1的一种抑制剂)和chir99021(一种gsk3抑制剂),这样的双途径抑制也可以增强2种外源性的tf(即ok)对人角质形成细胞的重编程序(li,w.等,stem cells 27:2992
‑
3000(2009))。但是,这样的2
‑
tf重编程序过程是非常效率低的和复杂的(例如涉及2种外源性的tf和4种化学试剂),甚至少一个tf的重编程序都似乎是令人沮丧的。为了仅oct4重编程序,我们在改进重编程序条件和鉴别新的重编程序化学实体中开发出了一种逐步策略。我们首先尝试在4种或3种tf(即oskm或osk)条件下在新生儿人表皮角质形成细胞(nhek)中进一步优化重编程序过程,其中使用以前报道的人ipsc表征方法(lin,t.等,nat methods 6:805
‑
808(2009)),测试tgfβ和mapk途径的不同浓度的各种抑制剂。鼓舞人心的是,我们发现0.5μm pd0325901和0.5μm a
‑
83
‑
01(一种更有效的和选择性的tgfβ受体抑制剂)的组合可以更有效地增强用oskm或osk转导的人角质形成细胞的重编程序(图8a)。值得注意的是,当我们进一步减少病毒转导至仅2种因子/ok时,当用0.5μm pd0325901和0.5μm a
‑
83
‑
01处理它们时,我们仍然从nhek产生了ipsc,尽管效率较低。然后,我们开始从以前报道的各种浓度的已知生物活性化合物的集合中筛选其它小分子。在迄今测试的许多化合物中,我们惊讶地发现,pdk1(3
’‑
磷酸肌醇依赖性激酶
‑
1)的小分子活化剂ps48(5μm)(其在重编程序中从未报道过)可以使重编程序效率显著增加约15倍。令人感兴趣地,我们也发现,对于在ok条件下产生ipsc而言,0.25mm丁酸钠
(nab,一种组蛋白脱乙酰酶抑制剂)被证实比以前报道的0.5mm vpa远远更可靠和有效(图8b)。随后的后续研究证实,5μm ps48和0.25mm nab的组合可以进一步增强重编程序效率超过25倍(图8b和表4)。利用在仅2种tf下将nhek重编程序的这种空前效率,我们通过在不同的处理窗中改进那些小分子的组合,进一步研究了使用单独的oct4产生ipsc的可能性。用oct4转导原代nhek,并用化学试剂处理(图8c)。在不同的条件下,与hesc类似的小ipsc集落(1,000,000个接种的细胞中的4
‑
6个集落)出现在oct4感染的nhek中,所述nhek在最开始的4周用0.25mm nab、5μm ps48和0.5μm a
‑
83
‑
01处理,随后用0.25mm nab、5μm ps48、0.5μm a
‑
83
‑
01和0.5μm pd0325901处理另外4周(图8c)。这样的tra
‑1‑
81阳性的ipsc集落(图8d)在常规hesc培养基下生长得更大,且可以连续传代,以产生被进一步表征的稳定的ipsc克隆(图8e和9)。更值得注意的是,通过向该化学混合物中加入2μm硫酸反苯环丙胺和3μm chir99021(它们已经被证实会改善在ok条件下的nhek的重编程序),也可以从人成年角质形成细胞产生仅具有oct4的ipsc。在用oct4和小分子将原代角质形成细胞可靠地重编程序成ipsc以后,我们将所述条件进一步应用于其它人原代细胞类型,包括huvec(分化的中胚层细胞)和afdc(从羊水获得的细胞)。类似地,tra
‑1‑
81阳性的ipsc集落出现在用化学试剂处理过的oct4感染的huvec和afdc中。值得注意的是,在oct4和小分子条件下,看起来对huvec和afdc的重编程序比对nhek的重编程序更有效和更快速(表4)。在常规hesc培养条件下,将来自每种细胞类型的ipsc的2个克隆长期扩展超过20代,并进一步表征(表5)。
[0295]
这些稳定扩展的hipsc
‑
ok和hipsc
‑
o细胞在形态学上与hesc不能辨别,且可以在无饲养细胞的且化学成分确知的条件下在ecm
‑
包被的表面上培养(图8e和图13)。它们是碱性磷酸酶(alp)染色阳性的,并表达典型的多能性标志物,包括oct4、sox2、nanog、tra
‑1‑
81和ssea4,这通过免疫细胞化学/icc检测到(图8e、10b、图11
‑
12)。另外,rt
‑
pcr分析证实了内源性的人oct4、sox2、nanog、rex1、utf1、tdgf2、fgf4基因的表达和外源性的oct4和klf4的沉默(图9a和10c)。此外,亚硫酸氢盐测序分析揭示,hipsc
‑
ok和hipsc
‑
o细胞的oct4和nanog启动子在很大程度上被脱甲基化(图9b和10d)。该结果提供了在hipsc
‑
ok和hipsc
‑
o细胞中重新活化多能性转录程序的进一步证据。hipsc
‑
o细胞、nhek和hesc的总基因表达分析证实,hipsc
‑
o细胞不同于nhek(皮尔逊相关值:0.87),最类似于hesc(皮尔逊相关值:0.98)(图9c)。基因分型分析证实,hipsc
‑
o细胞仅含有oct4转基因,没有转基因klf4或sox2的污染(图15)。dna印迹分析证实,在不同的克隆中存在oct4转基因的多个不同的整合位点(图16)。另外,核型分析结果证实,hipsc
‑
o在整个重编程序和扩展过程中维持正常核型(图17)。此外,dna指纹法实验排除了这些hipsc源自实验室中的hesc污染的可能性(表6)。为了检查这些hipsc
‑
o细胞的发育潜力,通过标准的胚状体(eb)分化方法,使它们在体外分化。icc分析证实,它们可以有效地分化成βiii
‑
微管蛋白
+
特征性的神经元细胞(外胚层)、sma
+
中胚层细胞和afp
+
内胚层细胞(图9d和10e)。定量pcr分析进一步证实了这些和其它谱系特异性的标记基因的表达,包括外胚层细胞(βiii
‑
微管蛋白和巢蛋白)、中胚层细胞(msx1和mlc2a)和内胚层细胞(foxa2和afp)(图9e)。按照eb方案,这些hipsc
‑
ok和hipsc
‑
o细胞也可以产生节奏性地搏动的心肌细胞。为了测试它们的体内多能性,将它们移植进scid小鼠中。4
‑
6周以后,这些hipsc
‑
o细胞有效地产生含有所有3个胚层的衍生物的典型畸胎瘤(图9f和10f)。这些体外和体内表征共同地证实,与确定的小分子混合物相组合的单个转录因子oct4足以将几种人原代体细胞重编程序为ipsc,所述ipsc在形态学上、分子上和功能上类
似于多能hesc。
[0296]
上述的研究具有许多重要的暗示:(1)尽管经证实胎儿nsc被单独的oct4的异位表达重编程序为ipsc,但是在下述方面存在重大的疑问(skepticism):单独的外源性的oct4基因是否足以将不内源地表达sox2(在重编程序中的2种主导多能性基因之一)、处于更晚的发育阶段(例如早期胚胎/胎儿vs.新生儿/成年人)且可以在对个体没有显著伤害的情况下得到的其它更实用的人的体细胞重编程序。据我们所知,我们的研究首次证实了ipsc可以在实践中源自可容易地得到的被单个外源性的重编程序基因oct4转导的原代的人的体细胞(例如角质形成细胞)。与来自脑的神经干细胞相比,角质形成细胞是更容易得到的,且可以经过更少的侵入性操作从新生个体容易地得到。这进一步强化了开发不同的实践中可获得的人的体细胞用于ipsc生产(具有更安全的方案和/或更好的质量)的策略。因而,该新的方法和它的进一步发展将会显著促进用于不同应用的患者
‑
特异性的多能干细胞的生产。(2)尽管已经鉴别出小分子和它们的组合来代替仅一种或两种重编程序tf,但是当一起省略更多的外源性的重编程序tf时,它对产生ipsc的挑战呈指数增长。该新小分子混合物(其在使用单独的oct4产生ipsc方面在功能上一起替代所有3种主要的转录因子(即sox2、klf4和cmyc))的鉴别,代表仅使用小分子进行最终重编程序的另一个主要步骤,并进一步证实和固化了产生ipsc的化学方案。(3)这证实了单基因条件也在蛋白诱导多能干细胞(pipsc)技术中具有重要用途。pipsc技术的实践挑战是4种可转导的重编程序蛋白的大规模的且可靠的生产,这4种可转导的重编程序蛋白中的每一种在生产中的表现均不同(例如它们的表达、折叠、稳定性等)。显然,将该小分子混合物与单一可转导的蛋白相组合,会显著简化pipsc技术并促进它的应用。(4)更值得注意的是,我们鉴别出一种新的小分子ps48,其在增强重编程序中具有新的靶标/机理。ps48是pdk1的变构小分子活化剂,所述pdk1是包括akt/pkb在内的几种agc激酶的重要上游激酶(alessi等,curr biol 7,261
‑
269(1997))。它的重编程序增强效应可以部分地归因于akt/pkb的活化,后者促进细胞增殖和存活(manning,b.d.,cantley,l.c.,cell 129,1261
‑
1274(2007))。关于涉及pdk1的机理如何在重编程序过程中精确地调节的进一步深入表征,会提供关于重编程序和多能性的其它洞察。此外,因为可能存在由重编程序的低效率和缓慢动力学产生的甚至更大的隐藏风险(例如在重编程序过程中可以产生或选择更精细的遗传的和/或后生的异常),所以(如在该研究中再次例证)用于增强重编程序的新小分子的鉴别,对于更安全的、更容易的和更有效的人ipsc制备操作而言总是非常有价值的。(5)最后,用于重编程序的该新的且有效的小分子混合物,将在这里提出的逐步化学优化和筛选策略验证为致力于最后纯化学诱导多能干细胞的生产方案。此外,调节相同靶标/机理的不同小分子可以对不同背景下的重编程序具有显著不同的影响的发现(由a
‑
83
‑
01和nab在人角质形成细胞中的更好的重编程序增强活性来例证),提示不同方案的“个体化的”优化和处理对于特定重编程序背景的重要性。
[0297]
细胞培养
[0298]
在角质形成细胞培养基(kcm,lonza)中维持正常人表皮角质形成细胞(lonza)。在endogro
‑
vegf完全培养基(hcm,chemicon)中维持人脐静脉内皮细胞(huvec,millipore)。在常规人esc培养基(hescm:dmem/f12、15%敲除的血清替代品、1%glutamax、1%非必需氨基酸、1%青霉素/链霉素、0.1mmβ
‑
巯基乙醇和10ng/ml bfgf)中,在mef饲养细胞上培养人esc和hipsc。除了指出以外,所有细胞培养产物均来自invitrogen/gibco brl。
[0299]
慢病毒生产
[0300]
如以前所述(yu,j.等,science 318:1917
‑
1920(2007)),生产和收获慢病毒上清液。用于慢病毒生产的质粒包括psin
‑
ef2
‑
puro
‑
hoct4、psin2
‑
ef2
‑
puro
‑
hsox2、plove
‑
mklf4、plove
‑
mmyc、包装质粒pspax2和编码被膜的质粒pmd2.g(yu,j.等,science 318:1917
‑
1920(2007)和li,w.等,stem cells 27:2992
‑
3000(2009))。
[0301]
nhek的重编程序
[0302]
在100mm组织培养皿中培养nhek,并用新鲜制备的慢病毒上清液转导3次(每次转导3
‑
4小时)。将1,000,000转导的nhek接种在100
‑
mm皿内的辐照过的x
‑
射线灭活的cf1 mef饲养细胞上,并在kcm中培养,用5μm ps48、0.25mm nab(stemgent)和0.5μm a
‑
83
‑
01(stemgent)处理2周,随后将一半体积的培养基更换为hescm,并补充5μm ps48、0.25mm nab和0.5μm a
‑
83
‑
01另外2周。然后,将细胞培养基更换为hescm,并补充5μm ps48、0.25mm nab、0.5μm a
‑
83
‑
01和0.5μm pd0325901(stemgent)另外4周。使用在没有化学物的培养基中培养的、相同的oct4感染的角质形成细胞作为对照。用accutase(millipore)分割培养物,并在分割后第一天用1μm thiazovivin(stemgent)处理。挑选被alexa fluor 555小鼠抗
‑
人tra
‑1‑
81抗体(bd pharmingen)阳性地染色的ipsc集落,用于在hescm内的饲养细胞上扩展,并常规地培养。
[0303]
huvec的重编程序
[0304]
在100mm组织培养皿中培养huvec,并用新鲜制备的慢病毒上清液转导2次(每次转导4
‑
6小时)。将200,000转导的huvec接种在明胶包被的100
‑
mm皿上,在hcm中培养,用5μm ps48、0.25mm nab和0.5μm a
‑
83
‑
01处理2周,随后将一半体积的培养基更换为hescm,并补充5μm ps48、0.25mm nab和0.5μm a
‑
83
‑
01另外2周。然后,将细胞培养基更换为hescm,并补充5μm ps48、0.25mm nab、0.5μm a
‑
83
‑
01和0.5μm pd0325901另外1
‑
2周。挑选被alexa fluor 555小鼠抗
‑
人tra
‑1‑
81抗体阳性地染色的ipsc集落,用于在hescm内的饲养细胞上扩展,并常规地培养。用accutase分割培养物,并在分割后第一天用1μm thiazovivin处理。
[0305]
体外分化
[0306]
通过标准的胚状体(eb)方法,进行hipsc的体外分化。简而言之,用accutase(millipore)脱离hipsc,在超低附着6
‑
孔板中培养8天,然后转移至基质胶
‑
包被的6
‑
孔板内的分化培养基中。固定所述细胞用于免疫细胞化学分析,或在8天后收获用于rt
‑
pcr实验。分化培养基:dmem/f12、10%fbs、1%glutamax、1%非必需氨基酸、1%青霉素/链霉素、0.1mmβ
‑
巯基乙醇。
[0307]
碱性磷酸酶染色和免疫细胞化学测定
[0308]
使用碱性磷酸酶检测试剂盒(stemgent),根据生产商的方案,进行碱性磷酸酶染色。如以前报道的(li,w.等,stem cells 27:2992
‑
3000(2009)),进行标准的免疫细胞化学测定。使用的第一抗体可以参见表3。第二抗体是alexa fluor 488驴抗
‑
小鼠或抗
‑
兔igg(1:1000)(invitrogen)。通过dapi(sigma
‑
aldrich)染色,使细胞核显影。使用nikon eclipse te2000
‑
u显微镜,捕获图像。
[0309]
通过rt
‑
pcr和qrt
‑
pcr进行基因表达分析
[0310]
对于rt
‑
pcr和qrt
‑
pcr分析,使用与qiashredder组合的rneasy plus微型试剂盒(qiagen),从人ipsc提取总rna。使用iscript
tm cdna合成试剂盒(biorad),使用2μg rna,进
行第一链的反转录。使用铂(platinum)pcr supermix(invitrogen),通过rt
‑
pcr来分析多能性标志物的表达。使用iq sybr green supermix(bio
‑
rad),通过qrt
‑
pcr,分析分化以后的谱系特异性的标志物的表达。引物可以参见表2。
[0311]
微阵列分析
[0312]
使用人ref
‑
8_v3表达beadchip(illumina,ca,usa)进行微阵列杂交,以检验nhek、hipsc和hes细胞的整体基因表达。用illumina totalprep rna扩增试剂盒(ambion amil1791,福斯特城,ca,usa)由500ng总rna合成生物素
‑
16
‑
utp
‑
标记的crna。按照illumina beadstation 500x系统手册(illumina,圣地亚哥,ca,usa),使用提供的试剂和ge健康护理(ge healthcare)的链霉抗生物素蛋白
‑
cy3染色溶液,制备包含750ng标记的扩增的crna的杂交混合物。与illumina人ref
‑
8_v3表达beadchip的杂交在beadchip hyb wheel上在55℃进行18小时。使用illumina beadarray读数仪扫描所述阵列。所有样品以两份生物学重复制备。微阵列数据的处理和分析使用illumina beadstudio软件进行。所述数据减去背景,并且使用秩不变量选项(rank invariant option)归一化。
[0313]
硫酸氢盐基因组测序
[0314]
使用non organic dna分离试剂盒(millipore),分离出基因组dna,然后用ez dna methylation
‑
gold试剂盒(zymo research corp.,orange,ca)处理。然后使用处理过的dna作为模板来扩增目标序列。用于oct4和nanog启动子片段扩增的引物如表2所示。使用用于测序的topo ta克隆试剂盒(invitrogen),克隆得到的片段,并测序。
[0315]
hipsc的基因分型
[0316]
使用特异性的引物,使用基因组dna的rt
‑
pcr,进行hipsc系的基因分型(表2;yu,j.等,science 318:1917
‑
1920(2007)和li,w.等,stem cells 27:2992
‑
3000(2009))。
[0317]
畸胎瘤形成
[0318]
使用0.05%胰蛋白酶
‑
edta,收获hipsc系。将500万细胞注射在scid小鼠(n=3)的肾囊下。4
‑
6周以后,收获发育良好的畸胎瘤,固定,然后在tsri组织学核心机构中进行组织学分析。
[0319]
表2使用的引物
[0320][0321]
表3应用的第一抗体
[0322][0323][0324]
表4重编程序实验的总结
[0325][0326]
nhek,新生儿人表皮角质形成细胞;huvec,人脐静脉内皮细胞;ahek,成年人表皮角质形成细胞;afdc,从羊水获得的细胞。使用的化学试剂浓度:pd,0.5μm pd0325901;a83,0.5μm a
‑
83
‑
01;ps48,5μm ps48;vpa,0.5mm丙戊酸;nab,0.25mm丁酸钠;par,2μm硫酸反苯环丙胺;chir,3μm chir99021。对于四因子或三因子诱导的重编程序,以100,000转导细胞/10cm皿的密度接种nhek,并在4周后对阳性集落计数;对于双因子诱导的重编程序,以100,000转导细胞/10cm皿的密度接种nhek,并在6周后对阳性集落计数;对于单因子诱导的重编程序,以1,000,000转导细胞/10cm皿的密度接种nhek和ahek,并在8周后对阳性集落计数;以200,000转导细胞/10cm皿的密度接种huvec和afdc,并在6周后对阳性集落计数。
[0327]
表5建立的人ipsc细胞系的表征
[0328][0329]
在常规hesc培养条件下,将表征的那些细胞系长期增殖超过20代,并进一步表征标志物表达和多能性;而建立的其它细胞系在第5或6代储存。空项表示未测定。
[0330]
表6对oct4诱导的ipsc和亲代细胞系的dna指纹分析
[0331]
基因组基因座nhek(混合的)hipsc
‑
o#1huvechipsc
‑
o#21牙釉蛋白x,yx,yxxvwa11,15,17,18,1915,1815;1615;16d8s117910,13,1613,10;1310;13tpox8,9,11,12888fga19,22,23,2419,2224;2724;27d3s135813,14,15,171714;1614;16tho16,7,9,9.37,966d21s1124.2,29,30.2,3524.2,2928;30.228;30.2d18s5113,14,16,17,18,1913,1713;1813;18五e(penta e)5,8,13,14,1913,191212d5s8188,11,12,1311,1312;1312;13d13s3178,9,11,12,139,1211;1411;14d7s8208,9,10,119,101111d16s5399,10,11,12,139,139;119;11csf1po10,11,1211,1211;1211;12五d(penta d)2.2,10,121012;1312;13
[0332]
研究了15个多态短串联重复(str)dna基因座和性染色体标志物牙釉蛋白。
[0333]
应当理解,本文所述的实施例和实施方案仅仅是为了例证目的,本领域技术人员在考虑它们以后会提出不同的修饰或变化,所述修饰或变化将被包括在本技术的实质和范围内和在后附权利要求书的范围内。在本文中引用的所有出版物、专利和专利申请为了所有目的通过引用整体并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1