杂芳类衍生物的盐及其制备方法与流程
1.本发明属于药物合成领域,具体涉及一种杂芳类衍生物的盐、晶型及其制备方法和应用。
背景技术:
2.janus激酶(jak)是一种胞内非受体酪氨酸激酶,介导各种细胞因子的信号传导和激活。jak激酶家族含有jak1、jak2、jak3和tyk2四个亚家族成员,各亚家族成员分别介导不同类型的细胞因子信号通路,jak1、jak2和tyk2在人体各组织细胞中均有表达,jak3主要表达于各造血组织细胞中。细胞因子受体的共同特点是受体本身不具有激酶活性,但受体胞内段具有酪氨酸激酶jak的结合位点。当细胞因子受体与其配体结合后,激活受体偶联的jaks,进而使受体被磷酸化,磷酸化的酪氨酸位点可与含有sh2结构域的stat蛋白结合,从而使stat被募集到受体并通过jaks磷酸化,随后磷酸酪氨酸介导stat二聚化,激活的stat二聚体转移到细胞核内并激活其靶点基因转录,进而调控多种细胞的生长、活化、分化等多种功能。
3.jak/stat信号通路介导细胞内大多数细胞因子的信号传导,在参与免疫调节、免疫细胞增殖等生物学过程中起关键作用。jak/stat信号通路功能广泛,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程,与多种炎症性疾病如类风湿性关节炎、皮炎、银屑病、炎症性肠病(溃疡性结肠炎及克罗恩病)等密切相关;同时jak/stat信号通路与肿瘤性疾病如骨髓纤维化、真性红细胞增多症及原发性血小板增多症密切相关,jak分子自身的突变也会导致急性骨髓细胞性白血病(aml)、急性淋巴细胞性白血病(all)、乳腺导管癌及非小细胞肺癌(nsclc)等肿瘤性疾病。
4.炎症性肠病是慢性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,uc)和克罗恩病(crohn’disease,cd)。目前治疗炎症性肠病的药物主要有氨基水杨酸制剂、糖皮质激素、免疫抑制剂、抗生素等。uc的治疗以调节免疫反应、抑制炎症为主要原则。目前在临床上,柳氮磺胺吡啶主要用于治疗轻度至中度的uc。而中度至重度的uc目前常用的药物包括糖皮质激素类,但是因为风险大于益处,所以不会作为长期的治疗手段。单克隆抗体则存在药物,成本高昂、产生药物抗体影响药物安全性和有效性,以及静脉给药的方式不够方便等问题,该领域仍存在着远未满足的医疗需求。许多接受治疗的患者还没有得到缓解,高达80%的克罗恩病患者和30%的uc患者最终需要接受手术治疗。
5.tofacitinib(xeljanz)是治疗中度至重度活动性uc成人患者的首个口服jak抑制剂,对jak1、2、3亚型均有显著的抑制活性,这增加了tofacitinib的疗效,但同时也带来了较为严重的副作用。不良反应包括感染、结核、肿瘤、贫血、肝损伤及胆固醇增加等。tofacitinib的说明书上有诸多的黑框标识:严重感染(肺结核、细菌、真菌、病毒)和恶性肿瘤(淋巴瘤等)。由于各个jak介导的功能广泛,这些副作用是该药物同时抑制多个jak引起的。由于jak广泛参与免疫细胞的调节,jak抑制剂不可避免地会引起免疫抑制相关的副作用,如严重的感染,甚至肿瘤的发生等。即使是目前在研的众多高选择性抑制剂,这种由抑
元杂环基,苯基或5
‑
6元含氮杂芳基,任选地进一步被卤素、氨基、氰基、c1‑3烷基、c1‑3烷氧基、c1‑3羟烷基、c1‑3烷基单取代的氨基、c1‑3烷基双取代的氨基、c3‑6环烷基、4
‑
7元杂环基,苯基或5
‑
6元含氮杂芳基中的一个或多个取代基所取代;
17.r4选自氢、c1‑6烷基、c1‑6羟烷基或c1‑6烷氧基;
18.环a选自芳基、五元含硫杂环基,优选苯基、环a选自芳基、五元含硫杂环基,优选苯基、
19.环b选自5
‑
10元含氮杂环基,优选10元含氮杂环基,优选
20.所述酸为无机酸或有机酸,优选地,所述无机酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸或磷酸;有机酸选自2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、帕莫酸、甲酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;
21.m为1、2或3;
22.r为0、1、2或3;
23.s为1、2或3。
24.在本发明进一步优选的实施方式中,所述化合物结构如通式(ii)所示:
[0025][0026]
其中,n为1或2。
[0027]
在本发明进一步优选的实施方式中,所述r1选自氢、氰基、卤素、c1‑3烷基、苯基、任选地进一步被氰基、卤素、c1‑3烷基、c1‑3烷氧基中的一个或多个取代基所取代。
[0028]
在本发明进一步优选的实施方式中,所述r3选自氢、羟基、卤氟、氯、溴、氨基、甲氨基、乙基氨基、二甲基氨基、甲基、乙基、羟甲基、甲氧基、乙氧基、苯基、基、乙基氨基、二甲基氨基、甲基、乙基、羟甲基、甲氧基、乙氧基、苯基、任选地进一步被卤素、氨基、c1‑3烷基单取代的氨基、c1‑3烷基双取代的氨基、c1‑3烷基、c1‑3羟烷基、c1‑3烷氧基、苯基、基、苯基、中的一个或多个取代基所取代。
[0029]
在本发明进一步优选的实施方式中,所述酸选自磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸、硬脂酸;优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、富马酸、马尿酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、草酸或氢溴酸;进一步优选磷酸、马来酸或苯磺酸。
[0030]
在本发明进一步优选的实施方式中,所述通式(i)选自以下化合物:
[0031]
[0032]
[0033]
[0034]
[0035]
[0036]
[0037]
[0038]
[0039][0040]
相应编号对应化合物的具体结构如下:
[0041]
[0042]
[0043]
[0044]
[0045]
[0046][0047]
在本发明进一步优选的实施方式中,所述通式(i)选自以下化合物:
[0048]
[0049]
[0050][0051]
所述酸选自磷酸、丁二酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、醋酸、丙二酸、帕莫酸、乙烷磺酸、苯甲酸、苹果酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸或硬脂酸,优选磷酸、丁二酸、马来酸、羟乙基磺酸、1,5
‑
萘二磺酸、对甲苯磺酸、氢溴酸、草酸或富马酸。
[0052]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的酸式盐,其中,所述酸选自盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸或硬脂酸。
[0053]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮的酸式盐,其中,所述酸式盐选自盐酸盐、马来酸盐、苯磺酸盐、羟乙基磺酸盐、1,5
‑
萘二磺酸盐、酒石酸盐、己二酸盐、硫酸盐、对甲苯磺酸盐、氢溴酸盐、草酸盐、富马酸盐、甲酸盐、马尿酸盐、月桂酸盐或硬脂酸盐。
[0054]
在本发明进一步优选的实施方式中,化合物2
‑
(乙胺基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的酸式盐,其中,所述酸式盐选自盐酸盐、马来酸盐、苯磺酸盐、羟乙基磺酸盐、1,5
‑
萘二磺酸盐、酒石酸盐、己二酸盐、硫酸盐、对甲苯磺酸盐、氢溴酸盐、草酸盐、富马酸盐、甲酸盐、马尿酸盐、月桂酸盐或硬脂酸盐。,
[0055]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的酸式盐,其中,所述酸选自磷酸、丁二酸、醋酸、盐酸、苯磺酸、氢溴酸、草酸、己二酸、乙烷磺酸、苯甲酸、1,5
‑
萘二磺酸、帕莫酸、马尿酸、硫酸、丙二酸、对甲苯磺酸、马来酸、苹果酸、酒石酸、富马酸,优选磷酸。
[0056]
在本发明进一步优选的实施方式中,所述酸的个数为0.2
‑
3,优选0.2、0.5、1、1.5、2、2.5或3,更优选0.5、1、2或3。
[0057]
在本发明进一步优选的实施方式中,所述的酸式盐为水合物或无水物,并且当酸式盐为水合物时,水的个数为0.2
‑
3,优选0.2、0.5、1、1.5、2、2.5或3,更优选0.5、1、2或3。
[0058]
在本发明进一步优选的实施方式中,所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮、1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮和2
‑
(乙胺基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的酸式盐,其中,所述酸式盐为马来酸盐,且酸的个数为1或2。
[0059]
在本发明进一步优选的实施方式中,所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的的酸式盐,其中,所述酸式盐为磷酸盐,且酸的个数为1或2。
[0060]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的酸式盐晶型,其中,所述酸选自盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸或硬脂酸。
[0061]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的酸式盐晶型,其中,所述酸选自磷酸、丁二酸、醋酸、盐酸、苯磺酸、氢溴酸、草酸、己二酸、乙烷磺酸、苯甲酸、1,5
‑
萘二磺酸、帕莫酸、马尿酸、硫酸、丙二酸、对甲苯磺酸、马来酸、苹果酸、酒石酸、富马酸,优选磷酸。
[0062]
在本发明进一步优选的实施方式中,所述酸的个数为0.2
‑
3,优选0.2、0.5、1、1.5、2、2.5或3,更优选0.5、1、2或3。
[0063]
在本发明进一步优选的实施方式中,所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为9.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为13.4
±
0.2
°
和22.7
±
0.2
°
处具有衍射
峰;更优选地,还包含在2θ(
±
0.2
°
)为11.0
±
0.2
°
、14.9
±
0.2
°
、18.2
±
0.2
°
和22.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为17.4
±
0.2
°
、17.8
±
0.2
°
、18.4
±
0.2
°
、19.1
±
0.2
°
、19.7
±
0.2
°
、20.2
±
0.2
°
、21.1
±
0.2
°
和25.7
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为24.1
±
0.2
°
、24.7
±
0.2
°
、25.9
±
0.2
°
、27.7
±
0.2
°
和29.1
±
0.2
°
处具有衍射峰;更更进一步优选地,还包含在2θ(
±
0.2
°
)为16.9
±
0.2
°
、23.1
±
0.2
°
、24.3
±
0.2
°
、26.5
±
0.2
°
、28.3
±
0.2
°
和29.7
±
0.2
°
处具有衍射峰;
[0064]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表1所示。
[0065]
表1
[0066]
[0067]
[0068][0069]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图1所示,其dsc图谱基本如图2所示,其tga图谱基本如图3所示。
[0070]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为13.6
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为21.4
±
0.2
°
和23.7
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.7
±
0.2
°
、9.2
±
0.2
°
、18.4
±
0.2
°
和23.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.9
±
0.2
°
、13.0
±
0.2
°
、14.3
±
0.2
°
、14.8
±
0.2
°
、15.8
±
0.2
°
、18.0
±
0.2
°
、19.2
±
0.2
°
和19.5
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为21.7
±
0.2
°
、22.3
±
0.2
°
和24.4
±
0.2
°
处具有衍射峰。
[0071]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表2所示。
[0072]
表2
[0073]
[0074][0075]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯
磺酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图4所示。
[0076]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为14.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为21.5
±
0.2
°
和22.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.1
±
0.2
°
、13.6
±
0.2
°
、18.3
±
0.2
°
和18.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为22.5
±
0.2
°
、23.4
±
0.2
°
、23.7
±
0.2
°
和24.5
±
0.2
°
处具有衍射峰。
[0077]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表3所示。
[0078]
表3
[0079]
[0080][0081]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型c,其x
‑
射线粉末衍射图谱基本如图5所示,其dsc图谱基本如图6所示,其tga图谱基本如图7所示。
[0082]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型d,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为18.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为11.0
±
0.2
°
和22.2
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.6
±
0.2
°
、21.2
±
0.2
°
、21.5
±
0.2
°
和25.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.7
±
0.2
°
、13.5
±
0.2
°
、14.9
±
0.2
°
、15.3
±
0.2
°
、17.4
±
0.2
°
、18.6
±
0.2
°
、19.1
±
0.2
°
和19.8
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为22.7
±
0.2
°
、24.7
±
0.2
°
、25.8
±
0.2
°
和27.6
±
0.2
°
处具有衍射峰;更更进一步优选地,还包含在2θ(
±
0.2
°
)为16.9
±
0.2
°
、19.4
±
0.2
°
、20.4
±
0.2
°
、23.1
±
0.2
°
、26.3
±
0.2
°
、28.2
±
0.2
°
和29.1
±
0.2
°
处具有衍射峰。
[0083]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表4所示。
[0084]
表4
[0085]
[0086]
[0087][0088]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型d,其x
‑
射线粉末衍射图谱基本如图8所示。
[0089]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型e,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.4
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为11.9
±
0.2
°
和21.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
、8.7
±
0.2
°
、14.3
±
0.2
°
和25.0
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.6
±
0.2
°
、12.1
±
0.2
°
、15.7
±
0.2
°
、16.1
±
0.2
°
、16.8
±
0.2
°
、22.5
±
0.2
°
、26.4
±
0.2
°
和27.2
±
0.2
°
处具有衍射峰;
[0090]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表5所示。
[0091]
表5
[0092]
[0093][0094]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型e,其x
‑
射线粉末衍射图谱基本如图9所示,其dsc图谱基本如图10所示,其tga图谱基本如图11所示。
[0095]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型f,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为18.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为13.4
±
0.2
°
和24.6
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为15.2
±
0.2
°
、16.8
±
0.2
°
、20.9
±
0.2
°
和25.0
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
、9.4
±
0.2
°
、18.2
±
0.2
°
、19.5
±
0.2
°
、21.6
±
0.2
°
、22.8
±
0.2
°
、23.11
±
0.2
°
、24.6
±
0.2
°
和29.7
±
0.2
°
处具有衍射峰;
[0096]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表6所示。
[0097]
表6
[0098]
[0099][0100]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型f,其x
‑
射线粉末衍射图谱基本如图12所示。
[0101]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型g,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为17.8
±
0.2
°
和21.3
±
0.2
°
处具有衍射峰;更优
选地,还包含在2θ(
±
0.2
°
)为15.9
±
0.2
°
、17.1
±
0.2
°
、20.8
±
0.2
°
和22.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为12.4
±
0.2
°
、13.1
±
0.2
°
、18.7
±
0.2
°
、19.7
±
0.2
°
和25.7
±
0.2
°
处具有衍射峰。
[0102]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表7所示。
[0103]
表7
[0104]
[0105][0106]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型g,其x
‑
射线粉末衍射图谱基本如图13所示。
[0107]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型h,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为11.9
±
0.2
°
和20.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.9
±
0.2
°
、14.2
±
0.2
°
、17.5
±
0.2
°
和26.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.7
±
0.2
°
、10.5
±
0.2
°
、16.0
±
0.2
°
、17.8
±
0.2
°
、22.0
±
0.2
°
、22.4
±
0.2
°
、25.0
±
0.2
°
和25.3
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为17.3
±
0.2
°
、18.4
±
0.2
°
和28.0
±
0.2
°
处具有衍射峰。
[0108]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表8所示。
[0109]
表8
[0110]
[0111][0112]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型h,其x
‑
射线粉末衍射图谱基本如图14所示。
[0113]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硫酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为14.0
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为16.0
±
0.2
°
和22.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为13.3
±
0.2
°
、19.3
±
0.2
°
、21.8
±
0.2
°
和22.7
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为7.4
±
0.2
°
、11.0
±
0.2
°
、11.5
±
0.2
°
、12.8
±
0.2
°
、15.0
±
0.2
°
、17.4
±
0.2
°
、21.5
±
0.2
°
和27.4
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为8.8
±
0.2
°
、10.0
±
0.2
°
、15.4
±
0.2
°
、16.9
±
0.2
°
、19.7
±
0.2
°
、20.8
±
0.2
°
、22.5
±
0.2
°
、23.1
±
0.2
°
、23.9
±
0.2
°
、24.2
±
0.2
°
、27.0
±
0.2
°
、28.0
±
0.2
°
和28.2
±
0.2
°
处具有衍射峰。
[0114]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表9所示。
[0115]
表9
[0116]
[0117]
[0118][0119]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硫酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图15所示,其dsc图谱基本如图16所示,其tga图谱基本如图17所示。
[0120]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为10.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为17.0
±
0.2
°
和22.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为7.0
±
0.2
°
、19.1
±
0.2
°
、20.1
±
0.2
°
和20.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为14.2
±
0.2
°
、14.7
±
0.2
°
、16.3
±
0.2
°
、21.4
±
0.2
°
、21.8
±
0.2
°
、22.2
±
0.2
°
、24.6
±
0.2
°
和26.0
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为9.3
±
0.2
°
、18.8
±
0.2
°
、23.8
±
0.2
°
和25.4
±
0.2
°
处具有衍射峰。
[0121]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表10所示。
[0122]
表10
[0123]
[0124][0125]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图18所示;其dsc图谱基本如图19所示;其tga图谱基本如图20所示。
[0126]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为11.4
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为18.4
±
0.2
°
和20.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.1
±
0.2
°
、11.4
±
0.2
°
、17.4
±
0.2
°
和26.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为15.8
±
0.2
°
、17.1
±
0.2
°
、21.5
±
0.2
°
、22.6
±
0.2
°
、23.0
±
0.2
°
、23.6
±
0.2
°
、24.9
±
0.2
°
和25.2
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为9.8
±
0.2
°
、13.9
±
0.2
°
、14.9
±
0.2
°
、22.9
±
0.2
°
、26.1
±
0.2
°
和28.6
±
0.2
°
处具有衍射峰。
[0127]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表11所示。
[0128]
表11
[0129]
[0130][0131]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图21所示;其dsc图谱基本如图22所示;其tga图谱基本如图23所示。
[0132]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为18.5
±
0.2
°
和21.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为15.7
±
0.2
°
、18.7
±
0.2
°
、19.7
±
0.2
°
和23.4
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为6.6
±
0.2
°
、11.3
±
0.2
°
、12.8
±
0.2
°
、14.6
±
0.2
°
、20.3
±
0.2
°
、20.6
±
0.2
°
、26.6
±
0.2
°
和27.1
±
0.2
°
处具有衍射峰;更更进一步优选地,还包含在2θ(
±
0.2
°
)为17.7
±
0.2
°
、23.0
±
0.2
°
、23.8
±
0.2
°
、26.2
±
0.2
°
、30.2
±
0.2
°
和32.1
±
0.2
°
处具有衍射峰;最优选地,还包含在2θ(
±
0.2
°
)为13.5
±
0.2
°
、16.5
±
0.2
°
、20.9
±
0.2
°
、25.7
±
0.2
°
、28.3
±
0.2
°
和33.5
±
0.2
°
处具有衍射峰。
[0133]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表12所示。
[0134]
表12
[0135]
[0136][0137]
[0138]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型c,其x
‑
射线粉末衍射图谱基本如图24所示;其dsc图谱基本如图25所示。
[0139]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为19.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为16.6
±
0.2
°
和20.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为18.0
±
0.2
°
、18.4
±
0.2
°
、18.6
±
0.2
°
和22.9
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.1
±
0.2
°
、9.8
±
0.2
°
、12.6
±
0.2
°
、13.0
±
0.2
°
、13.3
±
0.2
°
、17.8
±
0.2
°
、21.1
±
0.2
°
和26.4
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为24.2
±
0.2
°
和29.5
±
0.2
°
处具有衍射峰。
[0140]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表13所示。
[0141]
表13
[0142]
[0143][0144]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图26所示;其dsc图谱基本如图27所示;其tga图谱基本如图28所示。
[0145]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.5
±
0.2
°
处
具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为16.5
±
0.2
°
和19.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为13.2
±
0.2
°
、17.8
±
0.2
°
、21.3
±
0.2
°
和27.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.6
±
0.2
°
、11.0
±
0.2
°
、14.5
±
0.2
°
、16.1
±
0.2
°
、16.7
±
0.2
°
、21.9
±
0.2
°
、22.2
±
0.2
°
和23.5
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为17.5
±
0.2
°
、19.2
±
0.2
°
、23.3
±
0.2
°
、24.2
±
0.2
°
和29.4
±
0.2
°
处具有衍射峰。
[0146]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表14所示。
[0147]
表14
[0148]
[0149][0150]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图29所示;其dsc图谱基本如图30所示;其tga图谱基本如图31所示。
[0151]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为9.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为14.7
±
0.2
°
和17.8
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为10.7
±
0.2
°
、13.3
±
0.2
°
、21.1
±
0.2
°
和25.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.6
±
0.2
°
、14.9
±
0.2
°
、18.5
±
0.2
°
、19.8
±
0.2
°
、21.7
±
0.2
°
、22.2
±
0.2
°
、22.8
±
0.2
°
和28.7
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为14.4
±
0.2
°
、16.6
±
0.2
°
、19.5
±
0.2
°
、20.3
±
0.2
°
、24.2
±
0.2
°
、24.5
±
0.2
°
和25.5
±
0.2
°
处具有衍射峰;更更进一步优选地,还包含在2θ(
±
0.2
°
)为17.3
±
0.2
°
、22.4
±
0.2
°
、26.1
±
0.2
°
、26.7
±
0.2
°
、27.5
±
0.2
°
、29.7
±
0.2
°
和33.2
±
0.2
°
处具有衍射峰。
[0152]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表15所示。
[0153]
表15
[0154]
[0155][0156]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图32所示;其dsc图谱基本如图33所示;其tga图谱基本如图34所示。
[0157]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.9
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为7.0
±
0.2
°
和19.6
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.3
±
0.2
°
、10.3
±
0.2
°
、11.6
±
0.2
°
和25.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为12.4
±
0.2
°
、13.2
±
0.2
°
、14.6
±
0.2
°
、
16.3
±
0.2
°
、18.2
±
0.2
°
、19.0
±
0.2
°
、20.3
±
0.2
°
、21.6
±
0.2
°
和23.0
±
0.2
°
处具有衍射峰;
[0158]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表16所示。
[0159]
表16
[0160]
[0161][0162]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图35所示;其dsc图谱基本如图36所示;其tga图谱基本如图37所示。
[0163]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为12.1
±
0.2
°
和17.6
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为15.5
±
0.2
°
、17.8
±
0.2
°
、21.6
±
0.2
°
和25.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.8
±
0.2
°
、11.2
±
0.2
°
、14.4
±
0.2
°
、20.9
±
0.2
°
、22.7
±
0.2
°
、24.4
±
0.2
°
、24.7
±
0.2
°
、26.4
±
0.2
°
和26.8
±
0.2
°
处具有衍射峰;
[0164]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表17所示。
[0165]
表17
[0166]
[0167][0168]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图38所示;其dsc图谱基本如图39所示;其tga图谱基本如图40所示。
[0169]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为10.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为15.5
±
0.2
°
和19.8
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为11.8
±
0.2
°
、19.1
±
0.2
°
、20.1
±
0.2
°
和21.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.6
±
0.2
°
、14.1
±
0.2
°
、16.5
±
0.2
°
、17.2
±
0.2
°
、18.0
±
0.2
°
、23.9
±
0.2
°
、24.5
±
0.2
°
和24.8
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为11.3
±
0.2
°
、12.2
±
0.2
°
、17.6
±
0.2
°
和22.0
±
0.2
°
处具有衍射峰;
[0170]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表18所示。
[0171]
表18
[0172]
[0173][0174]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图41所示;其dsc图谱基本如图42所示。
[0175]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基
氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为15.5
±
0.2
°
和19.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为10.8
±
0.2
°
、19.9
±
0.2
°
、20.4
±
0.2
°
和21.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
、12.8
±
0.2
°
、8.6
±
0.2
°
、13.6
±
0.2
°
、16.6
±
0.2
°
、17.0
±
0.2
°
、18.0
±
0.2
°
和23.2
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为24.2
±
0.2
°
和24.6
±
0.2
°
处具有衍射峰。
[0176]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表19所示。
[0177]
表19
[0178][0179][0180]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并
[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型c,其x
‑
射线粉末衍射图谱基本如图43所示。
[0181]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的草酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为19.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为11.2
±
0.2
°
和18.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为和9.0
±
0.2
°
、22.4
±
0.2
°
、24.6
±
0.2
°
和25.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.6
±
0.2
°
、14.8
±
0.2
°
、17.7
±
0.2
°
、18.8
±
0.2
°
、20.3
±
0.2
°
、20.6
±
0.2
°
、23.6
±
0.2
°
和24.0
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为7.0
±
0.2
°
、13.0
±
0.2
°
、14.3
±
0.2
°
、15.6
±
0.2
°
、16.3
±
0.2
°
和20.9
±
0.2
°
和处具有衍射峰。
[0182]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表20所示。
[0183]
表20
[0184]
[0185][0186]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的草酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图44所示;其dsc图谱基本如图45所示;其tga图谱基本如图46所示。
[0187]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的氢溴酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为11.9
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为22.4
±
0.2
°
和27.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为14.9
±
0.2
°
、18.6
±
0.2
°
、20.5
±
0.2
°
和24.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为20.8
±
0.2
°
、21.6
±
0.2
°
和25.2
±
0.2
°
处具有衍射峰。
[0188]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表21所示。
[0189]
表21
[0190][0191]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的氢溴酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图47所示;其dsc图谱基本如图48所示;其tga图谱基本如图49所示。
[0192]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为16.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为10.4
±
0.2
°
和18.4
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为20.9
±
0.2
°
、21.6
±
0.2
°
、23.3
±
0.2
°
和和26.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为11.5
±
0.2
°
、12.4
±
0.2
°
、14.5
±
0.2
°
、17.5
±
0.2
°
、19.0
±
0.2
°
、22.0
±
0.2
°
、23.8
±
0.2
°
和24.3
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为6.7
±
0.2
°
、10.1
±
0.2
°
、11.7
±
0.2
°
、13.0
±
0.2
°
、15.5
±
0.2
°
和25.1
±
0.2
°
处具有衍射峰。
[0193]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表22所示。
[0194]
表22
[0195]
[0196][0197]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图50所示。
[0198]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为8.8
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为15.1
±
0.2
°
和24.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为13.4
±
0.2
°
、13.9
±
0.2
°
、15.5
±
0.2
°
和18.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为14.8
±
0.2
°
、17.0
±
0.2
°
、18.9
±
0.2
°
、19.8
±
0.2
°
、20.3
±
0.2
°
、21.0
±
0.2
°
、21.4
±
0.2
°
和24.1
±
0.2
°
处具有衍射峰;
[0199]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表23所示。
[0200]
表23
[0201]
[0202][0203]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型c,其x
‑
射线粉末衍射图谱基本如图51所示;其dsc图谱基本如图52所示;
其tga图谱基本如图53所示。
[0204]
在本发明进一步优选的的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型d,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.4
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为10.4
±
0.2
°
和20.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为12.6
±
0.2
°
、14.4
±
0.2
°
、22.5
±
0.2
°
和24.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为7.2
±
0.2
°
、10.9
±
0.2
°
、15.2
±
0.2
°
、16.9
±
0.2
°
、18.5
±
0.2
°
、24.7
±
0.2
°
、25.1
±
0.2
°
和26.5
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为9.2
±
0.2
°
、14.6
±
0.2
°
、16.0
±
0.2
°
、19.4
±
0.2
°
、21.9
±
0.2
°
、27.5
±
0.2
°
、28.1
±
0.2
°
和33.2
±
0.2
°
处具有衍射峰。
[0205]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表24所示。
[0206]
表24
[0207]
[0208][0209]
在本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型d,其x
‑
射线粉末衍射图谱基本如图54所示;其dsc图谱基本如图55所示;其tga图谱基本如图56所示。
[0210]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的酒石酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.6
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为16.0
±
0.2
°
和17.7
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为17.1
±
0.2
°
、19.8
±
0.2
°
、20.7
±
0.2
°
和22.5
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为13.1
±
0.2
°
、14.2
±
0.2
°
、14.5
±
0.2
°
、20.1
±
0.2
°
和28.6
±
0.2
°
处具有衍射峰。
[0211]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表25所示。
[0212]
表25
[0213][0214]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的酒石酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图57所示;其dsc图谱基本如图58所示;其tga图谱基本如图59所示。
[0215]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的甲酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为18.0
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为17.6
±
0.2
°
和23.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为12.8
±
0.2
°
、14.5
±
0.2
°
、21.0
±
0.2
°
和24.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.4
±
0.2
°
、13.1
±
0.2
°
、19.9
±
0.2
°
、22.9
±
0.2
°
、25.3
±
0.2
°
、28.8
±
0.2
°
和31.0
±
0.2
°
处具有衍射峰。
[0216]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表26所示。
[0217]
表26
[0218]
[0219][0220]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的甲酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图60所示。
[0221]
化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的马尿酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为19.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为18.0
±
0.2
°
和19.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为17.6
±
0.2
°
、21.3
±
0.2
°
、21.8
±
0.2
°
和23.0
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为5.8
±
0.2
°
、8.8
±
0.2
°
、13.7
±
0.2
°
、16.6
±
0.2
°
、18.5
±
0.2
°
、20.3
±
0.2
°
、23.4
±
0.2
°
和25.3
±
0.2
°
处具有衍射峰;
[0222]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表27所示。
[0223]
表27
[0224]
[0225][0226]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的马尿酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图61所示。
[0227]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的月桂酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)9.6
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)21.3
±
0.2
°
和23.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)8.6
±
0.2
°
、21.6
±
0.2
°
、22.8
±
0.2
°
和25.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为12.7
±
0.2
°
、15.0
±
0.2
°
、16.7
±
0.2
°
、17.4
±
0.2
°
、17.9
±
0.2
°
、20.0
±
0.2
°
、22.3
±
0.2
°
和24.2
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)14.8
±
0.2
°
、18.4
±
0.2
°
和26.2
±
0.2
°
处具有衍射峰。
[0228]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表28所示。
[0229]
表28
[0230]
[0231][0232]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的月桂酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图62所示;其dsc图谱基本如图63所示;其tga图谱基本如图64所示。
[0233]
在本发明进一步优选的实施方式中,化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硬脂酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为17.5
±
0.2
°
和22.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为16.1
±
0.2
°
、20.1
±
0.2
°
、21.0
±
0.2
°
和23.7
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)5.8
±
0.2
°
、7.3
±
0.2
°
、18.0
±
0.2
°
、19.6
±
0.2
°
、22.0
±
0.2
°
和23.2
±
0.2
°
处具有衍射峰。
[0234]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表29所示。
[0235]
表29
[0236]
[0237][0238]
本发明所述化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硬脂酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图65所示。
[0239]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.8
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为5.8
±
0.2
°
和22.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为12.4
±
0.2
°
、17.8
±
0.2
°
、19.0
±
0.2
°
和26.4
±
0.2
°
和处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.0
±
0.2
°
、11.7
±
0.2
°
、13.7
±
0.2
°
、14.8
±
0.2
°
、18.6
±
0.2
°
、20.1
±
0.2
°
、20.6
±
0.2
°
和23.5
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为16.7
±
0.2
°
、25.0
±
0.2
°
和27.0
±
0.2
°
处具有衍射峰;
[0240]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表30所示。
[0241]
表30
[0242]
[0243][0244]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型a,其x
‑
射线粉末
衍射图谱基本如图67所示。
[0245]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.6
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.4
±
0.2
°
和19.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为10.7
±
0.2
°
、16.5
±
0.2
°
、18.7
±
0.2
°
和19.7
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.9
±
0.2
°
、15.5
±
0.2
°
、17.0
±
0.2
°
、17.3
±
0.2
°
、20.3
±
0.2
°
、21.1
±
0.2
°
、25.7
±
0.2
°
和27.1
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为8.1
±
0.2
°
、17.9
±
0.2
°
和23.1
±
0.2
°
处具有衍射峰;
[0246]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表31所示。
[0247]
表31
[0248]
[0249][0250]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图68所示,其dsc图谱基本如图69所示,其tga图谱基本如图70所示;
[0251]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为20.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.3
±
0.2
°
和20.4
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.8
±
0.2
°
、10.2
±
0.2
°
、21.6
±
0.2
°
和23.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.9
±
0.2
°
、16.9
±
0.2
°
、19.2
±
0.2
°
、26.7
±
0.2
°
和27.2
±
0.2
°
处具有衍射峰;
[0252]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表32所示。
[0253]
表32
[0254]
[0255][0256]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图71所示。
[0257]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为8.1
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为9.6
±
0.2
°
和26.5
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为17.0
±
0.2
°
、17.2
±
0.2
°
、20.2
±
0.2
°
和22.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.6
±
0.2
°
、10.2
±
0.2
°
、14.0
±
0.2
°
、15.2
±
0.2
°
、16.3
±
0.2
°
、16.6
±
0.2
°
、19.8
±
0.2
°
和26.9
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为21.0
±
0.2
°
和23.6
±
0.2
°
处具有衍射峰;
[0258]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表33所示。
[0259]
表33
[0260]
[0261][0262]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图72所示。
[0263]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.4
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为10.3
±
0.2
°
和21.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为和15.7
±
0.2
°
、19.5
±
0.2
°
、22.9
±
0.2
°
和25.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.8
±
0.2
°
、16.7
±
0.2
°
、17.6
±
0.2
°
、18.8
±
0.2
°
、20.4
±
0.2
°
、24.1
±
0.2
°
、25.3
±
0.2
°
和29.0
±
0.2
°
处具有衍射峰;
[0264]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表34所示。
[0265]
表34
[0266]
[0267]
[0268][0269]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型c,其x
‑
射线粉末衍射图谱基本如图73所示。
[0270]
在本发明进一步优选的实施方案中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型d,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为4.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.1
±
0.2
°
和27.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为10.9
±
0.2
°
、13.4
±
0.2
°
、17.6
±
0.2
°
和18.9
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.3
±
0.2
°
、13.9
±
0.2
°
、14.4
±
0.2
°
、15.2
±
0.2
°
、20.3
±
0.2
°
、23.2
±
0.2
°
、25.8
±
0.2
°
和26.7
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为17.2
±
0.2
°
、20.7
±
0.2
°
、22.0
±
0.2
°
和22.6
±
0.2
°
处具有衍射峰;
[0271]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表35所示。
[0272]
表35
[0273]
[0274][0275]
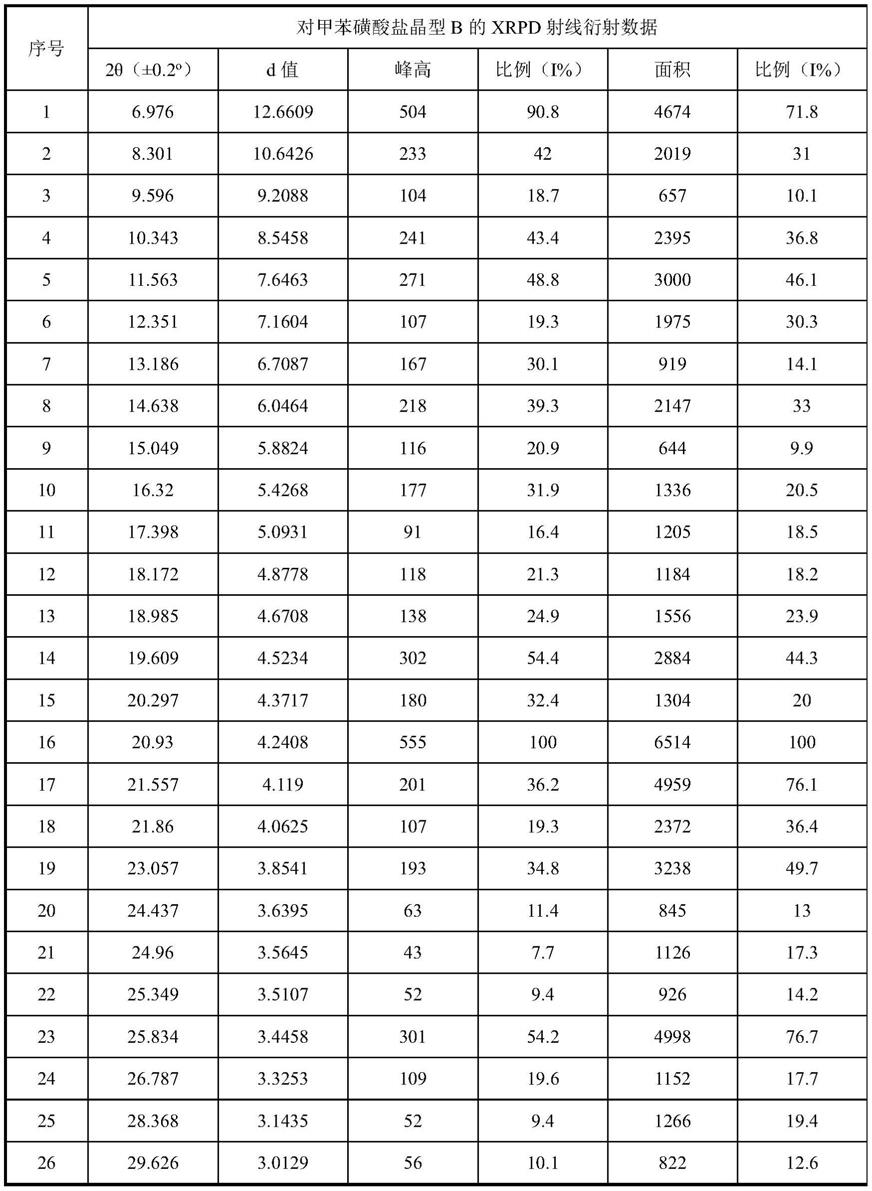
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型d,其x
‑
射线粉末衍射图谱基本如图74所示。
[0276]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型e,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为19.8
±
0.2
°
和20.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.0
±
0.2
°
、10.3
±
0.2
°
、22.3
±
0.2
°
和25.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为15.1
±
0.2
°
、26.9
±
0.2
°
、28.0
±
0.2
°
和29.5
±
0.2
°
处具有衍射峰;
[0277]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表36所示。
[0278]
表36
[0279]
[0280][0281]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型e,其x
‑
射线粉末衍射图谱基本如图75所示。
[0282]
在本发明进一步优选地实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为9.1
±
0.2
°
和20.5
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.3
±
0.2
°
、14.2
±
0.2
°
、16.2
±
0.2
°
和27.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.7
±
0.2
°
、10.3
±
0.2
°
、19.0
±
0.2
°
、25.1
±
0.2
°
和26.3
±
0.2
°
处具有衍射峰;
[0283]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表37所示。
[0284]
表37
[0285]
[0286][0287]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图76所示。
[0288]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为10.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.9
±
0.2
°
和20.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.5
±
0.2
°
、17.9
±
0.2
°
、22.2
±
0.2
°
和25.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为5.3
±
0.2
°
、15.0
±
0.2
°
、21.3
±
0.2
°
、26.1
±
0.2
°
、26.7
±
0.2
°
和29.5
±
0.2
°
处具有衍射峰;
[0289]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表38所示。
[0290]
表38
[0291]
[0292][0293]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图77所示。
[0294]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型c,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为18.9
±
0.2
°
和24.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为13.8
±
0.2
°
、18.0
±
0.2
°
、21.8
±
0.2
°
和27.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.4
±
0.2
°
、11.3
±
0.2
°
、16.0
±
0.2
°
、21.5
±
0.2
°
、23.0
±
0.2
°
、27.3
±
0.2
°
和29.4
±
0.2
°
处具有衍射峰;
[0295]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表39所示。
[0296]
表39
[0297]
[0298][0299]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型c,其x
‑
射线粉末衍
射图谱基本如图78所示。
[0300]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型d,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.8
±
0.2
°
和26.3
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.8
±
0.2
°
、13.8
±
0.2
°
、19.8
±
0.2
°
和25.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.3
±
0.2
°
、14.2
±
0.2
°
、15.8
±
0.2
°
、17.3
±
0.2
°
、18.5
±
0.2
°
和23.3
±
0.2
°
处具有衍射峰;
[0301]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表40所示。
[0302]
表40
[0303]
[0304][0305]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型d,其x
‑
射线粉末衍射图谱基本如图79所示。
[0306]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为12.1
±
0.2
°
和15.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为7.5
±
0.2
°
、21.2
±
0.2
°
、26.6
±
0.2
°
和27.0
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为14.8
±
0.2
°
、15.3
±
0.2
°
、16.2
±
0.2
°
、20.0
±
0.2
°
、20.5
±
0.2
°
、21.8
±
0.2
°
、23.8
±
0.2
°
和29.0
±
0.2
°
处具有衍射峰;
[0307]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表41所示。
[0308]
表41
[0309]
[0310]
[0311][0312]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图80所示。
[0313]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的氢溴酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.8
±
0.2
°
和19.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
、9.6
±
0.2
°
、18.5
±
0.2
°
和19.7
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.4
±
0.2
°
、9.8
±
0.2
°
、12.4
±
0.2
°
、17.2
±
0.2
°
、22.6
±
0.2
°
、24.6
±
0.2
°
、24.9
±
0.2
°
、25.9
±
0.2
°
和27.0
±
0.2
°
处具有衍射峰;
[0314]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表42所示。
[0315]
表42
[0316]
[0317][0318]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的氢溴酸盐晶型a,其x
‑
射线粉末
衍射图谱基本如图81所示。
[0319]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的草酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为8.4
±
0.2
°
和24.6
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.6
±
0.2
°
、13.1
±
0.2
°
、14.7
±
0.2
°
和27.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为7.2
±
0.2
°
、12.4
±
0.2
°
、16.9
±
0.2
°
、20.0
±
0.2
°
、20.9
±
0.2
°
、24.4
±
0.2
°
和25.4
±
0.2
°
处具有衍射峰;
[0320]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表43所示。
[0321]
表43
[0322]
[0323][0324]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的草酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图82所示。
[0325]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的己二酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为7.9
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为21.3
±
0.2
°
和23.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为7.7
±
0.2
°
、11.1
±
0.2
°
、24.7
±
0.2
°
和27.4
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为13.1
±
0.2
°
、16.5
±
0.2
°
、20.1
±
0.2
°
、25.1
±
0.2
°
和29.7
±
0.2
°
处具有衍射峰;
[0326]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表44所示。
[0327]
表44
[0328]
[0329]
[0330][0331]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的己二酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图83所示。
[0332]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的乙烷磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为5.5
±
0.2
°
和13.1
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.5
±
0.2
°
、16.4
±
0.2
°
、20.0
±
0.2
°
和22.0
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为12.9
±
0.2
°
和16.0
±
0.2
°
处具有衍射峰;
[0333]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表45所示。
[0334]
表45
[0335]
[0336][0337]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的乙烷磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图84所示。
[0338]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯甲酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为9.5
±
0.2
°
和15.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为5.9
±
0.2
°
、14.0
±
0.2
°
、15.5
±
0.2
°
和25.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
、9.1
±
0.2
°
、12.2
±
0.2
°
、19.7
±
0.2
°
、20.8
±
0.2
°
、23.7
±
0.2
°
、26.0
±
0.2
°
和28.1
±
0.2
°
处具有衍射峰;
[0339]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表46所示。
[0340]
表46
[0341]
[0342][0343]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯甲酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图85所示。
[0344]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的1,5
‑
萘二磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为9.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为4.7
±
0.2
°
和16.5
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为18.4
±
0.2
°
、20.6
±
0.2
°
、21.9
±
0.2
°
和23.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为13.0
±
0.2
°
、14.1
±
0.2
°
、17.6
±
0.2
°
、21.6
±
0.2
°
、22.5
±
0.2
°
、24.7
±
0.2
°
、25.1
±
0.2
°
、26.2
±
0.2
°
和27.6
±
0.2
°
处具有衍射峰;
[0345]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表47所示。
[0346]
表47
[0347]
[0348]
[0349][0350]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的1,5
‑
萘二磺酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图86所示。
[0351]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的帕莫酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为21.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为7.9
±
0.2
°
和17.8
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为9.9
±
0.2
°
、10.7
±
0.2
°
、20.8
±
0.2
°
和23.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为6.7
±
0.2
°
、11.2
±
0.2
°
、14.6
±
0.2
°
、16.4
±
0.2
°
、16.9
±
0.2
°
、18.3
±
0.2
°
、20.4
±
0.2
°
和23.0
±
0.2
°
处具有衍射峰;更进一步优选地,还包含在2θ(
±
0.2
°
)为12.7
±
0.2
°
、19.4
±
0.2
°
和22.4
±
0.2
°
处具有衍射峰;
[0352]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表48所示。
[0353]
表48
[0354]
[0355]
[0356][0357]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的帕莫酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图87所示。
[0358]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的其马尿酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为16.1
±
0.2
°
和23.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.1
±
0.2
°
、11.6
±
0.2
°
、21.7
±
0.2
°
和25.5
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为11.0
±
0.2
°
、16.4
±
0.2
°
、17.4
±
0.2
°
和24.6
±
0.2
°
处具有衍射峰;
[0359]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表49所示。
[0360]
表49
[0361]
[0362][0363]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的其马尿酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图88所示。
[0364]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.6
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为26.1
±
0.2
°
和29.55
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为12.1
±
0.2
°
、16.9
±
0.2
°
、17.8
±
0.2
°
和26.6
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.3
±
0.2
°
、13.8
±
0.2
°
、16.6
±
0.2
°
、21.9
±
0.2
°
、22.9
±
0.2
°
、23.9
±
0.2
°
、27.2
±
0.2
°
和27.7
±
0.2
°
处具有衍射峰;更进一步优选地,进一步还包含在2θ(
±
0.2
°
)为18.6
±
0.2
°
、19.6
±
0.2
°
和25.1
±
0.2
°
和处具有衍射峰;
[0365]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表50所示。
[0366]
表50
[0367]
[0368][0369]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图89所示。
[0370]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型b,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为18.9
±
0.2
°
和25.5
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.5
±
0.2
°
、14.1
±
0.2
°
、17.1
±
0.2
°
和22.1
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为16.8
±
0.2
°
、18.5
±
0.2
°
、24.2
±
0.2
°
和25.3
±
0.2
°
处具有衍射峰;
[0371]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表51所示。
[0372]
表51
[0373]
[0374][0375]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型b,其x
‑
射线粉末衍射图谱基本如图90所示。
[0376]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丙二酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为10.3
±
0.2
°
和10.8
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为4.8
±
0.2
°
和16.4
±
0.2
°
处具有衍射峰;
[0377]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表52所示。
[0378]
表52
[0379]
[0380][0381]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丙二酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图91所示。
[0382]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的对甲苯磺酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.9
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为7.2
±
0.2
°
和25.6
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为14.3
±
0.2
°
、15.4
±
0.2
°
、19.8
±
0.2
°
和27.3
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.8
±
0.2
°
、16.4
±
0.2
°
和20.3
±
0.2
°
处具有衍射峰;
[0383]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表53所示。
[0384]
表53
[0385]
[0386][0387]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的对甲苯磺酸盐晶型a,其x
‑
射线
粉末衍射图谱基本如图92所示。
[0388]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的马来酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为4.3
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为6.8
±
0.2
°
和26.2
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为6.1
±
0.2
°
、9.7
±
0.2
°
、15.5
±
0.2
°
和27.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为12.2
±
0.2
°
、12.6
±
0.2
°
、13.6
±
0.2
°
、16.4
±
0.2
°
、17.2
±
0.2
°
、18.0
±
0.2
°
、20.2
±
0.2
°
和25.7
±
0.2
°
处具有衍射峰;
[0389]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表54所示。
[0390]
表54
[0391]
[0392][0393]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的马来酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图93所示。
[0394]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苹果酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为7.7
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为19.6
±
0.2
°
和23.9
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为16.2
±
0.2
°
、17.3
±
0.2
°
、18.5
±
0.2
°
和24.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为9.5
±
0.2
°
、10.8
±
0.2
°
、19.1
±
0.2
°
、22.0
±
0.2
°
和26.5
±
0.2
°
处具有衍射峰;
[0395]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表55所示。
[0396]
表55
[0397]
[0398]
[0399][0400]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苹果酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图94所示。
[0401]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的酒石酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为5.5
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为9.5
±
0.2
°
和19.0
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为8.2
±
0.2
°
、15.0
±
0.2
°
、19.9
±
0.2
°
和25.8
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为10.9
±
0.2
°
、13.9
±
0.2
°
、16.4
±
0.2
°
、18.6
±
0.2
°
和24.6
±
0.2
°
处具有衍射峰;
[0402]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表56所示。
[0403]
表56
[0404]
[0405][0406]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的酒石酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图95所示。
[0407]
在本发明进一步优选的实施方式中,化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的富马酸盐晶型a,其x
‑
射线粉末衍射图谱在2θ(
±
0.2
°
)为6.2
±
0.2
°
处具有衍射峰;优选地,还包含在2θ(
±
0.2
°
)为6.9
±
0.2
°
和25.2
±
0.2
°
处具有衍射峰;更优选地,还包含在2θ(
±
0.2
°
)为15.8
±
0.2
°
、16.6
±
0.2
°
、18.7
±
0.2
°
和25.2
±
0.2
°
处具有衍射峰;进一步优选地,还包含在2θ(
±
0.2
°
)为8.7
±
0.2
°
、11.1
±
0.2
°
、14.3
±
0.2
°
、25.9
±
0.2
°
和26.7
±
0.2
°
处具有衍射峰;
[0408]
使用cu
‑
kα辐射,以2θ角和晶面间距d值表示的x
‑
射线特征衍射峰如表57所示。
[0409]
表57
[0410][0411]
本发明所述化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的富马酸盐晶型a,其x
‑
射线粉末衍射图谱基本如图96所示。
[0412]
在本发明进一步优选的实施方式中,所述的酸式盐晶型为水合物或无水物,并且当酸式盐晶型为水合物时,水的个数为0.2
‑
3,优选0.2、0.5、1、1.5、2、2.5或3,更优选0.5、1、2或3。
[0413]
本发明还提供一种制备通式(i)所示化合物酸式盐的方法,具体包括如下步骤:
[0414]
1)称取适量的自由碱,用良性溶剂溶解;
[0415]
2)称取适量的反离子酸,用有机溶剂溶解;
[0416]
3)把上述两种溶液合并,搅拌析出或滴加不良溶剂后搅拌析出;
[0417]
4)快速离心或静置吹干得目标产物;
[0418]
其中:
[0419]
所述的良性溶剂选自2
‑
丁醇、甲醇、异丙醇、2
‑
丁酮、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选2
‑
丁醇、甲醇或二甲基亚砜中的一种或多种;
[0420]
所述的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈中的一种或多种;
[0421]
所述的不良溶剂选自庚烷、水、甲基叔丁基醚、环己烷、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈中的一种或多种;优选水、甲基叔丁基醚或异丙醚中的一种或多种;
[0422]
所述的反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、帕莫酸、甲酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸、硬脂酸;更优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、富马酸、马尿酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、草酸或氢溴酸;进一步优选磷酸、马来酸或苯磺酸。
[0423]
本发明还提供一种制备通式(i)所示化合物酸式盐的方法,,具体包括如下步骤:
[0424]
1)称取适量的自由碱,用不良性溶剂混悬;
[0425]
2)称取适量的反离子酸,用有机溶剂溶解;
[0426]
3)将上述溶液加入上述混悬液中,搅拌;
[0427]
4)快速离心或静置吹干得到化合物的盐;
[0428]
其中:
[0429]
所述的不良性溶剂选自甲醇、丙酮、乙酸乙酯、乙腈、乙醇、88%丙酮、四氢呋喃、2
‑
甲基
‑
四氢呋喃、二氯甲烷、3
‑
戊酮、醋酸异丙酯、甲酸乙酯、1,4
‑
二氧六环、氯苯、苯、甲苯、异丙醇、正丁醇、异丁醇、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、正丙醇、叔丁醇或2
‑
丁酮;优选二氯甲烷、甲苯、乙腈、丙酮、甲醇或乙酸乙酯中的一种或多种;
[0430]
所述的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈中的一种或多种;
[0431]
所述的反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、帕莫酸、甲酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸、硬脂酸;更优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、富马酸、马尿酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、草酸或氢溴酸;进一步优选磷酸、马来酸或苯磺酸。
[0432]
本发明还提供一种制备通式(i)所示化合物酸式盐晶型的方法,具体包括如下步骤:
[0433]
1)称取适量的化合物盐,用不良溶剂混悬;
[0434]
2)振摇以上所得混悬液;
[0435]
3)将以上混悬液快速离心,去除上清液,剩余固体烘干至恒重得到目标产物;
[0436]
其中:
[0437]
所述的不良性溶剂选自甲醇、乙醇、二氯甲烷、1,4
‑
二氧六环、乙腈、氯苯、苯、甲苯、丙酮、乙酸乙酯、水、88%丙酮、醋酸异丙酯、3
‑
戊酮、甲酸乙酯、四氢呋喃、2
‑
甲基
‑
四氢呋喃、异丙醇、正丁醇、异丁醇、正丙醇、叔丁醇或2
‑
丁酮中的一种或多种。
[0438]
本发明的目的还在于提供了一种药物组合物,其含有治疗有效量的上述所述化合物的酸式盐或酸式盐晶型以及一种或多种药学上可接受的载体、稀释剂或赋形剂。
[0439]
本发明的目的还在于提供了一种上述所述的酸式盐或酸式盐晶型以及药物组合物在制备预防和/或治疗与jak激酶相关疾病药物中的应用,所述的jak激酶相关疾病优选炎症性疾病和/或肿瘤疾病。
[0440]
其中,所述的炎症性疾病选自类风湿性关节炎、皮炎、银屑病、炎症性肠病;其中炎症性肠病优选慢性肠道炎症性疾病,进一步优选溃疡性结肠炎和克罗恩氏病;
[0441]
所述的肿瘤疾病选自骨髓纤维化、真性红细胞增多症及原发性血小板增多症、骨髓细胞性白血病、急性淋巴细胞性白血病、乳腺导管癌及非小细胞肺癌。
附图说明
[0442]
图1
‑
3为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型a的xrpd、dsc、tga图示。
[0443]
图4为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型b的xrpd图示。
[0444]
图5
‑
7化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的为苯磺酸盐晶型c的xrpd、dsc、tga图示。
[0445]
图8为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型d的xrpd图示。
[0446]
图9
‑
11化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的为苯磺酸盐晶型e的xrpd、dsc、tga图示。
[0447]
图12为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型f的xrpd图示。
[0448]
图13为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型g的xrpd图示。
[0449]
图14为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型h的xrpd图示。
[0450]
图15
‑
17为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硫酸盐晶型a的xrpd、dsc、tga图示。
[0451]
图18
‑
20为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型a的xrpd、dsc、tga图示。
[0452]
图21
‑
23为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型b的xrpd、dsc、tga图示。
[0453]
图24
‑
25为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型c的xrpd、dsc图示。
[0454]
图26
‑
28为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二
酸盐晶型a的xrpd、dsc、tga图示。
[0455]
图29
‑
31为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型b的xrpd、dsc、tga图示。
[0456]
图32
‑
34为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型a的xrpd、dsc、tga图示。
[0457]
图35
‑
37为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的对甲苯磺酸盐晶型b的xrpd、dsc、tga图示。
[0458]
图38
‑
40为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型a的xrpd、dsc、tga图示。
[0459]
图41
‑
42为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型b的xrpd、dsc图示。
[0460]
图43为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的富马酸盐晶型c的xrpd图示。
[0461]
图44
‑
46为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的草酸盐晶型a的xrpd、dsc、tga图示。
[0462]
图47
‑
49为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的氢溴酸盐晶型a的xrpd、dsc、tga图示。
[0463]
图50为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型b的xrpd图示。
[0464]
图51
‑
53为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型c的xrpd、dsc、tga图示。
[0465]
图54
‑
56为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的1,5
‑
萘二磺酸盐晶型d的xrpd、dsc、tga图示。
[0466]
图57
‑
59为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的酒石酸盐晶型a的xrpd、dsc、tga图示。
[0467]
图60为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的甲酸盐
晶型a的xrpd图示。
[0468]
图61为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的马尿酸盐晶型a的xrpd图示。
[0469]
图62
‑
64为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的月桂酸盐晶型a的xrpd、dsc、tga图示。
[0470]
图65为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的硬脂酸盐晶型a的xrpd图示。
[0471]
图66为化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的自由碱晶型a的xrpd图示。
[0472]
图67为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型a的xrpd图示。
[0473]
图68
‑
70为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型b的xrpd、dsc、tga图示。
[0474]
图71为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型a的xrpd图示。
[0475]
图72为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型b的xrpd图示。
[0476]
图73为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型c的xrpd图示。
[0477]
图74为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型d的xrpd图示。
[0478]
图75为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的醋酸盐晶型e的xrpd图示。
[0479]
图76为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型a的xrpd图示。
[0480]
图77为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型b的xrpd图示。
[0481]
图78为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型c的xrpd图示。
[0482]
图79为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐酸盐晶型d的xrpd图示。
[0483]
图80为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯磺酸盐晶型a的xrpd图示。
[0484]
图81为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑
啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的氢溴酸盐晶型a的xrpd图示。
[0485]
图82为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的草酸盐晶型a的xrpd图示。
[0486]
图83为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的己二酸盐晶型a的xrpd图示。
[0487]
图84为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的乙烷磺酸盐晶型a的xrpd图示。
[0488]
图85为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苯甲酸盐晶型a的xrpd图示。
[0489]
图86为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的1,5
‑
萘二磺酸盐晶型a的xrpd图示。
[0490]
图87为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的帕莫酸盐晶型a的xrpd图示。
[0491]
图88为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的马尿酸盐晶型a的xrpd图示。
[0492]
图89为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型a的xrpd图示。
[0493]
图90为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的硫酸盐晶型b的xrpd图示。
[0494]
图91为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丙二酸盐晶型a的xrpd图示。
[0495]
图92为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的对甲苯磺酸盐晶型a的xrpd图示。
[0496]
图93为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的马来酸盐晶型a的xrpd图示。
[0497]
图94为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的苹果酸盐晶型a的xrpd图示。
[0498]
图95为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的酒石酸盐晶型a的xrpd图示。
[0499]
图96为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的富马酸盐晶型a的xrpd图示。
[0500]
图97为化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的自由碱晶型a的xrpd图示。
具体实施方式
[0501]
除非有相反陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0502]
术语“烷基”指饱和脂肪族烃基团,其为包含1至20个碳原子的直链或支链基团,优选含有1至8个碳原子的烷基,更优选1至6个碳原子的烷基,最更优选1至3个碳原子的烷基。非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,
1
‑
二甲基丙基、1,2
‑
二甲基丙基、2,2
‑
二甲基丙基、1
‑
乙基丙基、2
‑
甲基丁基、3
‑
甲基丁基、正己基、1
‑
乙基
‑2‑
甲基丙基、1,1,2
‑
三甲基丙基、1,1
‑
二甲基丁基、1,2
‑
二甲基丁基、2,2
‑
二甲基丁基、1,3
‑
二甲基丁基、2
‑
乙基丁基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基、2,3
‑
二甲基丁基、正庚基、2
‑
甲基己基、3
‑
甲基己基、4
‑
甲基己基、5
‑
甲基己基、2,3
‑
二甲基戊基、2,4
‑
二甲基戊基、2,2
‑
二甲基戊基、3,3
‑
二甲基戊基、2
‑
乙基戊基、3
‑
乙基戊基、正辛基、2,3
‑
二甲基己基、2,4
‑
二甲基己基、2,5
‑
二甲基己基、2,2
‑
二甲基己基、3,3
‑
二甲基己基、4,4
‑
二甲基己基、2
‑
乙基己基、3
‑
乙基己基、4
‑
乙基己基、2
‑
甲基
‑2‑
乙基戊基、2
‑
甲基
‑3‑
乙基戊基、正壬基、2
‑
甲基
‑2‑
乙基己基、2
‑
甲基
‑3‑
乙基己基、2,2
‑
二乙基戊基、正癸基、3,3
‑
二乙基己基、2,2
‑
二乙基己基及其各种支链异构体等。烷基可以是取代的或非取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,所述取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基,本发明优选甲基、乙基、异丙基、叔丁基、卤代烷基、氘代烷基、烷氧基取代的烷基、羟基取代的烷基和氰基取代的烷基。
[0503]
术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至8个碳原子,更优选包含3至6个碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等;多环环烷基包括螺环、稠环和桥环的环烷基,优选环丙基、环丁基、环己基、环戊基和环庚基。所述环烷基环可以稠合于芳基、杂芳基或杂环烷基环上,其中与母体结构连接在一起的环为环烷基,非限制性实例包括茚满基、四氢萘基、苯并环庚烷基等。环烷基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0504]
术语“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)
m
(其中m是整数0至2)的杂原子,但不包括
‑
o
‑
o
‑
、
‑
o
‑
s
‑
或
‑
s
‑
s
‑
的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至8个环原子;最优选包含3至8个环原子。单环杂环基的非限制性实例包括氧杂环丁烷基、吡咯烷基、吡咯烷酮基、咪唑烷基、四氢呋喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基、吡喃基等,优选氧杂环丁烷基、吡咯烷酮基、四氢呋喃基、吡唑烷基、吗啉基、哌嗪基和吡喃基。多环杂环基包括螺环、稠环和桥环的杂环基;其中涉及到的螺环、稠环和桥环的杂环基任选与其他基团通过单键相连接,或者通过环上的任意两个或者两个以上的原子与其他环烷基、杂环基、芳基和杂芳基进一步并环连接。杂环基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0505]
术语“芳基”指具有共轭的π电子体系的6至14元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为6至10元,例如苯基和萘基。更优选苯基。所述芳基环可以
稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环。芳基可以是取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0506]
术语“杂芳基”指包含1至4个杂原子、5至14个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为5至10元,更优选为5元或6元,例如咪唑基、呋喃基、噻吩基、噻唑基、吡唑基、噁唑基、吡咯基、三唑基、四唑基、吡啶基、嘧啶基、噻二唑、噁二唑、吡嗪基等,优选为噁唑基、噁二唑、四氮唑、三氮唑基、噻吩基、咪唑基、吡啶基、吡唑基、嘧啶基或噻唑基;更优选噁唑基、噁二唑、四氮唑、三氮唑基、噻吩基、吡啶基、噻唑基和嘧啶基。所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环。杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0507]
术语“烷氧基”指
‑
o
‑
(烷基)和
‑
o
‑
(非取代的环烷基),其中烷基的定义如上所述。优选含有1至8个碳原子的烷氧基,更优选1至6个碳原子的烷氧基,最更优选1至3个碳原子的烷氧基。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0508]“卤代烷基”指被一个或多个卤素取代的烷基,其中烷基如上所定义。
[0509]“卤代烷氧基”指被一个或多个卤素取代的烷氧基,其中烷氧基如上所定义。
[0510]“羟烷基”指被羟基取代的烷基,其中烷基如上所定义。
[0511]“烯基”指链烯基,又称烯烃基,其中所述的烯基可以进一步被其他相关基团取代,例如:烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0512]“羟基”指
‑
oh基团。
[0513]“卤素”指氟、氯、溴或碘。
[0514]“氨基”指
‑
nh2。
[0515]“氰基”指
‑
cn。
[0516]“硝基”指
‑
no2。
[0517]“thf”指四氢呋喃。
[0518]“etoac”指乙酸乙酯。
[0519]“dmso”指二甲基亚砜。
[0520]“lda”指二异丙基胺基锂。
[0521]“dmap”指4
‑
二甲氨基吡啶。
[0522]“etmgbr”指乙基溴化镁。
[0523]“hosu”指n
‑
羟基琥珀酰亚胺。
[0524]“edcl”指1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐。
[0525]“ipa”指异丙醇。
[0526]“meoh”指甲醇。
[0527]“etoh”指乙醇。
[0528]“dmf”指n、n
‑
二甲基甲酰胺。
[0529]“dipea”指n,n
‑
二异丙基乙胺。
[0530]“hepes”指4
‑
羟乙基哌嗪乙磺酸。
[0531]“x选自a、b、或c”、“x选自a、b和c”、“x为a、b或c”、“x为a、b和c”等不同用语均表达了相同的意义,即表示x可以是a、b、c中的任意一种或几种。
[0532]“任选”或“任选地”意味着随后所描述的事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生的场合。
[0533]“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。例如,具有游离氢的氨基或羟基与具有不饱和(如烯属)键的碳原子结合时可能是不稳定的。
[0534]“立体异构”包含几何异构(顺反异构)、旋光异构、构象异构三类。
[0535]
本发明所述的氢原子均可被其同位素氘所取代,本发明涉及的实施例化合物中的任一氢原子也均可被氘原子取代。
[0536]“药物组合物”表示含有一种或多种本文所述化合物或其生理学上/可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0537]
x
‑
射线粉末衍射图谱(xrpd),是指实验观测到的衍射图或源自其的参数,通过峰位置(横坐标)及峰强度(纵坐标)表征x
‑
射线粉末衍射图谱。本领域技术人员能够理解,其中的实验误差取决于仪器的条件、样品的准备和样品的纯度。特别是,本领域技术人员公知,x射线衍射图通常会随着仪器的条件而有所改变,本领域技术人员应理解xrpd合适的误差容限可以为:2θ
±
0.5
°
;2θ
±
0.4
°
;2θ
±
0.3
°
;2θ
±
0.2
°
。特别需要指出的是,x射线衍射图的相对强度也可能随着实验条件的变化而变化,所以峰强度的顺序不能作为唯一或决定性因素。另外,由于样品高度等实验因素的影响,会造成峰角度的整体偏移,通常允许一定的偏移。因而,本领域技术人员可以理解的是,任何具有与本发明图谱的特征峰相同或相似的晶型均属于本发明的范畴之内。
[0538]“tga”是指热重分析(tga)实验。
[0539]“dsc”是指差示扫描量热法(dsc)实验。
[0540]“hplc”是指高效液相色谱(hplc)实验。
[0541]“pk”是指药物代谢动力学(pk)实验。
[0542]
以下结合实施例进一步描述本发明,但这些实施例并非限制着本发明的范围。
[0543]
一、化合物的制备
[0544]
本发明的化合物结构是通过核磁共振(nmr)或/和液质联用色谱(lc
‑
ms)来确定的。nmr化学位移(δ)以百万分之一(ppm)的单位给出。nmr的测定是用bruker avance
‑
400核
磁仪,测定溶剂为氘代二甲基亚砜(dmso
‑
d6),氘代甲醇(cd3od)和氘代氯仿(cdcl3),内标为四甲基硅烷(tms)。
[0545]
液质联用色谱lc
‑
ms的测定用agilent 1200infinity series质谱仪。hplc的测定使用安捷伦1200dad高压液相色谱仪(sunfire c18 150
×
4.6mm色谱柱)和waters 2695
‑
2996高压液相色谱仪(gimini c
18 150
×
4.6mm色谱柱)。
[0546]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,tlc采用的规格是0.15mm~0.20mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0547]
本发明实施例中的起始原料是已知的并且可以在市场上买到,或者可以采用或按照本领域已知的方法来合成。
[0548]
在无特殊说明的情况下,本发明的所有反应均在连续的磁力搅拌下,在干燥氮气或氩气氛下进行,溶剂为干燥溶剂,反应温度单位为摄氏度。
[0549]
实施例1
[0550]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0551][0552]
第一步:2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[3,2
‑
d]嘧啶
‑4‑
胺的制备
[0553][0554]
往2,4
‑
二氯噻吩并[3,2
‑
d]嘧啶(205mg,1mmol)的n
‑
甲基吡咯烷酮(10ml)的溶液中,依次加入3
‑
氨基
‑5‑
甲基吡唑(116mg,1.2mmol),dipea(258mg,2mmol),然后70℃加热搅拌1小时。反应结束向反应液中加入水(50ml),将析出固体过滤并用乙酸乙酯打浆处理后得到标题化合物淡黄色固体(135mg,51%)。
[0555]
ms m/z(esi):266.0[m+h]
+
.
[0556]
第二步:叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0557][0558]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[3,2
‑
d]嘧啶
‑4‑
胺(135mg,0.51mmol)的正丁醇(5ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(138mg,0.61mmol),dipea(129mg,1mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=98:2)得到标题化合物淡黄色固体(146mg,63%)。
[0559]
ms m/z(esi):456.2[m+h]
+
.
[0560]
第三步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0561][0562]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(146mg,0.32mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(10ml)将其溶解,缓慢滴加入dipea(166mg,1.28mmol),室温下搅拌10分钟,加入丙烯腈(25mg,0.48mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(14.4mg,11%)。
[0563]1h nmr(400mhz,dmso)δ12.02(s,1h),9.70(s,1h),7.89(s,1h),6.99(s,1h),6.44(d,j=59.6hz,2h),4.14(s,1h),3.29(s,2h),2.62(s,4h),2.22(s,3h),1.89(s,2h),1.64(dd,j=47.8,17.6hz,6h).
[0564]
ms m/z(esi):409.2[m+h]
+
.
[0565]
实施例2
[0566]3‑
((3
‑
exo)
‑3‑
((7
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0567][0568]3‑
((3
‑
exo)
‑3‑
((7
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例1。
[0569]
ms m/z(esi):423.2[m+h]
+
.
[0570]
实施例3
[0571]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0572][0573]
第一步:2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺的制备
[0574][0575]
往2,4
‑
二氯噻吩并[2,3
‑
d]嘧啶(205mg,1mmol)的n
‑
甲基吡咯烷酮(10ml)的溶液中,依次加入3
‑
氨基
‑5‑
甲基吡唑(116mg,1.2mmol),dipea(258mg,2mmol),然后70℃加热搅拌1小时。反应结束向反应液中加入水(50ml),有固体析出,将固体过滤并用乙酸乙酯打浆处理后得到标题化合物黄色固体(250mg,94%)。
[0576]
ms m/z(esi):266.0[m+h]
+
.
[0577]
第二步:叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0578][0579]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(250mg,0.94mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(256mg,1.13mmol),dipea(242mg,1.88mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=98:2)得到标题化合物淡黄色固体(200mg,47%)。
[0580]
ms m/z(esi):456.1[m+h]
+
.
[0581]
第三步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0582][0583]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(200mg,0.44mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(10ml)将其溶解,缓慢滴加入dipea(227mg,1.76mmol),室温下搅拌10分钟,加入丙烯腈(35mg,0.66mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(31.6mg,18%)。
[0584]1h nmr(400mhz,dmso)δ12.13(s,1h),9.93(s,1h),7.73(s,1h),6.88(d,j=117.2hz,3h),4.27(s,1h),3.37(s,2h),2.70(s,4h),2.32(s,3h),1.99(s,2h),1.86
‑
1.61(m,6h).
[0585]
ms m/z(esi):409.2[m+h]
+
.
[0586]
实施例4
[0587]3‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻唑并[4,5
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0588][0589]3‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻唑并[4,5
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例1。
[0590]
ms m/z(esi):410.2[m+h]
+
.
[0591]
实施例5
[0592]3‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0593][0594]
第一步:5
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻唑并[5,4
‑
d]嘧啶
‑7‑
胺的制备
[0595][0596]
往5,7
‑
二氯噻唑并[5,4
‑
d]嘧啶(206mg,1mmol)的二甲亚砜(10ml)的溶液中,依次加入3
‑
氨基
‑5‑
甲基吡唑(116mg,1.2mmol),dipea(258mg,2mmol),然后70℃加热搅拌1小时。反应结束向反应液中加入水(50ml),有固体析出,将固体过滤并用乙酸乙酯打浆处理后得到标题化合物黄色固体(200mg,75%)。
[0597]
ms m/z(esi):267.0[m+h]
+
.
[0598]
第二步:叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0599][0600]
往5
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻唑并[5,4
‑
d]嘧啶
‑7‑
胺(200mg,0.75mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(204mg,0.9mmol),dipea(193mg,1.5mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=95:5)得到标题化合物淡黄色固体(74mg,22%)。
[0601]
ms m/z(esi):457.1[m+h]
+
.
[0602]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0603][0604]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(74mg,0.16mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,2ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(10ml)将其溶解,缓慢滴加入dipea(83mg,0.64mmol),室温下搅拌10分钟,加入丙烯腈(9mg,0.24mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(16.3mg,25%)。
[0605]1h nmr(400mhz,dmso)δ12.07(s,1h),9.33(s,1h),8.76(d,j=20.4hz,1h),6.96(s,1h),6.55(d,j=12.0hz,1h),4.14(s,1h),3.31(s,2h),2.61(s,4h),2.21(s,3h),1.91(s,2h),1.78
‑
1.54(m,6h).
[0606]
实施例6
[0607]1‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0608][0609]
第一步:(3
‑
((2
‑
氯噻吩并[2,3
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇的制备
[0610][0611]
将2,4
‑
二氯噻吩并[2,3
‑
d]嘧啶(100mg,0.49mmol)、(3
‑
氨基
‑
1h
‑
吡唑
‑5‑
基)甲醇(55mg,0.49mmol)、dipea(190mg,1.47mmol)加入n’n
‑
二甲基甲酰胺(2ml)中,反应液在70℃条件下搅拌过夜。减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到标题化合物为黄色固体(100mg,73%)。
[0612]
ms m/z(esi):282.0[m+h]
+
.
[0613]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯的备
[0614][0615]
将(3
‑
((2
‑
氯噻吩并[2,3
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇(100mg,0.36mmol)、叔
‑
丁基(3
‑
exo)
‑3‑
(甲基氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(135mg,0.53mmol)、dipea(140mg,1.08mmol)加入正丁醇(2.5ml)中,混匀后于微波150℃条件下反应10小时,冷却至室温,反应液减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到目标产物为白色固体(70mg,39%)。
[0616]
ms m/z(esi):500.1[m+h]
+
.
[0617]
第三步:1
‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备
[0618][0619]
向叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(70mg,0.14mmol)的甲醇(10ml)溶液中缓慢滴加盐酸二氧六环(4n,2.5ml),室温反应2小时,反应液减压浓缩,将粗品溶入dmf(5ml)中,在0℃冰水浴条件下分别加入dipea(0.3ml)、3
‑
氰基氮杂环丁烷
‑1‑
磺酰氯(22mg,0.12mmol),室温反应过夜。反应液减压浓缩,用prep
‑
hplc分离纯化得到目标化合物为白色固体(9.7mg,13%)
[0620]1h nmr(400mhz,dmso
‑
d6)δ9.81(s,1h),7.68(d,j=4.4hz,1h),7.04(d,j=6.0hz,1h),6.52
‑
6.54(m,1h),5.53
‑
5.55(m,1h),5.33
‑
5.35(m,1h),4.44(d,j=5.2hz,2h),4.05
‑
4.01(m,4h),3.94
‑
3.90(m,2h),382
‑
3.79(m,1h),2.89(d,j=8.4hz,3h),2.08
‑
1.68(m,11h).
[0621]
ms m/z(esi):544.1[m+h]
+
.
[0622]
实施例7
[0623]1‑
(((3
‑
exo)
‑3‑
((7
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0624][0625]1‑
(((3
‑
exo)
‑3‑
((7
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例6。
[0626]
ms m/z(esi):545.2[m+h]
+
.
[0627]
实施例8
[0628]1‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0629][0630]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(200mg,0.439mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(20ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(1.45ml,8.78mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(95mg,0.527mmol),反应混合液继续于0℃下搅拌反应16.5小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(70mg,32%)。
[0631]1h nmr(400mhz,meod
‑
d4)δ7.37(d,j=6.0hz,1h),6.94(d,j=6.0hz,1h),6.25(s,1h),4.44
‑
4.34(m,1h),4.26(s,2h),4.16(t,j=8.5hz,2h),4.12
‑
4.05(m,2h),3.57(ddd,j=15.3,8.7,6.5hz,1h),2.31(s,3h),2.23
‑
2.10(m,4h),2.01(d,j=7.4hz,2h),1.73(dd,j=18.2,7.1hz,2h).
[0632]
ms m/z(esi):500.1[m+h]
+
.
[0633]
实施例9
[0634]3‑
((3
‑
exo)
‑3‑
(((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基))
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)磺酰基)氮杂环丁烷
‑3‑
腈
[0635][0636]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑
2
‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后将其溶解于n,n
‑
二甲基甲酰胺(10ml)中,缓慢滴加入dipea(108mg,0.84mmol),室温下搅拌10分钟,加入3
‑
腈基氮杂环丁烷
‑1‑
磺酰氯(45mg,0.25mmol)后继续室温搅拌过夜。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(14.4mg,13%)。
[0637]1h nmr(400mhz,dmso)δ=12.02(s,1h),9.81(s,1h),7.61(s,1h),6.90(s,1h),6.59(d,j=57.6hz,2h),4.74(s,1h),3.96(t,j=8.4hz,2h),3.85(dd,j=16.8hz,6.4,4h),3.75
‑
3.67(m,1h),2.14(s,3h),2.00(d,j=8.4hz,2h),1.87
‑
1.60(m,8h).
[0638]
ms m/z(esi):514.1[m+h]
+
.
[0639]
实施例10
[0640]1‑
(((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)磺酰基)氮杂环丁烷
‑3‑
腈
[0641][0642]
第一步:叔丁基
‑
(3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[0643][0644]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(250mg,0.94mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
(甲基氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(287mg,1.13mmol),dipea(242mg,1.88mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=98:2)得到标题化合物淡白色固体(228mg,50%)。
[0645]
ms m/z(esi):484.2[m+h]
+
.
[0646]
第二步:1
‑
(((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)磺酰基)氮杂环丁烷
‑3‑
腈的制备
[0647][0648]
将叔丁基
‑
(3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后将其溶解于n,n
‑
二甲基甲酰胺(10ml)中,缓慢滴加入dipea(108mg,0.84mmol),室温下搅拌10分钟,加入3
‑
腈基氮杂环丁烷
‑1‑
磺酰氯(45mg,0.25mmol)后继续室温搅拌过夜。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(46.0mg,42%)。
[0649]1h nmr(400mhz,dmso)δ=12.09(s,1h),9.79(s,1h),7.68(d,j=6.0hz,1h),7.02(d,j=6.0hz,1h),6.43(s,1h),5.77(s,1h),3.98(dt,j=14.4,8.4hz,6h),3.84
‑
3.74(m,1h),2.90(s,3h),2.22(s,3h),2.13
‑
1.61(m,10h).
[0650]
ms m/z(esi):528.2[m+h]
+
.
[0651]
实施例11
[0652]1‑
(((3
‑
exo)
‑3‑
(甲基(6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0653][0654]
第一步反应:叔
‑
丁基(3
‑
exo)
‑3‑
(甲基(6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0655][0656]
将2
‑
氯
‑6‑
甲基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(150mg,0.536mmol)和叔
‑
丁基(3
‑
exo)
‑3‑
(甲基氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(257mg,1.072mmol)加入到正丁醇(10ml)中,微波合成仪加热至170℃反应8小时。减压浓缩除去溶剂,残余物溶解于二氯甲烷中,依次经过饱和碳酸氢钠水溶液和饱和氯化钠水溶液洗涤,有机相经无水硫酸钠干燥,过滤,浓缩,硅胶柱层析分离得到标题化合物(73mg,28%)。
[0657]
ms m/z(esi):484.2[m+h]
+
.
[0658]
第二步反应:1
‑
(((3
‑
exo)
‑3‑
(甲基(6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备
[0659][0660]
将叔
‑
丁基(3
‑
exo)
‑3‑
(甲基(6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(73mg,0.151mmol)溶解于4m hcl的1,4
‑
环氧六环(20ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余固体溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.75ml,4.53mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(30mg,0.166mmol),反应混合液继续于0℃下搅拌反应4.5小时。减压浓缩除去溶剂,残余物经prep
‑
hplc分离得到标题化合物(31.5mg,40%)。
[0661]1h nmr(400mhz,dmso
‑
d6)δ12.06(s,1h),9.66(s,1h),7.35(s,1h),6.48(s,1h),5.31
‑
5.15(m,1h),4.18(d,j=1.0hz,2h),4.06(t,j=8.6hz,2h),4.00
‑
3.91(m,2h),3.80(ddd,j=12.8,8.9,6.5hz,1h),2.90(s,3h),2.40(s,3h),2.22(s,3h),2.07
‑
1.99(m,2h),1.95(dd,j=18.2,7.0hz,2h),1.88
‑
1.79(m,2h),1.62(dd,j=11.8,4.1hz,2h).
[0662]
ms m/z(esi):528.2[m+h]
+
.
[0663]
实施例12
[0664]1‑
(((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0665][0666]
第一步反应:叔
‑
丁基(3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0667][0668]
将2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(100mg,0.376mmol)和叔
‑
丁基(3
‑
exo)
‑3‑
(甲基氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(181mg,0.752mmol)加入到正丁醇(3ml)中,微波合成仪加热至170℃反应18小时。减压浓缩除去溶剂,残余物直接用于下一步反应。
[0669]
ms m/z(esi):470.2[m+h]
+
.
[0670]
第二步反应:1
‑
(((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备
[0671][0672]
将叔
‑
丁基(3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯溶解于4m hcl的1,4
‑
环氧六环(20ml)中,室温搅拌反应30分钟,减压浓缩除去溶剂,残余物经反相柱层析分离得117mg白色固体。
[0673]
将上述白色固体溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.14ml,0.632mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(57mg,0.316mmol),反应混合液继续于0℃下搅拌反应17小时。减压浓缩除去溶剂,残余物经prep
‑
hplc分离得到标题化合(16.4mg,10%)。
[0674]1h nmr(400mhz,meod
‑
d4)δ7.37(d,j=5.9hz,1h),6.98(d,j=5.7hz,1h),6.40(s,1h),5.40
‑
5.28(m,1h),4.31
‑
4.24(m,2h),4.17(t,j=8.5hz,2h),4.11
‑
4.04(m,2h),3.57
(ddd,j=15.4,8.9,6.7hz,1h),3.04(s,3h),2.31(s,3h),2.17(dd,j=8.6,3.3hz,2h),2.11
‑
2.01(m,2h),2.00
‑
1.92(m,2h),1.75(ddd,j=10.8,4.3,2.7hz,2h).
[0675]
ms m/z(esi):514.1[m+h]
+
.
[0676]
实施例13
[0677]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)乙烷
‑1‑
酮
[0678][0679][0680]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.32mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入二甲基甘氨酸(24mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(17.1mg,18%)。
[0681]1h nmr(400mhz,dmso)δ=12.00(s,1h),9.80(s,1h),7.61(s,1h),6.98
‑
6.45(m,3h),4.76(s,1h),4.59(s,1h),4.27(s,1h),3.30(s,6h),3.05(s,2h),2.16(s,3h),2.14(s,2h),2.07
‑
1.92(m,2h),1.86
‑
1.40(m,6h).
[0682]
ms m/z(esi):455.2[m+h]
+
.
[0683]
实施例14
[0684]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[0685][0686]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(40mg,0.09mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,2ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(51mg,0.13mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(46mg,0.36mmol),冰水浴下搅拌10分钟,加入二甲基甘氨酸(10mg,0.1mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(4.4mg,11%)。
[0687]1h nmr(400mhz,dmso)δ=12.08(s,1h),9.88(s,1h),7.65(s,1h),7.11
‑
6.46(m,3h),4.47(d,j=30.0hz,3h),3.06(s,2h),2.21(s,9h),2.04
‑
1.66(m,6h),1.62
‑
1.44(m,2h).
[0688]
ms m/z(esi):441.2[m+h]
+
.
[0689]
实施例15
[0690]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[0691][0692]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(40mg,0.09mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,2ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(51mg,0.13mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(46mg,0.36mmol),冰水浴下搅拌10分钟,加入2
‑
吗啉代乙酸(14.5mg,0.1mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(7.8mg,18%)。
[0693]1h nmr(400mhz,dmso)δ=12.07(s,1h),9.88(s,1h),7.66(s,1h),7.11
‑
6.49(m,3h),4.48(d,j=26.4hz,3h),3.60(s,4h),3.17(s,2h),2.46(s,4h),2.23(s,3h),1.98(s,2h),1.90
‑
1.45(m,6h).
[0694]
ms m/z(esi):483.2[m+h]
+
.
[0695]
实施例16
[0696]1‑
((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[0697][0698]1‑
((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮的制备参照实施例244。
[0699]1h nmr(400mhz,dmso
‑
d6)δ=9.85(s,1h),8.22(s,1h),7.68(d,j=6.0hz,1h),7.02(d,j=6.0hz,1h),6.53(s,1h),5.37(s,1h),4.54(d,j=16.4hz,2h),3.58(d,j=4.0hz,4h),3.04(d,j=13.2hz,2h),2.85(s,3h),2.45(s,4h),2.23(s,3h),2.03
‑
1.97(m,
2h),1.87
‑
1.59(m,6h).
[0700]
ms m/z(esi):497.2[m+h]
+
.
[0701]
实施例17
[0702]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[0703][0704][0705]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
吗啉代乙酸(33mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(18.0mg,17%)。
[0706]1h nmr(400mhz,dmso)δ=12.08(s,1h),9.87(s,1h),7.68(s,1h),7.07
‑
6.53(m,3h),4.83(s,1h),4.65(s,1h),4.37(s,1h),3.59(d,j=4.0hz,4h),3.12(dd,j=25.2,12.4hz,2h),2.39(s,4h),2.21(s,3h),2.11
‑
1.51(m,10h).
[0707]
ms m/z(esi):497.2[m+h]
+
.
[0708]
实施例18
[0709]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮
[0710]
[0711]
第一步:叔丁基甲基(2
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑
2羰基乙基)氨基甲酸酯的制备
[0712][0713]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(200mg,0.42mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,10ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(240mg,0.64mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(216mg,1.68mmol),冰水浴下搅拌10分钟,加入n
‑
(叔丁氧基羰基)
‑
n
‑
甲基甘氨酸(87mg,0.46mmol)后继续搅拌1小时。反应结束用二氯甲烷萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=95:5)得到标题化合物白色固体(205mg,90%)。
[0714]
ms m/z(esi):541.2[m+h]
+
.
[0715]
第二步:1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的制备
[0716][0717]
将叔丁基甲基(2
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑
2羰基乙基)氨基甲酸酯(205mg,0.38mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,10ml)中,室温搅拌30分钟后,在冰水浴中向反应液逐滴滴加氨水(10ml),然后将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(37.6mg,22%)。
[0718]1h nmr(400mhz,dmso)δ=12.10(s,1h),9.88(s,1h),7.68(s,1h),6.96(s,1h),6.61(s,2h),4.84(s,1h),4.69(s,1h),4.12(s,1h),2.29(s,3h),2.20(s,3h),2.15
‑
1.96(m,3h),1.87
‑
1.47(m,10h).
[0719]
ms m/z(esi):441.2[m+h]
+
.
[0720]
实施例19
[0721]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨
基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)((r)
‑
吡咯烷
‑2‑
基)甲酮
[0722][0723]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)((r)
‑
吡咯烷
‑2‑
基)甲酮的制备参照实施例18。
[0724]1h nmr(400mhz,dmso
‑
d6)δ=12.08(s,1h),9.89(s,1h),7.66(s,1h),7.06
‑
6.51(m,3h),4.55
‑
4.35(m,3h),3.73(s,1h),3.01(s,1h),2.64(d,j=6.8hz,2h),2.23(s,3h),2.10
‑
1.43(m,12h).
[0725]
ms m/z(esi):453.1[m+h]
+
.
[0726]
实施例20
[0727]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)((s)
‑
吡咯烷
‑2‑
基)甲酮
[0728][0729]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)((s)
‑
吡咯烷
‑2‑
基)甲酮的制备参照实施例18。
[0730]1h nmr(400mhz,dmso
‑
d6)δ=12.11(s,1h),9.90(s,1h),7.67(s,1h),5.98
‑
6.54(m,3h),4.58
‑
4.35(m,3h),4.09
‑
4.02(m,1h),3.11(s,1h),2.97
‑
2.64(m,2h),2.23(s,3h),2.10
‑
1.37(m,10h).
[0731]
ms m/z(esi):453.1[m+h]
+
.
[0732]
实施例21
[0733]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)((r)
‑
吗啉
‑3‑
基)甲酮
[0734][0735]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)((r)
‑
吗啉
‑3‑
基)甲酮的制备参照实施例18。
[0736]
ms m/z(esi):483.2[m+h]
+
.
[0737]
实施例22
[0738]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)((r)
‑
吡咯烷
‑2‑
基)甲酮
[0739][0740]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)((r)
‑
吡咯烷
‑2‑
基)甲酮的制备参照实施例18。
[0741]
ms m/z(esi):467.2[m+h]
+
.
[0742]
实施例23
[0743]2‑
((2
‑
甲氧基乙基)氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)乙烷
‑1‑
酮
[0744][0745]2‑
((2
‑
甲氧基乙基)氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)乙烷
‑1‑
酮的制备参照实施例18。
[0746]
ms m/z(esi):485.2[m+h]
+
.
[0747]
实施例24
[0748]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
((吡啶
‑3‑
基甲基)氨基)乙烷
‑1‑
酮
[0749][0750]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
((吡啶
‑3‑
基甲基)氨基)乙烷
‑1‑
酮的制备参照实施例18。
[0751]
ms m/z(esi):518.2[m+h]
+
.
[0752]
实施例25
[0753]2‑
((4
‑
甲氧苄基)氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[0754][0755]2‑
((4
‑
甲氧苄基)氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例18。
[0756]
ms m/z(esi):533.2[m+h]
+
.
[0757]
实施例26
[0758]2‑
(乙胺基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[0759][0760]2‑
(乙胺基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例18。
[0761]
ms m/z(esi):441.2[m+h]
+
.
[0762]
实施例27
[0763]2‑
(环丙基氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[0764][0765]2‑
(环丙基氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例18。
[0766]
ms m/z(esi):453.2[m+h]
+
.
[0767]
实施例28
[0768]1‑
((3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(4
‑
甲基哌嗪
‑1‑
基)乙烷
‑1‑
酮
[0769][0770]
将叔丁基
‑
(3
‑
exo)
‑3‑
(甲基(4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
(4
‑
甲基哌嗪
‑1‑
基)乙酸(36mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(43.8mg,40%)。
[0771]1h nmr(400mhz,dmso)δ=12.07(s,1h),9.79(s,1h),7.68(d,j=6.0hz,1h),7.02
(d,j=6.0hz,1h),6.46(s,1h),5.81(s,1h),4.71(s,1h),4.39(s,1h),3.22(d,j=12.8hz,1h),3.06(d,j=12.8hz,1h),2.85(s,3h),2.40(s,8h),2.22(s,3h),2.17(s,3h),2.12
‑
2.02(m 2h),1.90
‑
1.61(m,8h).
[0772]
ms m/z(esi):424.2[m+h]
+
.
[0773]
实施例29
[0774]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(4
‑
甲基哌嗪
‑1‑
基)乙烷
‑1‑
酮
[0775][0776]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
(4
‑
甲基哌嗪
‑1‑
基)乙酸(36mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(25.2mg,24%)。
[0777]1h nmr(400mhz,dmso
‑
d6)δ=12.07(s,1h),9.92(s,1h),7.68(s,1h),6.96
‑
6.61(m,3h),4.85(s,1h),4.65(s,1h),4.37(s,1h),3.10(s,2h),2.37(s,8h),2.21(s,3h),2.14(s,3h),2.09
‑
1.99(m,2h),1.97
‑
1.46(m,8h).
[0778]
ms m/z(esi):510.2[m+h]
+
.
[0779]
实施例30
[0780]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
(哌嗪
‑1‑
基)乙烷
‑1‑
酮
[0781][0782]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
(哌嗪
‑1‑
基)乙烷
‑1‑
酮的制备参照实施例18。
[0783]
ms m/z(esi):496.2[m+h]
+
.
[0784]
实施例31
[0785]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)(吡啶
‑2‑
基)甲酮
[0786][0787]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入吡啶
‑2‑
甲酸(28mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(27.3mg,21%)。
[0788]1h nmr(400mhz,dmso)δ=12.07(s,1h),9.86(s,1h),8.59(d,j=4.4hz,1h),7.94(td,j=7.7,1.6hz,1h),7.73
‑
7.44(m,3h),7.05
‑
6.50(m,3h),4.84(d,j=28.0hz,2h),3.94(s,1h),2.21(s,3h),2.18
‑
1.59(m,10h).
[0789]
ms m/z(esi):475.1[m+h]
+
.
[0790]
实施例32
[0791]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)(吡啶
‑3‑
基)甲酮
[0792][0793]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入吡啶
‑3‑
甲酸(28mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(28.6mg,22%)。
[0794]1h nmr(400mhz,dmso
‑
d6)δ=12.07(s,1h),9.87(s,1h),8.71
‑
8.58(m,2h),7.84(d,j=7.6hz,1h),7.69(d,j=6.0hz,1h),7.51(dd,j=7.6,4.8hz,1h),6.96(d,j=5.2hz,1h),6.68
‑
6.50(m,2h),4.83(d,j=39.2hz,2h),3.78(s,1h),2.21(s,3h),2.13
‑
1.61(m,10h).
[0795]
ms m/z(esi):475.1[m+h]
+
.
[0796]
实施例33
[0797]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)(吡啶
‑4‑
基)甲酮
[0798][0799]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入吡啶
‑4‑
甲酸(28mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(34.5mg,27%)。
[0800]1h nmr(400 mhz,dmso
‑
d6)δ=12.07(s,1h),9.87(s,1h),8.69(d,j=6.0hz,2h),7.69(d,j=5.6hz,1h),7.39(d,j=5.6hz,2h),6.97(d,j=6.0hz,1h),6.57(d,j=7.6hz,2h),4.82(d,j=41.6 hz,2h),3.68(s,1h),2.21(s,3h),2.14
‑
1.59(m,10h).
[0801]
ms m/z(esi):475.1[m+h]
+
.
[0802]
实施例34
[0803]
(1
‑
甲基
‑
1氢
‑
咪唑
‑2‑
基)((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)甲酮
[0804][0805]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入1
‑
甲基
‑
1氢
‑
咪唑
‑2‑
羧酸(29mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(15.0mg,12%)。
[0806]1h nmr(400mhz,dmso
‑
d6)δ=12.08(s,1h),9.87(s,1h),7.68(s,1h),7.29(s,1h),6.97(s,2h),6.65(s,2h),4.91
‑
4.80(m,3h),3.77(s,3h),2.22(s,3h),2.14
‑
1.60(m,10h).
[0807]
ms m/z(esi):478.2[m+h]
+
.
[0808]
实施例35
[0809]
(1
‑
甲基
‑
1氢
‑
咪唑
‑4‑
基)((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)甲酮
[0810][0811]
(1
‑
甲基
‑
1氢
‑
咪唑
‑4‑
基)((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)甲酮的制备参照实施例21
[0812]1h nmr(400mhz,dmso
‑
d6)δ=12.08(s,1h),9.86(s,1h),7.70
‑
7.60(m,3h),6.95(s,1h),6.65(s,1h),5.57(s,1h),4.82(d,j=65.2hz,3h),3.68(s,3h),2.22(s,3h),2.13
‑
1.58(s,10h).
[0813]
ms m/z(esi):478.1[m+h]
+
.
[0814]
实施例36
[0815]
n4‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)
‑
n2‑
((3
‑
exo)
‑
8(吡啶
‑
3基磺酰基)
‑8‑
氮杂双环[3.2.1]辛烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0816][0817]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(40mg,0.09mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,2ml)中,室温搅拌30分钟后将反应液浓缩;然后加入n,n
‑
二甲基甲酰胺(5ml)将其溶解,缓慢滴加入dipea(46mg,0.36mmol),冰水浴下搅拌10分钟,加入吡啶
‑3‑
磺酰氯(18mg,0.1mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(5.6mg,13%)。
[0818]1h nmr(400mhz,dmso)δ=12.01(s,1h),9.86(s,1h),9.05(s,1h),8.87(d,j=4.4hz,1h),8.31(d,j=8.0hz,1h),7.65(dd,j=7.8hz,5.0,2h),6.97(s,1h),6.78(s,1h),6.54(s,1h),4.33(s,2h),3.17(d,j=5.2hz,1h),2.14(s,3h),1.99(s,2h),1.76
‑
1.56(m,4h),1.35
‑
1.26(m,2h).
[0819]
ms m/z(esi):497.1[m+h]
+
.
[0820]
实施例37
[0821]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑8‑
(吡啶
‑2‑
基磺酰)
‑8‑
氮杂二环[3.2.1]辛烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0822][0823]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑8‑
(吡啶
‑2‑
基磺酰)
‑8‑
氮杂二环[3.2.1]辛烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺的制备参照实施例23。
[0824]1h nmr(400mhz,cd3od:cdcl3,v/v=1:2)δ8.70(d,j=4.6hz,1h),8.00(dt,j=8.0,4.6hz,2h),7.60(ddd,j=6.8,4.8,1.8hz,1h),7.35(d,j=6.0hz,1h),6.92(d,j=6.0hz,1h),6.19(s,1h),4.43(s,2h),4.40
‑
4.32(m,1h),2.27(s,3h),2.15(ddd,j=12.7,5.3,2.6hz,2h),1.88
‑
1.81(m,2h),1.80
‑
1.70(m,2h),1.62(dd,j=8.6,4.7hz,2h).
[0825]
ms m/z(esi):497.1[m+h]
+
.
[0826]
实施例38
[0827]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑9‑
(吡啶
‑2‑
基磺酰)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0828][0829]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.213mmol)分散于4m hcl的1,4
‑
环氧六环(15ml)中,室温搅拌反应60分钟,减压浓缩除去溶剂,残余固体溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(1.05ml,6.39mmol)和吡啶
‑2‑
磺酰氯(40mg,0.224mmol),反应混合液继续于0℃下搅拌反应2.5小时。减压浓缩除去溶剂,残余物经prep
‑
hplc分离得到标题化合物为白色固体(12.4mg,25%)。
[0830]1h nmr(400mhz,dmso
‑
d6)δ12.07(s,1h),9.85(s,1h),8.78(d,j=4.0hz,1h),8.08(td,j=7.7,1.4hz,1h),7.96(d,j=7.8hz,1h),7.67(dd,j=6.7,4.7hz,2h),6.95(s,1h),6.59(d,j=30.3hz,2h),4.85
‑
4.71(m,1h),4.18(s,2h),2.17(s,3h),2.05(dd,j=12.8,4.9hz,3h),1.68(d,j=2.6hz,7h).
[0831]
ms m/z(esi):511.1[m+h]
+
.
[0832]
实施例39
[0833]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑9‑
(吡啶
‑3‑
基磺酰)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0834][0835]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑9‑
(吡啶
‑3‑
基磺酰)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺的制备参照实施例38。
[0836]1h nmr(400mhz,cd3od:cdcl3,v/v=1:1)δ9.11(s,1h),8.84(d,j=3.9hz,1h),8.29(d,j=8.2hz,1h),7.70
‑
7.62(m,1h),7.39(d,j=5.9hz,1h),6.96(d,j=5.8hz,1h),6.62(s,1h),5.05
‑
4.90(m,1h),4.34(d,j=2.8hz,2h),2.55
‑
2.19(m,5h),2.19
‑
1.61(m,8h).
[0837]
ms m/z(esi):511.1[m+h]
+
.
[0838]
实施例40
[0839]
n2
‑
((3
‑
exo)
‑9‑
((1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)磺酰)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)
‑
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0840][0841]
n2
‑
((3
‑
exo)
‑9‑
((1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)磺酰)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)
‑
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺的制备参照实施例38。
[0842]1h nmr(400mhz,dmso
‑
d6)δ12.05(s,1h),9.86(s,1h),7.67(d,j=2.9hz,1h),7.45(s,1h),7.08(s,1h),6.96(d,j=4.9hz,1h),6.73
‑
6.47(m,2h),4.88
‑
4.74(m,1h),4.12(s,2h),3.87(s,3h),2.19(s,3h),2.09(ddd,j=5.5,5.1,1.0hz,3h),1.91
‑
1.58(m,7h).
[0843]
ms m/z(esi):514.1[m+h]
+
.
[0844]
实施例41
[0845]
n,n
‑
二甲基
‑2‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)乙酰胺
[0846][0847][0848]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入n,n
‑
二甲基甲酰胺(5ml)将其溶解,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
溴
‑
n,n
‑
二甲基乙酰胺(38mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(16.6mg,17%)。
[0849]1h nmr(400mhz,dmso)δ=12.00(s,1h),9.80(s,1h),7.63(s,1h),6.74(d,j=128.0hz,3h),4.62(s,1h),3.42(s,2h),3.04(s,3h),2.86(s,2h),2.77(s,3h),2.16(s,3h),1.96
‑
1.47(m,10h).
[0850]
ms m/z(esi):455.2[m+h]
+
.
[0851]
实施例42
[0852]
n4‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)
‑
n2‑
((3
‑
exo)
‑9‑
(吡啶
‑2‑
基甲基)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0853]
[0854][0855]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
(氯甲基)吡啶盐酸盐(38mg,0.23mmol)后升温至70℃搅拌过夜。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(20.8mg,22%)。
[0856]1h nmr(400mhz,dmso
‑
d6)δ=12.06(s,1h),9.85(s,1h),8.47(d,j=4.0hz,1h),7.81
‑
7.48(m,3h),7.33
‑
6.52(m,4h),4.74(s,1h),3.92(s,2h),2.89(s,2h),2.23(d,j=13.6hz,3h),2.08
‑
1.50(m,10h).
[0857]
ms m/z(esi):461.1[m+h]
+
.
[0858]
实施例43
[0859]
n2‑
((3
‑
exo)
‑9‑
((1
‑
甲基
‑
1氢
‑
咪唑
‑2‑
基)甲基)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)
‑
n4‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺
[0860][0861]
n2‑
((3
‑
exo)
‑9‑
((1
‑
甲基
‑
1氢
‑
咪唑
‑2‑
基)甲基)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)
‑
n4‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑
2,4
‑
二胺的制备参照实施例42。
[0862]1h nmr(400mhz,dmso
‑
d6)δ=12.06(s,1h),9.84(s,1h),7.67(s,1h),7.08(s,1h),6.95(s,1h),6.74
‑
6.55(m,3h),4.69(s,1h),3.91(s,2h),3.69(s,3h),2.84(s,2h),2.20(s,3h),2.01
‑
1.66(m,10h).
[0863]
ms m/z(esi):464.2[m+h]
+
.
[0864]
实施例44
[0865]3‑
((3
‑
exo))
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0866][0867]
第一步:(3
‑
((2
‑
氯噻吩并[2,3
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇的制备
[0868][0869]
将2,4
‑
二氯噻吩并[2,3
‑
d]嘧啶(100mg,0.49mmol)、(3
‑
氨基
‑
1h
‑
吡唑
‑5‑
基)甲醇(55mg,0.49mmol)、dipea(190mg,1.47mmol)加入n’n
‑
二甲基甲酰胺(2ml)中,反应液在70℃条件下搅拌过夜。减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到标题化合物为黄色固体(100mg,73%)。
[0870]
ms m/z(esi):282.0[m+h]
+
.
[0871]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0872][0873]
将(3
‑
((2
‑
氯噻吩并[2,3
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇(100mg,0.36mmol)、n
‑
boc
‑
exo
‑3‑
氨基托烷乙酸盐(113mg,0.40mmol)、dipea(140mg,1.08mmol)加入正丁醇(2.5ml)中,反应液均匀混合后,在微波加热150℃条件下反应10小时,冷却至室温,减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到标题化合物为淡黄色固体(60mg,35%)。
[0874]
ms m/z(esi):472.0[m+h]
+
.
[0875]
第三步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0876][0877]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(60mg,0.13mmol)溶于甲醇(10ml)中,随后缓慢将盐酸二氧六环(4n,2.5ml)滴入反应液中,在室温条件下反应2小时,减压浓缩,所得粗品加入由甲醇(15ml),dipea(0.5ml),丙烯腈(1ml)混合的溶液中,室温条件下反应2小时,减压浓缩,用prep
‑
hplc分离纯化得到标题化合物为白色固体(11.6mg,21%)。
[0878]1h nmr(400mhz,cd3od)δ7.39(dd,j=6.0hz,1h),6.99(dd,j=5.6hz,1h),6.02
‑
6.04(m,1h),4.60(s,2h),4.21
‑
4.24(m,1h),3.45
‑
3.42(m,2h),2.83(s,2h),2.69
‑
2.65(m,2h),2.08
‑
1.91(m,6h),1.69(t,j=12.4hz,2h).
[0879]
ms m/z(esi):425.1[m+h]
+
.
[0880]
实施例45
[0881]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[0882][0883]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例44。
[0884]
ms m/z(esi):439.2[m+h]
+
.
[0885]
实施例46
[0886]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[0887]
[0888]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例44。
[0889]
ms m/z(esi):453.2[m+h]
+
.
[0890]
实施例47
[0891]1‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0892][0893]1‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例44。
[0894]
ms m/z(esi):530.2[m+h]
+
.
[0895]
实施例48
[0896]3‑
((3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)丙腈
[0897][0898]
第一步:叔丁基
‑
(3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0899][0900]
往2
‑
氯
‑6‑
甲基
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(200mg,0.72mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(194mg,0.86mmol),dipea(186mg,1.44mmol),然后160℃微波条件
下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=98:2)得到标题化合物淡黄色固体(124mg,37%)。
[0901]
ms m/z(esi):470.2[m+h]
+
.
[0902]
第二步:3
‑
((3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0903][0904]
将叔丁基
‑
(3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(124mg,0.26mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(10ml)将其溶解,缓慢滴加入dipea(137mg,1.06mmol),室温下搅拌10分钟,加入丙烯腈(21mg,0.39mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(12.7mg,12%)。
[0905]1h nmr(400mhz,dmso)δ=9.70(s,1h),7.30(s,1h),6.59(s,3h),4.15(s,1h),3.29(s,2h),2.61(s,4h),2.39(s,3h),2.22(s,3h),1.90(s,2h),1.78
‑
1.50(m,6h).
[0906]
ms m/z(esi):423.2[m+h]
+
.
[0907]
实施例49
[0908]3‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)丙腈
[0909][0910]
第一步:5
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻唑并[5,4
‑
d]嘧啶
‑7‑
胺的制备
[0911][0912]
往5,7
‑
二氯噻唑并[5,4
‑
d]嘧啶(206mg,1mmol)的二甲亚砜(10ml)的溶液中,依次加入3
‑
氨基
‑5‑
甲基吡唑(116mg,1.2mmol),dipea(258mg,2mmol),然后70℃加热搅拌一小时。反应结束向反应液中加入水(50ml),有固体析出,将固体过滤并用乙酸乙酯打浆处理后得到标题化合物黄色固体(200mg,75%)。
[0913]
ms m/z(esi):267.0[m+h]
+
.
[0914]
第二步:叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[0915][0916]
往5
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻唑并[5,4
‑
d]嘧啶
‑7‑
胺(200mg,0.75mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(216mg,0.9mmol),dipea(193mg,1.5mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=95:5)得到标题化合物淡黄色固体(232mg,66%)。
[0917]
ms m/z(esi):471.2[m+h]
+
.
[0918]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)丙腈的制备
[0919][0920]
将叔丁基
‑
(3
‑
exo)
‑3‑
((7
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻唑并[5,4
‑
d]嘧啶
‑5‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(232mg,0.49mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(10ml)将其溶解,缓慢
滴加入dipea(127mg,0.98mmol),室温下搅拌10分钟,加入丙烯腈(39mg,0.74mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物淡黄色固体(63mg,30%)。
[0921]1h nmr(400mhz,dmso)δ=12.06(s,1h),9.29(s,1h),8.76(d,j=18.8hz,1h),6.92(d,j=7.2hz,1h),6.57(s,1h),4.67(s,1h),3.31(s,2h),2.58(t,j=6.2hz,4h),2.19(s,3h),2.00
‑
1.65(m,10h).
[0922]
ms m/z(esi):424.2[m+h]
+
.
[0923]
实施例50
[0924]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氧代)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0925][0926]
第一步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氧代)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[0927][0928]
室温下将nah(120mg,3.01mmol,60%)分批加入到叔
‑
丁基(3
‑
exo)
‑3‑
羟基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(427mg,1.88mmol)的n,n
‑
二甲基甲酰胺(2ml)溶液中,室温搅拌5分钟,然后滴加2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(100mg,0.376mmol)的n,n
‑
二甲基甲酰胺(1ml)溶液,氮气保护下升温至120℃搅拌2小时。将反应液冷却至室温后倾入冰水(10ml)中搅拌10分钟,过滤,滤液用乙酸乙酯萃取,合并有机相,用饱和氯化钠水溶液洗涤,收集有机相经无水硫酸钠干燥,过滤,减压浓缩有机溶剂,所得残余物经硅胶柱层析分离纯化得到标题化合物为黄色油状物(149mg,87%)。
[0929]
第二步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氧代)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[0930][0931]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氧代)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(77mg,0.169mmol)溶解于甲醇(2ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(1ml)中,依次加入dipea(109mg,0.844mmol)和丙烯腈(45mg,0.844mmol),所得反应混合液继续于室温下搅拌反应1小时。反应液减压浓缩后,残余物用硅胶层析初步分离纯化,再用制备tlc进一步分离纯化,得标题化合物为灰色固体(7mg,10%)。
[0932]1h nmr(400mhz,cd3od)δ7.50(d,j=6.1hz,1h),7.22(d,j=5.9hz,1h),6.51(s,1h),5.43
‑
5.26(m,1h),3.44
‑
3.37(m,2h),2.78(t,j=6.9hz,2h),2.62(t,j=6.9hz,2h),2.33(s,3h),2.12
‑
2.00(m,4h),1.86
‑
1.74(m,4h).
[0933]
ms m/z(esi):410.1[m+h]
+
.
[0934]
实施例51
[0935]3‑
((3
‑
exo)
‑3‑
((6
‑
(甲氧基甲基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0936][0937]3‑
((3
‑
exo)
‑3‑
((6
‑
(甲氧基甲基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例48。
[0938]
ms m/z(esi):453.2[m+h]
+
.
[0939]
实施例52
[0940]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
吗啉代噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0941][0942]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
吗啉代噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例48。
[0943]
ms m/z(esi):494.2[m+h]
+
.
[0944]
实施例53
[0945]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
(吗啉代甲基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[0946][0947]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
(吗啉代甲基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例48。
[0948]
ms m/z(esi):508.3[m+h]
+
.
[0949]
实施例54
[0950]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
((4
‑
甲基哌嗪
‑1‑
基)甲基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[0951][0952]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
((4
‑
甲基哌嗪
‑1‑
基)甲基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例48。
[0953]
ms m/z(esi):535.3[m+h]
+
.
[0954]
实施例55
[0955]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
(吡啶
‑3‑
基硫代)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[0956][0957]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
(吡啶
‑3‑
基硫代)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例48。
[0958]
ms m/z(esi):532.2[m+h]
+
.
[0959]
实施例56
[0960]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)磺酰基)氮杂环丁烷
‑3‑
腈
[0961][0962]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.22mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后将其溶解于n,n
‑
二甲基甲酰胺(10ml)中,缓慢滴加入dipea(108mg,0.84mmol),室温下搅拌10分钟,加入3
‑
腈基氮杂环丁烷
‑1‑
磺酰氯(45mg,0.25mmol)后继续室温搅拌过夜。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(23.2mg,21%)。
[0963]1h nmr(400mhz,dmso
‑
d6)δ=12.07(s,1h),9.74(s,1h),7.90(s,1h),7.00(s,1h),6.54(s,2h),4.27(s,1h),4.13(s,2h),4.04(t,j=8.4hz,2h),3.98
‑
3.89(m,2h),3.80(dd,j=15.2,6.0hz,1h),2.23(s,3h),1.99(s,4h),1.84(d,j=7.2hz,2h),1.63(s,2h).
[0964]
ms m/z(esi):500.1[m+h]
+
.
[0965]
实施例57
[0966]1‑
(((3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[0967][0968]1‑
(((3
‑
exo)
‑3‑
((6
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例38。
[0969]1h nmr(400mhz,dmso
‑
d6)δ12.02(s,1h),9.64(s,1h),6.77
‑
6.45(m,3h),4.25
‑
4.23(m,1h),4.12(s,2h),4.06
‑
4.02(m,2h),3.95
‑
3.88(m,2h),3.83
‑
3.77(m,1h),2.24
‑
2.21(m,4h),1.99
‑
1.98(m,5h),1.84
‑
1.81(m,2h),1.64
‑
1.59(m,3h).
[0970]
ms m/z(esi):513.1[m+h]
+
.
[0971]
实施例58
[0972]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[0973][0974]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例56。
[0975]1h nmr(400mhz,dmso
‑
d6)δ=12.06(s,1h),9.72(s,1h),7.89(s,1h),6.99(s,1h),6.49(d,j=58.8hz,2h),4.59
‑
4.28(m,3h),3.04(s,2h),2.15(s,9h),1.98
‑
1.80(m,6h),1.59
‑
1.45(m,2h).
[0976]
ms m/z(esi):441.1[m+h]
+
.
[0977]
实施例59
[0978]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[0979][0980]
第一步:叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[0981][0982]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[3,2
‑
d]嘧啶
‑4‑
胺(250mg,0.94mmol)
的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(271mg,1.13mmol),dipea(242mg,1.88mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=98:2)得到标题化合物淡白色固体(150mg,34%)。
[0983]
ms m/z(esi):470.1[m+h]
+
.
[0984]
第二步:叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[0985][0986]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入2
‑
(7
‑
氧化苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(120mg,0.31mmol)后将其溶解于n,n
‑
二甲基甲酰胺(5ml)中,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
吗啉代乙酸(33mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(17.8mg,17%)。
[0987]1h nmr(400mhz,dmso
‑
d6)δ=11.99(s,1h),9.69(s,1h),7.84(s,1h),7.07
‑
6.23(m,3h),4.77(s,1h),4.58(s,1h),4.30(s,1h),3.52(d,j=4.0hz,4h),3.10
‑
3.01(m,2h),2.32(s,3h),2.14(s,2h),2.09
‑
1.39(m,10h).
[0988]
ms m/z(esi):497.1[m+h]
+
.
[0989]
实施例60
[0990]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)乙烷
‑1‑
酮
[0991][0992]1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)乙烷
‑1‑
酮的制备参照实施例18。
[0993]
ms m/z(esi):441.2[m+h]
+
.
[0994]
实施例61
[0995]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)(吡啶
‑2‑
基)甲酮
[0996][0997]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)(吡啶
‑2‑
基)甲酮的制备参照实施例59。
[0998]
ms m/z(esi):475.2[m+h]
+
.
[0999]
实施例62
[1000]
(1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)甲酮
[1001][1002]
(1
‑
甲基
‑
1h
‑
咪唑
‑2‑
基)((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)甲酮的制备参照实施例59。
[1003]
ms m/z(esi):478.2[m+h]
+
.
[1004]
实施例63
[1005]2‑
(二甲氨基)
‑1‑
((1r,3r,5s)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[1006][1007]2‑
(二甲氨基)
‑1‑
((1r,3r,5s)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例13。
[1008]
ms m/z(esi):441.2[m+h]
+
.
[1009]
实施例64
[1010]
n,n
‑
二甲基
‑2‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙酰胺
[1011][1012][1013]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后加入n,n
‑
二甲基甲酰胺(5ml)将其溶解,缓慢滴加入dipea(108mg,0.84mmol),冰水浴下搅拌10分钟,加入2
‑
溴
‑
n,n
‑
二甲基乙酰胺(38mg,0.23mmol)后继续搅拌1小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(16.4mg,17%)。
[1014]1h nmr(400mhz,dmso
‑
d6)δ=12.05(s,1h),9.74(s,1h),7.90(d,j=4.0hz,1h),7.14
‑
6.30(m,3h),4.15(s,1h),3.32
‑
3.23(m,4h),3.08(s,3h),2.83(s,3h),2.22(s,3h),1.97(s,2h),1.82
‑
1.55(m,6h).
[1015]
ms m/z(esi):441.1[m+h]
+
.
[1016]
实施例65
[1017]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1018][1019]
第一步:(3
‑
((2
‑
氯
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇
的制备
[1020][1021]
将2,4
‑
二氯
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶(200mg,0.91mmol)、(3
‑
氨基
‑
1h
‑
吡唑
‑5‑
基)甲醇(120mg,1.09mmol)、dipea(350mg,2.73mmol)溶于n,n
‑
二甲基甲酰胺(10ml)中,混合均匀后在条件70℃下反应过夜。冷却至室温,反应液中分别加入水(30ml),乙酸乙酯(20ml*3)萃取,合并有机相,减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到标题化合物为白色固体(200mg,75%)。
[1022]
ms m/z(esi):296.0[m+h]
+
.
[1023]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[1024][1025]
将(3
‑
((2
‑
氯
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇(150mg,0.51mmol)、叔
‑
丁基(3
‑
exo)
‑3‑
氨基
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯草酸盐(200mg,0.61mmol)、dipea(200mg,1.53mmol)加入正丁醇(3ml)中,均匀混合后,在微波加热165℃条件下,反应8小时,冷却至室温,反应液减压浓缩,所得粗品(200mg)不纯化,直接用于下一步反应。
[1026]
ms m/z(esi):500.1[m+h]
+
.
[1027]
第三步:(3
‑
((2
‑
(((3
‑
exo)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇的制备
[1028]
[1029]
向叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(200mg,0.40mmol)的甲醇(10ml)溶液中,缓慢滴加盐酸二氧六环(4n,5ml),反应液室温反应3小时,减压浓缩,所得粗品用prep
‑
hplc分离纯化得到标题化合物为黄色固体(100mg,63%)。
[1030]
ms m/z(esi):400.1[m+h]
+
.
[1031]
第四步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d嘧啶
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备
[1032][1033]
将(3
‑
((2
‑
(((3
‑
exo)
‑9‑
氮杂二环[3.3.1]壬烷
‑3‑
基)氨基)
‑6‑
甲基噻吩并[3,2
‑
d]嘧啶
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇(100mg,0.25mmol)、丙烯腈(0.2ml)、dipea(0.1ml)加入甲醇(10ml)中,均匀混合后,在室温条件下反应1小时,减压浓缩,所得粗品用prep
‑
hplc分离纯化得到标题化合物为白色固体(11.7mg,10%)。
[1034]1h nmr(400mhz,dmso
‑
d6)δ12.28(s,1h),10.12(s,1h),7.09
‑
6.64(m,2h),6.29
‑
6.23(s,1h),5.22
‑
4.94(m,1h),4.67
‑
4.37(m,3h),2.95(s,2h),2.85
‑
2.81(m,2h),2.70
‑
2.57(m,5h),1.95
‑
1.49(m,10h).
[1035]
ms m/z(esi):453.2[m+h]
+
.
[1036]
实施例66
[1037]3‑
(cis
‑5‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1h)
‑
基)丙腈
[1038][1039]
第一步:叔
‑
丁基cis
‑5‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1h)
‑
羧酸酯的制备
[1040][1041]
将2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(100mg,0.376mmol),叔
‑
丁基cis
‑5‑
氨基六氢环戊二烯并[c]吡咯
‑
2(1h)
‑
羧酸酯(102mg,0.452mmol),dipea(146mg,1.13mmol)分别加入到nmp(1ml)中,氮气保护下微波加热至160℃反应8小时。将反应液冷却至室温后倾入冰水(10ml)中搅拌10分钟,过滤,滤饼用水(15ml)洗涤,真空干燥得到标题化合物为黄色固体(171mg,粗品)。
[1042]
第二步:3
‑
(cis
‑5‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1h)
‑
基)丙腈的制备
[1043][1044]
将叔
‑
丁基cis
‑5‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1h)
‑
羧酸酯(86mg,0.188mmol)溶解于甲醇(2ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(2ml)中,依次加入dipea(121mg,0.938mmol)和丙烯腈(15mg,0.282mmol),所得反应混合液继续于室温下搅拌反应16小时。反应液用dcm(20ml)稀释后,用水(5ml)洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩,残余物用硅胶层析分离纯化,得标题化合物为白色固体(17mg,22%)。
[1045]1h nmr(400mhz,cd3od)δ7.36(d,j=6.0hz,1h),7.02
‑
6.86(m,1h),6.54(s,0.6h),5.80(s,0.4h),4.34
‑
4.09(m,1h),2.86
‑
2.72(m,4h),2.73
‑
2.57(m,4h),2.40
‑
2.19(m,7h),1.57
‑
1.37(m,2h).
[1046]
ms m/z(esi):409.1[m+h]
+
.
[1047]
实施例67
[1048]3‑
(cis
‑5‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1氢)
‑
基)丙腈
[1049][1050]
第一步:叔丁基
‑
cis
‑5‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1氢)
‑
羧酸酯的制备
[1051][1052]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)噻吩并[3,2
‑
d]嘧啶
‑4‑
胺(100mg,0.38mmol)的正丁醇(5ml)的溶液中,依次加入叔丁基
‑
cis
‑5‑
氨基六氢环戊二烯并[c]吡咯
‑
2(1氢)
‑
羧酸酯(102mg,0.45mmol),dipea(98mg,0.76mmol),然后160℃微波条件下搅拌15小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=95:5)得到标题化合物淡黄色固体(80mg,46%)。
[1053]
ms m/z(esi):456.2[m+h]
+
.
[1054]
第二步:3
‑
(cis
‑5‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1氢)
‑
基)丙腈的制备
[1055][1056]
将叔丁基
‑
cis
‑5‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)六氢环戊二烯并[c]吡咯
‑
2(1氢)
‑
羧酸酯(80mg,0.18mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,2ml)中,室温搅拌30分钟后将反应液浓缩;然后加入甲醇(5ml)将其溶解,缓慢滴加入dipea(93mg,0.72mmol),室温下搅拌10分钟,加入丙烯腈(14mg,0.27mmol)后继续搅拌2小时。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(26.3mg,37%)。
[1057]1h nmr(400mhz,dmso
‑
d6)δ=12.30(s,1h),9.92(s,1h),7.90(s,1h),7.51
‑
6.25(m,3h),4.11(s,1h),2.66(dd,j=13.6,7.2hz,6h),2.22(s,8h),1.31(s,3h).
[1058]
ms m/z(esi):409.1[m+h]
+
.
[1059]
实施例68
[1060]3‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈
[1061][1062]
第一步:叔
‑
丁基4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
羧酸酯的制备
[1063][1064]
将2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)噻吩并[2,3
‑
d]嘧啶
‑4‑
胺(100mg,0.376mmol),1
‑
boc
‑4‑
氨基哌啶(108mg,0.539mmol),dipea(146mg,1.13mmol)分别加入到nmp(1ml)中,氮气保护下微波加热至130℃反应16小时。将反应液冷却至室温后倾入冰水(10ml)中搅拌10分钟,过滤,滤饼用水(5ml)洗涤,真空干燥得到标题化合物为黄色固体(100mg,粗品)。
[1065]
第二步:3
‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈的制备
[1066][1067]
将叔
‑
丁基4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
羧酸酯(100mg,0.233mmol)溶解于甲醇(2ml)中,室温搅拌下加入4mhcl的乙酸
乙酯(2ml),室温下搅拌反应2小时,反应液减压浓缩,残余物重新溶解于无水甲醇(2ml)中,依次加入dipea(150mg,1.17mmol)和丙烯腈(62mg,1.17mmol),所得反应混合液继续于室温下搅拌反应1小时。反应液用dcm(20ml)稀释后,用水(5ml)洗涤,有机相用无水硫酸钠干燥,过滤,减压浓缩,残余物用硅胶层析分离纯化得标题化合物为白色固体(18mg,20%)。
[1068]1h nmr(400mhz,cd3od)δ7.37(d,j=6.0hz,1h),6.97(d,j=6.1hz,1h),6.55(s,0.5h),5.81(s,0.5h),3.92
‑
3.74(m,1h),3.04
‑
2.88(m,2h),2.81
‑
2.57(m,4h),2.44
‑
2.15(m,5h),2.14
‑
1.97(m,2h),1.73
‑
1.52(m,2h).
[1069]
ms m/z(esi):383.1[m+h]
+
.
[1070]
实施例69
[1071]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1072][1073]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例8。
[1074]1h nmr(400mhz,cd3od)δ7.38(d,j=6.0hz,1h),6.99(d,j=6.0hz,1h),6.49(s,0.5h),5.83(s,0.5h),4.20
‑
4.10(m,2h),4.07
‑
3.99(m,2h),3.99
‑
3.89(m,1h),3.77
‑
3.61(m,3h),3.09
‑
2.99(m,2h),2.28(s,3h),2.17
‑
2.06(m,2h),1.67
‑
1.51(m,2h).
[1075]
ms m/z(esi):474.0[m+h]
+
.
[1076]
实施例70
[1077]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
(甲基氨基)乙烷
‑1‑
酮
[1078][1079]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
(甲基氨基)乙烷
‑1‑
酮的制备参照实施例18。
[1080]
ms m/z(esi):401.2[m+h]
+
.
[1081]
实施例71
[1082]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[1083][1084]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮的制备参照实施例17。
[1085]
ms m/z(esi):457.2[m+h]
+
.
[1086]
实施例72
[1087]
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)(吡啶
‑2‑
基)甲酮
[1088][1089]
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)(吡啶
‑2‑
基)甲酮的制备参照实施例31。
[1090]
ms m/z(esi):435.2[m+h]
+
.
[1091]
实施例73
[1092]3‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈
[1093][1094]3‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈的制备参照实施例1。
[1095]
ms m/z(esi):383.2[m+h]
+
.
[1096]
实施例74
[1097]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1098][1099]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例1。
[1100]
ms m/z(esi):474.1[m+h]
+
.
[1101]
实施例75
[1102]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮
[1103][1104]1‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)
‑2‑
吗啉代乙烷
‑1‑
酮的制备参照实施例17。
[1105]
ms m/z(esi):457.2[m+h]
+
.
[1106]
实施例76
[1107]
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)(吡啶
‑2‑
基)甲酮
[1108]
[1109]
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)哌啶
‑1‑
基)(吡啶
‑2‑
基)甲酮的制备参照实施例31。
[1110]
ms m/z(esi):435.2[m+h]
+
.
[1111]
实施例77
[1112]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈
[1113][1114]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈的制备参照实施例3。
[1115]
ms m/z(esi):381.2[m+h]
+
.
[1116]
实施例78
[1117]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈
[1118][1119]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)噻吩并[3,2
‑
d]嘧啶
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈的制备参照实施例1。
[1120]
ms m/z(esi):381.2[m+h]
+
.
[1121]
实施例79
[1122]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1123][1124]
第一步:2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺的制备
[1125][1126]
将2,4
‑
二氯喹唑啉(199mg,1.0mmol)、5
‑
甲基
‑
1h
‑
吡唑
‑3‑
胺(99mg,1.02mmol)以及三乙胺(213mg,2.1mmol)加入无水乙醇(5ml)中,室温下搅拌18小时。将反应液减压浓缩,所得固体悬浮于水
‑
乙醇(v\v=9:1,20ml)中,过滤后所得固体经石油醚洗涤,干燥得标题化合物(240mg,92%)。
[1127]
ms m/z(esi):260.1,262.1[m+h]
+
.
[1128]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯
[1129][1130]
将2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(40mg,0.154mmol)和叔丁基(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(70mg,0.308mmol)加入到正丁醇(3ml)中,室温搅拌均匀后微波150℃反应4小时。减压浓缩除去溶剂,残余物经硅胶柱层析分离纯化得到标题化合物粗品(120mg),直接用于下一步反应。
[1131]
ms m/z(esi):450.2[m+h]
+
.
[1132]
第三步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1133][1134]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯粗品(120mg,0.154mmol)溶解于甲醇(3ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环溶液(10ml)中,所得反应液室温搅拌反应30分钟,减压浓缩除去溶剂,残余物溶解于无水甲醇(10ml)中,室温搅拌下依次加入二异丙基乙基胺(0.51ml,3.08mmol)和丙烯腈(10mg,0.154mmol),所得反应混合液继续于室温下搅拌反应
2.5小时,减压浓缩除去溶剂,残余物依次经硅胶柱层析和反相hplc分离纯化得标题化合物(6.0mg,10%)。
[1135]1h nmr(400mhz,cd3od)δ8.04(d,j=8.1hz,1h),7.58(t,j=7.5hz,1h),7.39(s,1h),7.16(t,j=7.5hz,1h),6.62(s,1h),4.35(s,1h),3.37(s,2h),2.76(t,j=6.9hz,2h),2.62(t,j=6.9hz,2h),2.31(s,3h),2.16
‑
1.74(m,6h),1.67(t,j=11.7hz,2h).
[1136]
ms m/z(esi):403.2[m+h]
+
.
[1137]
实施例80
[1138]3‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1139][1140]
第一步:2
‑
氯
‑7‑
甲氧基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺的制备
[1141][1142]
将2,4
‑
二氯
‑7‑
甲氧基喹唑啉(500mg,2.18mmol),5
‑
甲基
‑
1h
‑
吡唑
‑3‑
胺(223mg,2.29mmol),dipea(592mg,4.58mmol)分别加入到无水乙醇(10ml)中,室温下搅拌3天。将反应液过滤,滤饼用乙腈(5ml)洗涤,真空干燥,得到标题化合物为白色固体(355mg,56%)。
[1143]
ms m/z(esi):290.1[m+h]
+
.
[1144]
第二步:(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸叔丁酯的制备
[1145]
[1146]
将化合物2
‑
氯
‑7‑
甲氧基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(355mg,1.23mmol),叔丁基(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯乙酸盐(421mg,1.47mmol)和dipea(475mg,3.68mmol)混合于正丁醇(7ml)中,将该混合液微波加热至150℃搅拌反应4小时。将反应液冷却至室温后减压浓缩,残余物经硅胶柱层析分离纯化得到标题化合物为白色固体(259mg,44%)。
[1147]
ms m/z(esi):480.2[m+h]
+
.
[1148]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1149][1150]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(259mg,0.540mmol)溶解于甲醇(3ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(4ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(3ml)中,依次加入dipea(349mg,2.70mmol)和丙烯腈(43mg,0.810mmol),所得反应混合液继续于室温下搅拌反应0.5小时。将反应液过滤,滤液减压浓缩除,残余物经硅胶柱层析分离纯化得标题化合物为白色固体(76.8mg,33%)。
[1151]1h nmr(400mhz,methanol
‑
d4)δ8.12(s,1h),7.14
‑
6.75(m,2h),6.50(s,1h),4.50
‑
4.21(m,1h),3.92(s,3h),3.41(s,2h),2.91
‑
2.55(m,4h),2.34(s,3h),2.14
‑
1.50(m,7h),1.40
‑
1.23(m,1h).
[1152]
ms m/z(esi):433.2[m+h]
+
.
[1153]
实施例81
[1154]3‑
((3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1155][1156]
第一步:7
‑
溴
‑2‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺的制备
[1157][1158]
将7
‑
溴
‑
2,4
‑
二氯喹唑啉(3.36g,12.1mmol),5
‑
甲基
‑
1h
‑
吡唑
‑3‑
胺(1.29g,13.3mmol),tea(2.57g,25.4mmol)分别加入到无水乙醇(67ml)中,室温下搅拌16小时。将反应液过滤,滤饼用无水乙醇(20ml)洗涤,真空干燥,得到标题化合物为白色固体(4.17g,100%)。
[1159]
第二步:叔丁基(3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1160][1161]
将化合物7
‑
溴
‑2‑
氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(500mg,1.48mmol),叔丁基(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯乙酸盐(465mg,1.62mmol)和dipea(591mg,4.58mmol)混合于nmp(5ml)中,将该混合液微波加热至130℃搅拌反应4小时。将反应液冷却至室温后倾入25ml冰水中搅拌30分钟。混合物过滤,滤饼用乙腈(2ml)洗涤,减压干燥,得标题化合物为灰色固体(877mg,100%)。
[1162]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1163][1164]
将叔丁基(3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(220mg,0.416mmol)溶解于甲醇(2ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2ml),室温下搅拌反应2小时,反应液减压浓缩,残余物重新溶解于无水甲醇(2ml)中,依次加入dipea(269mg,2.08mmol)和丙烯腈(66mg,1.25mmol),所
得反应混合液继续于室温下搅拌反应1小时。将反应液过滤,滤液减压浓缩除,残余物经硅胶柱层析分离纯化得标题化合物为白色固体(17.4mg,9%)。
[1165]1h nmr(400mhz,cd3od)δ7.94(d,j=8.8hz,1h),7.74
‑
7.37(m,1h),7.24(dd,j=8.9,2.0hz,1h),6.59(s,0.8h),5.92(s,0.2h),4.51
‑
4.12(m,1h),3.42
‑
3.35(m,2h),2.75(t,j=6.9hz,2h),2.62(t,j=6.9hz,2h),2.31(s,3h),2.09
‑
1.61(m,8h).
[1166]
ms m/z(esi):481.1[m+h]
+
.
[1167]
实施例82
[1168]3‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1169][1170]
第一步:2,7
‑
二氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺的制备
[1171][1172]
将2,4,7
‑
三氯喹唑啉(2.0g,8.58mmol),5
‑
甲基
‑
1h
‑
吡唑
‑3‑
胺(915mg,9.42mmol),tea(1.82g,18.0mmol)分别加入到无水乙醇(40ml)中,室温下搅拌16小时。将反应液过滤,滤饼用无水乙醇(5ml)洗涤,真空干燥,得到标题化合物为白色固体(2.5g,99%)。
[1173]
ms m/z(esi):294.0[m+h]
+
.
[1174]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1175][1176]
将化合物2,7
‑
二氯
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(500mg,1.70mmol),叔丁基(3
‑
exo)
‑3‑
氨基
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯乙酸盐(535mg,1.87mmol)和dipea(681mg,5.27mmol)混合于nmp(7ml)中,将该混合液微波加热至180℃搅拌反应2小时。将反应液冷却至室温后,加入到冰水中搅拌,将析出的固体过滤。滤饼用水洗涤,真空干燥,然后经硅胶柱层析分离纯化得到标题化合物为白色固体(405mg,49%)。
[1177]
ms m/z(esi):484.2[m+h]
+
.
[1178]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1179][1180]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(405mg,0.837mmol)溶解于甲醇(4ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2.5ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(4ml)中,依次加入dipea(486mg,3.77mmol)和丙烯腈(53mg,1.00mmol),所得反应混合液继续于室温下搅拌反应16小时。将反应液过滤,滤液减压浓缩,残余物经硅胶柱层析初步分离纯化后再用prep
‑
hplc分离纯化得标题化合物为白色固体(40mg,11%)。
[1181]1h nmr(400mhz,methanol
‑
d4)δ8.02(d,j=8.8hz,1h),7.54
‑
7.22(m,1h),7.14
‑
7.07(m,1h),6.71
‑
6.49(m,0.6h),6.05
‑
5.76(m,0.4h),4.44
‑
4.17(m,1h),3.40
‑
3.35(m,2h),2.75(t,j=7.0hz,2h),2.62(t,j=6.9hz,2h),2.46
‑
2.12(m,3h),2.07
‑
2.00(m,2h),1.96
‑
1.75(m,4h),1.71
‑
1.61(m,2h).
[1182]
ms m/z(esi):437.2[m+h]
+
.
[1183]
实施例83
[1184]3‑
((3
‑
exo)
‑3‑
((7
‑
氟
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1185][1186]3‑
((3
‑
exo)
‑3‑
((7
‑
氟
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例82。
[1187]
ms m/z(esi):421.2[m+h]
+
.
[1188]
实施例84
[1189]3‑
((3
‑
exo)
‑3‑
((5
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1190][1191]3‑
((3
‑
exo)
‑3‑
((5
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1192]1h nmr(400mhz,dmso
‑
d6)δ12.24(s,1h),9.62(s,1h),7.45(t,j=8.0hz,1h),7.33
‑
6.92(m,3h),6.92
‑
6.55(m,1h),4.32
‑
4.15(m,1h),3.33
‑
3.25(m,2h),2.68
‑
2.56(m,4h),2.26(s,3h),2.00
‑
1.85(m,2h),1.83
‑
1.54(m,6h).
[1193]
ms m/z(esi):437.2[m+h]
+
.
[1194]
实施例85
[1195]3‑
((3
‑
exo)
‑3‑
((8
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1196][1197]3‑
((3
‑
exo)
‑3‑
((8
‑
甲基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1198]1h nmr(400mhz,methanol
‑
d4)δ7.86(d,1h),7.44(d,j=7.1hz,1h),7.03(t,j=7.7hz,1h),6.70
‑
6.54(m,0.6h),5.96
‑
5.84(m,0.4h),4.49
‑
4.32(m,1h),3.46
‑
3.36(m,2h),2.75(t,j=6.9hz,2h),2.62(t,j=6.9hz,2h),2.48(s,3h),2.38
‑
2.17(m,3h),2.10
‑
1.89(m,4h),1.88
‑
1.77(m,2h),1.64(t,j=12.0hz,2h).
[1199]
ms m/z(esi):417.2[m+h]
+
.
[1200]
实施例86
[1201]3‑
((3
‑
exo)
‑3‑
((8
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1202][1203]3‑
((3
‑
exo)
‑3‑
((8
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1204]1h nmr(400mhz,methanol
‑
d4)δ8.01(s,1h),7.69(d,j=7.6hz,1h),7.09(s,1h),6.83
‑
5.77(m,1h),4.52
‑
4.26(m,1h),3.57
‑
3.36(m,2h),2.94
‑
2.71(m,2h),2.71
‑
2.53(m,2h),2.32(s,3h),2.19
‑
1.49(m,8h).
[1205]
ms m/z(esi):437.2[m+h]
+
.
[1206]
实施例87
[1207]3‑
((3
‑
exo)
‑3‑
((6
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1208][1209]3‑
((3
‑
exo)
‑3‑
((6
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1210]1h nmr(400mhz,methanol
‑
d4)δ8.15(d,j=2.3hz,1h),7.54(d,j=8.8hz,1h),7.49
‑
7.21(m,1h),6.72
‑
6.46(m,0.6h),6.08
‑
5.75(m,0.4h),4.46
‑
4.20(m,1h),3.41
‑
3.36(m,2h),2.76(t,j=7.0hz,2h),2.62(t,j=7.0hz,2h),2.42
‑
2.22(m,3h),2.08
‑
2.01(m,2h),1.97
‑
1.77(m,4h),1.72
‑
1.61(m,2h).
[1211]
ms m/z(esi):437.2[m+h]
+
.
[1212]
实施例88
[1213]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1214][1215]
第一步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1216][1217]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(400mg,0.758mmol),3
‑
吡啶硼酸(187mg,1.52mmol),pd(dppf)cl2(110mg,0.152mmol),碳酸铯(740g,2.27mmol)分别加入到dioxane(8ml)和水(0.8ml)的混合溶剂中,氮气保护下升温至100℃搅拌1小时。将反应液浓缩后,残留物经硅胶柱层析分离纯化得标题化合物为淡黄色胶状体(160mg,40%)。
[1218]
第二步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1219][1220]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑
啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(160mg,0.302mmol)溶解于甲醇(4ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(4ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(2ml)中,依次加入dipea(195mg,1.51mmol)和丙烯腈(48mg,0.906mmol),所得反应混合液继续于室温下搅拌反应2小时。反应后减压浓缩,残余物经硅胶柱层析初步分离纯化,得灰色固体,该灰色固体用n,n
‑
二甲基甲酰胺/乙腈(2ml/4ml)打浆,滤出的固体再用n,n
‑
二甲基甲酰胺/乙腈(1.1ml/2.2ml)打浆,滤出固体,真空干燥,得标题化合物为白色固体(49mg,34%)。
[1221]1h nmr(400mhz,cd3od)δ8.90(d,j=2.3hz,1h),8.59(dd,j=4.9,1.6hz,1h),8.31
‑
8.08(m,2h),7.84
‑
7.40(m,3h),6.63(s,0.8h),5.94(s,0.2h),4.49
‑
4.26(m,1h),3.45
‑
3.37(m,2h),2.77(t,j=6.9hz,2h),2.63(t,j=6.9hz,2h),2.34(s,3h),2.13
‑
1.63(m,8h).
[1222]
ms m/z(esi):480.2[m+h]
+
.
[1223]
实施例89
[1224]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1225][1226]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例88。
[1227]1h nmr(400mhz,cd3od)δ8.73
‑
8.58(m,2h),8.21(d,j=8.5hz,1h),7.95
‑
7.64(m,3h),7.59
‑
7.49(m,1h),6.64(s,1h),4.49
‑
4.22(m,1h),3.45
‑
3.35(m,2h),2.77(t,j=7.0hz,2h),2.63(t,j=7.0hz,2h),2.33(s,3h),2.16
‑
1.58(m,8h).
[1228]
ms m/z(esi):480.2[m+h]
+
.
[1229]
实施例90
[1230]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑2‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1231][1232]3‑
((3
‑
exo)
‑3‑
((7
‑
氟
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例88。
[1233]
ms m/z(esi):480.3[m+h]
+
.
[1234]
实施例91
[1235]3‑
((3
‑
exo)
‑3‑
((7
‑
(5
‑
甲氧基吡啶
‑3‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1236][1237]3‑
((3
‑
exo)
‑3‑
((7
‑
(5
‑
甲氧基吡啶
‑3‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例88。
[1238]1h nmr(400mhz,cd3od)δ8.54
‑
8.41(m,1h),8.27(d,j=2.7hz,1h),8.17(d,j=8.5hz,1h),7.88
‑
7.56(m,2h),7.47(dd,j=8.5,1.8hz,1h),6.62(s,1h),4.49
‑
4.25(m,1h),3.97(s,3h),3.44
‑
3.37(m,2h),2.76(t,j=7.0hz,2h),2.63(t,j=7.0hz,2h),2.32(s,3h),2.10
‑
1.64(m,8h).
[1239]
ms m/z(esi):510.2[m+h]
+
.
[1240]
实施例92
[1241]3‑
((3
‑
exo)
‑3‑
((7
‑
(6
‑
甲氧基吡啶
‑3‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1242][1243]3‑
((3
‑
exo)
‑3‑
((7
‑
(6
‑
甲氧基吡啶
‑3‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例88。
[1244]
ms m/z(esi):510.3[m+h]
+
.
[1245]
实施例93
[1246]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
苯基喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1247][1248]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
苯基喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例88。
[1249]1h nmr(400mhz,dmso
‑
d6,少量cd3od)δ8.47
‑
8.23(m,1h),7.88
‑
7.69(m,2h),7.67
‑
7.25(m,5h),6.92
‑
6.62(m,0.8h),5.88(s,0.2h),4.41
‑
4.20(m,1h),3.58(s,2h),2.76
‑
2.57(m,4h),2.38
‑
2.11(m,3h),2.06
‑
1.47(m,8h).
[1250]
ms m/z(esi):479.3[m+h]
+
.
[1251]
实施例94
[1252]3‑
((3
‑
exo)
‑3‑
((7
‑
(1
‑
环丙基
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1253][1254]
第一步:叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
(1
‑
环丙基
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1255][1256]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.189mmol),(1
‑
环丙基
‑
1h
‑
吡唑
‑4‑
基)硼酸(35mg,0.227mmol),碳酸铯(185mg,0.567mmol),氯(2
‑
二环己基膦基
‑
2,4,6
‑
三异丙基
‑
1,1
‑
联苯基)[2
‑
(2
‑
氨基
‑
1,1
‑
联苯)]钯(ii)(x
‑
phos pd g2)(15mg,0.0189mmol)分别加入到二氧六环(2ml)和水(0.4ml)的混合溶剂中,氮气置换三次后,升温至100℃搅拌反应2小时。将反应液冷却后减压浓缩,剩余物用硅胶柱层析纯化得到标题化合物为棕色油状物(60mg,57%)。
[1257]
第二步:3
‑
((3
‑
exo)
‑3‑
((7
‑
(1
‑
环丙基
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1258][1259]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
(1
‑
环丙基
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(60mg,0.108mmol)溶解于甲醇(2ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(1ml)中,依次加入dipea(70mg,0.542mmol)和丙烯腈(17mg,0.324mmol),所得反应混合液继续于室温下搅拌反应16小时。反应液用dcm(30ml)稀释后,用水(10ml)洗涤,减压浓缩,残余物用硅胶层析初步分离纯化,得标题化合物为灰色固体(20mg,36%)。
[1260]1h nmr(400mhz,cd3od)δ8.20(s,1h),8.06(d,j=8.3hz,1h),7.93(s,1h),7.72
‑
7.34(m,2h),6.60(s,1h),4.45
‑
4.23(m,1h),3.78
‑
3.67(m,1h),3.43
‑
3.36(m,2h),2.76(t,j=6.8hz,2h),2.63(t,j=6.8hz,2h),2.32(s,3h),2.09
‑
1.64(m,8h),1.24
‑
1.00(m,4h).
[1261]
ms m/z(esi):509.2[m+h]
+
.
[1262]
实施例95
[1263]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1264][1265]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例94。
[1266]1h nmr(400mhz,cd3od)δ8.09(s,1h),8.03(d,j=8.5hz,1h),7.93(s,1h),7.64
‑
7.43(m,1h),7.38(dd,j=8.6,1.7hz,1h),6.62(s,0.8h),5.92(s,0.2h),4.42
‑
4.28(m,1h),3.95(s,3h),3.42
‑
3.36(m,2h),2.76(t,j=7.0hz,2h),2.63(t,j=7.0hz,2h),2.32
(s,3h),2.08
‑
2.01(m,2h),2.00
‑
1.80(m,4h),1.77
‑
1.62(m,2h).
[1267]
ms m/z(esi):483.2[m+h]
+
.
[1268]
实施例96
[1269]3‑
((3
‑
exo)
‑3‑
((7
‑
(1
‑
(2
‑
氟乙基)
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1270][1271]3‑
((3
‑
exo)
‑3‑
((7
‑
(1
‑
(2
‑
氟乙基)
‑
1h
‑
吡唑
‑4‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例94。
[1272]
ms m/z(esi):515.3[m+h]
+
.
[1273]
实施例97
[1274]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噻唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1275][1276]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噻唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例94。
[1277]
ms m/z(esi):486.2[m+h]
+
.
[1278]
实施例98
[1279]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1280][1281]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例88。
[1282]
ms m/z(esi):494.3[m+h]
+
.
[1283]
实施例99
[1284]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1285][1286]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例88。
[1287]
ms m/z(esi):497.3[m+h]
+
.
[1288]
实施例100
[1289]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1290]
[1291]
第一步:叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1292][1293]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
溴
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(300mg,0.568mmol),吗啉(494mg,5.68mmol),pd2(dba)3(104mg,0.114mmol),davephos(90mg,0.227mmol),t
‑
buona(109mg,1.14mmol)分别加入到dioxane(6ml)中,氮气保护下升温至100℃搅拌4小时。将反应液冷却至室温后加入乙酸乙酯(20ml)稀释,分别用水(20ml)、饱和氯化钠水溶液(10ml)洗涤,收集有机相经无水硫酸钠干燥,过滤,减压浓缩,所得残余物经硅胶柱层析分离纯化得到标题化合物为淡黄色油状物(66mg,22%)。
[1294]
第二步:3
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备
[1295][1296]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(66mg,0.123mmol)溶解于甲醇(2ml)中,室温搅拌下加入4m hcl的1,4
‑
二氧六环(2ml),室温下搅拌反应1小时,反应液减压浓缩,残余物重新溶解于无水甲醇(1ml)中,依次加入dipea(80mg,0.617mmol)和丙烯腈(20mg,0.369mmol),所得反应混合液继续于室温下搅拌反应2小时。反应液减压浓缩后,残余物用硅胶层析初步分离纯化,再用制备tlc进一步分离纯化,得标题化合物为灰色固体(12mg,20%)。
[1297]1h nmr(400mhz,cd3od)δ8.06(d,j=9.3hz,1h),7.08(d,j=9.4hz,1h),6.68(s,1h),6.49(s,1h),4.46
‑
4.28(m,1h),3.97
‑
3.73(m,4h),3.52
‑
3.36(m,6h),2.73(t,j=
6.7hz,2h),2.62(t,j=6.7hz,2h),2.34(s,3h),2.11
‑
1.61(m,8h).
[1298]
ms m/z(esi):488.2[m+h]
+
.
[1299]
实施例101
[1300]3‑
((3
‑
exo)
‑3‑
((7
‑
(3
‑
甲氧基吖丁啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1301][1302]3‑
((3
‑
exo)
‑3‑
((7
‑
(3
‑
甲氧基吖丁啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1303]
ms m/z(esi):488.3[m+h]
+
.
[1304]
实施例102
[1305]3‑
((3
‑
exo)
‑3‑
((7
‑
(4
‑
甲氧基哌啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1306][1307]3‑
((3
‑
exo)
‑3‑
((7
‑
(4
‑
甲氧基哌啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1308]
ms m/z(esi):516.3[m+h]
+
.
[1309]
实施例103
[1310]3‑
((3
‑
exo)
‑3‑
((7
‑
(4
‑
(二甲氨基)哌啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1311][1312]3‑
((3
‑
exo)
‑3‑
((7
‑
(4
‑
(二甲氨基)哌啶
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1313]
ms m/z(esi):529.3[m+h]
+
.
[1314]
实施例104
[1315]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡咯烷
‑1‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1316][1317]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡咯烷
‑1‑
基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1318]
ms m/z(esi):472.3[m+h]
+
.
[1319]
实施例105
[1320]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(甲基氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1321]
[1322]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(甲基氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1323]
ms m/z(esi):432.3[m+h]
+
.
[1324]
实施例106
[1325]3‑
((3
‑
exo)
‑3‑
((7
‑
(甲基(噁丁环
‑3‑
基甲基)氨基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1326][1327]3‑
((3
‑
exo)
‑3‑
((7
‑
(甲基(噁丁环
‑3‑
基甲基)氨基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1328]
ms m/z(esi):502.3[m+h]
+
.
[1329]
实施例107
[1330]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((1
‑
甲基吖丁啶
‑3‑
基)甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1331][1332]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((1
‑
甲基吖丁啶
‑3‑
基)甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1333]
ms m/z(esi):501.3[m+h]
+
.
[1334]
实施例108
[1335]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((四氢
‑
2h
‑
吡喃
‑4‑
基)
甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1336][1337]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((四氢
‑
2h
‑
吡喃
‑4‑
基)甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1338]
ms m/z(esi):516.3[m+h]
+
.
[1339]
实施例109
[1340]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((1
‑
甲基哌啶
‑4‑
基)甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1341][1342]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(((1
‑
甲基哌啶
‑4‑
基)甲基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1343]
ms m/z(esi):529.3[m+h]
+
.
[1344]
实施例110
[1345]3‑
((3
‑
exo)
‑3‑
((7
‑
(甲基(吡啶
‑3‑
基甲基)氨基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1346][1347]3‑
((3
‑
exo)
‑3‑
((7
‑
(甲基(吡啶
‑3‑
基甲基)氨基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1348]
ms m/z(esi):523.3[m+h]
+
.
[1349]
实施例111
[1350]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1351][1352]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
吗啉代喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例100。
[1353]
ms m/z(esi):502.3[m+h]
+
.
[1354]
实施例112
[1355]3‑
((3
‑
exo)
‑3‑
((7
‑
(1h
‑
咪唑
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1356][1357]3‑
((3
‑
exo)
‑3‑
((7
‑
(1h
‑
咪唑
‑1‑
基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例100。
[1358]1h nmr(400mhz,cd3od)δ8.29(s,1h),8.21(d,j=8.9hz,1h),7.70(s,1h),7.64
‑
7.26(m,2h),7.19(s,1h),6.62(s,0.8h),5.93(s,0.2h),4.47
‑
4.22(m,1h),3.41
‑
3.36(m,2h),2.76(t,j=6.9hz,2h),2.63(t,j=6.9hz,2h),2.33(s,3h),2.08
‑
2.01(m,2h),2.00
‑
1.79(m,4h),1.74
‑
1.63(m,2h).
[1359]
ms m/z(esi):469.2[m+h]
+
.
[1360]
实施例113
[1361]3‑
((3
‑
exo)
‑3‑
((7
‑
(2
‑
甲氧基乙氧基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1362][1363]3‑
((3
‑
exo)
‑3‑
((7
‑
(2
‑
甲氧基乙氧基)
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1364]
ms m/z(esi):477.3[m+h]
+
.
[1365]
实施例114
[1366]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噁丁环
‑3‑
基甲氧基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1367][1368]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噁丁环
‑3‑
基甲氧基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例80。
[1369]
ms m/z(esi):503.3[m+h]
+
.
[1370]
实施例115
[1371]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基吖丁啶
‑3‑
基)甲氧基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1372][1373]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基吖丁啶
‑3‑
基)甲氧基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1374]
ms m/z(esi):502.3[m+h]
+
.
[1375]
实施例116
[1376]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基甲氧基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1377][1378]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吡啶
‑3‑
基甲氧基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1379]
ms m/z(esi):510.3[m+h]
+
.
[1380]
实施例117
[1381]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基吖丁啶
‑3‑
基)氧代)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1382][1383]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基吖丁啶
‑3‑
基)氧代)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1384]
ms m/z(esi):488.3[m+h]
+
.
[1385]
实施例118
[1386]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基哌啶
‑4‑
基)氧代)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1387][1388]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
((1
‑
甲基哌啶
‑4‑
基)氧代)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例80。
[1389]
ms m/z(esi):516.3[m+h]
+
.
[1390]
实施例119
[1391]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吗啉代甲基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1392][1393]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(吗啉代甲基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例80。
[1394]
ms m/z(esi):516.3[m+h]
+
.
[1395]
实施例120
[1396]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基吖丁啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1397][1398]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(1
‑
甲基吖丁啶
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例80。
[1399]
ms m/z(esi):486.3[m+h]
+
.
[1400]
实施例121
[1401]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噁丁环
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1402]
[1403]3‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)
‑7‑
(噁丁环
‑3‑
基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备参照实施例80。
[1404]
ms m/z(esi):473.3[m+h]
+
.
[1405]
实施例122
[1406]1‑
(((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1407][1408]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.222mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(10ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.73ml,4.44mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(44mg,0.244mmol),反应混合液继续于0℃下搅拌反应5小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(59.3mg,54%)。
[1409]1h nmr(400mhz,cd3od)δ8.12(s,1h),7.50(s,1h),7.29(d,j=44.1hz,1h),7.06(s,1h),6.58(s,1h),4.36(s,1h),4.12(s,2h),4.03(t,j=8.4hz,2h),3.90(t,j=7.0hz,2h),3.69
‑
3.57(m,1h),2.20(s,3h),2.10
‑
1.51(m,8h).
[1410]
ms m/z(esi):494.2[m+h]
+
.
[1411]
实施例123
[1412]1‑
(((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1413][1414]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(174mg,0.36mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(20ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲
酰胺(10ml)中,冷却至0℃,依次加入dipea(1.19ml,7.2mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(78mg,0.432mmol),反应混合液继续于0℃下搅拌反应16.5小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(17.7mg,9%)。
[1415]1h nmr(400mhz,meod
‑
d4)δ8.02(s,1h),7.42(s,1h),7.20(s,1h),6.57(s,1h),4.51
‑
4.40(m,1h),4.27(s,2h),4.17(t,j=8.5hz,2h),4.13
‑
4.05(m,2h),3.64
‑
3.53(m,1h),2.34(s,3h),2.16(s,4h),1.98(d,j=42.2hz,2h),1.76(t,j=11.9hz,2h).
[1416]
ms m/z(esi):528.2[m+h]
+
.
[1417]
实施例124
[1418]1‑
(((3
‑
exo)
‑3‑
((7
‑
氟
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1419][1420]1‑
(((3
‑
exo)
‑3‑
((7
‑
氟
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例122。
[1421]1h nmr(400mhz,cd3od)δ8.11(dd,j=9.1,6.1hz,1h),7.21
‑
6.82(m,2h),6.56(s,0.8h),5.88(s,0.2h),4.58
‑
4.34(m,1h),4.29
‑
4.19(m,2h),4.17
‑
4.08(m,2h),4.06
‑
3.96(m,2h),3.72
‑
3.58(m,1h),2.31(s,3h),2.18
‑
1.85(m,6h),1.82
‑
1.66(m,2h).
[1422]
ms m/z(esi):512.1[m+h]
+
.
[1423]
实施例125
[1424]1‑
(((3
‑
exo)
‑3‑
((7
‑
环丙基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1425][1426]1‑
(((3
‑
exo)
‑3‑
((7
‑
环丙基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例122。
[1427]1h nmr(400mhz,cd3od)δ8.04(s,1h),7.26
‑
6.93(m,2h),6.50(s,1h),4.58
‑
4.37(m,1h),4.31
‑
4.18(m,2h),4.18
‑
4.07(m,2h),4.06
‑
3.95(m,2h),3.71
‑
3.58(m,1h),2.32(s,3h),2.17
‑
1.71(m,8h),1.34
‑
1.25(m,1h),1.19
‑
1.03(m,2h),0.94
‑
0.75(m,2h).
[1428]
ms m/z(esi):534.1[m+h]
+
.
[1429]
实施例126
[1430]3‑
((3
‑
exo)
‑3‑
(((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)磺酰基)氮杂环丁烷
‑3‑
腈
[1431][1432]
第一步:叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯的制备
[1433][1434]
往2
‑
氯
‑
n
‑
(5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(200mg,0.77mmol)的正丁醇(10ml)的溶液中,依次加入叔丁基
‑
(3
‑
exo)
‑3‑
氨基
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(222mg,0.92mmol),dipea(199mg,1.54mmol),然后170℃微波条件下搅拌4小时。反应结束用乙酸乙酯萃取反应液(15mlx3),饱和氯化钠水溶液洗涤(15mlx3),收集有机相用无水硫酸钠干燥,过滤后减压浓缩有机相,所得产物用硅胶柱层析分离纯化(二氯甲烷:甲醇=95:5)得到标题化合物白色固体(275mg,77%)。
[1435]
ms m/z(esi):464.2[m+h]
+
.
[1436]
第三步:3
‑
((3
‑
exo)
‑3‑
(((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)磺酰基)氮杂环丁烷
‑3‑
腈的制备
[1437][1438]
将叔丁基
‑
(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
羧酸酯(100mg,0.21mmol)溶于盐酸1,4
‑
环氧六环溶液(4.0n,5ml)中,室温搅拌30分钟后将反应液浓缩;然后将其溶解于n,n
‑
二甲基甲酰胺(10ml)中,缓慢滴加入dipea(108mg,0.84mmol),室温下搅拌10分钟,加入3
‑
腈基氮杂环丁烷
‑1‑
磺酰氯(45mg,0.25mmol)后继续室温搅拌过夜。将反应液减压浓缩,所得产物经prep
‑
hplc得到标题化合物白色固体(30.5mg,29%)。
[1439]1h nmr(400mhz,dmso)δ=12.09(s,1h),10.04(s,1h),8.24(s,1h),7.45(s,1h),7.33
‑
6.42(m,4h),4.79(s,1h),4.01
‑
3.79(m,6h),3.74
‑
3.67(m,1h),2.15(s,3h),2.09
‑
1.57(m,10h).
[1440]
ms m/z(esi):508.2[m+h]
+
.
[1441]
实施例127
[1442]1‑
(((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1443][1444]
第一步反应:2
‑
氯
‑7‑
甲氧基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺的制备
[1445][1446]
将2,4
‑
二氯
‑7‑
甲氧基喹唑啉(497mg,2.17mmol)、5
‑
甲基
‑
1h
‑
吡唑
‑3‑
胺(221mg,2.28mmol)和dipea(0.75ml,4.56mmol)加入无水乙醇(10ml)中,室温下搅拌24小时后升温至50℃反应5小时。减压浓缩除去溶剂,残余物经乙醇
‑
水(v/v=1:9,20ml)混合溶剂洗涤,滤渣经减压干燥得标题化合物(509mg,81%)。
[1447]
ms m/z(esi):290.0[m+h]
+
.
[1448]
第二步反应:叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1449][1450]
将2
‑
氯
‑7‑
甲氧基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(150mg,0.518mmol)、叔
‑
丁基(3
‑
exo)
‑3‑
(甲基氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(249mg,1.036mmol)和dipea(0.43ml,2.59mmol)加入正丁醇(3ml)中,微波合成仪加热至170℃反应6小时。减压浓缩除去溶剂,残余物经反相柱层析分离得到标题化合物(193mg,75%)。
[1451]
ms m/z(esi):494.2[m+h]
+
.
[1452]
第三步反应:1
‑
(((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备
[1453][1454]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(193mg,0.39mmol)溶解于4m hcl的1,
4
‑
环氧六环(20ml)中,室温搅拌反应60分钟,减压浓缩除去溶剂,残余固体溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(1.93ml,11.7mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(71mg,0.39mmol),反应混合液继续于0℃下搅拌反应4小时。减压浓缩除去溶剂,残余物经prep
‑
hplc分离得到标题化合物(97mg,46%)。
[1455]1h nmr(400mhz,dmso
‑
d6)δ12.11(s,1h),9.77(s,1h),8.23(d,j=8.9hz,1h),6.72(s,1h),6.67(d,j=8.8hz,1h),6.48(s,1h),5.40
‑
5.25(m,1h),4.18(s,2h),4.06(t,j=8.6hz,2h),4.01
‑
3.92(m,2h),3.87
‑
3.74(m,4h),2.96(s,3h),2.23(s,3h),2.06
‑
1.89(m,4h),1.83(d,j=5.8hz,2h),1.61(d,j=11.2hz,2h).
[1456]
ms m/z(esi):538.2[m+h]
+
.
[1457]
实施例128
[1458]1‑
(((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1459][1460]
第一步反应:叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯
[1461][1462]
将2
‑
氯
‑7‑
甲氧基
‑
n
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑4‑
胺(50mg,0.173mmol)和叔
‑
丁基(3
‑
exo)
‑3‑
氨基
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯草酸盐(171mg,0.518mmol)加入到正丁醇(10ml)中,微波合成仪加热至170℃反应8小时,减压浓缩除去溶剂,残余物经硅胶柱层析分离得到标题化合物(68mg,80%)。
[1463]
ms m/z(esi):494.2[m+h]
+
.
[1464]
第二步反应:1
‑
(((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1465][1466]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(68mg,0.138mmol)溶解于4m hcl的1,4
‑
环氧六环(15ml)中,室温搅拌反应60分钟。减压浓缩除去溶剂,残余固体溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.68ml,4.14mmol)和3
‑
氰基吖丁啶
‑1‑
磺酰氯(25mg,0.138mmol),反应混合液继续于0℃下搅拌反应8小时。减压浓缩除去溶剂,残余物经prep
‑
hplc分离得到标题化合物(6.9mg,9%)。
[1467]1h nmr(400mhz,dmso
‑
d6)δ12.10(s,1h),9.83(s,1h),8.24(d,j=7.3hz,1h),6.65(dd,j=29.7,20.4hz,4h),4.83(s,1h),4.02(t,j=8.5hz,2h),3.92(dd,j=14.9,8.4hz,4h),3.87
‑
3.73(m,4h),2.21(s,3h),2.04(d,j=4.3hz,3h),1.92
‑
1.68(m,7h).
[1468]
ms m/z(esi):538.2[m+h]
+
.
[1469]
实施例129
[1470]1‑
((1r,3s,5s)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂双环[3.2.1]辛烷
‑8‑
基)
‑2‑
(二甲氨基)乙烷
‑1‑
酮
[1471][1472]
将叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯分散于二氯甲烷(2ml)中,加入4m hcl的1,4
‑
环氧六环溶液(20ml),反应混合液于室温下搅拌反应1.5小时。减压浓缩除去溶剂,残余物于油泵上减压干燥10分钟。将得到的粗品溶解于无水n,n
‑
二甲基甲酰胺中(8ml),冰水浴冷却至0℃,搅拌条件下依次加入dipea(1.2ml,7.1mmol)、二甲基甘氨酸(0.31ml,4.72mmol)和hatu(118mg,0.31mmol),所得反应混合液继续于0℃下搅拌反应60分钟。减压浓缩除去溶剂,粗品经prep
‑
hplc分离得标题化合物为白色固体(20.7mg,21%)。
[1473]1h nmr(400mhz,dmso
‑
d6)δ10.12(s,1h),8.33(s,1h),7.31(s,1h),7.17(s,1h),7.13
‑
6.86(m,2h),6.60(s,1h),4.52(s,1h),4.42(d,j=3.4hz,2h),3.16(s,2h),2.38
‑
2.12(m,9h),2.05
‑
1.94(m,2h),1.93
‑
1.73(m,4h),1.63
‑
1.46(m,2h).
[1474]
ms m/z(esi):469.1[m+h]
+
.
[1475]
实施例130
[1476]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[1477][1478]2‑
(二甲氨基)
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮的制备参照实施例129。
[1479]1h nmr(400mhz,dmso
‑
d6)δ12.21(s,1h),10.13(s,1h),8.33(s,1h),7.54(t,j=7.5hz,1h),7.27(d,j=30.8hz,1h),7.08(s,1h),6.78(s,1h),6.61(s,1h),4.56(d,j=6.1hz,1h),4.48(s,1h),4.32(d,j=5.3hz,1h),3.65(dd,j=32.9,14.8hz,2h),2.53(s,6h),2.25(s,3h),1.94(ddd,j=36.8,20.0,10.6hz,6h),1.56(dd,j=19.2,9.5hz,2h).
[1480]
ms m/z(esi):435.2[m+h]
+
.
[1481]
实施例131
[1482]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑2‑
基)甲酮
[1483][1484]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑2‑
基)甲酮的制备参照实施例129。
[1485]1h nmr(400mhz,dmso
‑
d6)δ12.29(s,1h),10.80(s,1h),10.33(s,1h),8.61(d,j=4.3hz,1h),8.52
‑
8.24(m,1h),7.96(td,j=7.8,1.7hz,1h),7.73(d,j=7.8hz,1h),7.71
‑
7.57(m,1h),7.52(ddd,j=7.5,4.9,1.0hz,1h),7.39(d,j=18.4hz,1h),7.21(d,j=39.2hz,1h),6.60(s,1h),4.74(s,1h),4.69
‑
4.44(m,2h),2.27(s,3h),2.12
‑
1.69(m,8h).
[1486]
ms m/z(esi):455.2[m+h]
+
.
[1487]
实施例132
[1488]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑3‑
基)甲酮
[1489][1490]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑3‑
基)甲酮的制备参照实施例129。
[1491]1h nmr(400mhz,dmso
‑
d6)δ12.25(s,1h),10.36(s,1h),10.05(s,1h),8.78
‑
8.62(m,2h),8.34(d,j=29.6hz,1h),7.90(d,j=7.0hz,1h),7.62
‑
7.48(m,2h),7.31(dd,j=19.3,8.1hz,1h),7.12(s,1h),6.60(s,1h),4.68(d,j=4.8hz,1h),4.53(d,j=9.2hz,1h),4.02(d,j=3.1hz,1h),2.25(s,3h),2.16
‑
1.48(m,8h).
[1492]
ms m/z(esi):455.2[m+h]
+
.
[1493]
实施例133
[1494]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑4‑
基)甲酮
[1495][1496]
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)(吡啶
‑4‑
基)甲酮的制备参照实施例129。
[1497]1h nmr(400mhz,dmso
‑
d6)δ12.23(s,1h),10.21(s,1h),8.70(d,j=5.5hz,2h),8.32(dd,j=28.3,8.1hz,1h),7.59
‑
7.51(m,1h),7.45(d,j=1.8hz,2h),7.36
‑
7.22(m,1h),7.09(t,j=7.4hz,1h),6.86(s,1h),6.59(s,1h),4.67(d,j=4.9hz,1h),4.61
‑
4.44(m,1h),3.94(d,j=1.9hz,1h),2.24(s,3h),2.09
‑
1.53(m,8h).
[1498]
ms m/z(esi):455.2[m+h]
+
.
[1499]
实施例134
[1500]
2,2
‑
二氟
‑1‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)乙烷
‑1‑
酮
[1501][1502]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.222mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(10ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,加入dipea(0.73ml,4.44mmol),混合均匀后再加入二氟乙酸(0.023ml,0.233mmol)和hatu(169mg,4.44mmol)的混合物(预先溶解于1ml干燥n,n
‑
二甲基甲酰胺中反应10分钟),反应混合液继续于0℃下搅拌反应1小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(48.9mg,52%)。
[1503]1h nmr(400mhz,meod
‑
d4)δ7.99(d,j=7.7hz,1h),7.56
‑
7.44(m,1h),7.40
‑
7.19(m,1h),7.13
‑
7.03(m,1h),6.55(d,j=4.7hz,1h),6.33(t,j=53.6hz,1h),4.57(s,2h),4.46
‑
4.40(m,1h),2.18(d,j=33.6hz,3h),2.09
‑
1.75(m,6h),1.56(t,j=12.1hz,2h).
[1504]
ms m/z(esi):428.1[m+h]
+
.
[1505]
实施例135
[1506]
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)
‑
n2
‑
((3
‑
exo)
‑8‑
(吡啶
‑3‑
基磺酰)
‑8‑
氮杂二环[3.2.1]辛烷
‑3‑
基)喹唑啉
‑
2,4
‑
二胺
[1507][1508]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.222mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(10ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.73ml,4.44mmol)和3
‑
吡啶磺酰氯盐酸盐(50mg,0.233mmol),反应混合液继续于0℃下搅拌反应0.5小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(20.5mg,19%)。
[1509]1h nmr(400mhz,dmso
‑
d6)δ8.98(d,j=2.0hz,1h),8.76(dd,j=4.8,1.4hz,1h),8.27
‑
8.19(m,1h),8.14
‑
8.01(m,1h),7.60
‑
7.44(m,2h),7.29(ddd,j=15.0,9.9,4.2hz,1h),7.07(t,j=7.4hz,1h),6.58
‑
6.39(m,1h),4.30(dd,j=6.0,2.6hz,3h),2.17(s,3h),
2.08
‑
1.95(m,2h),1.74(dd,j=16.7,6.2hz,2h),1.64(dd,j=17.3,6.7hz,2h),1.43
‑
1.32(m,2h).
[1510]
ms m/z(esi):491.1[m+h]
+
.
[1511]
实施例136
[1512]
n2
‑
((3
‑
exo)
‑8‑
((2
‑
甲氧基乙基)磺酰)
‑8‑
氮杂二环[3.2.1]辛烷
‑3‑
基)
‑
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑
2,4
‑
二胺
[1513][1514]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.222mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(10ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(10ml)中,冷却至0℃,依次加入dipea(0.73ml,4.44mmol)和2
‑
甲氧基乙烷
‑1‑
磺酰氯(37mg,0.233mmol),反应混合液继续于0℃下搅拌反应2小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题化合物(25.1mg,43%)。
[1515]1h nmr(400mhz,dmso
‑
d6)δ8.31(s,1h),7.64(s,1h),7.41(s,1h),7.24(dd,j=23.8,8.5hz,1h),6.61(s,1h),4.49
‑
4.43(m,1h),4.26(s,2h),3.76(t,j=6.2hz,2h),3.43
‑
3.29(m,5h),2.32(s,3h),2.11
‑
1.86(m,6h),1.74(t,j=13.5hz,2h).
[1516]
ms m/z(esi):472.2[m+h]
+
.
[1517]
实施例137
[1518]
n2
‑
((3
‑
exo)
‑8‑
(2
‑
氟乙基)
‑8‑
氮杂二环[3.2.1]辛烷
‑3‑
基)
‑
n4
‑
(5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)喹唑啉
‑
2,4
‑
二胺
[1519][1520]
将叔
‑
丁基(3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(100mg,0.222mmol)溶解于4m hcl的1,4
‑
环氧六环溶液(10ml)中,室温搅拌反应30分钟。减压浓缩除去溶剂,残余物溶解于无水n,n
‑
二甲基甲酰胺(5ml)中,依次加入无水碳酸钾(184mg,1.33mmol)和1
‑
溴
‑2‑
氟乙烷(50mg,0.233mmol),反应混合液于40℃下搅拌反应19小时。减压浓缩除去溶剂,残余物经过反相hplc分离得标题
化合物(27.3mg,31%)。
[1521]1h nmr(400mhz,dmso
‑
d6)δ8.15(d,j=17.8hz,1h),7.56(s,1h),7.35(d,j=44.5hz,1h),7.11(s,1h),6.71(s,1h),4.64
‑
4.45(m,2h),4.33
‑
4.19(m,1h),3.35(s,2h),2.91
‑
2.68(m,2h),2.32(s,3h),2.11
‑
1.56(m,8h).
[1522]
ms m/z(esi):396.2[m+h]
+
.
[1523]
实施例138
[1524]3‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈
[1525][1526]
第一步:(3
‑
((2,7
‑
二氯喹唑啉
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇的制备
[1527][1528]
将2,4,7
‑
三氯喹唑啉(300mg,1.29mmol)、(3
‑
氨基
‑
1h
‑
吡唑
‑5‑
基)甲醇(180mg,1.55mmol)、dipea(500mg,3.87mmol)加入1,4
‑
二氧六环(5ml)中,均匀混合后在室温条件下反应过夜。减压浓缩,所得粗品中加入甲醇(5ml),过滤,固体干燥得到标题化合物为白色固体(350mg,87%)
[1529]
ms m/z(esi):310.0[m+h]
+
.
[1530]
第二步:叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯的制备
[1531]
[1532]
将(3
‑
((2,7
‑
二氯喹唑啉
‑4‑
基)氨基)
‑
1h
‑
吡唑
‑5‑
基)甲醇(150mg,0.49mmol)、叔
‑
丁基(3
‑
exo)
‑3‑
(甲基氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
羧酸酯(150mg,0.58mmol)、dipea(190mg,1.47mmol)加入正丁醇(2ml)中,混匀后于微波150℃条件下反应10小时,冷却至室温,反应液减压浓缩,所得粗品用快速硅胶柱层析分离纯化得到目标产物为白色固体(140mg,55%)。
[1533]
ms m/z(esi):528.2[m+h]
+
.
[1534]
第三步:3
‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑9‑
氮杂二环[3.3.1]壬烷
‑9‑
基)丙腈的制备
[1535][1536]
向叔
‑
丁基(3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸酯(140mg,0.27mmol)的甲醇(10ml)溶液中,缓慢滴加盐酸二氧六环(4n,2ml),室温反应2小时,反应液减压浓缩,将所得粗品溶于甲醇(15ml)中,在室温条件下,分别加入dipea(0.5ml),丙烯腈(25mg,0.46mmol),室温反应1小时。反应液减压浓缩,用prep
‑
hplc分离纯化得到标题化合物为白色固体(22mg,20%)。
[1537]1h nmr(400mhz,dmso
‑
d6)δ12.41(s,1h),10.02(s,1h),8.35(d,j=8.4hz,1h),7.28(s,1h),7.06(d,j=8.4hz,1h),6.52
‑
6.54(m,1h),5.53
‑
5.55(m,1h),5.25(s,1h),4.46(t,j=5.2hz,2h),3.31
‑
2.87(m,7h),2.66
‑
2.59(m,2h),2.08
‑
1.87(m,5h),1.60
‑
1.41(m,5h).
[1538]
ms m/z(esi):481.2[m+h]
+
.
[1539]
实施例139
[1540]3‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈
[1541][1542]3‑
((3
‑
exo)
‑3‑
((7
‑
氯
‑4‑
((5
‑
(羟甲基)
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)(甲基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的制备参照实施例138。
[1543]
h nmr(400mhz,dmso
‑
d6)δ12.45(s,1h),10.08(d,j=8.8hz,1h),8.36(d,j=8.8hz,1h),7.29(s,1h),7.07(d,j=8.8hz,1h),6.62
‑
6.54(m,1h),5.27
‑
5.11(m,2h),4.50(d,j=5.6hz,2h),3.31
‑
2.27(m,2h),2.94(d,j=16.0hz,3h),2.67
‑
2.58(m,4h),1.92
‑
1.81(m,4h),1.71
‑
1.62(m,2h),1.39
‑
1.23(m,2h).
[1544]
ms m/z(esi):467.2[m+h]
+
.
[1545]
实施例140
[1546]3‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈
[1547][1548]3‑
(4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)哌啶
‑1‑
基)丙腈的制备参照实施例68。
[1549]1h nmr(400mhz,cd3od:cdcl3,v/v=1:1)δ8.03(d,j=8.1hz,1h),7.59(d,j=7.9hz,1h),7.44(s,1h),7.20(t,j=7.4hz,1h),6.63(s,1h),5.92(s,1h),4.01
‑
3.87(m,1h),2.98(d,j=11.6hz,2h),2.77(t,j=6.9hz,2h),2.64(t,j=6.9hz,2h),2.45
‑
2.22(m,5h),2.19
‑
2.07(m,2h),1.65(td,j=14.0,3.4hz,2h).
[1550]
ms m/z(esi):377.1[m+h]
+
.
[1551]
实施例141
[1552]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈
[1553][1554]1‑
((4
‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)哌啶
‑1‑
基)磺酰)吖丁啶
‑3‑
甲腈的制备参照实施例122。
[1555]1h nmr(400mhz,cd3od:cdcl3,v/v=1:1)δ8.04(d,j=8.1hz,1h),7.65
‑
7.59(m,1h),7.45(d,j=8.2hz,1h),7.22(t,j=7.5hz,1h),6.31(s,1h),4.17(t,j=8.3hz,2h),4.12
‑
4.01(m,3h),3.74(d,j=12.7hz,2h),3.61(ddd,j=15.1,8.7,6.4hz,1h),3.06(t,j=11.3hz,2h),2.32(s,3h),2.21
‑
2.11(m,2h),1.64(td,j=13.6,3.3hz,2h).
[1556]
ms m/z(esi):468.1[m+h]
+
.
[1557]
实施例142
[1558]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈
[1559][1560]3‑
(endo
‑6‑
((4
‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑3‑
氮杂二环[3.1.0]己烷
‑3‑
基)丙腈的制备参照实施例79。
[1561]
ms m/z(esi):375.2[m+h]
+
.
[1562]
二、生物学测试评价
[1563]
以下结合测试例进一步描述解释本发明,但这些实施例并非意味着限制本发明的范围。
[1564]
测试例1、本发明化合物对jak激酶活性抑制作用的测定
[1565]
实验目的:该测试例的目的是测试化合物对jak激酶活性抑制的活性。
[1566]
实验仪器:离心机(5702r)购自eppendorf公司,移液器购自eppendorf或rainin公司,酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪。
[1567]
实验方法:本实验采用荧光共振能量转移(tr
‑
fret)的方法测试化合物对jak激酶活性的抑制作用,并得出化合物对jak激酶活性的半数抑制浓度ic
50
。
[1568]
具体实验操作如下:
[1569]
激酶反应在白色384孔板(perkinelmer)中进行,每孔加入1
‑
5μl用dmso和ddh2o稀释的不同浓度的化合物,阳性对照孔加入1
‑
5μl相应溶媒,然后每孔加入1
‑
5μl用激酶缓冲液(hepes 50
‑
250mm,mgcl
2 5
‑
20mm等)稀释的0.1
‑
20nm jak激酶溶液,阴性对照孔加入1
‑
5μl的激酶缓冲液,加入1~5ul包含多肽底物和atp的底物混合液,室温孵育0.5~5小时,加入10ul edta和含标记抗体的检测液,室温孵育1~24小时,用biotek synergy h1酶标仪测定各板孔的约620nm和665nm荧光信号值,通过荧光信号值计算抑制率。根据不同浓度的抑制率通过曲线拟合得出化合物的ic
50
。
[1570]
实验数据处理方法:
[1571]
通过于板上阳性对照孔(dmso对照孔)和阴性对照孔(不添加激酶)计算使用化合物处理的孔的百分比抑制数据{%抑制率=100
‑
[(测试化合物值
‑
阴性对照值)]/(阳性对照值
‑
阴性对照值)
×
100}。使用graphpad prism拟合不同浓度和相应百分比抑制率数据至4参数非线性逻辑公式计算出ic
50
值。
[1572]
实验结论:
[1573]
通过以上方案得出本发明所示的实施例化合物在jak1/2/3/tyk2激酶活性试验中显示出如下表1的生物活性。
[1574]
表1
[1575]
[1576]
[1577]
[1578]
[1579][1580]
由上表可知:以上实施例化合物都能显著抑制jak1/2/3/tyk2激酶的酶学活性,部分化合物对jak1/2/3/tyk2激酶表现出强效的抑制作用(na表示未检测)。
[1581]
测试例2、本发明化合物对细胞jak
‑
stat信号通路抑制作用的测定
[1582]
实验目的:
[1583]
该测试例的目的是测试化合物对细胞jak
‑
stat信号通路抑制的活性。
[1584]
实验仪器:
[1585]
微孔板振荡器(88880024)购自thermo scientific
tm
公司
[1586]
离心机(5702r)购自eppendorf公司
[1587]
移液器购自eppendorf公司
[1588]
酶标仪购自美国biotek公司,型号为synergyh1全功能酶标仪。
[1589]
实验方法:
[1590]
本实验采用u266细胞系,通过inf
‑
α刺激激活jak
‑
stat信号通路,检测化合物对其下游stat3磷酸化的抑制活性,并得出化合物对jak
‑
stat信号通路活性的半数抑制浓度ic
50
。
[1591]
具体实验操作如下:
[1592]
384孔检测板中铺入u266细3
‑
12μl,每孔细胞个数为100
‑
300k,加入2μl梯度稀释好的化合物溶液,室温350rpm震荡孵育2小时。2小时后加入2μlinf
‑
α,inf
‑
α终浓度1000u/ml,室温震荡15分钟。加入2
‑
5μl(5x)lance ultra lysis buffer 2溶液,室温震荡2小时。2小时后加入5μl终浓度为0.5nm的lance ultra eu
‑
labeled anti
‑
stat3 antibody(perkinelmer)和终浓度为5nm的lance ultra ulight
‑
labeled anti
‑
stat3 antibody(perkinelmer)溶液,室温孵育过夜。酶标仪测定各板孔的665nm荧光信号值,通过荧光信号值计算抑制率,根据不同浓度的抑制率通过曲线拟合得出化合物的ic
50
。
[1593]
实验数据处理方法:
[1594]
通过于板上阳性对照孔(dmso对照孔)和阴性对照孔(不加细胞)计算使用化合物处理的孔的百分比抑制数据{%抑制率=100
‑
[(测试化合物值
‑
阴性对照值)]/(阳性对照值
‑
阴性对照值)
×
100}。使用graphpad prism拟合不同浓度和相应百分比抑制率数据至4参数非线性逻辑公式计算出ic
50
值。
[1595]
实验结论:
[1596]
通过以上方案得出本发明所示的实施例化合物对u266细胞jak
‑
stat信号通路活性中显示出如下表2的生物活性。
[1597]
表2
[1598]
[1599][1600]
由上表可知:以上实施例化合物对人骨髓瘤细胞u266的jak
‑
stat信号通路活性具有明显的抑制作用。
[1601]
测试3、balb/c小鼠药代动力学测定
[1602]
1.研究目的:
[1603]
以balb/c小鼠为受试动物,研究化合物实施例1、实施例8、实施例9、实施例15、实施例17、实施例18、实施例28、实施例31、实施例33、实施例34、实施例38、实施例48、实施例49、实施例59、实施例67、实施例68、实施例80、实施例81、实施例82、实施例88、实施例100、实施例122、和实施例123,在5mg/kg剂量下口服给药后小鼠体内(血浆和结肠、回肠组织)的药代动力学行为,通过分析结肠和回肠的药物浓度,以及结肠/回肠药物浓度、结肠/血浆药物浓度比值,筛选pk优异的化合物用于下一步研究。
[1604]
2.试验方案
[1605]
2.1试验药品:
[1606]
本发明实施例1、实施例8、实施例9、实施例15、实施例17、实施例18、实施例28、实施例31、实施例33、实施例34、实施例38、实施例48、实施例49、实施例59、实施例67、实施例
68、实施例80、实施例81、实施例82、实施例88、实施例100、实施例122、和实施例123,自制。
[1607]
2.2试验动物:
[1608]
balb/c mouse每组12只,雄性,上海杰思捷实验动物有限公司,动物生产许可证号(scxk(沪)2013
‑
0006n0.311620400001794)。
[1609]
2.3给药:
[1610]
balb/c小鼠每组12只,雄性;禁食一夜后分别p.o.,剂量为5mg/kg,给药体积10ml/kg。
[1611]
2.4样品采集:
[1612]
小鼠给药前和给药后,在0、0.5、1、2、3、5和7小时,采用co2处死,心脏采血0.2ml,置于edta
‑
k2试管中,4℃6000rpm离心6分钟分离血浆,于
‑
80℃保存;回肠取靠近盲肠端,长度约4
‑
5cm;结肠同样取靠近盲肠端,长度约2
‑
3cm,取出称重后,置于2ml离心管中,于
‑
80℃保存。
[1613]
2.5样品处理:
[1614]
1)血浆样品40ul加入160ul乙腈沉淀,混合后3500
×
g离心5~20分钟。
[1615]
2)血浆和肠匀浆样品30μl加入90μl含内标(100ng/ml)乙腈沉淀,混合后13000rpm离心8分钟。
[1616]
3)取处理后上清溶液70ul加入70μl水,涡旋混合10分钟,随后取20μl进行lc/ms/ms分析待测化合物的浓度,lc/ms/ms分析仪器:absciex api 4000qtrap。
[1617]
2.6液相分析
[1618]
·
液相条件:shimadzu lc
‑
20ad泵
[1619]
·
色谱柱:agilent zorbax xdb
‑
c18(50
×
2.1mm,3.5μm)移动相:
[1620]
a液为0.1%甲酸水溶液,b液为乙腈
[1621]
·
流速:0.4ml/min
[1622]
·
洗脱时间:0
‑
4.0分钟,洗脱液如下:
[1623][1624][1625]
3.试验结果与分析
[1626]
药代动力学主要参数用winnonlin 6.1计算得到,小鼠药代实验结果见表3:
[1627]
表3
[1628]
[1629]
[1630][1631]
na表示未检出或未检测(血药浓度的检测定量限为1ng/ml,当血液检测中c
max
为na时,血液检测指标中的na是指未检出;当血液检测中c
max
高于定量限1ng/ml时,血液检测指标中的na是指未检测;组织(结肠与回肠)中的na表示未检测)。
[1632]
实验结论:
[1633]
从表中小鼠药代动力学(pk)实验结果可以看出:本发明实施例化合物在结肠和回肠中表现出良好的暴露水平,血药浓度时间曲线下面积(auc)和最大血药浓度(c
max
)均达到筛选标准;并且化合物的结肠/回肠药物浓度、结肠/血浆药物浓度比值高,表现出良好的选择性。
[1634]
测试4、体内药效试验步骤及结果
[1635]
4.1实验目的:
[1636]
评价实施例化合物在dss(dextran sulfate sodium)诱导的c57bl/6小鼠结肠炎模型上的药效。
[1637]
4.2.实验主要材料
[1638]
4.2.1仪器
[1639]
1、天平mettler toledo al104
[1640]
2、天平tp
‑
602
[1641]
4.2.2试剂
[1642]
1、右旋糖酐硫酸钠(dss):mp biomedicals,llc,solon,ohio,货号:160110
[1643]
2、环孢素(csa):瑞士诺华公司,批号:s0033a
[1644]
3、羧甲基纤维素钠:国药集团化学试剂有限公司
[1645]
4、吐温80:sigma,货号:8cbm 513v
[1646]
4.2.3实验动物
[1647]
动物种属及品系:c57bl/6性别、年龄/体重:雌性,6
‑
8周龄/18
‑
20克供应商:上海斯莱克实验动物有限公司
[1648]
4.3.实验步骤
[1649]
4.3.1分组
[1650]
根据动物体重,在day
‑
1天,使用biobook软件对动物进行随机分组,以确保每组动物的体重值相似,以减少偏差,分组及给药方案见下表。
[1651]
分组及给药方案
[1652][1653]
a:溶媒为0.5%cmc
‑
na+1%tween 80
[1654]
b:间隔8小时
[1655]
4.3.2实验过程
[1656]
1、试剂配制
[1657]
含dss饮用水:将适量的dss粉末溶解于高压灭菌过的饮用水中,配置成2%dss溶液。
[1658]
2、肠炎诱导
[1659]
第
‑
1天,动物被平均分为12组,每组10只。(具体分组方案参照表1)
[1660]
第0天9:00开始到第6天9:00,第2组到第9组小鼠饮用含2%dss水溶液6天(从第0天到第6天),之后小鼠自由饮用正常用水3天(从第6天9:00到第9天剖检前)。将造模当天计为0天。dss水溶液用锡箔纸包裹,保证避光。每2天更换一次dss水溶液。
[1661]
第1组小鼠自由饮用正常用水9天(从第0天9:00到第9天剖检前)。
[1662]
3、给药
[1663]
具体的给药剂量,给药途径和给药时间参照上表。
[1664]
4.4测量
[1665]
1)体重
[1666]
记录频率为一天一次。
[1667]
2)日常疾病指数(dai)
[1668]
记录频率为一天一次,按照以下标准评为4个等级:
[1669]
体重变化(0,≤1%;1,1
‑
5%;2,5
‑
10%;3,10
‑
15%;4,>15%);
[1670]
血便(0,阴性;4,阳性);
[1671]
粪便评分(0,正常;2,稀便;4,腹泻)
[1672]
以上3部分的分数相加除以3得到日常疾病指数值(dai)。根据每天dai评分绘制dai
‑
时间(天)曲线,并计算曲线下峰面积(auc)。dai auc下降比例为给药组与vehicle组相比计算所得,计算公式为(dai auc
给药组
‑
dai auc
vehicle
)/dai auc
vehicle
×
100%
[1673]
4.5.实验结果:
[1674][1675][1676]
4.6.实验结论
[1677]
在dss诱导的c57bl/6小鼠结肠炎模型上,以上实施例化合物能显著降低日常疾病指数(dai),有明显药效。
[1678]
三、化合物盐及其晶型的研究
[1679]
1.实验仪器
[1680]
1.1物理化学检测仪器的一些参数
[1681][1682]
1.2仪器和液相分析条件
[1683]
1.2.1仪器与设备
[1684][1685][1686]
1.2.2色谱条件
[1687]
色谱柱:zorbax(sb
‑
c8,3.5μm,4.6*75mm)
[1688]
流速:1.5ml/min
[1689]
柱温:40℃
[1690]
检测波长:242nm
[1691]
进样体积:5.0μl
[1692]
运行时间:15min
[1693]
稀释剂:acn
‑
水(v/v,1:1)
[1694]
流动相:a:水(0.05%三氟乙酸);b:乙腈(0.05%三氟乙酸)
[1695]
t(min)a(%)b(%)0.009558.006040
12.00109012.1095515.00955
[1696]
2.化合物盐型筛选
[1697]
化合物盐型的制备方法如下:
[1698]
制备通式(i)所示化合物酸式盐的方法1,具体包括如下步骤:
[1699]
1)称取适量的自由碱,用良性溶剂溶解;
[1700]
2)称取适量的反离子酸,用有机溶剂溶解;
[1701]
3)把上述两种溶液合并,搅拌析出或滴加不良溶剂后搅拌析出;
[1702]
4)快速离心或静置吹干得目标产物;
[1703]
其中:
[1704]
所述的良性溶剂选自2
‑
丁醇、甲醇、异丙醇、2
‑
丁酮、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮;优选2
‑
丁醇、甲醇或二甲基亚砜中的一种或多种;
[1705]
所述的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈中的一种或多种;
[1706]
所述的不良溶剂选自庚烷、水、甲基叔丁基醚、环己烷、甲苯、异丙醚、乙酸乙酯、丙酮或乙腈中的一种或多种;优选水、甲基叔丁基醚或异丙醚中的一种或多种;
[1707]
所述的反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、帕莫酸、甲酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸、硬脂酸;更优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、富马酸、马尿酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、草酸或氢溴酸;进一步优选磷酸、马来酸或苯磺酸。
[1708]
制备通式(i)所示化合物酸式盐的方法2,具体包括如下步骤:
[1709]
1)称取适量的自由碱,用不良性溶剂混悬;
[1710]
2)称取适量的反离子酸,用有机溶剂溶解;
[1711]
3)将上述溶液加入上述混悬液中,搅拌;
[1712]
4)快速离心或静置吹干得到化合物的盐;
[1713]
其中:
[1714]
所述的不良性溶剂选自甲醇、丙酮、乙酸乙酯、乙腈、乙醇、88%丙酮、四氢呋喃、2
‑
甲基
‑
四氢呋喃、二氯甲烷、3
‑
戊酮、醋酸异丙酯、甲酸乙酯、1,4
‑
二氧六环、氯苯、苯、甲苯、异丙醇、正丁醇、异丁醇、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、正丙醇、叔丁醇或2
‑
丁酮;优选二氯甲烷、甲苯、乙腈、丙酮、甲醇或乙酸乙酯中的一种或多种;
[1715]
所述的有机溶剂选自甲醇、乙醇、乙酸乙酯、二氯甲烷、丙酮、正己烷、石油醚、苯、甲苯、氯仿、乙腈、四氯化碳、二氯乙烷、四氢呋喃、2
‑
甲基
‑
四氢呋喃、2
‑
丁酮、3
‑
戊酮、庚烷、甲基叔丁基醚、异丙醚、1,4
‑
二氧六环、叔丁醇或n,n
‑
二甲基甲酰胺;优选甲醇、乙醇或乙腈中的一种或多种;
[1716]
所述的反离子酸选自盐酸、硫酸、硝酸、氢溴酸、氢氟酸、氢碘酸、磷酸、2,5
‑
二羟基苯甲酸、1
‑
羟基
‑2‑
萘甲酸、醋酸、二氯醋酸、三氯醋酸、乙酰氧肟酸、己二酸、苯磺酸、4
‑
氯苯磺酸、苯甲酸、4
‑
乙酰氨基苯甲酸、4
‑
氨基苯甲酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环己烷氨基磺酸、樟脑磺酸、天门冬氨酸、樟脑酸、葡萄糖酸、葡糖醛酸、谷氨酸、异抗坏血酸、乳酸、苹果酸、扁桃酸、焦谷氨酸、酒石酸、十二烷基硫酸、二苯甲酰酒石酸、乙烷
‑
1,2
‑
二磺酸、乙磺酸、蚁酸、富马酸、半乳糖酸、龙胆酸、戊二酸、2
‑
酮戊二酸、乙醇酸、马尿酸、羟乙基磺酸、乳糖酸、抗坏血酸、天冬氨酸、月桂酸、樟脑酸、马来酸、丙二酸、甲磺酸、1,5
‑
萘二磺酸、萘
‑2‑
磺酸、烟酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、丙酸、水杨酸、4
‑
氨基水杨酸、癸二酸、硬脂酸、丁二酸、硫氰酸、帕莫酸、甲酸、十一碳烯酸、三氟乙酸、苯磺酸、对甲基苯磺酸或l
‑
苹果酸;优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、对甲苯磺酸、氢溴酸、草酸、富马酸、甲酸、马尿酸、月桂酸、硬脂酸;更优选磷酸、丁二酸、醋酸、乙烷磺酸、苯甲酸、帕莫酸、丙二酸、对甲苯磺酸、苹果酸、盐酸、马来酸、苯磺酸、富马酸、马尿酸、羟乙基磺酸、1,5
‑
萘二磺酸、酒石酸、己二酸、硫酸、草酸或氢溴酸;进一步优选磷酸、马来酸或苯磺酸。
[1717]
2.1化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的盐型筛选
[1718]
2.1.1实验目的:
[1719]
选择不同的反离子酸,检测哪些反离子酸可以形成化合物盐。
[1720]
2.1.2实验步骤:
[1721]
1)仪器和设备
[1722]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1723]
2)操作程序
[1724]
以甲醇为溶剂溶析或混悬成盐:
[1725]
称取自由碱10mg,加甲醇溶剂200μl,50℃加热搅拌,分别加入不同的反离子酸(碱:酸=1:1.2的摩尔反应比,其中不同的反离子酸在加入之前分别用如下的有机溶液溶
解),搅拌进行反应,反应完成后若有固体析出直接快速离心或静置吹干得到化合物的盐,如果没有固体析出,向反应溶液中加入反溶剂搅拌析出后快速离心或静置吹干得到化合物的盐,结果如下:
[1726]
序号酸加酸后现象结果11.0m苯磺酸(甲醇溶液)溶清后析出成盐21.0m硫酸(乙醇溶液)溶清后析出成盐30.5m d
‑
酒石酸(乙醇溶液)溶清后析出成盐41.0m对甲基苯磺酸(乙醇溶液)溶清后析出成盐50.25m富马酸(乙醇溶液)混悬成盐61.0m草酸(乙醇溶液)溶清加反溶剂mtbe成油后逐渐混悬成盐71.0m氢溴酸(乙醇溶液)溶清后析出成盐81.0m柠檬酸(乙醇溶液)溶清,挥干或加异丙醚、mtbe均成油n/a91.0m马来酸(甲醇溶液)溶清后析出成盐101.0m丁二酸(甲醇溶液)未完全溶清,加异丙醚析出成盐111.0m丙二酸(乙醇溶液)混悬未成盐121.0m醋酸(甲醇溶液)混悬未成盐131.0m己二酸(甲醇溶液)混悬成盐141.0m羟乙基磺酸(甲醇溶液)溶清后析出成盐151.0m苯甲酸(甲醇溶液)混悬成盐
[1727]
2.1.3实验结果
[1728]
盐型筛选实验,能够与化合物自由碱成盐的盐型为马来酸盐、苯磺酸盐、硫酸盐、羟乙基磺酸盐、己二酸盐、对甲苯磺酸盐、富马酸盐、草酸盐、氢溴酸盐、1,5
‑
萘二磺酸盐和酒石酸盐。
[1729]
2.2化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐型筛选
[1730]
2.2.1实验目的:
[1731]
选择不同的反离子酸,检测哪些反离子酸可以形成化合物盐。
[1732]
2.2.2实验步骤:
[1733]
1)仪器和设备
[1734]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1735]
2)操作程序
[1736]
以甲醇为溶剂自然挥干法成盐:
[1737]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的溶液,作为贮备液。取0.5ml或1ml贮备液,分别加入不同的反离子酸溶液(碱:酸=1:1.2的摩尔反应比或碱:酸=1:2.2的摩尔反应比),进行反应,然后室温敞口挥发溶剂,结果如下:
[1738][1739][1740]
2.2.3实验结果
[1741]
盐型筛选实验,得到能与化合物成盐的盐型为磷酸盐、丁二酸盐、醋酸盐、盐酸盐、苯磺酸盐、氢溴酸盐、草酸盐、己二酸盐、乙烷磺酸盐、苯甲酸盐、1,5
‑
萘二磺酸盐、帕莫酸
盐、马尿酸盐、硫酸盐、丙二酸盐、对甲苯磺酸盐、马来酸盐、苹果酸盐、酒石酸盐和富马酸盐。
[1742]
3.化合物盐晶型筛选
[1743]
3.1化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的盐晶型筛选
[1744]
3.1.1实验目的:
[1745]
选择不同的反离子酸,通过合适的结晶方法,检测哪些反离子酸可以形成化合物盐。
[1746]
3.1.2实验步骤:
[1747]
3)仪器和设备
[1748]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1749]
4)操作程序
[1750]
i、以甲醇为溶剂自然挥干法成盐结晶
[1751]
称取自由碱10mg,加甲醇溶剂200μl,分别加入不同的反离子酸(碱:酸=1:1.2的摩尔反应比)进行反应,然后室温敞口挥发溶剂,无定型或晶型差的,各加200μl乙酸乙酯打浆。结果如下:
[1752][1753][1754]
ii、以不同溶剂溶析或混悬成盐结晶
[1755][1756]
iii、以不同溶剂打浆
[1757]
取以甲醇为溶剂得到的不同盐型的晶型固体10mg,分别加入200μl有机溶剂,50℃打浆。结果如下:
[1758]
[1759]
3.1.3实验结果
[1760]
盐晶型型筛选实验,得到有晶型的盐型为马来酸盐、苯磺酸盐、硫酸盐、羟乙基磺酸盐、己二酸盐、对甲苯磺酸盐、富马酸盐、草酸盐、氢溴酸盐、1,5
‑
萘二磺酸盐、酒石酸盐,其中马来酸、苯磺酸、硫酸、羟乙基磺酸、己二酸结晶度和晶型个数均较好,比较有优势。
[1761]
3.2化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐晶型筛选
[1762]
3.2.1实验目的:
[1763]
选择不同的反离子酸,通过合适的结晶方法,检测哪些反离子酸可以形成化合物盐。
[1764]
3.2.2实验步骤:
[1765]
1)仪器和设备
[1766]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1767]
2)操作程序
[1768]
i、以不同溶剂溶析或混悬成盐结晶
[1769]
称取自由碱10mg或20mg,以不同溶剂为反应溶剂,分别加入不同的反离子酸溶液(碱:酸=1:1.2的摩尔反应比或碱:酸=1:2.2的摩尔反应比),进行反应,结果如下:
[1770]
[1771][1772]
3.2.3实验结果
[1773]
盐晶型筛选实验,得到有晶型的盐型为磷酸盐、丁二酸盐、醋酸盐、盐酸盐、苯磺酸盐、氢溴酸盐、草酸盐、己二酸盐、乙烷磺酸盐、苯甲酸盐、1,5
‑
萘二磺酸盐、帕莫酸盐、马尿酸盐、硫酸盐、丙二酸盐、对甲苯磺酸盐、马来酸盐、苹果酸盐、酒石酸盐、富马酸盐,其中磷酸盐、丁二酸盐和醋酸盐比较有优势。
[1774]
3.3化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的盐晶型筛选
[1775]
3.3.1实验目的:
[1776]
根据盐型筛选的结果,选择合适的结晶方法,筛选盐的不同晶型。
[1777]
3.3.2实验步骤:
[1778]
1)仪器和设备
[1779]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1780]
2)操作程序
[1781]
i、苯磺酸盐晶型a的制备
[1782]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,溶清后析出大量固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型a。经检测分析,其有如下如图1所示的xrpd图、如图2所示的dsc图及如图3所示的tga图。
[1783]
ii、苯磺酸盐晶型b的制备
[1784]
称取10mg自由碱,加入200μl丙酮,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,成油室温搅拌后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型b。经检测分析,其有如下如图4所示的xrpd图。
[1785]
iii、苯磺酸盐晶型c的制备
[1786]
称取10mg自由碱,加入200μl二氯甲烷,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,不溶室温搅拌2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型c。经检测分析,其有如下如图5所示的xrpd图、如图6所示的dsc图及如图7所示的tga图。
[1787]
iv、苯磺酸盐晶型d的制备
[1788]
称取10mg自由碱,加入200μl乙醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,不溶室温搅拌2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型d。经检测分析,其有如下如图8所示的xrpd图。
[1789]
v、苯磺酸盐晶型e的制备
[1790]
称取10mg自由碱,加入200μl乙腈,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,成油室温搅拌后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型e。经检测分析,其有如下如图9所示的xrpd图、如图10所示的dsc图及如图11所示的tga图。
[1791]
vi、苯磺酸盐晶型f的制备
[1792]
称取10mg自由碱,加入200μl氯苯,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,溶清后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型f。经检测分析,其有如下如图12所示的xrpd图。
[1793]
vii、苯磺酸盐晶型g的制备
[1794]
称取10mg自由碱,加入200μl 3
‑
戊酮,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,成油后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型g。经检测分析,其有如下如图13所示的xrpd图。
[1795]
viii、苯磺酸盐晶型h的制备
[1796]
称取10mg自由碱,加入200μl88%丙酮,50℃加热搅拌,向体系中缓慢加入28μl1.0m苯磺酸盐的甲醇溶液,溶清后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到苯磺酸盐晶型h。经检测分析,其有如下如图14所示的xrpd图。
[1797]
ix、硫酸盐晶型a的制备
[1798]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m硫酸的乙醇溶液,溶清后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到硫酸盐晶型a。经检测分析,其有如下如图15所示的xrpd图、如图16所示的dsc图及如图17所示的tga图。
[1799]
x、羟乙基磺酸盐晶型a的制备
[1800]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m羟乙基磺酸的甲醇溶液,溶清后析出固体,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到羟乙基磺酸盐晶型a。经检测分析,其有如下如图18所示的xrpd图、如图19所示的dsc图及如图20所示的tga图。
[1801]
xi、羟乙基磺酸盐晶型b的制备
[1802]
称取10mg自由碱,加入200μl乙酸乙酯,50℃加热搅拌,向体系中缓慢加入28μl1.0m羟乙基磺酸的甲醇溶液,不溶搅拌过夜,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到羟乙基磺酸盐晶型b。经检测分析,其有如下如图21所示的xrpd图、如图21所示的dsc图及如图23所示的tga图。
[1803]
xii、羟乙基磺酸盐晶型c的制备
[1804]
称取10mg自由碱,加入200μl四氢呋喃,50℃加热搅拌,向体系中缓慢加入28μl1.0m羟乙基磺酸的甲醇溶液,不溶搅拌过夜,离心去除上清液,剩余固体放入50℃真空干
燥箱中烘干至恒重,得到羟乙基磺酸盐晶型c。经检测分析,其有如下如图24所示的xrpd图、如图25所示的dsc图。
[1805]
xiii、己二酸盐晶型a的制备
[1806]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m己二酸的甲醇溶液,溶清后析出,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到己二酸盐晶型a。经检测分析,其有如下如图26所示的xrpd图、如图27所示的dsc图及如图28所示的tga图。
[1807]
xiv、己二酸盐晶型b的制备
[1808]
称取10mg自由碱,加入200μl乙酸乙酯,50℃加热搅拌,向体系中缓慢加入28μl1.0m己二酸的甲醇溶液,不溶搅拌过夜,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到己二酸盐晶型b。经检测分析,其有如下如图29所示的xrpd图、如图30所示的dsc图及如图31所示的tga图。
[1809]
xv、对甲苯磺酸盐晶型a的制备
[1810]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m己二酸的甲醇溶液,溶清后析出,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到对甲苯磺酸盐晶型a。经检测分析,其有如下如图32所示的xrpd图、如图33所示的dsc图及如图34所示的tga图。
[1811]
xvi、对甲苯磺酸盐晶型b的制备
[1812]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m己二酸的甲醇溶液,溶清降温后析出,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到对甲苯磺酸盐晶型b。经检测分析,其有如下如图35所示的xrpd图、如图36所示的dsc图及如图37所示的tga图。
[1813]
xvii、富马酸盐晶型a的制备
[1814]
称取100mg自由碱,加入2ml甲醇,50℃加热搅拌,向体系中缓慢加入1120μl 0.25m富马酸的乙醇溶液,不溶室温搅拌过夜,过滤,固体50℃真空干燥箱中烘干至恒重,得到富马酸盐晶型a。经检测分析,其有如下如图38所示的xrpd图、如图39所示的dsc图及如图40所示的tga图。
[1815]
xviii、富马酸盐晶型b的制备
[1816]
称取10mg富马酸盐晶型a,加入200μl甲醇,50℃打浆1天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到富马酸盐晶型b。经检测分析,其有如下如图41所示的xrpd图、如图42所示的dsc图。
[1817]
xix、富马酸盐晶型c的制备
[1818]
称取10mg富马酸盐晶型a,加入200μl丙酮,50℃打浆1天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到富马酸盐晶型c。经检测分析,其有如下如图43所示的xrpd图。
[1819]
xx、草酸盐晶型a的制备
[1820]
称取100mg自由碱,加入2ml甲醇,50℃加热搅拌,向体系中缓慢加入280μl1.0m草酸的乙醇溶液,不溶继续搅拌过夜,过滤,固体放入50℃真空干燥箱中烘干至恒重,得到草酸盐晶型a。经检测分析,其有如下如图44所示的xrpd图、如图45所示的dsc图及如图46所示
的tga图。
[1821]
xxi、氢溴酸盐晶型a的制备
[1822]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1.0m氢溴酸的乙醇溶液,溶清后析出,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到氢溴酸盐晶型a。经检测分析,其有如下如图47所示的xrpd图、如图48所示的dsc图及如图49所示的tga图。
[1823]
xxii、1,5
‑
萘二磺酸盐晶型b的制备
[1824]
称取10mg自由碱,加入200μl乙醇,50℃加热搅拌,向体系中缓慢加入224μl0.125m 1,5
‑
萘二磺酸的乙醇溶液,不溶继续搅拌过夜,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到1,5
‑
萘二磺酸盐晶型b。经检测分析,其有如下如图50所示的xrpd图。
[1825]
xxiii、1,5
‑
萘二磺酸盐晶型c的制备
[1826]
称取10mg自由碱,加入200μl异丙醇,50℃加热搅拌,向体系中缓慢加入224μl0.125m 1,5
‑
萘二磺酸的乙醇溶液,不溶继续搅拌过夜,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到1,5
‑
萘二磺酸盐晶型c。经检测分析,其有如下如图51所示的xrpd图、如图52所示的dsc图及如图53所示的tga图。
[1827]
xxiv、1,5
‑
萘二磺酸盐晶型d的制备
[1828]
称取10mg的1,5
‑
萘二磺酸盐晶型a,加入200μl水,50℃打浆1天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到1,5
‑
萘二磺酸盐晶型d。经检测分析,其有如下如图54所示的xrpd图、如图55所示的dsc图及如图56所示的tga图。
[1829]
xxv、酒石酸盐晶型a的制备
[1830]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入56μl0.5m酒石酸的乙醇溶液,溶清后析出,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到酒石酸盐晶型a。经检测分析,其有如下如图57所示的xrpd图、如图58所示的dsc图及如图59所示的tga图。
[1831]
xxvi、甲酸盐晶型a的制备
[1832]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1m甲酸的甲醇溶液,溶清后室温挥干,加200μl乙酸乙酯50℃打浆2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到甲酸盐晶型a。经检测分析,其有如下如图60所示的xrpd图。
[1833]
xxvii、马尿酸盐晶型a的制备
[1834]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入140μl0.2m马尿酸的乙醇溶液,溶清后室温挥干,加200μl乙酸乙酯50℃打浆2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到马尿酸盐晶型a。经检测分析,其有如下如图61所示的xrpd图。
[1835]
xxviii、月桂酸盐晶型a的制备
[1836]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入28μl1m月桂酸的甲醇溶液,不溶室温挥干,加200μl乙酸乙酯50℃打浆2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到月桂酸盐晶型a。经检测分析,其有如下如图62所
示的xrpd图、如图63所示的dsc图及如图64所示的tga图。
[1837]
xxix、硬脂酸盐晶型a的制备
[1838]
称取10mg自由碱,加入200μl甲醇,50℃加热搅拌,向体系中缓慢加入187μl0.15m硬脂酸的乙醇溶液,不溶室温挥干,加200μl乙酸乙酯50℃打浆2天,离心去除上清液,剩余固体放入50℃真空干燥箱中烘干至恒重,得到硬脂酸盐晶型a。经检测分析,其有如下如图65所示的xrpd图。
[1839]
xxx、自由碱晶型a的制备
[1840]
称取1000mg化合物自由碱的盐酸盐到40ml的玻璃瓶中,加入7ml甲醇,50℃加热搅拌,加1m hcl盐酸溶液使其溶清后过滤,加入1m naoh溶液至其有沉淀析出(ph10左右),室温搅拌过夜,过滤水洗,固体50℃真空干燥,得到自由碱晶型a。经检测分析,其有如下如图66所示的xrpd图。
[1841]
3.4化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐晶型筛选
[1842]
3.4.1实验目的:
[1843]
根据盐型筛选的结果,选择合适的结晶方法,筛选马来酸盐的不同晶型。3.4.2实验步骤:
[1844]
1)仪器和设备
[1845]
名称型号来源分析天平bsa224s
‑
cwsartorius超声波清洗仪sk5200lhc上海科导超声仪器移液枪eppendorf(50ml,1000μl)eppendorf
[1846]
2)操作程序
[1847]
i、丁二酸盐晶型a的制备
[1848]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取磷酸7.96mg,加入200μl甲醇,溶清后加入1ml贮备液,室温敞口挥干,真空干燥,得到丁二酸盐晶型a。经检测分析,其具有如图67所示的xrpd图。
[1849]
ii、丁二酸盐晶型b的制备
[1850]
称取10mg自由碱,加入1ml乙腈,40℃加热搅拌,向体系中缓慢加入24μl1.0m丁二酸的甲醇溶液,搅拌过夜,离心去除上清液,剩余固体真空干燥,得到丁二酸盐晶型b。经检测分析,其具有如图68所示的xrpd图、如图69所示的dsc图及如图70所示的tga图。
[1851]
iii、醋酸盐晶型a的制备
[1852]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取醋酸3.50mg,加入200μl甲醇,溶清后加入1ml贮备液,室温敞口挥干,真空干燥,得到醋酸盐晶型a。经检测分析,其具有如图71所示的xrpd图。
[1853]
iv、醋酸盐晶型b的制备
[1854]
称取醋酸盐晶型a固体适量,置高湿条件下放置过夜,干燥,得到醋酸盐晶型b。经检测分析,其具有如图72所示的xrpd图。
[1855]
v、醋酸盐晶型c的制备
[1856]
称取10mg自由碱,加入1ml乙腈,40℃加热搅拌,向体系中缓慢加入1.95mg醋酸溶
液,不溶搅拌过夜,离心去除上清液,剩余固体真空干燥,得到醋酸盐晶型c。经检测分析,其具有如图73所示的xrpd图。
[1857]
vi、醋酸盐晶型d的制备
[1858]
称取10mg自由碱,加入1ml甲苯,40℃加热搅拌,向体系中缓慢加入1.94mg醋酸溶液,不溶搅拌过夜,离心去除上清液,剩余固体真空干燥,得到醋酸盐晶型d。经检测分析,其具有如图74所示的xrpd图。
[1859]
vii、醋酸盐晶型e的制备
[1860]
称取10mg自由碱,加入1ml二氯甲烷,40℃加热搅拌,向体系中缓慢加入1.99mg醋酸溶液,不溶搅拌过夜,离心去除上清液,剩余固体真空干燥,得到醋酸盐晶型e。经检测分析,其具有如图75所示的xrpd图。
[1861]
viii、盐酸盐晶型a的制备
[1862]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取1ml贮备液,加入5.1μl盐酸溶液,室温敞口挥干,真空干燥,得到盐酸盐晶型a。经检测分析,其具有如图76所示的xrpd图。
[1863]
ix、盐酸盐晶型b的制备
[1864]
称取20mg自由碱,加1ml 2
‑
丁酮,30℃加热搅拌,向体系中缓慢加入16.5μl盐酸溶液,不溶搅拌过夜,离心去除上清液,剩余固体真空干燥,得到盐酸盐晶型c。经检测分析,其具有如图77所示的xrpd图。
[1865]
x、盐酸盐晶型c的制备
[1866]
称取20mg自由碱,加1ml甲醇,30℃加热搅拌,向体系中缓慢加入16.5μl盐酸溶液,不溶搅拌过夜,离心去除上清液,剩余固体真空干燥,得到盐酸盐晶型d。经检测分析,其具有如图78所示的xrpd图。
[1867]
xi、盐酸盐晶型d的制备
[1868]
称取盐酸盐晶型d固体适量,置高湿条件下放置过夜,干燥,得到盐酸盐晶型e。经检测分析,其具有如图79所示的xrpd图。
[1869]
xii、苯磺酸盐盐晶型a的制备
[1870]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入25μl1.0m苯磺酸的甲醇溶液,室温敞口挥干,真空干燥,得到苯磺酸盐盐晶型a。经检测分析,其具有如图80所示的xrpd图。
[1871]
xiii、氢溴酸盐晶型a的制备
[1872]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入25μl1.0m氢溴酸的乙醇溶液,室温敞口挥干,真空干燥,得到氢溴酸盐晶型a。经检测分析,其具有如图81所示的xrpd图。
[1873]
xiv、草酸盐晶型a的制备
[1874]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取草酸7.09mg,加入100μl甲醇,溶清后加入0.5ml贮备液,析出固体后室温敞口挥干,真空干燥,得到草酸盐晶型a。经检测分析,其具有如图82所示的xrpd图。
[1875]
xv、己二酸盐晶型a的制备
[1876]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入25
μl1.0m己二酸的甲醇溶液,室温敞口挥干,真空干燥,得到己二酸盐晶型a。经检测分析,其具有如图83所示的xrpd图。
[1877]
xvi、乙烷磺酸盐晶型a的制备
[1878]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入25μl1.0m乙烷磺酸的甲醇溶液,析出固体后室温敞口挥干,真空干燥,得到乙烷磺酸盐晶型a。经检测分析,其具有如图84所示的xrpd图。
[1879]
xvii、苯甲酸盐晶型a的制备
[1880]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入25μl1.0m苯甲酸的甲醇溶液,室温敞口挥干,真空干燥,得到苯甲酸盐晶型a。经检测分析,其具有如图85所示的xrpd图。
[1881]
xviii、1,5
‑
萘二磺酸盐晶型a的制备
[1882]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入204μl 0.125m1,5
‑
萘二磺酸的乙醇溶液,析出固体后室温敞口挥干,真空干燥,得到1,5
‑
萘二磺酸盐晶型a。经检测分析,其具有如图86所示的xrpd图。
[1883]
xix、帕莫酸盐晶型a的制备
[1884]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入204μl 0.125m帕莫酸的吡啶溶液,析出固体后室温敞口挥干,真空干燥,得到帕莫酸盐晶型a。经检测分析,其具有如图87所示的xrpd图。
[1885]
xx、马尿酸盐晶型a的制备
[1886]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取0.5ml贮备液,加入127μl 0.2m马尿酸的乙醇溶液,析出固体后室温敞口挥干,真空干燥,得到马尿酸盐晶型a。经检测分析,其具有如图88所示的xrpd图。
[1887]
xxi、硫酸盐晶型a的制备
[1888]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取贮备液1ml,加入51μl硫酸溶液,析出固体后室温敞口挥干,真空干燥,得到硫酸盐晶型a。经检测分析,其具有如图89所示的xrpd图。
[1889]
xxii、硫酸盐晶型b的制备
[1890]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;取贮备液0.5ml,加入51μl硫酸溶液,析出固体后室温敞口挥干,真空干燥,得到硫酸盐晶型b。经检测分析,其具有如图90所示的xrpd图。
[1891]
xxiii、丙二酸盐晶型a的制备
[1892]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取丙二酸6.54mg,加入200μl甲醇,溶清后加入1ml贮备液,室温敞口挥干,真空干燥,得到丙二酸盐晶型a。经检测分析,其具有如图91所示的xrpd图。
[1893]
xxiv、对甲苯磺酸盐晶型a的制备
[1894]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取对甲苯磺酸10.09mg,加入200μl甲醇,溶清后加入1ml贮备液,室温敞口挥干,真空干燥,得到对甲苯磺酸盐晶型a。经检测分析,其具有如图92所示的xrpd图。
[1895]
xxv、马来酸盐晶型a的制备
[1896]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取马来酸6.09mg,加入200μl甲醇,溶清后加入1ml贮备液,室温敞口挥干,真空干燥,得到马来酸盐晶型a。经检测分析,其具有如图93所示的xrpd图。
[1897]
xxvi、苹果酸盐晶型a的制备
[1898]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取苹果酸6.48mg,加入200μl甲醇,溶清后加入1ml贮备液,析出固体后室温敞口挥干,真空干燥,得到苹果酸盐晶型a。经检测分析,其具有如图94所示的xrpd图。
[1899]
xxvii、酒石酸盐晶型a的制备
[1900]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取酒石酸7.70mg,加入200μl甲醇,溶清后加入1ml贮备液,析出固体后室温敞口挥干,真空干燥,得到酒石酸盐晶型a。经检测分析,其具有如图95所示的xrpd图。
[1901]
xxviii、富马酸盐晶型a的制备
[1902]
称取自由碱适量,加甲醇配制成浓度为20mg/ml的贮备液;称取富马酸6.16mg,加入200μl甲醇,溶清后加入1ml贮备液,析出固体后室温敞口挥干,真空干燥,得到富马酸盐晶型a。经检测分析,其具有如图96所示的xrpd图。
[1903]
xix、自由碱晶型a的制备
[1904]
称取9.4g(3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
羧酸叔丁酯溶解于甲醇(47ml)中,在温度10
‑
20℃下搅拌下加入4m hcl的1,4
‑
二氧六环(94ml),在20
‑
30℃下搅拌反应1
‑
2小时,反应完成后,过滤反应液,滤饼使用甲醇(20ml)洗涤,并将固体直接用于下一步反应,将固体溶于甲醇中(56ml),在温度为10
‑
20℃下,滴加dipea(10g,0.0784mol),滴加完毕后,调整反应液温度为20
‑
30℃,并滴加丙烯腈(3.1g,0.0588mol)至反应溶液中,在20
‑
30℃温度下反应2小时。将反应液过滤,滤饼用15ml甲醇洗涤,干燥后得式iv化合物白色固体(7.6g)。经检测分析,其有如下如图97所示的xrpd图。
[1905]
4.晶型的稳定性实验
[1906]
4.1实验目的:
[1907]
考察候选化合物的候选盐晶型在光照5000lx、高温60℃、高湿92.5%rh、高温高湿50℃75%rh条件下,化合物的物理化学稳定性,为盐型筛选与化合物盐贮存提供依据。
[1908]
4.2实验方案:
[1909]
取不同盐晶型约2mg,于光照5000lx、高温60℃、高湿92.5%rh、高温高湿50℃75%rh条件下,考察5天、10天,用hplc,外标法测定盐的含量,并采用色谱峰面积归一化法计算有关物质的变化。
[1910]
4.3实验结果:
[1911]
1)化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的盐晶型的物理化学稳定性结果:
[1912][1913]
稳定性结果表明,化合物不同盐的晶型的稳定性不同,富马酸盐晶型在高温、高温高湿条件下不稳定,后期需要在常温、干燥环境中保存。
[1914]
2)化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的盐晶型的物理化学稳定性结果:
[1915][1916]
稳定性结果表明,化合物成盐后晶型的稳定性不同,其中,丁二酸盐晶型b和醋酸盐晶型d的稳定性良好。
[1917]
4.4实验结论
[1918]
综合不同条件下的不同盐的不同晶型的稳定性,其中化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的羟乙基磺酸盐晶型a、羟乙基磺酸盐晶型b、己二酸盐晶型b在光照、高温、高温高湿条件下都比较稳定。化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型b和醋酸盐晶型d在光照、高温、高温高湿条件下都比较稳定。
[1919]
5引湿性实验
[1920]
5.1实验目的
[1921]
考察化合物不同盐晶型在不同相对湿度条件下的引湿性,为化合物盐晶型筛选与贮存提供依据。
[1922]
5.2实验方案:
[1923]
将化合物盐晶型置于不同相对湿度的饱和水蒸气中,使化合物与水蒸气达到动态平衡,并计算平衡后化合物吸湿增重的百分数。
[1924]
5.3实验结果:
[1925]
5.3.1化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的不同盐晶型的引湿性
[1926]
1)苯磺酸盐晶型a在rh80%条件下吸湿增重2.518%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,苯磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1927]
2)硫酸盐晶型a在rh80%条件下吸湿增重5.040%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,硫酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1928]
3)羟乙基磺酸盐晶型a经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,羟乙基磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1929]
4)己二酸盐晶型a在rh80%条件下吸湿增重0.942%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,己二酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1930]
5)己二酸盐晶型b在rh80%条件下吸湿增重1.521%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,己二酸盐晶型b的xrpd谱图未发生改变,即晶型未转变。
[1931]
6)对甲苯磺酸盐晶型a在rh80%条件下吸湿增重3.228%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,对甲苯磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1932]
7)草酸盐晶型a在rh80%条件下吸湿增重1.488%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,草酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1933]
8)氢溴酸盐晶型a在rh80%条件下吸湿增重2.421%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,氢溴酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1934]
4.3.2化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的不同盐的引湿性
[1935]
1)丁二酸盐晶型a在rh80%条件下吸湿增重10.770%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,丁二酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1936]
2)丁二酸盐晶型b在rh80%条件下吸湿增重0.829%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,丁二酸盐晶型b的xrpd谱图未发生改变,即晶型未转变。
[1937]
3)醋酸盐晶型a在rh80%条件下吸湿增重1.586%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,醋酸盐晶型a的xrpd谱图发生改变,即转变为醋酸盐晶
型b。
[1938]
4)醋酸盐晶型d在rh80%条件下吸湿增重1.911%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,醋酸盐晶型d的xrpd谱图未发生改变,即晶型未转变。
[1939]
5)苯磺酸盐晶型a在rh80%条件下吸湿增重2.450%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,苯磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1940]
6)草酸盐晶型a在rh80%条件下吸湿增重3.838%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,草酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1941]
7)帕莫酸盐晶型a在rh80%条件下吸湿增重6.004%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,帕莫酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1942]
8)苹果酸盐晶型a在rh80%条件下吸湿增重7.465%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,苹果酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1943]
9)对甲苯磺酸盐晶型a在rh80%条件下吸湿增重3.549%,有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,对甲苯磺酸盐晶型a的xrpd谱图未发生改变,即晶型未转变。
[1944]
10)盐酸盐晶型c在rh80%条件下吸湿增重1.620%,略有引湿性。且经0
‑
95%相对湿度条件下吸湿与解吸湿循环2次,盐酸盐晶型c的xrpd谱图未发生改变,即晶型未转变。
[1945]
5.4实验结论
[1946]
化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的己二酸盐晶型a、己二酸盐晶型b、草酸盐晶型a引湿性较小;化合物3
‑
((3
‑
exo)
‑3‑
((7
‑
甲氧基
‑4‑
((5
‑
甲基
‑
1h
‑
吡唑
‑3‑
基)氨基)喹唑啉
‑2‑
基)氨基)
‑8‑
氮杂二环[3.2.1]辛烷
‑8‑
基)丙腈的丁二酸盐晶型b、醋酸盐晶型a、醋酸盐晶型d和盐酸盐晶型c引湿性较小。
[1947]
6.不同介质中溶解度实验
[1948]
6.1实验目的
[1949]
比较化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的自由碱晶型a、化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型a在不同ph缓冲液、人工模拟胃液(fassgf)、禁食人工模拟肠液(fassif)、非禁食人工模拟肠液(fessif)、禁食人工模拟结肠液(fasscof)、非禁食人工模拟结肠液(fesscof)以及纯水等媒介中溶解度大小,为盐可成药性评估提供依据。6.2实验方案:
[1950]
将约1mg化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮自由碱晶型a及苯磺酸盐晶型a混悬到不同介质中6小时,用hplc,外标法测定化合物37℃下的热力学溶解度。
[1951]
6.3实验结果:
[1952]
化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮自由碱晶型a及苯磺酸盐晶型a的溶解度数据如下所示:
[1953][1954]
6.4实验结论
[1955]
结果表明化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮自由碱晶型a成苯磺酸盐晶型a后由于环境ph值改变,对其在水中的溶解度有一定提高作用。
[1956]
7.晶型热力学稳定实验
[1957]
7.1实验目的:
[1958]
通过多晶筛选及晶型竞争性试验,找到热力学比较稳定的盐晶型。
[1959]
7.2实验方案:
[1960]
选择有一定溶解度的有机溶剂、水,将化合物悬浮于溶剂体系中,分别室温和50℃搅拌打浆1周后,离心,弃掉上清液,固体在50℃条件真空干燥(
‑
0.1mpa)过夜后,测定固体的xrpd,并与原料化合物盐的xrpd比较。
[1961]
7.3实验结果:
[1962]
通过打浆,改变结晶溶剂、结晶方式等得到不同盐的不同晶型。根据晶型竞争性试验以及dsc结果均可以判断出化合物1
‑
((3
‑
exo)
‑3‑
((4
‑
((5
‑
甲基
‑
1氢
‑
吡唑
‑3‑
基)氨基)噻吩并[2,3
‑
d]嘧啶
‑2‑
基)氨基)
‑9‑
氮杂双环[3.3.1]壬烷
‑9‑
基)
‑2‑
(甲基氨基)
‑
乙烷
‑1‑
酮的苯磺酸盐晶型a、羟乙基磺酸盐晶型b、己二酸盐晶型b、氢溴酸盐晶型a、1,5
‑
萘二磺酸盐晶型c及酒石酸盐晶型a为热力学稳定晶型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1