一种暗褐网柄牛肝菌液体发酵制备麦角硫因的方法与流程
本发明属于生物发酵工程技术领域,具体涉及一种暗褐网柄牛肝菌液体发酵制备麦角硫因的方法。
背景技术:
egt(ergothioneine)是一种天然的硫咪唑氨基酸(thiol-imidazoleaminoacids)类抗氧化剂,通过清除羟自由基、次氯酸盐、过氧亚硝酸盐以及螯合氧化还原活性阳离子,参与维持活细胞内的氧化还原态。大量研究表明,egt具有预防和治疗由机体氧化胁迫而引起的癌症、心血管疾病、认知功能障碍等慢性疾病的潜力。此外,egt通过抗氧化作用抑制肉类、海鲜和水果等食品的氧化与褐变,延长食品的货架期。它具有以下几个特点:
(1)强抗氧化性:相比于谷胱甘肽(gsh)、尿酸(uricacid)和trolox等传统抗氧化剂,egt具有更强的自由基清除能力。
(2)稳定性:由于egt特殊的构型,它的氧化还原电位(eo=-0.06v)比gsh高(eo=-0.24v);因而它具有极高的稳定性,不易发生自氧化。
(3)安全性:egt在人体受试者中持续一周给药高达25mg/天未发现不良反应;在动物模型中,按每公斤给药1600mg,也未表现出任何的不良影响和组织病理学变化。成人和儿童每天用量分别为30mg和20mg均没有观察到遗传毒性。此外,2017年,欧盟发布了egt作为新食品的安全声明,计算了(按个体体重)以下人群的建议日摄入量:2.82mg/kg/天(婴儿)、3.39mg/kg/天(幼儿)、1.31mg/kg/天(普通成人,妊娠及哺乳期妇女)。因egt独特的生物学和药理特性以及安全、稳定等优点,在化妆品、功能食品、医疗、治疗学和生物医学等领域展现出良好的应用前景。
目前,egt的制备方法有三种:化学合成法、提取法以及生物合成法。化学方法合成左旋l-egt十分困难,且存在产品安全性难以保证、合成原料及成本高昂等缺点;生物提取法因生物体内的egt含量一般较低,提取成本高;生物合成法是目前生产egt的主要方式,其利用蘑菇中egt含量高的特点,采用液体发酵技术制备egt;比如专利文献(cn103184246a)提及利用香菇菌丝发酵后获得发酵液中的egt含量为23.6mg/l;专利文献(cn103184246a)提到花脸香菇、肺形侧耳以及野生紫孢侧耳等真菌的菌丝发酵液中egt最高含量分别为51mg/l、48mg/l、37mg/l;专利文献(cn201210392417.8)提到利用糙皮侧耳(pleurotusostreatus)深层发酵后,发酵液中的egt最高含量可达140mg/l;专利文献(cn201811605003.2)也提到利用猴头菌发酵获得egt,但发酵液中的egt含量最高也只有240mg/l。此外,专利文献(cn201811605003.2)中提及使用酶解法提取真菌菌丝体egt的方法,存在提取过程复杂,且成本高昂,不适宜用于大规模提取和检测蘑菇类真菌发酵液中的egt含量。
综上所述,目前利用蘑菇类真菌深层发酵制备egt方法主要存在以下问题:
(1)egt产量低,导致egt生产成本偏高,不利于egt的推广和利用;
(2)从菌丝体中提取egt多采用搅拌加热、酶解等方法,普遍存在菌丝体细胞破碎不完全、操作繁琐、提取成本高。
技术实现要素:
针对以上现有技术存在的缺点和不足之处,本发明的目的在于提供一种暗褐网柄牛肝菌液体发酵制备麦角硫因的方法。
本发明目的通过以下技术方案实现:
一种暗褐网柄牛肝菌液体发酵制备麦角硫因的方法,包括如下步骤:
(1)将暗褐网柄牛肝菌(phlebopusportentosus)固体菌种接种至母种培养基中培养获取母种菌液;
(2)将获得的母种菌液接种至发酵培养基中,同时添加生物合成egt的前体物质进行发酵培养,得到菌丝发酵液;
(3)将步骤(2)所得菌丝发酵液采用乙醇溶液超声浸提,过滤得到含有egt的提取液。
进一步地,步骤(1)中所述母种培养基包括以下组分:0.5~8%(w/v)果糖、0.5~2%(w/v)玉米干粉、0.5~2%(w/v)酵母粉、、0.02~0.2%(w/v)kh2po4、0.01~0.1%(w/v)mgso4、0.01~0.1%(w/v)cacl2、ph4.0~6.0。
进一步地,步骤(1)中所述母种培养基中培养条件为:在18~35℃、90~250rpm振荡条件下,培养6~11天。
进一步地,步骤(2)中所述发酵培养基包括以下组分:1~10%(w/v)碳源、0.1~5%(w/v)氮源、0.01~2%(w/v)无机盐、0.001~0.5%(w/v)微量元素、0.001~0.01%(w/v)生长因子、ph4.0~6.0。
进一步地,步骤(2)中所述发酵培养的条件为:在18~35℃、90~250rpm振荡条件下,培养6~18天。
进一步优选地,所述碳源包括可溶性淀粉、乳糖、葡萄糖、蔗糖、果糖、麦芽糖、马铃薯粉、大米粉、玉米粉、半乳糖、甘露糖中的至少一种。更优选为果糖。
进一步优选地,所述氮源包括牛肉膏、蛋白胨、鱼粉、酵母粉、酵母浸出液、酵母膏、豆饼粉、麸皮、酪蛋白胨、胰蛋白胨、玉米浆、玉米干粉、尿素、(nh4)2so4、nh4no3、nano3中的至少一种。更优选为酵母粉。
进一步优选地,所述无机盐包括mgso4、ki、cacl2、caco3、kh2po4、nah2po4中的至少一种。
进一步优选地,所述微量元素包括h3bo3、znso4、mnso4、na2moo4、cocl2、cuso4、feso4中的至少一种。
进一步优选地,所述生长因子包括肌醇、盐酸硫胺素、盐酸吡哆醇、烟酸中的至少一种。更优选为肌醇。
进一步地,步骤(2)中所述生物合成egt的前体物质包括蛋氨酸(met)、赖氨酸(lys)、组氨酸(his)、亮氨酸(leu)、丙氨酸(ala)、半胱氨酸(cys)、精氨酸(arg)、甘氨酸(gly)、酪氨酸(tyr)、谷氨酸(glu)、脯氨酸(pro)、胱氨酸(hcy)中的至少一种。
进一步优选地,步骤(2)中所述发酵培养基组成为:1~10%(w/v)果糖、0.1~2%(w/v)的酵母粉、0.001~0.05%(w/v)mgso4、0.01~0.05%(w/v)kh2po4、0.0001~0.001%(w/v)mnso4,0.001~0.005%(w/v)的肌醇。
进一步地,步骤(3)中所述乙醇溶液是指浓度为70%的乙醇溶液,所述菌丝发酵液与乙醇溶液的体积比为1:9。
进一步地,步骤(3)中所述超声浸提的时间为30min。
与现有技术相比,本发明的有益效果是:
(1)本发明通过对发酵培养基中的碳源、氮源、生长因子、无机盐等成分进行优化,显著提高了发酵液中egt的产量,在优化条件下,发酵液中的egt的产量达到500mg/l以上,最高可达600mg/l。
(2)本发明通过乙醇超声提取法,可快速简便有效的提取菌丝体中的egt,可有效的减少一些发酵副产物对后续egt检测的干扰。
附图说明
图1为本发明实施例1中不同的超声浸提时间对egt含量的影响结果图;
图2为本发明实施例2中不同种类碳源对egt产量的影响结果图;
图3为本发明实施例3中不同果糖浓度对发酵液中egt含量的影响结果图;
图4为本发明实施例4中不同种类氮源对发酵液中egt含量的影响结果图;
图5为本发明实施例5中不同酵母粉浓度对发酵液中egt含量的影响结果图;
图6为本发明实施例6中不同种类生长因子对发酵液中egt含量的影响结果图;
图7为本发明实施例7中不同肌醇浓度对发酵液中egt含量的影响结果图;
图8为本发明实施例8中不同发酵培养基初始ph对发酵液中egt含量的影响结果图;
图9为本发明实施例9中优选组分浓度的配比差异对发酵液中egt含量的影响结果图;
图10为本发明实施例10中不同初始果糖浓度下所得egt粗提液的hplc图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1
本实施例中1l液体母种培养基:2%(w/v)果糖、1%(w/v)的酵母粉、0.8%(w/v)的玉米干粉、0.2%(w/v)kh2po4,0.1%(w/v)mgso4,0.02%(w/v)cacl2、其余为水,ph5.2-5.8,于121℃灭菌20min。
发酵培养基:2.5%(w/v)的葡萄糖、1%(w/v)的玉米干粉、0.1%(w/v)kh2po4,0.2%(w/v)mgso4、0.0005%(w/v)mnso4、0.001%的肌醇、其余为水,ph5.2-5.8,于121℃灭菌20min。
(1)从暗褐网柄斜面培养基上挑取0.5cm3的菌块,置于液体母种培养基中,在24℃摇床90rpm培养8天,获得母种菌液。
(2)将母种菌液按10%的体积比接种至发酵培养基中,在25℃摇床120rpm培养3天,随后按补充前体物质胱氨酸0.1%(w/v)、谷氨酸0.1%(w/v)、甲硫氨酸0.1%(w/v),继续培养5天,待发酵结束后,即得到暗褐网柄牛肝菌的egt菌丝发酵液。
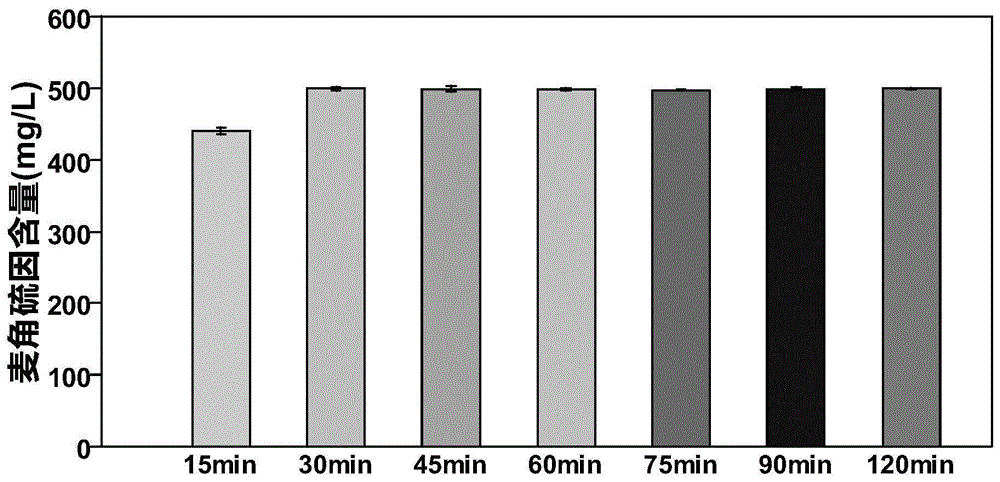
(3)利用乙醇和超声浸提菌丝发酵液中的egt。取20ml的菌丝发酵液,加入180ml70%乙醇,混匀,放置于超声仪上,超声浸提时间设置如下:15min、30min、45min、60min、75min、90min、120min。随后取3ml上述超声浸提后的发酵液,经过4.5μm的过滤膜过滤,并测定滤液中egt的含量。结果见表1和图1,超声浸提30min可完全的提取菌丝体中的egt,延长超声时间对菌丝体中的egt提取无影响。
表1.不同的超声浸提时间对egt含量的影响
实施例2
将实施例1中发酵培养基中葡萄糖分别替换为,可溶性淀粉、乳糖、果糖、蔗糖、麦芽糖、马铃薯粉、大米粉、玉米粉、半乳糖、甘露糖,其余的物质及浓度保持不变,其余为水,ph为5.2-5.8,于121℃灭菌20min。随后按实例1中方法进行发酵培养及乙醇超声提取egt,并测定提取液中egt的含量。结果见表2和图2,其中以果糖做碳源时,发酵液中egt的含量最高为520.5±32.8mg/l,其次为蔗糖(493.3±42.4mg/l)和麦芽糖(468.6±23.0mg/l)。
表2.不同种类碳源对egt产量的影响
实施例3
将实施例1中发酵培养基中葡萄糖替换为果糖,并分别将果糖浓度(w/v)调整为0%、0.5%、1%、2%、4%、6%、8%、10%,制成不同浓度的果糖发酵培养基,调ph5.2-5.8,121℃灭菌20分钟,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测egt的含量。结果见表3及图3,当发酵培养基中果糖含量为0时,菌丝停止生长,发酵液中的egt含量为0,随着发酵培养基中果糖含量的增加,egt含量随之增加,当果糖浓度到达4%(w/v)时,发酵液中egt含量最高为540.2±46.5mg/l;而随着发酵液中果糖浓度持续增加,发酵液中egt含量逐渐降低。
表3.不同果糖浓度对发酵液中egt含量的影响
实施例4
将实施例1中发酵培养基中的玉米干粉(w/v)分别替换为:牛肉膏、蛋白胨、鱼粉、酵母粉、酵母浸出液、酵母膏、麸皮、酪蛋白胨、胰蛋白胨、玉米浆、尿素、(nh4)2so4、nh4no3、nano3,其余物质及浓度均保持不变,调ph5.2-5.8,121℃灭菌20分钟,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测提取液中egt的含量。结果见表4与图4,其中酵母粉作为氮源时,发酵液中egt含量最高可达513.2±27.2mg/l。因此,酵母粉作为优选氮源。
表4.不同种类氮源对发酵液中egt含量的影响
实施例5
将实施例1中发酵培养基中的玉米干粉(w/v)替换为酵母粉,分别将酵母粉浓度(w/v)调整为0%、0.3%、0.6%、1%、1.3%、1.6%、2%,制成不同浓度的酵母粉发酵培养基,调整ph5.2-5.8,121℃灭菌20min,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测egt的含量。结果见表5及图5,当发酵培养基不含酵母粉时,菌丝生长缓慢,发酵液中的egt含量极低为250.5±15.8mg/l,随着发酵培养基中酵母粉含量的增加,egt含量随之增加,当酵母粉浓度到达1%(w/v)时,发酵液中egt含量最高为501.3±26.6mg/l;而随着发酵液中酵母粉浓度持续增加,发酵液中egt含量呈现逐渐降低趋势。
表5.不同酵母粉浓度对发酵液中egt含量的影响
实施例6
将实施例1中发酵培养基中分别添加不同的生长因子:肌醇、盐酸硫胺素、盐酸吡哆醇、烟酸,其余物质及浓度均保持不变,调ph5.2-5.8,121℃灭菌20分钟,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测提取液中egt的含量。结果见表6与图6,其中肌醇作为生长因子时,发酵液中egt含量最高可达465.3±40.0mg/l。因此,肌醇作为优选生长因子。
表6.不同种类生长因子对发酵液中egt含量的影响
实施例7
将实施例1中发酵培养基中肌醇浓度(w/v)分别调整为0%、0.002%、0.004%、0.008%、0.01%,制成不同浓度的肌醇发酵培养基,调ph5.2-5.8,121℃灭菌20分钟,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测egt的含量。结果见表7及图7,当发酵培养基不含肌醇时,发酵液中的egt含量较低为440.1±40.9mg/l,当肌醇浓度到达0.002%(w/v)时,发酵液中egt含量最高为480.5±25.5mg/l;而随着发酵液中肌醇浓度持续增加,发酵液中egt含量变化并不明显。
表7.不同肌醇浓度对发酵液中egt含量的影响
实施例8
按实施例1中发酵培养基组分配制初始ph分别为4、4.5、5、5.5、6、6.5、7的发酵培养基,121℃灭菌20分钟,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测egt的含量。结果见表8及图8,当发酵培养基的初始ph为5.0、5.5、6.0时,发酵液中的egt含量较高,分别为471.8±33.5mg/l、477.3±31.5mg/l、474.6±23.3mg/l;当发酵培养基初始ph为4.0、4.5、6.5、7.0时,发酵液中的egt含量分别为425.1±14.0mg/l、445.5±26.3mg/l、463.2±37.5mg/l、425.5±38.3mg/l,低于ph为5.0、5.5和6.0中的egt含量。
表8.不同发酵培养基初始ph对发酵液中egt含量的影响
实施例9
将实施例1中发酵培养基中的碳源、氮源、生长因子分别替换为优选的果糖、酵母粉、肌醇,并配制成发酵培养基,121℃灭菌20min,随后按实施例1中方法进行发酵培养及乙醇超声提取egt,并检测egt的含量。结果见表9及图9。
表9.不同的优选组分浓度配比对发酵液中egt含量的影响。
实施例10
取实施例3中发酵培养基初始果糖浓度为分别为0.5%、1%、2%、4%和6%的发酵液20ml,分别往上述的发酵液中加入180ml的70%乙醇,置于超声仪(100%功率)上超声提取30分钟。随后取一定体积的的超声粗取液,用0.45μm的过滤膜过滤,即获得egt粗提液,采用hplc法对粗提液中的egt含量进行测定。
hplc设定条件如下:
采用dikmac18色谱柱(250mm×4.6mm,粒径5μm);柱温:30℃;流动相:水-甲醇(95:5);流速:0.5ml/min;检测波长:254nm;进样量:20μl;hplc检测结果如图10所示。其中(a)egt标准品的hplc图谱;(b)0.5%果糖的发酵液hplc图谱、(c)1%果糖的hplc图谱、(d)2%果糖的hplc图谱、(e)4%果糖的hplc图谱(f)6%果糖的hplc图谱。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!