一种非洲猪瘟病毒TaqMan荧光定量PCR检测试剂盒及其应用
一种非洲猪瘟病毒taqman荧光定量pcr检测试剂盒及其应用
技术领域
1.本发明涉及基因检测技术领域,具体涉及一种非洲猪瘟病毒taqman荧光定量pcr检测试剂盒及其应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引起的,以高热、内部器官出血为主要特征的高度接触性病毒性传染病,能够影响所有年龄阶段的猪。它可以表现为多种形式,从渗透型、急性型、亚急性型,到慢性和不明显。其中最常见的是急性型,致死率高达100%。
3.asfv于1921年在肯尼亚首次发现,在2007年到达高加索地区,随后通过俄罗斯逐步进入东欧地区。2018年8月我国首次出现非洲猪瘟疫情,仅一年时间蔓延至我国34个省市、自治区,给我国养猪业造成巨大经济损失。且由于尚无有效的疫苗药物防治此病,严格的生物安全措施是目前防控该病蔓延的最有效办法。
4.asfv传播速度快、致死率高,由于现阶段没有可用的疫苗,及早的发现疫情以及迅速展开严格的生物安全措施对控制asf传播具有重要意义。asfv接触感染的潜伏期为4~19d,出现临床症状的2d前感染动物就开始散播病毒,感染后的7~9d血清转阳。据此可说明,asf的早期诊断抗原检测技术要优于抗体检测技术。荧光定量pcr检测法作为一种特异、灵敏、快速的检测方法,可在临床症状发生前2
‑
4d在扁桃体样本中检测到病毒dna,是应用于asf早期检测的一种必不可少的检测手段,可应用于asf爆发的监测或早期疾病控制。为解决这一需求,本研究建立了一种高特异性、高灵敏性的asfv taqman实时荧光定量检测方法,该方法可用于asf的临床前诊断和疾病暴发的监测或应急管理。
5.asfv的 e248r基因可编码pe248r蛋白, 这是asfv表达的晚期膜蛋白,核苷酸序列为747nt,编码蛋白大小为32kd。asfv pe248r蛋白是一个豆蔻酰化的完整膜蛋白,位于病毒内膜处,是病毒粒子组成的晚期结构成分。rodr
í
guez等利用重组病毒诱导表达e248r基因来研究pe248r蛋白在asfv复制过程中的功能,结果表明e248r蛋白缺失不影响病毒组装,但病毒的感染性与野生型病毒相比降低了100倍。hern
á
ez等研究发现pe248r蛋白是病毒与细胞融合以及核心传递到细胞质过程中所必需的蛋白。andr
é
s等表明pe248r缺陷型病毒后代是非传染性的。pe248r蛋白在病毒侵入细胞的过程中发挥了重要作用,因此该蛋白具有重要的研究价值,同时e248r基因缺失可以极大的降低asfv的感染性,这也为asf疫苗以及抗病毒药物的研究提供新的思路,具有重要研究价值。本实验建立的荧光定量检测方法可有效特异的检测e248r基因,这为pe248r蛋白的进一步研究提供了基础研究工具。
6.
技术实现要素:
本发明的首要目的在于弥补现有技术的缺点与不足,提供一种非洲猪瘟病毒taqman荧光定量pcr检测引物和探针的检测组合物。
7.本发明的另一目的在于提供包含上述检测组合物的一种非洲猪瘟病毒taqman荧光定量pcr检测试剂盒。
8.本发明的再一目的在于提供基于上述检测试剂盒的非洲猪瘟病毒的taqman荧光定量pcr检测方法。
9.本发明的目的通过下列技术方案实现:taqman荧光定量pcr检测组合物,包括用于扩增非洲猪瘟病毒的1组特异性引物对和1条探针。
10.所述的特异性引物对的序列如seq id no.1(ggaggctctacaagcaaa)和seq id no.2(catcaccgaatacgccta)所示。
11.所述的探针的序列如seq id no.3(fam
‑
aatacgaccaacattatcagcaat
‑
3bhq1)所示。
12.进一步的,本发明提供所述非洲猪瘟病毒的taqman荧光定量pcr检测组合物在制备非洲猪瘟病毒检测试剂盒中的应用。
13.所述一种非洲猪瘟病毒pcr检测试剂盒,包含上述检测组合物。
14.所述的检测试剂盒还包含阳性对照。
15.所述的阳性对照为阳性克隆质粒pcold i
‑
asfv
‑
e248r。
16.上述非洲猪瘟病毒taqman荧光定量pcr检测试剂盒在鉴定和/或检测非洲猪瘟病毒中的应用。
17.本发明提供非洲猪瘟病毒taqman荧光定量pcr检测试剂盒检测方法,包括如下步骤:(1)提取样品的基因组dna;(2)配制荧光定量pcr反应体系;(3)将步骤(2)中配制的荧光定量pcr反应体系置于荧光定量pcr仪中,进行扩增反应;(4)将基因组dna的循环阈值ct与标准曲线对照,得到基因组dna中非洲猪瘟病毒基因片段拷贝浓度。
18.步骤(2)中所述的pcr反应体系为: 所述的上游引物、下游引物和探针的序列依次如seq id no.1、seq id no.2和seqid no.3所示。
19.步骤(3)中所述的扩增反应的反应条件为:95℃预变性1min;95℃变性5s,退火30s,40个循环。
20.有益效果 本发明相对于现有技术具有如下的优点及效果:本研究建立了一种基于asfv e248r基因的taqman实时荧光定量pcr检测方法。该方法仅特异性扩增asfv,不与csfv、
prrsv、pedv、prv等发生交叉反应,特异性较高。该方法的最低检测数为10个拷贝,王建华等建立的基于asfv cp530r基因taqman
‑
mgb探针real
‑
time pcr检测方法,该方法最低可检测到61个拷贝的质粒。张泉等建立了基于asfv b646l基因荧光定量pcr方法最低检测出20个病毒核酸分子。本研究建立的方法与之相比较更为灵敏。与郭少平等建立的基于k205r基因的实时荧光定量pcr检测方法敏感性试验最低检测量为10个拷贝结果相似,具有较高的灵敏性。组间与组内的重复性试验变异系数均小于2.220%,实验结果表明该方法具有良好的重复性。通过对临床样品检测可见,本研究建立的taqman实时荧光定量检测方法可有效的检测出阳性核酸样品。样品核酸抽提以及荧光定量pcr检测最快可在2小时完成。由此可见,本研究建立基于asfv e248r基因的taqman实时荧光定量检测方法是一种特异、灵敏、高效的可应用于临床的taqman实时荧光定量pcr检测方法。
附图说明
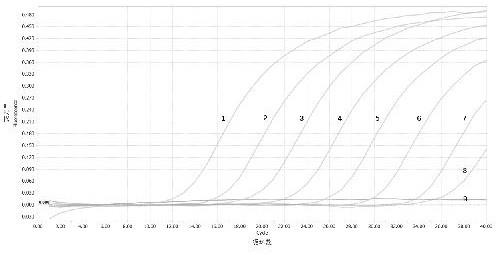
21.图 1 asfv e248r基因taqman实时荧光定量pcr敏感性试验扩增曲线 ,其中,1
‑
8. 1
×
108‑1×
10
1 copies/μl质粒模板;9. 阴性对照图 2 asfv e248r基因taqman实时荧光定量pcr敏感性试验标准曲线图 3 asfv e248r基因taqman实时荧光定量pcr特异性试验,其中,1.阳性质粒;2
‑
5.阴性对照、csfv、prrsv、pedv、prv。
具体实施方式
22.下面结合实施例对本发明提供的具体实施方式作详细说明。
23.实施例1以asfv e248r基因序列为基础用oligo7软件荧光定量pcr所需要的特异性探针和引物,上游引物序列为ggaggctctacaagcaaa,下游引物序列为 catcaccgaatacgccta,探针序列为fam
‑ꢀ
aatacgaccaacattatcagcaat
ꢀ‑
bhq1。上述探针和引物序列均经过blast分析为asfv特异性序列,且探针引物所在区域序列与其他毒株对比较为保守(见图2
‑
1)。探针由上海吉玛制药技术有限公司合成,引物由上海擎科生物公司合成。
24.荧光定量pcr检测使用probe qpcr mix(2
×
)酶20μl体系(见表1)进行反应,反应的循环条件为:95℃预变性1min;95℃变性5s,退火30s,40个循环,每个循环结束后采集fam通道荧光信号。其中退火温度可根据引物tm值选取合适温度进行优化。
25.表1 probe qpcr mix(2
×
)酶20μl反应体系实施例2
根据以优化的荧光定量pcr反应条件对制备好的标准品进行荧光定量pcr试验,每个梯度设置三个重复,由荧光定量pcr仪自动生成。
26.用105、106、10
7 copies/μl的标准品同时进行荧光定量pcr试验,每个梯度设置三个重复,所得ct值分别计算组内标准差和变异系数(cv)。用105、106、10
7 copies/μl的标准品在不同时间进行三次荧光定量pcr试验,所得ct值计算组间标准差和变异系数。用组间和组内的变异系数对荧光定量pcr方法的重复性进行评估(表2,表3)。
27.结果显示,asfv实时荧光定量pcr检测方法的组内变异系数在0.139
‑
1.239%之间;组间变异系数在1.439
‑
2.220%之间,组内与组间变异系数均小于2.220%。结果表明,该方法具有良好的重复性。
28.表2 asfv e248r基因taqman实时荧光定量pcr的组内重复性试验表3 asfv e248r基因taqman实时荧光定量pcr的组间重复性试验实施例3用1
×
101‑1×
108copies/μl的标准品进行敏感性试验,每个梯度设置3个重复,通过观察标准曲线确定方法的最低检测浓度,且以ct值为纵坐标,拷贝数为纵坐标,建立标准曲线,评价其线性关系,验证该方法的敏感性(见图1)该方法的最低检测量是10个拷贝,样品浓度大于10 copies/μl时均能出现扩增曲线,由罗氏荧光定量仪自动生成标准曲线(见图2)。标准曲线方程为y =
ꢀ‑
3.431x + 41.31,r
²ꢀ
= 1.00。试验结果表明,本实验建立的asfv荧光定量检测方法具有较高的灵敏度。
29.实施例4
用实验室保存的猪瘟病毒(csfv)、猪繁殖与呼吸综合征病毒(prrsv)、猪流行性腹泻病毒(pedv)的cdna和猪伪狂犬病毒(prv)的dna为模板,进行荧光定量pcr反应,观察扩增曲线,验证该方法的特异性。结果显示(见图3),仅105标准品产生特异性扩增曲线,其他病毒样品扩增结果均为阴性。实验结果证明,本研究设计的asfv taqman荧光定量pcr的探针、引物不能识别csfv、prrsv、pedv、prv病毒序列,该方法不与这些病原发生交叉反应,具有良好的特异性。
30.猪瘟病毒(csfv)、猪繁殖与呼吸综合征病毒(prrsv)、猪伪狂犬病毒(prv)、猪流行性腹泻病毒(pedv)灭活抗原均由中国农业科学院上海兽医研究所猪病毒性繁殖障碍综合征研究团队保存。
31.实施例5采集猪场的猪血清样本,按照dna提取试剂盒操作说明书提取dna,采用优化后的反应体系和反应条件进行荧光定量pcr检测。根据表4可知,共采集样本248份,其中阴性样品232份,阳性样品16份。结果与使用商品化的asfv elisa检测试剂盒检测结果一致。试验结果表明,本研究建立的实时荧光定量pcr检测方法可利用于临床样品检测。
32.表4 临床样品asfv实时荧光定量pcr检测结果由此可见,本研究建立了一种基于asfv e248r基因的taqman实时荧光定量pcr检测方法。该方法仅特异性扩增asfv,不与csfv、prrsv、pedv、prv等发生交叉反应,特异性较高,可以广泛的应用在实际生产中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1