CSMD家族基因预测晚期肺腺癌免疫治疗疗效的制作方法
本发明属于精准医疗临床分子诊断领域,涉及一种预测晚期肺腺癌的免疫治疗,例如使用免疫检查点抑制剂的免疫治疗的疗效的方法、试剂盒、系统以及计算设备。
背景技术:
非小细胞肺癌是中国人群中最为常见及致命的癌种之一,其中肺腺癌是最为常见的亚型(约占60-70%)。晚期肺腺癌经典的治疗手段为化疗和/或放疗,当存在egfr、alk、ros1等敏感突变时使用受体酪氨酸激酶抑制剂(tkis)等靶向药物有较好的治疗效果。然而这些治疗面临的主要问题是获益人群仅限于携带特定基因突变的癌症患者,并且随着治疗进程的发展,癌细胞终将适应并逐渐发展出相应的耐药抗性。
免疫治疗,特别是以免疫检查点抑制剂(immunecheckpointinhibitors,icis)为代表的生物大分子药物带来了晚期肺腺癌治疗的极大变革。然而,仅有部分晚期肺腺癌患者(大约20-30%左右)能获益于这种治疗方法,因此亟需有效的生物标志物预测临床获益人群。目前临床上常见的免疫治疗疗效预测生物标志物包括pd-l1和tmb,已展现出一定的预测效力,然而依然存在很多的局限,包括较高的检测成本(tmb)和对样本要求较高(pd-l1)等。
免疫治疗通过重新激活人体适应性免疫系统特别是cd8+t细胞识别来自肿瘤细胞的抗原(肿瘤新抗原,tumorneoantigen)。这些新抗原来自肿瘤细胞中发生的体细胞非同义变异所产生的异常氨基酸序列,并与i型hla特异性识别与结合。通常肿瘤新抗原数量与肿瘤突变负荷存在显著正相关性。
tmb检测:tmb全称“肿瘤基因突变负荷”(tumormutationalburden),是获得nccn指南推荐的免疫治疗生物标志物(biomarker)。通过全外显子组测序(wes)或大基因panel(如msk-impact、foundationone等)对肿瘤组织或外周血游离肿瘤dna(ctdna)的全部或特定基因编码区进行深度测序,并通过一定的生物信息学变异识别软件,计算得到每mb基因区域内发生体细胞非同义突变的个数。多个独立临床研究表明,在包括黑色素瘤及非小细胞肺癌在内的多个癌种中,tmb与免疫治疗疗效存在显著的正相关关系。
但是tmb检测对技术平台要求较高,工作周期较长,并且测序成本高昂(对患者经济条件要求较高)。
pd-l1检测:pd-l1是一种表达于细胞膜表面的蛋白,由人体cd274基因编码。通过与cd8+t细胞上的pd-1及b7.1结合,传导免疫抑制信号,抑制效应t细胞。临床上通过免疫组化方法对手术或穿刺后取得的肿瘤组织进行切片染色,镜下观察根据着色深浅来评价表达情况。通常pd-l1蛋白高表达的实体瘤患者,对免疫治疗应答率更高。但是,多个临床试验结果显示pd-l1表达对免疫治疗疗效的预测能力并不一致,部分pd-l1阴性患者依然能从免疫治疗获益,且持续缓解时间并不逊于pd-l1阳性患者。
因此,临床上仍然迫切需要更多新的预测性生物标记物或方法来预测癌症免疫治疗疗效。
技术实现要素:
本发明提出了一个与tmb显著正相关的重要基因家族csmd1/2/3,发现它们存在显著共同突变的现象,并在公共数据集中验证了该家族基因能有效预测免疫治疗疗效,同时降低检测成本和分析时间。与连续型变量tmb不同的是,只通过csmd家族基因突变的有无划分疗效评估分组。
具体地,本发明通过公共数据挖掘,针对晚期肺腺癌基因检测数据和免疫治疗疗效评估数据,发现csmd家族基因(csmd1/2/3)的体细胞非同义突变状态能有效预测免疫检查点抑制剂对晚期肺腺癌的治疗疗效。因此,本发明提供了一种有效预测晚期肺腺癌免疫治疗疗效的低成本高效力检测手段。
首先,在第一方面,本发明涉及生物标志物,其用于预测晚期肺腺癌患者对免疫治疗(例如使用免疫检查点抑制剂的免疫治疗)的敏感性,以预测免疫治疗的疗效,所述生物标志物包含csmd家族基因;进一步地,为csmd1、csmd2、csmd3共三个基因。
术语“生物标记物”是指,可在患者的生物样品中检测的患者表型(例如,病理学状态或可能对治疗剂的响应性)的指标。生物标志物包括但不限于基于dna、rna、蛋白质、碳水化合物或糖脂的分子标志物。
具体地,本发明的生物标志物是基于dna的基因家族csmd1、csmd2、csmd3;旨在预测或判断治疗方法在目标人群中的有效性。csmd蛋白家族(cubandsushimultipledomainsproteinfamily,cub和sushi多结构域蛋白家族)的三个成员都有非常相似的蛋白质结构(包含14个由sushi结构域间隔的cub结构域,另外一串不间断的sushi结构域,一个跨膜蛋白,和一个短胞质尾)。对应的三个编码基因csmd1/2/3分别位于人类染色体8p23.2、1p35.1和8q23.3,这些基因的表达缺失或功能异常多报道与精神类疾病密切相关,并与多种肿瘤的发生发展有着密切的关系。作为一类候选抑癌基因,csmd家族基因与癌症及其治疗的相关性有待进一步深入研究。
术语“预测”是指,患者将从某种药物、治疗剂或治疗方案获益的可能性。在一个治疗方案中,预测涉及:在例如用特定治疗剂治疗后,患者是否和/或有多大概率将存活、改善或持续无复发的一定时间段。本发明的预测方法可在临床上使用,以便通过该预测确定或排除某种治疗方案的使用。
在另一方面,本发明提供了一种用于预测晚期肺腺癌免疫治疗疗效的试剂盒,所述试剂盒包含特异性检测csmd1、csmd2和csmd3基因突变的试剂。
在一些实施方案中,所述试剂盒包含选自核酸提取试剂、基因的特异性引物或探针、pcr试剂、核酸测序试剂中的一种或多种。
在一些实施方案中,所述测序是高通量测序也称二代测序(ngs测序)。可用本发明的ngs测序平台是商用可得的,包括但不限于roche/454flx、illumina/solexagenomeanalyzer和appliedbiosystemssolidsystem等。
外显子组测序是利用序列捕获技术将基因组外显子区域dna捕捉并富集后进行高通量测序的基因组分析方法。由于它具有对常见和罕见突变高灵敏度,因此仅需对2%的基因组进行测序就能发现外显子区域的大部分疾病相关突变。所述高通量测序可以是全外显子组测序,也可以是针对基因组中部分基因或区域的测序。具体地,在本发明中,测序可针对csmd1/2/3基因进行。
在一些优选的实施方案中,所述试剂盒还包含样品处理剂,如样品裂解试剂、样品纯化试剂及核酸提取试剂等。
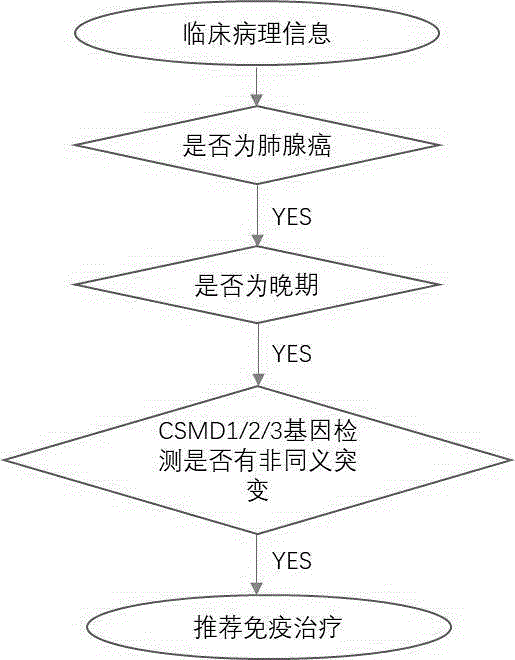
在另一方面,本发明提供一种用于预测晚期肺腺癌免疫治疗,例如免疫检查点抑制剂治疗的疗效的方法,所述方法包括以下步骤:
a)评估晚期肺腺癌患者的肿瘤组织中的csmd1、csmd2和csmd3基因的体细胞非同义突变;
b)根据所述步骤a)的评估结果进行分类:若在csmd1、csmd2和csmd3基因中至少一个基因发生至少一个体细胞非同义突变,则归为csmd=1组;若三基因中均未发生体细胞非同义突变,或仅在非编码区发生突变,则归为csmd=0组;其中,若三基因中至少一个基因在编码区发生了体细胞非同义突变,无论突变数量和类型如何,均归为csmd=1组;
c)基于步骤b)的分类结果,进行判断,预测csmd=1组免疫治疗有效,而csmd=0组免疫治疗无效。
在本发明中,基因非同义突变可以包括点突变(pointmutation)和片段突变(fragmentmutation);点突变可以是单核苷酸多态性(snp)、碱基取代、单碱基插入或碱基缺失、剪接突变;片段突变可以是融合/重排突变、扩增突变、插入/缺失和截短突变。
在一些实施方案中,所述免疫治疗是指免疫检查点抑制剂的免疫治疗。
如本文所用,术语“免疫检查点”是指免疫系统中存在的一些抑制性信号通路。机体在正常情况下,免疫检查点可以通过调节自身免疫反应的强度来维持免疫耐受,然而机体在受到肿瘤侵袭时,免疫检查点的激活会抑制自身免疫,有利于肿瘤细胞的生长和逃逸。通过使用免疫检查点抑制剂,可以恢复机体正常的抗肿瘤免疫反应,从而控制和清除肿瘤。本领域已知多种可用于肿瘤治疗的免疫检查点抑制剂。
本发明所述免疫检查点为pd-1、pd-l1和/或ctla-4。本发明所述免疫检查点抑制剂包括但不限于pd1抑制剂、pd-l1抑制剂和/或ctla-4抑制剂,例如帕博丽珠单抗(pembrolizumab,商品名keytruda)、纳武利尤单抗(nivolumab,商品名opdivo)、阿特珠单抗(atezolizumab,商品名tecentriq)、依匹木单抗(ipilimumab,商品名yervoy)及德瓦鲁单抗(durvalumab,商品名imfinzi)等。
在一些实施方案中,通过比较肿瘤组织与对照组织的测序数据,例如全外显子组测序或靶向csmd1/2/3的测序数据评估肿瘤组织中csmd1、csmd2和csmd3基因的体细胞非同义突变。
在一些实施方案中,所述肿瘤组织为癌组织;进一步地,所述肿瘤组织为原发灶或转移灶。
在一些实施方案中,所述对照组织是来自所述对象的正常组织(非肿瘤组织),例如癌旁组织或白细胞等。
在一些实施方案中,评估csmd1、csmd2和csmd3的基因突变信息包括确定其编码区是否存在非同义突变,例如移码突变、错义、剪接、移码或者stop-gain突变等。
在一些实施方案中,通过高通量测序技术评估csmd1、csmd2和csmd3的基因突变状态。本领域各种已知的可以检测具体基因突变的方法都可以应用于本发明。
术语“突变负荷”,在肿瘤的背景下,在本文中又称为“肿瘤突变负荷”或“tmb”。肿瘤突变负荷(tmb)被定义为每百万碱基中被检测出的体细胞非同义突变的个数,包括基因错义突变、移码或框内插入或缺失等突变的总数。tmb一般以非同义突变的总数量除以测量基因区间大小即每1mb(1兆碱基)的非同义突变数量来表示(mutants/mb)。
在一些实施方案中,如果i)csmd1、csmd2和csmd3基因中的体细胞非同义突变至少存在一个,则预测所述免疫治疗有效。在另一些实施方案中,如果ii)csmd1、csmd2和csmd3基因中无体细胞非同义突变或突变发生在非编码区,则预测所述免疫治疗无效。
在本发明中,通过组合考虑csmd1、csmd2和csmd3基因的突变状态,够准确预测晚期肺腺癌患者中对免疫检查点抑制剂敏感的群体,避免盲目用药,提高免疫检查点抑制剂治疗的经济性能。
在另一方面,本发明提供一种用于预测晚期肺腺癌的免疫治疗,例如免疫检查点抑制剂治疗的疗效的系统或装置,所述系统或装置包括以下三个模块:
评估模块i),评估晚期肺腺癌患者的肿瘤组织中的csmd1、csmd2和csmd3基因的体细胞非同义突变;
计算模块ii),根据评估模块i)的评估结果进行分类:若在csmd1、csmd2和csmd3基因中任一个基因发生至少一个体细胞非同义突变,则归为csmd=1组;若三基因中均未发生体细胞非同义突变,或仅在非编码区发生突变,则归为csmd=0组;其中,若三基因中至少一个基因在编码区发生了体细胞非同义突变,无论突变数量和类型如何,均归为csmd=1组;
判断模块iii),基于计算模块的结果,进行判断,预测csmd=1组免疫治疗有效,而csmd=0组免疫治疗无效。
在一些实施方案中,评估模块i)通过比较肿瘤组织与对照组织的测序数据,例如全外显子组测序或靶向测序数据评估所述csmd1、csmd2和csmd3基因的体细胞非同义突变。
在一些优选的实施方案中,评估模块i)确定csmd1、csmd2和csmd3基因的编码区是否存在体细胞突变,例如移码突变、错义、剪接、移码或者stop-gain突变等。
在一些实施方案中,如果i)csmd1、csmd2和csmd3基因的编码区的体细胞非同义突变至少存在一个,则判断所述免疫治疗有效;在另一些实施方案中,如果ii)csmd1、csmd2和csmd3基因在编码区无体细胞非同义突变,则判断所述免疫治疗无效。
在另一方面,本发明还涉及了特异性检测csmd1/2/3基因突变的试剂在用于预测晚期肺腺癌免疫治疗疗效的试剂盒、系统和装置中的用途。
在一些实施方案中,所述试剂例如基因测序试剂、基因特异性引物或探针等。
进一步地,所述试剂盒为上文所述的试剂盒;所述系统和装置为上文所述的系统和装置。
本领域技术人员可以理解,上述方法步骤的全部或部分功能可以通过硬件的方式实现,也可以通过计算机程序的方式实现。
当上述方法步骤中全部或部分功能通过计算机程序的方式实现时,该程序可以存储于计算机可读存储介质中,存储介质可以包括:只读存储器、随机存储器、磁盘、光盘、硬盘等,通过计算机执行该程序以实现上述功能。例如,将程序存储在设备的存储器中,当通过处理器执行存储器中程序,即可实现上述全部或部分功能。另外,当上述实施方式中全部或部分功能通过计算机程序的方式实现时,该程序也可以存储在服务器、另一计算机、磁盘、光盘、闪存盘或移动硬盘等存储介质中,通过下载或复制保存到本地设备的存储器中,或对本地设备的系统进行版本更新,当通过处理器执行存储器中的程序时,即可实现上述实施方式中全部或部分功能。
在另一方面,本发明还提供一种计算设备,其包含:
至少一个处理单元;和至少一个存储器,所述存储器与耦合至所述处理单元,并存储用于由所述处理单元执行的指令,所述指令当被执行时,所述设备能够实现本发明上文所述的预测晚期肺腺癌免疫治疗疗效的方法。
在另一方面,本发明涉及一种计算机可读存储介质,其存储有计算机程序,该程序能够被机器执行,以实现本发明上文所述的预测晚期肺腺癌免疫治疗的疗效的方法。
本发明的有益效果:
本发明提供了一种有效预测晚期肺腺癌免疫治疗疗效的低成本高效力检测手段。与pd-l1检测需人工判读免疫组化片子相比,本发明只通过有无csmd家族体细胞基因突变评估分组,预测疗效;与tmb检测成本较高相比,本发明可简化检测内容,降低检测成本,加快检测报告出具效率。本发明的基因突变状态的检测简单、直接、可靠和高效。
附图说明
为更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。以下描述中的附图是本发明的一些实施方式,对于本领域技术人员而言,在不付出创造性劳动的前提下,还可根据这些附图获得其他的附图。
图1:本发明方法的具体分析流程图。
图2:csmd突变情况与tmb的关联:图2a显示tcga数据队列中tmb与csmd突变的关联;图2b显示89例晚期肺腺癌队列中tmb与csmd突变的关联。
图3:存活概率(survivalprobability)结果图。
图4:多因素分析结果。
具体实施方式
下面结合具体实施方式以及附图对本发明进行详细的说明。
实施例1:csmd1/2/3存在显著共突变且与tmb显著正相关
分析tcga数据中的567例晚期肺腺癌(luad)数据,发现csmd家族三个基因的突变频率从高到低分别是csmd3(36.5%)、csmd1(19.2%)和csmd2(13.2%)。同时,发现csmd家族基因存在显著的共突变(两个基因同时发生突变)现象,提示它们在结构和功能上存在一定的重叠互补。具体如表1。
将在csmd1/2/3三个基因中至少存在一个体细胞非同义突变的病例归为csmd=1组;而在csmd1/2/3三个基因中均不存在体细胞非同义突变,或仅在非编码区发生突变的病例归为csmd=0组。
研究发现,tcga数据中csmd=1组的tmb显著高于csmd=0组(wilcoxon检验p<2.2e-16,参见图2a)。可知,csmd1/2/3三个基因的突变都与体细胞突变负荷(tmb)总数成正比,提示csmd突变(即:csmd1/2/3三个基因中至少有一个基因发生体细胞非同义突变)与tmb类似,是可作为免疫治疗预后的生物标志物。
实施例2:csmd1/2/3突变预测肺腺癌(luad)免疫治疗疗效
选择两个iii期临床研究的数据集checkmate-012(治疗药物:纳武利尤单抗+依匹木单抗,n=59)和keynote-001(治疗药物:帕博丽珠单抗,n=30),共89例晚期肺腺癌(luad)病人临床数据和基因检测数据。其中包括基因突变数据、治疗方案数据和无进展生存期(progressionfreesurvival,pfs)数据。
参照上文所述的计算方法,分为csmd=1组和csmd=0组。由图2b可见,与图2a类似,在89例晚期肺腺癌(luad)病人中,其csmd=1组的tmb同样显著高于csmd=0组(wilcoxon检验p<8.7e-09)。
此外,观察到csmd=1组获得了显著的临床pfs获益(hr:0.49(95%ci:0.28-0.86);log-ranktest,p=0.01)。具体生存分析结果如图3所示。
进一步地,同时考虑年龄、性别和治疗药物对pfs的影响,对其进行多因素cox分析,结果仍显示,csmd=1组pfs显著优于csmd=0组。具体结果如图4所示。
由上述分析可知,在晚期肺腺癌中,csmd家族基因是一个有效的预测免疫治疗疗效的生物标志物。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!