一种硅萘酞菁阴极界面材料及其制备方法和应用与流程
1.本发明属于光电材料技术领域,更具体地涉及一种硅萘酞菁阴极界面材料及其制备方法和应用。
背景技术:
2.随着社会的发展,清洁无污染、可再生能源的需求日益迫切。作为能将太阳能有效转化为电能的设备,太阳能电池近年来发展迅速。与昂贵笨重的无机太阳能电池相比,有机太阳能电池具有制造成本低,重量轻,柔韧性好,制造面积大等优点。随着一系列性能优异的活性层材料的研发成功,有机太阳能电池(oscs)在过去的几十年中取得了显著进步,电池转换效率(pce)已超过18%(joule2019,3,1140;sci.bull.2020,65,272)。
3.有机太阳能电池主要由电极、界面层、活性层组成。工作原理如下:活性层对光子进行吸收并转换成激子,激子(电子和空穴)扩散分离,再由界面层传输至电极,电极对电子或空穴进行收集。界面层材料的引入能有效降低载流子的抽取势垒,改善活性层和电极的接触,从而在电极界面处实现良好的欧姆接触,增强载流子的传输,减少复合,最终实现提高器件性能的作用。因此,在不断提升oscs效率的过程中,界面修饰工程是不可或缺的一部分。
4.界面材料可分为阳极界面材料(aim)和阴极界面材料(cim),aim例如pedot:pss、moo3、v2o5等已经被成熟的应用于oscs中,并表现出优秀的性能。商品化的无机cim例如金属(ca,mg)需要真空蒸发(adv.funct.mater.2018,28,1705847),金属氧化物(zno和tiox)纳米粒子的不稳定,限制了它们在oscs中的应用(j.mater.chem.c2019,7,7947)。因此,能采取正交溶剂加工的有机cim是未来高效、低成本oscs的发展趋势。目前具有代表性的有机cim例如pfn,pdin及其衍生物(pfn
‑
br和pdino),而在醇溶液中具有良好溶解性和成膜性的pfn
‑
br和pdino被广泛用于光伏器件。但是由于聚芴骨架的电子迁移率低,基于pfn
‑
br的器件只能在极薄的阴极界面层(约5nm)下高效工作(chem.mater.2004,16,708.)。pdino降低金属电极功函(wf)的能力有限,仅在铝(al)电极的有机光伏器件中显示出优异的性能。并且pdino热稳定差,难以得到高稳定性的有机太阳能电池(energ.environ.sci.2014,7,1966;nat.commun.2020,11,1)。
5.萘酞菁是由四个异吲哚单元构成的大共轭体系,具有可见吸收强、稳定性高、耐酸碱、耐光、耐热的优点。但是未修饰的萘酞菁类分子虽然在有机光伏中具有诸多优势,但是它的溶解性差,不能通过低成本的溶液处理,lumo能级高(
‑
3.6ev),电子接受能力差,一般只能用作空穴传输材料(angew.chem.,int.ed.2018,57,9885)。然而采取蒸镀方法制备薄膜条件苛刻,成本高,极大地限制了萘酞菁化合物的应用。因此开发一类没有以上缺陷的萘酞菁类cim对其在有机太阳能电池中的应用具有重要意义。
技术实现要素:
6.针对现有技术的以上缺陷或改进需求,本发明提供了一种硅萘酞菁阴极界面材料
及其制备方法和应用。通过将酰亚胺基团引入到萘酞菁外围,8个强吸电子羰基基团有效降低了分子能级,增强了分子吸电子能力,使其成为一类电子传输材料;通过氮端烷基可以有效改善分子在普通有机溶剂的溶解性,实现该材料的溶液加工;轴向采用四配位的硅原子,引入多个具有自掺杂效应的叔胺或季铵盐,有效增加分子在醇(甲醇、乙醇等)中溶解性,增强分子改善金属电极功函的能力,增强导电率,并首次将这类萘酞菁酰亚胺分子作为界面层应用到有机太阳能电池中。
7.本发明的第一目的是:提供了一种硅萘酞菁阴极界面材料。
8.本发明的第二目的是:提供了一种硅萘酞菁类阴极界面材料的制备方法。
9.本发明的第三目的是:提供了以上述硅萘酞菁作为阴极界面材料的太阳能电池。
10.为了实现上述第一目的,本发明提供一种硅萘酞菁类阴极界面材料,其结构通式如下式所示:
[0011][0012]
其中,r1各自独立的为含有取代基或不含取代基的c4
‑
c50的直链烷基、c4
‑
c50的支链烷基、c5
‑
c50的芳基、c4
‑
c50的烷氧基、c3
‑
c50的环烷基、c5
‑
c50的杂环基、c4
‑
50的亚烷基氧基烷基、c6
‑
c50的亚烷基氧基芳基、c6
‑
c50的亚烷基氧基杂环基。
[0013]
所述取代基为c1
‑
c16的烷基、c1
‑
c16的烷氧基、c5
‑
c16的芳基、c3
‑
c16的环烷基、c5
‑
16的杂环基、由c5
‑
c16的芳基和c1
‑
c16的烷基组成的杂芳烷基、由c5
‑
c16的芳基和c1
‑
c16的烷氧基组成的杂芳烷氧基、乙烯基、烯丙基、2
‑
丁烯基、3
‑
戊烯基、炔丙基、3
‑
戊炔基、氨基、甲基氨基、二甲基氨基、甲酰基、乙酰基、苯甲酰基、甲硫基、乙硫基、芳硫基、吡啶基硫基、羟基、卤素原子、氰基、醛基、c2
‑
c16的酯基、磺基、亚磺基、硝基、羧基和肼基中的至少一种。
[0014]
r2各自独立的为各自独立的为
[0015]
其中,n各自独立的为1
‑
18的整数,x
‑
为阴离子,所述阴离子各自独立的为cl
‑
、br
‑
、i
‑
或者
[0016]
优选地,r1各自独立的为含有取代基或不含取代基的c4
‑
c30的直链烷基、c4
‑
c30的支链烷基、c5
‑
c30的芳基、c4
‑
c30的烷氧基、c3
‑
c30的环烷基、c5
‑
c30的杂环基、c4
‑
c30的亚烷基氧基烷基、c6
‑
c30的亚烷基氧基芳基、c6
‑
c30的亚烷基氧基杂环基。
[0017]
所述的取代基为甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、羟基、
巯基、氟原子、氯原子、溴原子、碘原子、氰基、醛基、酯基、磺酸基、亚磺酸基、硝基、氨基、亚氨基、羧基和肼基中的至少一种。
[0018]
优选地,r2各自独立的为各自独立的为
[0019]
其中,n各自独立的为1
‑
10的整数,x
‑
为阴离子,所述阴离子各自独立的为cl
‑
、br
‑
、i
‑
或
[0020]
上述的r1可具体的选自含有取代基或不含取代基的甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基、己基、庚基、辛基、壬基、癸基、十一碳烷基、十二碳烷基、十三碳烷基、十四碳烷基、十五碳烷基、十六碳烷基、十七碳烷基、十八碳烷基、十九碳烷基、二十碳烷基、甲氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、仲丁氧基、异丁氧基、叔丁氧基、戊氧基、己氧基、庚氧基、辛氧基、壬氧基、癸氧基、十一碳烷氧基、十二碳烷氧基、十三碳烷氧基、十四碳烷氧基、十五碳烷氧基、十六碳烷氧基、十七碳烷氧基、十八碳烷氧基、十九碳烷氧基、二十碳烷氧基、苯基、萘基、蒽基、菲基、并四苯基、并五苯基、并六苯基、芘基、茚基、联苯基、芴基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基、十一碳环烷基、十二碳环烷基、十三碳环烷基、十四碳环烷基、十五碳环烷基、十六碳环烷基、十七碳环烷基、十八碳环烷基、十九碳环烷基、二十碳环烷基、噻吩基、吡咯基、呋喃基、硒吩基、噻咯基、碲吩基、噁唑基、吡啶基或者嘧啶基。
[0021]
更优选地,r1为结构式如下的取代基团:
[0022]
正丁基:正戊基:正己基:正庚基:正辛基:5
‑
异壬基:6
‑
十一烷基:7
‑
十三烷基:8
‑
十五烷基:9
‑
十七烷基:2,6
‑
二异丙基苯基:
[0023]
更优选地,r2选自如下的取代基团:n,n
‑
二甲基丙烷基:n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷基:n,n
‑
二甲基
‑
丙基氧化铵基:n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷基二氧化二铵基:n,n,n
‑
三甲基
‑
丙基氯化铵基:n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二氯化二铵基:n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基溴化铵基:n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基二溴化二铵
基:n,n,n
‑
三甲基
‑
丙基碘化铵基:n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二碘化二铵基:双三氟甲烷磺酰亚胺基
‑
n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基:二
‑
(双三氟甲烷磺酰亚胺基)
‑
n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基:
[0024]
为了实现上述第二目的,本发明所述的硅萘酞菁阴极界面材料的制备方法,其反应方程式如下:
[0025][0026]
其中,r1和r2的定义同结构通式中的定义。
[0027]
制备步骤如下:
[0028]
步骤一:以化合物1为反应底物,甲醇钠为碱试剂,甲醇为溶剂,加入甲醇氨的溶液制得化合物2;
[0029]
步骤二:以化合物2为反应底物,喹啉作为溶剂,加热条件下与sicl4成环生成化合物cl
‑
sincti;
[0030]
步骤三:以化合物cl
‑
sincti为反应底物,在碱性溶剂和水混合条件下加热反应生成化合物ho
‑
sincti;
[0031]
步骤四:r2为时,以化合物ho
‑
sincti为反应底物,均三甲苯为溶剂,加入oh
‑
r2,加热反应制得化合物sincti
‑
n;
[0032]
r2为时,以化合物sincti
‑
n为反应底物,氯仿为溶剂,间氯过氧苯甲酸为氧化剂,加热反应得到化合物sincti
‑
o;
[0033]
r2为x
‑
=br
‑
或i
‑
时,以化合物sincti
‑
n为反应底物,氯仿为溶剂,溴乙烷、碘乙烷、碘甲烷、溴代甲烷为季铵化试剂剂,加热反应得到化合物sincti
‑
i或sincti
‑
br;
[0034]
r2为时,以化合物sincti
‑
i为反应底物,四氢呋喃和水为溶剂,氯化碘为氯化剂,反应得到化合物sincti
‑
cl;
[0035]
r2为时,以化合物sincti
‑
i、sincti
‑
br或sincti
‑
cl为反应底物,甲醇为溶剂,双三氟甲烷磺酰亚胺锂为反应试剂,加热反应得到化合物sincti
‑
tfsi。
[0036]
优选地,所述的步骤一中,化合物1和甲醇钠的摩尔比为1:1~1:10,化合物1和氨的摩尔比为1:1~1:10,反应温度为40~64℃,反应时间为0.5~4h;
[0037]
步骤二中,sicl4与化合物2的摩尔比为1:2~1:10,反应温度为180~220℃,反应时间为0.25~2h;
[0038]
步骤三中,化合物cl
‑
sincti和水的摩尔比为1:2~1:10,碱性溶剂为喹啉、二甲基甲酰胺或二甲基亚砜,反应温度为60~120℃,反应时间为0.5~4h;
[0039]
步骤四中,
[0040]
r2为时,化合物ho
‑
sincti和oh
‑
r2的摩尔比为1:1~1:10,反应温度为150~180℃,反应时间为0.5~4h;
[0041]
r2为时,化合物sincti
‑
n和间氯过氧苯甲酸的摩尔比为1:1~1:10,反应温度为45~61℃,反应时间为0.5~24h;
[0042]
r2为x
‑
=br
‑
或i
‑
时,化合物sincti
‑
n与季铵化试剂的摩尔比为1:1~1:10,反应温度为45~61℃,反应时间为0.5~36h;
[0043]
r2为时,化合物sincti
‑
i和氯
化碘的摩尔比为1:1~1:10,反应温度为25~65℃,反应时间为0.5~12h;
[0044]
r2为时,化合物sincti
‑
i、sincti
‑
br或sincti
‑
cl和双三氟甲烷磺酰亚胺锂的摩尔比为1:2~1:10,反应温度为25~61℃,反应时间为0.5~6h。
[0045]
其中,部分化合物的具体制备过程如下:
[0046]
步骤一:以二氰基邻萘二甲酰亚胺为反应底物,甲醇钠为碱试剂,甲醇为溶剂,再加入甲醇氨的溶液制得1,3
‑
二亚氨基苯并酰亚胺异吲哚啉(化合物2)(二氰基邻萘二甲酰亚胺与甲醇钠摩尔比在1:1~10,二氰基邻萘二甲酰亚胺与氨摩尔比在1:1~10,温度40~64℃,反应0.5~4h)。例如1,3
‑
二亚氨基
‑
n
‑
(6
‑
十一烷基)苯并酰亚胺异吲哚啉,1h nmr(400mhz,cdcl3)δ8.38(d,j=19.3hz,4h),4.26(m,1h),2.09(m,2h),1.74(m,2h),1.24(m,12h),0.81(m,6h)ppm.
13
c nmr(101mhz,d6‑
dmso)δ167.8,137.8,137.4,134.23,134.0,129.3,129.2,126.5,125.9,124.8,123.9,52.1,32.1,31.3,26.1,22.4,14.2ppm.hrms(maldi
‑
tof):calcd for c
25
h
30
n4o
2 exact mass:418.2369,found:418.2376(m
+
)。二氰基邻萘酰亚胺合成方法参考文献(j.mater.chem.c2020,8,2186)。
[0047]
步骤二:以1,3
‑
二亚氨基苯并酰亚胺异吲哚啉(化合物2)为反应底物,喹啉作为溶剂,高温条件下与sicl4成环生成二氯硅萘酞菁酰亚胺(cl
‑
sincti)(sicl4与1,3
‑
二亚氨基苯并酰亚胺异吲哚啉摩尔比在1:2~10,温度180~220℃,反应0.25~2h)。例如n
‑
(6
‑
十一烷基)
‑
二氯硅萘酞菁酰亚胺(cl
‑
sincti
‑
c11),1h nmr(400mhz,cdcl3)δ10.31(s,2h),9.13(s,2h),4.48(m,1h),2.30(m,2h),1.89(m,2h),1.43(m,12h),0.92(t,6h)ppm.
13
c nmr(101mhz,cdcl3)δ167.9,149.7,136.7,133.4,129.5,127.0,126.5,53.0,32.5,31.5,26.5,22.6,14.1ppm.hrms(maldi
‑
tof):calcd for c
100
h
108
cl2n
12
o8si exact mass:1702.7559,found:1702.7588(m
+
).
[0048]
步骤三:以二氯硅萘酞菁酰亚胺为反应底物,在碱性溶剂和水一定温度条件下反应生成二羟基硅萘酞菁酰亚胺(ho
‑
sincti)(二氯硅萘酞菁酰亚胺与水摩尔比在1:2~10,碱性溶剂为喹啉、二甲基甲酰胺或二甲亚砜,温度60~120℃,反应0.5~4h)。例如n
‑
(6
‑
十一烷基)
‑
二羟基硅萘酞菁酰亚胺(ho
‑
sincti
‑
c11),1h nmr(400mhz,cdcl3)δ10.62(s,2h),9.18(s,2h),4.47(m,1h),2.31(m,2h),1.89(m,2h),1.43(m,12h),0.92(t,6h)ppm.
13
c nmr(101mhz,cdcl3)δ168.1,149.5,136.4,133.1,129.4,126.5,126.3,53.2,32.3,31.4,26.4,22.5,14.0ppm.hrms(maldi
‑
tof):calcd for c
100
h
110
n
12
o
10
si exact mass:1666.8237,found:1666.8254(m
+
).
[0049]
步骤四:以二羟基硅萘酞菁酰亚胺为反应底物。当r2为n,n
‑
二甲基丙烷时,以均三甲苯为溶剂。再加入3
‑
二甲氨基
‑1‑
丙醇,高温反应制得二
‑
(n,n
‑
二甲基丙烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
n)(二羟基硅萘酞菁酰亚胺与3
‑
二甲氨基
‑1‑
丙醇摩尔比在1:1~10,温度150~180℃,反应0.5~4h)。例如:二
‑
(n,n
‑
二甲基丙烷氧基
‑
n
‑
(6
‑
十一烷基))
‑
硅萘酞菁酰亚胺(sincti
‑
c11
‑
n),1h nmr(400mhz,cdcl3)δ10.26(s,2h),9.11(s,2h),4.46(m,1h),2.28(m,2h),1.91(m,2h),1.36(m,12h),1.07(s,3h),0.91(m,6h),
‑
0.21(m,1h),
‑
1.07(m,h),
‑
1.27(m,1h)ppm.
13
c nmr(101mhz,cdcl3)δ168.1,149.6,136.4,134.7,129.1,126.4,
126.3,54.5,54.1,53.1,44.4,32.5,31.6,27.4,26.6,22.6,14.1ppm.hrms(maldi
‑
tof):calcd for c
110
h
132
n
14
o
10
si exact mass:1837.0020,found:1837.0084(m
+
).当r2为n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷时,以均三甲苯为溶剂。再加入n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙醇胺,高温反应制得二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2n)(二羟基硅萘酞菁酰亚胺与n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙醇胺摩尔比在1:1~10,温度150~180℃,反应0.5~4h)。例如:二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基
‑
n
‑
(6
‑
十一烷基))
‑
硅萘酞菁酰亚胺(sincti
‑
c11
‑
2n),1h nmr(400mhz,cdcl3)δ10.34(s,2h),9.15(s,2h),4.46(s,1h),2.26(s,2h),1.89(s,2h),1.52(s,4h),1.31(d,j=41.6hz,12h),0.92(s,6h),0.56(s,1.5h),
‑
0.30(s,1h),
‑
1.22(s,1h)ppm.
13
c nmr(101mhz,cdcl3)δ167.8,149.5,136.4,134.3,129.3,126.3,125.0,109.7,56.5,55.3,54.0,53.0,44.4,40.9,32.4,31.5,26.5,22.6,14.0ppm.hrms(maldi
‑
tof):calcd for c
114
h
142
n
16
o
10
si exact mass:1924.0898,found:1924.0852(m
‑
).
[0050]
以二
‑
(n,n
‑
二甲基丙氧烷基)
‑
硅萘酞菁酰亚胺(sincti
‑
n)或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2n)为反应底物。当r2为n,n
‑
二甲基
‑
丙基氧化铵或n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷基氧化二铵时,以氯仿为溶剂,间氯过氧苯甲酸为氧化剂,一定温度下反应得到二
‑
(n,n
‑
二甲基
‑
丙基氧化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
o)或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷基二氧化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2o)(二
‑
(n,n
‑
二甲基丙氧烷基)
‑
硅萘酞菁酰亚胺或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺与间氯过氧苯甲酸摩尔比在1:1~10,温度45~61℃,反应0.5~24h)。当r2为n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基溴化铵或n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基二溴化二铵时,以氯仿为溶剂,溴乙烷为溴化剂,一定温度下反应得到二
‑
(n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基溴化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
br)或二
‑
(n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基二溴化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2br)(二
‑
(n,n
‑
二甲基丙氧烷基)
‑
硅萘酞菁酰亚胺或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺与溴乙烷摩尔比在1:1~10,温度45~61℃,反应0.5~36h)。当r2为n,n,n
‑
三甲基
‑
丙基碘化铵或n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二碘化二铵时,以氯仿为溶剂,碘甲烷为碘化剂,一定温度下反应得到二
‑
(n,n,n
‑
三甲基
‑
丙基碘化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
i)或二
‑
(n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二碘化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2i)(二
‑
(n,n
‑
二甲基丙氧烷基)
‑
硅萘酞菁酰亚胺或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺与碘甲烷摩尔比在1:1~10,温度45~65℃,反应0.5~12h)。
[0051]
以二
‑
(n,n,n
‑
三甲基
‑
丙基碘化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
i)或二
‑
(n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二碘化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2i)为反应底物。当r2为n,n,n
‑
三甲基
‑
丙基氯化铵或n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二氯化二铵时,以四氢呋喃和水为溶剂,氯化碘为氯化剂,一定温度下反应得到二
‑
(n,n,n
‑
三甲基
‑
丙基氯化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
cl)或二
‑
(n,n
‑
二甲基
‑
n
‑
(n,n,n
‑
三甲胺基乙基)乙烷基二氯化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2cl)(二
‑
(n,n
‑
二甲基丙氧烷基)
‑
硅萘酞菁酰亚胺或二
‑
(n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺与次氯酸钠摩尔比在1:1~10,温度25~65℃,反应0.5~12h)。
[0052]
以二
‑
(n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基溴化铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
br)或二
‑
(n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基二溴化二铵烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2br)为反应底物。当r2为双三氟甲烷磺酰亚胺基
‑
n,n
‑
二甲基
‑
n
‑
乙基
‑
丙基或二
‑
(双三氟甲烷磺酰亚胺基)
‑
n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷基时,以甲醇为溶剂,双三氟甲烷磺酰亚胺锂为反应试剂,一定温度下反应得到二
‑
(双三氟甲烷磺酰亚胺基
‑
n,n
‑
二甲基
‑
n
‑
乙基
‑
丙烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
tfsi)或二
‑
(二
‑
(双三氟甲烷磺酰亚胺基)
‑
n
‑
甲基
‑
n
‑
乙基
‑
n
‑
(n,n
‑
二甲基
‑
n
‑
乙胺基乙基)乙烷氧基)
‑
硅萘酞菁酰亚胺(sincti
‑
2tfsi)。
[0053]
本发明还提供一种硅萘酞菁阴极界面材料的应用,所述硅萘酞菁阴极界面材料用于制备有机太阳能电池。
[0054]
本发明还提供了一种由上述硅萘酞菁为阴极界面材料的有机太阳能电池,所述有机太阳能电池包括ito玻璃层、设置在ito玻璃层上的pedot/pass层、设置在pedot/pass层上的活性层、设置在活性层上的硅萘酞菁阴极界面层和设置在硅萘酞菁界面层上的金属电极层。
[0055]
优选地,所述硅萘酞菁阴极界面层采用所述的硅萘酞菁阴极界面材料制成。
[0056]
优选地,所述金属电极为铜电极、铝电极、银电极或金电极。
[0057]
本发明的有益效果:这种硅萘酞菁阴极界面材料具有以下优势:
[0058]
1.本发明制备得到的硅萘酞菁阴极界面材料是首次在萘酞菁的共轭母体上引入四个酰亚胺基团,使lumo能级从
‑
3.60ev降低至(
‑
3.84~
‑
3.99ev)。
[0059]
2.本发明制备得到的硅萘酞菁阴极界面材料通过改变酰亚胺基团n原子上的烷基链调节分子的溶解性,使得硅萘酞菁酰亚胺分子在氯仿、氯苯等普通有机溶剂中的溶解性良好,更有利于目标分子的分离提纯,制备获得的硅萘酞菁酰亚胺分子纯度也更高。
[0060]
3.本发明制备得到的硅萘酞菁阴极界面材料通过轴向引入两个叔胺或季铵盐基团,增大分子极性,有利于硅萘酞菁酰亚胺分子在极性溶剂(甲醇或乙醇)中溶解,达到其用极性溶剂处理,利于阴极界面层的制备。
[0061]
4.本发明合成工艺较现有技术产率更高、耗能更少、更有利于规模化大生产。
[0062]
5.本发明制备得到的硅萘酞菁酰亚胺分子首次用作阴极界面材料应用于有机太阳能电池,最高光电转化效率可达16.71%,远高于未修饰阴极界面层10.56%的器件效率。硅萘酞菁阴极界面材料能有效降低金属电极的功函,使其能修饰多种金属电极。同时硅萘酞菁阴极界面材料表现出良好的厚度不明感性、普适性和器件稳定性。
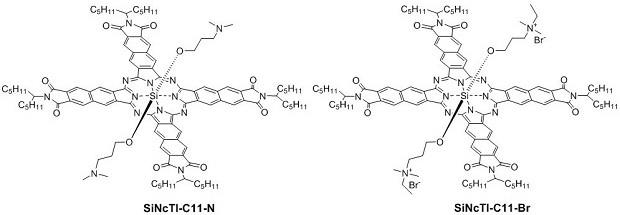
附图说明
[0063]
图1是化合物sincti
‑
c11
‑
n和sincti
‑
c11
‑
br硅萘酞菁阴极界面材料的结构示意图。
[0064]
图2是化合物sincti
‑
c11
‑
n和sincti
‑
c11
‑
br作为阴极界面材料的太阳能电池器件的结构图。
[0065]
图3是实施例54中四种有机太阳能电池器件的光电性质曲线图,其中,a是基于pm6:y6活性层的有机太阳能电池器件的电流密度
‑
电压曲线图,b是相对应的入射光电转换效率曲线图。
具体实施方式
[0066]
下面结合具体的实施例对本发明所述的硅萘酞菁阴极界面材料的合成方法做进一步说明,但是本发明的保护范围并不限于此。
[0067]
本发明用到的原料nh3的甲醇溶液、四氯化硅、3
‑
二甲氨基
‑1‑
丙醇、n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙醇胺、碘甲烷、溴乙烷和双三氟甲烷磺酰亚胺锂等均为市售商品,6,7
‑
二氰基萘酰亚胺根据文献方法(org.lett.2014,16,5442
‑
5445;org.lett.2019,21,3382
‑
3386)制备。
[0068]
实施例1
[0069]
化合物2a的合成(6,7
‑
二氰基
‑
正丁基
‑
萘单酰亚胺(化合物1a)的氨基化)如下:
[0070][0071]
氩气保护下,向100ml两口瓶中加入化合物1a(1g,3.30mmol),naoch3(178mg,3.30mmol),nh3(7m in ch3oh,33.0mmol),甲醇(30ml),在65℃下反应45min后,冷却至室温。将反应物在45ml的水中沉降,抽滤,得到白色固体。用二氯甲烷和甲醇(25/1,v/v)混合溶剂作洗脱剂进行柱分离,得白色固体2a,产量为695mg,产率为66.08%。
[0072]1h nmr(400mhz,cdcl3)δ8.35(d,4h),4.23(m,2h),2.12(m,2h),1.23(m,2h),0.81(m,3h)ppm.
[0073]
13
c nmr(101mhz,d6‑
dmso)δ167.7,137.66,137.3,134.1,134.2,129.4,129.2,126.4,125.6,124.4,123.4,52.3,26.4,22.1,14.1ppm.
[0074]
hrms(maldi
‑
tof):calcd for c
18
h
16
n4o
2 exact mass:320.1273,found:320.1245(m
+
).
[0075]
实施例2
[0076]
化合物2b的合成(6,7
‑
二氰基
‑
(6
‑
十一烷基)萘单酰亚胺(化合物1b)的氨基化)如下:
[0077][0078]
氩气保护下,向100ml两口瓶中加入化合物1b(1g,2.49mmol),naoch3(269mg,4.98mmol),nh3(7m in ch3oh,24.9mmol),甲醇(30ml),在65℃下反应30min后,冷却至室温。将反应物在30ml的水中沉降,抽滤,得到白色固体。用二氯甲烷和甲醇(50/1,v/v)混合溶剂作洗脱剂进行柱分离,得白色固体2b,产量为711mg,产率为68.11%。
[0079]1h nmr(400mhz,cdcl3)δ8.38(d,j=19.3hz,4h),4.26(m,1h),2.09(m,2h),1.74(m,2h),1.24(m,12h),0.81(m,6h)ppm.
[0080]
13
c nmr(101mhz,d6‑
dmso)δ167.8,137.8,137.4,134.2,134.0,129.3,129.2,126.5,125.9,124.8,123.9,52.1,32.1,31.3,26.1,22.4,14.2ppm.
[0081]
hrms(maldi
‑
tof):calcd for c
25
h
30
n4o
2 exact mass:418.2369,found:418.2376(m
+
).
[0082]
实施例3:化合物2c的合成
[0083][0084]
氩气保护下,向100ml两口瓶中加入化合物1c(0.81g,2.00mmol),naoch3(538mg,10mmol),nh3(7m in ch3oh,2mmol),甲醇(30ml),在50℃下反应30min后,冷却至室温。将反应物在30ml的水中沉降,抽滤,得到白色固体。用二氯甲烷和甲醇(50/1,v/v)混合溶剂作洗脱剂进行柱分离,得白色固体2c,产量为510mg,产率为60.15%。
[0085]
hrms(maldi
‑
tof):calcd for c
26
h
24
n4o
2 exact mass:424.1899,found:424.2860(m
+
).
[0086]
实施例4:化合物2d的合成
[0087][0088]
合成方法参照实施例3,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
21
h
12
n6o
2 exact mass:380.1022,found:380.3568(m
+
).
[0089]
实施例5:化合物2e的合成
[0090][0091]
合成方法参照实施例3,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
20
h
18
n4o
2 exact mass:346.1430,found:346.5689(m
+
).
[0092]
实施例6:化合物2f的合成
[0093][0094]
氩气保护下,向100ml两口瓶中加入化合物1f(1.68g,4.89mmol),naoch3(269mg,4.98mmol),nh3(7m in ch3oh,30mmol),甲醇(30ml),在40℃下反应1h后,冷却至室温。将反应物在30ml的水中沉降,抽滤,得到白色固体。用二氯甲烷和甲醇(50/1,v/v)混合溶剂作洗脱剂进行柱分离,得白色固体2f,产量为1.06g,产率为60.05%。
[0095]
hrms(maldi
‑
tof):calcd for c
20
h
19
n5o
2 exact mass:361.1539,found:361.5989(m
+
)。
[0096]
实施例7:化合物2g的合成
[0097][0098]
合成方法参照实施例6,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
20
h
11
n5o
4 exact mass:385.0811,found:385.4631(m
+
)。
[0099]
实施例8:化合物2h的合成
[0100][0101]
合成方法参照实施例6,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
18
h
10
n4o2s exact mass:346.0524,found:346.2358(m
+
)。
[0102]
实施例9:化合物2i的合成
[0103][0104]
合成方法参照实施例6,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
21
h
22
n4o
3 exact mass:378.1692,found:378.9872(m
+
)。
[0105]
实施例10:化合物2j的合成
[0106][0107]
合成方法参照实施例6,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
18
h
16
n4o
3 exact mass:336.1222,found:336.6587(m
+
)。
[0108]
实施例11:化合物2k的合成
[0109][0110]
合成方法参照实施例6,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
20
h
19
n5o
2 exact mass:424.0727,found:424.2354(m
+
)。
[0111]
实施例12:化合物cl
‑
sincti
‑
c4的合成
[0112][0113]
氩气保护下,在200℃条件下将sicl4(202mg,1.20mmol)逐滴添加到化合物2a(1g,3.12mmol)的干燥喹啉(20ml)溶液中,搅拌反应35分钟。冷却至室温,将反应物在80ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
c4,产量为553mg,产率为57.71%。
[0114]1h nmr(400mhz,cdcl3)δ10.30(s,2h),9.11(s,2h),4.45(m,2h),1.95(m,2h),1.48(m,2h),0.94(t,3h)ppm.
[0115]
13
c nmr(101mhz,cdcl3)δ167.8,149.4,136.3,133.1,129.2,127.0,126.1,52.0,26.4,23.6,14.3ppm.
[0116]
hrms(maldi
‑
tof):calcd for c
72
h
52
cl2n
12
o8si exact mass:1310.3177,found:1310.3196(m
+
).
[0117]
实施例13:化合物cl
‑
sincti
‑
c11的合成
[0118][0119]
氩气保护下,在210℃条件下将sicl4(101mg,0.60mmol)逐滴添加到化合物2b(500mg,1.19mmol)的干燥喹啉(10ml)溶液中,搅拌反应25分钟。冷却至室温,将反应物在50ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
c11,产量为265mg,产率为52.04%。
[0120]1h nmr(400mhz,cdcl3)δ10.31(s,2h),9.13(s,2h),4.48(m,1h),2.30(m,2h),1.89(m,2h),1.43(m,12h),0.92(t,6h)ppm.
[0121]
13
c nmr(101mhz,cdcl3)δ167.9,149.7,136.7,133.4,129.5,127.0,126.5,53.0,32.5,31.5,26.5,22.6,14.1ppm.
[0122]
hrms(maldi
‑
tof):calcd for c
100
h
108
cl2n
12
o8si exact mass:1702.7559,found:1702.7588(m
+
).
[0123]
实施例14:化合物cl
‑
sincti
‑
c12的合成
[0124][0125]
氩气保护下,在180℃条件下将sicl4(101mg,0.60mmol)逐滴添加到化合物2c(763mg,1.8mmol)的干燥喹啉(15ml)溶液中,搅拌反应50分钟。冷却至室温,将反应物在50ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
c13,产量为427mg,产率为55.01%。
[0126]
hrms(maldi
‑
tof):calcd for c
104
h
84
cl2n
12
o8si exact mass:1726.5681,found:1726.8064(m
+
).
[0127]
实施例15:化合物cl
‑
sincti
‑
c7的合成
[0128][0129]
氩气保护下,在220℃条件下将sicl4(101mg,0.60mmol)逐滴添加到化合物2d(904mg,2.38mmol)的干燥喹啉(12ml)溶液中,搅拌反应25分钟。冷却至室温,将反应物在
50ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
c7,产量为461mg,产率为50.02%。
[0130]
hrms(maldi
‑
tof):calcd for c
84
h
36
cl2n
20
o8si exact mass:1550.2171,found:1550.5698(m
+
).
[0131]
实施例16:化合物cl
‑
sincti
‑
c6的合成
[0132][0133]
合成方法参照实施例15,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
60
cl2n
12
o8si exact mass:1414.3803,found:1414.3589(m
+
).
[0134]
实施例17:化合物cl
‑
sincti
‑
c8的合成
[0135][0136]
合成方法参照实施例15,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
64
cl2n
16
o8si exact mass:1474.4239,found:1474.8903(m
+
).
[0137]
实施例18:化合物cl
‑
sincti
‑
c6n的合成
[0138][0139]
合成方法参照实施例15,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
32
cl2n
16
o
16
si exact mass:1570.1329,found:1570.6893(m
+
).
[0140]
实施例19:化合物cl
‑
sincti
‑
c6o的合成
[0141]
[0142]
氩气保护下,在205℃条件下将sicl4(101mg,0.60mmol)逐滴添加到化合物2i(2.26g,6mmol)的干燥喹啉(10ml)溶液中,搅拌反应150分钟。冷却至室温,将反应物在50ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
c6o,产量为536mg,产率为58.05%。
[0143]
hrms(maldi
‑
tof):calcd for c
84
h
76
cl2n
12
o
12
si exact mass:1542.4852,found:1542.9103(m
+
).
[0144]
实施例20:化合物cl
‑
sincti
‑
cs的合成
[0145][0146]
氩气保护下,在195℃条件下将sicl4(101mg,0.60mmol)逐滴添加到化合物2i(1.04g,6mmol)的干燥喹啉(15ml)溶液中,搅拌反应25分钟。冷却至室温,将反应物在50ml的甲醇中沉降,随后将沉淀物过滤并在真空烘箱中干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体cl
‑
sincti
‑
cs,产量为422mg,产率为48.9%。
[0147]
hrms(maldi
‑
tof):calcd for c
72
h
28
cl2n
12
o8s4si exact mass:1414.0182,found:1414.3271(m
+
).
[0148]
实施例21:化合物cl
‑
sincti
‑
c4o的合成
[0149][0150]
合成方法参照实施例20,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
72
h
52
cl2n
12
o
12
si exact mass:1374.2974,found:1374.3125(m
+
).
[0151]
实施例22:化合物cl
‑
sincti
‑
c10cl的合成
[0152][0153]
合成方法参照实施例20,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
96
h
40
cl6n
12
o8si exact mass:1726.0992,found:1726.5691(m
+
).
[0154]
实施例23:化合物ho
‑
sincti
‑
c6的合成
[0155][0156]
氩气保护下,向50ml两口瓶中加入化合物cl
‑
sincti
‑
c6(500mg,0.351mmol),h2o(63mg,63μl,3.51mmol),普通喹啉(15ml),在120℃温度下搅拌反应2小时。冷却至室温,将反应物在60ml的甲醇中沉降,抽滤,干燥得到绿色固体ho
‑
sincti
‑
c6,产量为477mg,产率为97.94%。
[0157]
hrms(maldi
‑
tof):calcd for c
80
h
70
n
12
o
10
si exact mass:1386.5107,found:1386.5134(m
+
).
[0158]
实施例24:化合物ho
‑
sincti
‑
c11的合成
[0159][0160]
氩气保护下,在50ml两口瓶中加入化合物cl
‑
sincti(200mg,0.117mmol),h2o(21mg,21μl,1.17mmol),普通喹啉(10ml),在100℃温度下搅拌反应1小时。冷却至室温,将反应物在40ml的甲醇中沉降,抽滤,干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体ho
‑
sincti
‑
c11,产量为187mg,产率为95.57%。
[0161]1h nmr(400mhz,cdcl3)δ10.62(s,2h),9.18(s,2h),4.47(m,1h),2.31(m,2h),1.89(m,2h),1.43(m,12h),0.92(t,6h)ppm.
[0162]
13
c nmr(101mhz,cdcl3)δ168.1,149.5,136.4,133.1,129.4,126.5,126.3,53.2,32.3,31.4,26.4,22.5,14.0ppm.
[0163]
hrms(maldi
‑
tof):calcd for c
100
h
110
n
12
o
10
si exact mass:1666.8237,found:1666.8254(m
+
).
[0164]
实施例25:化合物ho
‑
sincti
‑
c12的合成
[0165][0166]
氩气保护下,在50ml两口瓶中加入化合物cl
‑
sincti
‑
c12(202mg,0.117mmol),h2o(10mg,10μl,0.56mmol),普通喹啉(10ml),在120℃温度下搅拌反应0.5小时。冷却至室温,将反应物在40ml的甲醇中沉降,抽滤,干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固
体ho
‑
sincti
‑
c12,产量为189mg,产率为96.01%。
[0167]
hrms(maldi
‑
tof):calcd for c
104
h
86
n
12
o
10
si exact mass:1690.6359,found:1690.9632(m
+
).
[0168]
实施例26:化合物ho
‑
sincti
‑
c7的合成
[0169][0170]
氩气保护下,在50ml两口瓶中加入化合物cl
‑
sincti
‑
c7(181mg,0.117mmol),h2o(4.2mg,4.2μl,0.234mmol),普通二甲基亚砜(10ml),在60℃温度下搅拌反应3小时。冷却至室温,将反应物在40ml的甲醇中沉降,抽滤,干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体ho
‑
sincti
‑
c7,产量为167mg,产率为94.51%。
[0171]
hrms(maldi
‑
tof):calcd for c
84
h
38
n
20
o
10
si exact mass:1514.2849,found:1514.5763(m
+
).
[0172]
实施例27:化合物ho
‑
sincti
‑
c6的合成
[0173][0174]
合成方法参照实施例26,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
62
n
12
o
10
si exact mass:1378.4481,found:1378.8974(m
+
).
[0175]
实施例28:化合物ho
‑
sincti
‑
c8的合成
[0176][0177]
合成方法参照实施例26,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
66
n
16
o
10
si exact mass:1438.4917,found:1438.6485(m
+
).
[0178]
实施例29:化合物ho
‑
sincti
‑
c4o的合成
[0179][0180]
合成方法参照实施例26,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
72
h
54
n
12
o
14
si exact mass:1338.3652,found:1338.9106(m
+
).
[0181]
实施例30:化合物ho
‑
sincti
‑
cs的合成
[0182][0183]
氩气保护下,在50ml两口瓶中加入化合物cl
‑
sincti
‑
cs(165mg,0.117mmol),h2o(10.5mg,10.5μl,0.585mmol),普通二甲基甲酰胺(12ml),在95℃温度下搅拌反应2小时。冷却至室温,将反应物在40ml的甲醇中沉降,抽滤,干燥。用二氯甲烷作洗脱剂进行柱分离,得到绿色固体ho
‑
sincti
‑
cs,产量为154.7mg,产率为96.05%。
[0184]
hrms(maldi
‑
tof):calcd for c
72
h
30
n
12
o
10
s4si exact mass:1378.0860,found:1378.4396(m
+
).
[0185]
实施例31:化合物ho
‑
sincti
‑
c6o的合成
[0186][0187]
合成方法参照实施例30,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
84
h
78
n
12
o
14
si exact mass:1506.5530,found:1506.5530(m
+
).
[0188]
实施例32:化合物ho
‑
sincti
‑
c6n的合成
[0189][0190]
合成方法参照实施例30,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
80
h
34
n
16
o
18
si exact mass:1534.2006,found:1534.8923(m
+
).
[0191]
实施例33:化合物ho
‑
sincti
‑
c10cl的合成
[0192][0193]
合成方法参照实施例30,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
96
h
42
cl4n
12
o
10
si exact mass:1690.1670,found:1690.9463(m
+
).
[0194]
实施例34:化合物sincti
‑
c11
‑
n的合成
[0195][0196]
氩气保护下,在50ml两口瓶中加入化合物ho
‑
sincti
‑
c11(100mg,59.95μmol),3
‑
二甲氨基
‑1‑
丙醇(31mg,0.3mmol),均三甲苯(5ml),在180℃温度下搅拌反应0.5小时。冷却至室温,直接用二氯甲烷和甲醇(100/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c11
‑
n,产量为102mg,产率为92.55%。
[0197]1h nmr(400mhz,cdcl3)δ10.26(s,2h),9.11(s,2h),4.46(m,1h),2.28(m,2h),1.91(m,2h),1.36(m,12h),1.07(s,3h),0.91(m,6h),
‑
0.21(m,1h),
‑
1.07(m,1h),
‑
1.27(m,1h)ppm.
[0198]
13
c nmr(101mhz,cdcl3)δ168.1,149.6,136.4,134.7,129.1,126.4,126.3,54.5,54.1,53.1,44.4,32.5,31.6,27.4,26.6,22.6,14.1ppm.
[0199]
hrms(maldi
‑
tof):calcd for c
110
h
132
n
14
o
10
si exact mass:1837.0020,found:1837.0084(m
+
).
[0200]
实施例35:化合物sincti
‑
c4
‑
2n的合成
[0201][0202]
合成方法同实施例34,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
86
h
86
n
16
o
10
si exact mass:1530.6482,found:1530.7320(m
+
).
[0203]
实施例36:化合物sincti
‑
c11
‑
2n的合成
[0204][0205]
氩气保护下,在25ml两口瓶中加入化合物ho
‑
sincti
‑
11(350mg,210μmol),n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)乙醇胺(184.1mg,1.26mmol),均三甲苯(10ml),在180℃温度下搅拌反应1小时。冷却至室温,直接用二氯甲烷和甲醇(100/3,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c11
‑
2n,产量为385mg,产率为95.34%。
[0206]1h nmr(400mhz,cdcl3)δ10.34(s,2h),9.15(s,2h),4.46(s,1h),2.26(s,2h),1.89(s,2h),1.52(s,4h),1.31(d,j=41.6hz,12h),0.92(s,6h),0.56(s,1.5h),
‑
0.30(s,1h),
‑
1.22(s,1h)ppm.
[0207]
13
c nmr(101mhz,cdcl3)δ167.8,149.5,136.4,134.3,129.3,126.3,125.0,109.7,56.5,55.3,54.0,53.0,44.4,40.9,32.4,31.5,26.5,22.6,14.0ppm.
[0208]
hrms(maldi
‑
tof):calcd for c
114
h
142
n
16
o
10
si exact mass:1924.0898,found:1924.0852(m
‑
).
[0209]
实施例37:化合物sincti
‑
c11
‑
br的合成
[0210][0211]
氩气保护下,在25ml两口瓶中加入化合物sincti
‑
c11
‑
n(100mg,54.39μmol),溴乙烷(59mg,0.54mmol)和氯仿(10ml),在25℃温度下搅拌反应11小时。直接用二氯甲烷和甲醇(100/3,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c11
‑
br,产量为74mg,产率为66.45%。
[0212]1h nmr(400mhz,cdcl3)δ10.25(s,2h),9.07(s,2h),4.41(m,1h),2.23(m,2h),1.85(m,2h),1.67(m,2h),1.32(m,12h),0.89(m,6h),0.57(m,1h),
‑
0.21(t,1.5h),
‑
0.81(m,1h),
‑
1.31(m,1h)ppm.
[0213]
13
c nmr(101mhz,cdcl3)δ167.7,149.6,136.6,133.7,129.6,126.7,126.3,57.8,53.0,52.3,49.6,32.3,31.5,26.5,22.6,14.0,6.4ppm.
[0214]
hrms(maldi
‑
tof):calcd for c
114
h
142
br2n
14
o
10
si exact mass:2052.9169,found:2052.9194(m
+
).
[0215]
实施例38:化合物sincti
‑
c11
‑
2i的合成
[0216][0217]
氩气保护下,在25ml两口瓶中加入化合物sincti
‑
c11
‑
2n(100mg,51.96μmol),碘甲烷(74mg,0.52mmol)和氯仿(10ml),在40℃温度下搅拌反应24小时。用二氯甲烷和甲醇(20/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c11
‑
2i,产量为68mg,产率为64.45%。
[0218]1h nmr(400mhz,cdcl3)δ10.30(s,2h),9.06(s,2h),4.39(s,1h),3.25(s,1.5h),2.50(s,2h),2.36(s,2h),2.18(s,6h),1.84(s,4h),1.32(s,18h),1.14(s,2h),0.86(s,6h),0.39(s,1.5h),
‑
0.26(s,1h),
‑
1.23(s,1h)ppm.
[0219]
13
c nmr(101mhz,cdcl3)δ167.9,149.5,136.6,133.9,129.3,126.7,126.5,60.6,54.0,52.9,39.5,32.3,31.5,26.5,22.5,14.1ppm.
[0220]
hrms(maldi
‑
tof):calcd for c
118
h
154
i4n
16
o
10
si exact mass:2490.7982,found:2490.7990(m
+
).
[0221]
实施例39:化合物sincti
‑
c7
‑
2n的合成
[0222][0223]
合成方法参照实施例35,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
102
h
78
n
24
o
10
si exact mass:1826.6102,found:1826.5713(m
+
).
[0224]
实施例40:化合物sincti
‑
c8
‑
n的合成
[0225][0226]
合成方法参照实施例35,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
94
h
96
n
18
o
10
si exact mass:1664.7326,found:1664.2351(m
+
).
[0227]
实施例41:化合物sincti
‑
c6
‑
2n的合成
[0228][0229]
合成方法参照实施例35,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
94
h
94
n
16
o
10
si exact mass:1634.7108,found:1634.8980(m
+
).
[0230]
实施例42:化合物sincti
‑
c7
‑
i的合成
[0231][0232]
合成方法参照实施例37,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
106
h
90
i4n
24
o
10
si exact mass:2394.3220,found:2394.3220(m
+
).
[0233]
实施例43:化合物sincti
‑
c12
‑
2n的合成
[0234]
[0235]
合成方法参照实施例35,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
122
h
126
n
16
o
10
si exact mass:2002.9612,found:2002.5637(m
+
).
[0236]
实施例44:化合物sincti
‑
c10cl
‑
n的合成
[0237][0238]
氩气保护下,在50ml两口瓶中加入化合物ho
‑
sincti
‑
c10cl(101mg,60.00μmol),二甲氨基
‑1‑
辛醇(10mg,60.00μmol),均三甲苯(5ml),在150℃温度下搅拌反应3小时。冷却至室温,直接用二氯甲烷和甲醇(100/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c10cl
‑
n,产量为107.8mg,产率为90.06%。
[0239]
hrms(maldi
‑
tof):calcd for c
118
h
88
cl4n
14
o8si exact mass:1996.5433,found:1996.5893(m
+
).
[0240]
实施例45:化合物sincti
‑
c6o
‑
2n的合成
[0241][0242]
合成方法参照实施例43,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
112
h
138
n
16
o
12
si exact mass:1927.0449,found:1927.5693(m
+
).
[0243]
实施例46:化合物sincti
‑
c4o
‑
2n的合成
[0244][0245]
氩气保护下,在50ml两口瓶中加入化合物ho
‑
sincti
‑
c4o(80mg,60.00μmol),3
‑
n
‑
甲基
‑
n
‑
(n,n
‑
二甲胺基乙基)
‑1‑
丙醇(80mg,0.5mmol),均三甲苯(5ml),在170℃温度下搅拌反应1小时。冷却至室温,直接用二氯甲烷和甲醇(100/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c4o
‑
2n,产量为93.4mg,产率为96.08%。
[0246]
hrms(maldi
‑
tof):calcd for c
80
h
90
n
16
o
14
si exact mass:1622.6592,found:1622.9631(m
+
).
[0247]
实施例47:化合物sincti
‑
cs
‑
2n的合成
[0248][0249]
合成方法参照实施例45,产物经质谱鉴定。
[0250]
hrms(maldi
‑
tof):calcd for c
86
h
62
n
16
o
10
s4si exact mass:1634.3487,found:1634.8901(m
+
).
[0251]
实施例48:化合物sincti
‑
c6n
‑
n的合成
[0252][0253]
合成方法参照实施例45,产物经质谱鉴定。hrms(maldi
‑
tof):calcd for c
92
h
60
n
18
o8si exact mass:1732.4102,found:1732.5890(m
+
).
[0254]
实施例49:化合物sincti
‑
c6o
‑
2i的合成
[0255][0256]
氩气保护下,在25ml两口瓶中加入化合物sincti
‑
c6o
‑
2n(100mg,51.89μmol),碘甲烷(29.5mg,0.21mmol)和氯仿(10ml),在61℃温度下搅拌反应0.5小时。用二氯甲烷和甲醇(20/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c6o
‑
2i,产量为80mg,产率为61.80%。
[0257]
hrms(maldi
‑
tof):calcd for c
116
h
150
i4n
16
o
12
si exact mass:2494.7567,found:2494.8013(m
+
).
[0258]
实施例50:化合物sincti
‑
c6o
‑
2o的合成
[0259][0260]
氩气保护下,在25ml两口瓶中加入化合物sincti
‑
c6o
‑
2i(100mg,40.09μmol),间氯过氧苯甲酸(27.5mg,0.16mmol)和氯仿(12ml),在45℃温度下搅拌反应0.5小时。用二氯甲烷和甲醇(20/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c6o
‑
2o,产量为76mg,产率为95.08%。
[0261]
hrms(maldi
‑
tof):calcd for c
112
h
138
n
16
o
16
si exact mass:1991.0246,found:1991.8732(m
+
).
[0262]
实施例51:化合物sincti
‑
c6n
‑
br的合成
[0263][0264]
合成方法参照实施例48,产物结构经质谱鉴定。hrms(maldi
‑
tof):calcd for c
96
h
70
br2n
18
o
18
si exact mass:1948.3251,found:1948.7901(m
+
).
[0265]
实施例52:化合物sincti
‑
c6n
‑
tfsi的合成
[0266][0267]
氩气保护下,在25ml两口瓶中加入化合物sincti
‑
c6n
‑
br(100mg,51.30μmol),双三氟甲烷磺酰亚胺锂(29.4mg,0.10mmol)和甲醇(15ml),在25℃温度下搅拌反应0.5小时。用二氯甲烷和甲醇(20/1,v/v)的混合溶剂作洗脱剂进行柱分离,得到绿色固体sincti
‑
c6n
‑
tfsi,产量为116mg,产率为96.31%。
[0268]
hrms(maldi
‑
tof):calcd for c
100
h
70
f
12
n
20
o
26
s4si exact mass:2350.3236,
found:2350.1675(m
+
).
[0269]
实施例53
[0270]
对化合物sincti
‑
c11
‑
n和sincti
‑
c11
‑
br采用空间电荷限制电流(sclc)的方法测量其纯膜的电子迁移率,采用紫外光电子能谱得出两个分子在金属电极银和铝上的功函值,并采用半导体测试系统测试了它们的电导率。
[0271]
表1材料电化学性质对比表
[0272][0273][0274]
结果如表1所示。由表1可知,电子迁移率:sincti
‑
c11
‑
br和sincti
‑
c11
‑
n与已有技术报道的优秀界面层材料pdino差不多,表明这两个化合物均具有优异的电子传输能力,并且性能较好;电导率:sincti
‑
c11
‑
br能媲美pdino,优于sincti
‑
c11
‑
n,表明本发明的硅萘酞菁分子中引入叔胺和离子化的季铵盐基团均能提高分子导电率;功函:sincti
‑
c11
‑
br和sincti
‑
c11
‑
n都能有效降低金属电极功函,从4.52(ag)和4.28(al)降低至3.96
‑
4.23ev和3.70
‑
4.04ev,说明本发明制得的硅萘酞菁类分子能有效降低活性层与金属间功函,降低界面势垒,增强电荷传输。
[0275]
实施例54
[0276]
制备以化合物sincti
‑
c11
‑
n和sincti
‑
c11
‑
br作为阴极界面材料的太阳能电池:
[0277]
以化合物sincti
‑
c11
‑
n和sincti
‑
c11
‑
br作为阴极界面材料,其分子结构式见图1。以商品化的聚合物pm6和小分子y6为活性层材料,通过把给体和受体混在一起旋涂成膜,作为太阳能电池的活性层;然后采用正相结构法,在glass/ito基底层上、旋涂pedot/pass层、旋涂活性层、旋涂阴极界面层、蒸镀ag层,制备得到体相异质结太阳能电池。阴极界面层材料配成1mg/ml或0.5mg/ml的溶液进行旋涂。该太阳能电池的结构从下往上依次为:glass/ito基底层
→
pedot/pass层(厚度:30nm)
→
pm6:y6活性材料层(厚度:90nm)
→
阴极界面层(厚度:10nm)
→
ag层(厚度:10nm),具体结构见图2。
[0278]
表2电池光电转换效率对比表
[0279]
cilv
oc
(v)j
sc
(j
cal
.)
a
(ma cm
‑2)ff(%)pce(%)w/o0.78524.67(24.17)54.5610.56pdino0.83025.81(25.72)72.3415.49sincti
‑
c11
‑
n0.80124.78(24.36)58.5211.62sincti
‑
c11
‑
br0.84725.98(25.49)75.9416.71
[0280]
a
短路电流(j
cal.
)通过外量子转换效率(ipce,图3)计算得到.
[0281]
以没旋涂界面层和已有技术报道的pdino为参比,考察sincti
‑
c11
‑
n和sincti
‑
c11
‑
br作为阴极界面层,制备得到的正向有机太阳能电池,进行光电转化效率测定,其结果
见表2。
[0282]
由表2可知,当以sincti
‑
c11
‑
br作为阴极界面层的电池效率最高,达到16.71%,远高于没有界面层电池的10.56%效率,也高于已有技术的pdino的15.49%效率(效率曲线图如图3所示)。
[0283]
实施例55
[0284]
其它化合物的性质以如下表格(表格3)的形式给出,测试条件参照实施例52和实施例53。
[0285]
表3其他化合物性质列表
[0286]
化合物迁移率/cm
2 v
‑1s
‑1电导率/s cm
‑1pce(%)sincti
‑
c4
‑
2n3.73
×
10
‑51.01
×
10
‑611.89sincti
‑
c12
‑
n3.33
×
10
‑51.21
×
10
‑611.69sincti
‑
c8
‑
n3.56
×
10
‑51.69
×
10
‑612.39sincti
‑
c7
‑
i6.15
×
10
‑51.31
×
10
‑515.78sincti
‑
c6
‑
n2.89
×
10
‑54.12
×
10
‑611.98sincti
‑
c6o
‑
2o5.15
×
10
‑52.21
×
10
‑514.73sincti
‑
c6o
‑
2i6.38
×
10
‑56.79
×
10
‑515.65sincti
‑
c6n
‑
tfsi4.92
×
10
‑56.34
×
10
‑515.58sincti
‑
cs
‑
2n3.63
×
10
‑54.01
×
10
‑612.69
[0287]
最后需要强调的是,以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种变化和更改,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1