一种PCR检测猕猴桃软腐病病原菌拟茎点霉菌的特异性引物、方法及应用
一种pcr检测猕猴桃软腐病病原菌拟茎点霉菌的特异性引物、方法及应用
技术领域
1.本发明涉及dna分子标记技术领域,具体涉及一种pcr检测猕猴桃软腐病病原菌拟茎点霉菌的特异性引物、方法及应用。
背景技术:
2.我国是猕猴桃驯化品种的起源地和野生品种多样性中心,具有得天独厚的丰富自然资源。近年来,猕猴桃产业发展迅速。据2019年7月联合国粮农组织统计,截止到2017年底,我国猕猴桃采收面积和产量均稳居世界第一位,在世界猕猴桃产业发展中都占有举足轻重的地位。
3.猕猴桃属于呼吸跃变型果实,有明显的生理后熟过程,采后极易变软腐烂,不耐贮藏。猕猴桃软腐病是发生在果实贮藏期的最常见的真菌性病害,发病初期果实外表无明显症状,随着病情发展,发病部位表皮开始变软,微微凹陷,病斑中心果肉呈乳白色,周围果肉呈黄绿色透明状,7天左右果实完全腐烂,并产生刺鼻的气味。猕猴桃软腐病在世界各个主产国,如新西兰,智利,韩国,意大利,伊朗及我国都有过相应报道,最高发病率最高达68%。猕猴桃软腐病分布广,发病快,发病率高,造成严重的经济损失,且有逐年加重的趋势,对猕猴桃产业发展产生严重威胁。
4.目前报道的猕猴桃软腐病病原菌有葡萄座腔菌botryosphaeria dothidea,拟茎点霉菌 phomopsis spp.(有性态diaporthe spp.),灰霉菌botrytis cinerea,链格孢菌alternaria spp.,青霉菌penicillium spp.等等,其中葡萄座腔菌botryosphaeria dothidea和拟茎点霉菌phomopsisspp.(有性态diaporthe spp.)为主要致病菌。目前,猕猴桃软腐病病原菌的检测鉴定主要依赖于传统的病原菌分离鉴定,主要包括症状观察、病原菌分离、显微形态观察及分子鉴定等,耗时较长,极不利于猕猴桃软腐病的早期检测及预防。pcr检测是最常用的一种分子生物学检测方法,可通过快速扩增病原微生物的特异性核酸序列,实现病原菌的快速检测,近年来已在传染病、食源性致病菌污染、环境污染、肿瘤遗传标记等领域广泛应用,是比较成熟且应用范围最广的检测技术。但是现有的pcr检测猕猴桃软腐病病原菌的引物特异性不够高,检测的准确度比较低。
5.鉴于上述缺陷,本发明创作者经过长时间的研究和实践终于获得了本发明。
技术实现要素:
6.本发明的目的在于解决目前没有快速检测猕猴桃软腐病病原的菌拟茎点霉属的特异性引物,现有pcr检测的准确度低、特异性不高的问题,提供了一种pcr检测猕猴桃软腐病病原菌拟茎点霉菌的特异性引物、方法及应用。
7.为了实现上述目的,本发明提供一种pcr检测猕猴桃软腐病病原菌拟茎点霉菌的特异性引物,所述特异性引物为两对,第一对引物为正向引物d.sp
‑
29和反向引物d.sp
‑
485,第二对引物为正向引物d.sp
‑
140和反向引物d.sp
‑
506,其序列分别为:
8.d.sp
‑
29:5
′‑
ccctttgtgaacttatacctt
‑3′
;
9.d.sp
‑
485:5
′‑
cagggcaccgccagggccttccag
‑3′
;
10.d.sp
‑
140:5
′‑
ttgtttttacactgaaactctg
‑3′
;
11.d.sp
‑
506:5
′‑
aagttgggggtttaacggca
‑3′
。
12.所述第一对引物针对拟茎点霉属特异性扩增片段大小为456bp,所述第二队引物针对拟茎点霉属特异性扩增片段大小为366bp。
13.本发明还公开了一种采用上述特异性引物通过pcr检测猕猴桃软腐病病原菌拟茎点霉菌的方法,包括以下步骤:
14.s1:提取待检测样品dna;
15.s2:以待测样品为dna为模板,分别采用两对引物进行pcr扩增;
16.s3:扩增产物琼脂糖凝胶电泳分析。
17.所述步骤s1中提待检测样品dna的具体步骤如下:
18.s11:称取待检测样品1g左右,加液氮在研钵中用研磨棒研磨成细末,将细末转移至2ml 离心管中,加入600μl预热至65℃的2
×
ctab,颠倒混匀,65℃水浴45~60min;
19.s12:取出离心管冷却至室温,加入600μl氯仿:异戊醇溶液,振荡混匀,10000rpm离心10min,取上清液至另一1.5ml离心管中,再加入等体积氯仿:异戊醇溶液,10000rpm离心10min;
20.s13:取上清液至另一1.5ml离心管中,加入0.6倍体积的预冷的异丙醇,轻轻颠倒混匀,
ꢀ‑
20℃放置1h,10000rpm离心10min;
21.s14:去掉上清液,加入70%无水乙醇清洗2次,室温干燥后用适量无菌ddh2o溶解沉淀的dna,
‑
20℃保存备用。
22.所述步骤s11中2
×
ctab含2%巯基乙醇和2%的pvpp。
23.所述步骤s12中氯仿:异戊醇的体积比为24:1。
24.所述步骤s2中pcr扩增的反应体系总体积为25μl,包括10
×
taq pcr buffer 2.5μl, 2.5mmol/l dntp 2μl,taq酶0.5μl,上下游引物各0.5μl,模板dna1μl,无菌ddh2o 13μl。
25.所述步骤s2中pcr扩增程序为:94℃预变性3min,94℃变性30s,61℃退火30s,72℃延伸30s,35个循环,72℃总延伸5min。
26.所述步骤s3中琼脂糖凝胶电泳采用1%的琼脂糖凝胶,采用120v恒压电泳15min。
27.与现有技术比较本发明的有益效果在于:本发明提供两对用于快速检测猕猴桃软腐病病原菌拟茎点霉属的特异性引物及其检测方法,可以快速检测猕猴桃中拟茎点霉属的存在,检测准确度和特异性高,并分别能在接种拟茎点霉菌后早期检测到病原菌,达到猕猴桃软腐病早期检测的目的,对于猕猴桃软腐病的早期检测,预防和控制具有非常重要的意义和经济意义。
附图说明
28.图1为引物特异性的pcr检测结果图,(a)为引物d.sp
‑
29/d.sp
‑
485的引物特异性,(b) 为引物d.sp
‑
140/d.sp
‑
506的引物特异性;
29.图2为引物准确性的pcr检测结果图,(a)为引物d.sp
‑
29/d.sp
‑
485的引物准确性,(b) 为引物d.sp
‑
140/d.sp
‑
506的引物准确性;
30.图3为猕猴桃接种拟茎点霉菌(diaporthe nobilis)后不同时间发病情况;
31.图4为引物灵敏性的pcr检测结果图,(a)为引物d.sp
‑
140/d.sp
‑
506的引物灵敏性, (b)为引物d.sp
‑
29/d.sp
‑
485的引物灵敏性。。
具体实施方式
32.以下结合附图,对本发明上述的和另外的技术特征和优点作更详细的说明。
33.一、检验引物特异性
34.以葡萄座腔菌botryosphaeria dothidea,扩展青霉菌penicillium expansum,链格孢菌 alternaria alternata,灰霉菌botrytis cinerea,节菱孢菌arthrinium saccharicola,枝孢霉菌 cladosporium sp.,拟隐壳属cryptosporiopsis spp.,拟茎点霉菌diaporthe sp.,黑附球菌 epicoccum nigrum,新壳梭孢菌neofusicoccum parvum,镰刀菌fusarium spp.,毛霉菌mucorspp.等共计12个种属的16个真菌dna为模板,通过pcr验证引物的特异性。
35.pcr检测过程如下:
36.1、提取待检测样品dna
37.(1)称取待检测样品1g左右,加液氮在研钵中用研磨棒研磨成细末,将细末转移至2ml 离心管中,加入600μl预热至65℃的2
×
ctab,颠倒混匀,65℃水浴45~60min;
38.(2)取出离心管冷却至室温,加入600μl氯仿:异戊醇溶液,振荡混匀,10000rpm离心10min,取上清液至另一1.5ml离心管中,再加入等体积氯仿:异戊醇溶液,10000rpm离心10min;
39.(3)取上清液至另一1.5ml离心管中,加入0.6倍体积的预冷的异丙醇,轻轻颠倒混匀,
ꢀ‑
20℃放置1h,10000rpm离心10min;
40.(4)去掉上清液,加入70%无水乙醇清洗2次,室温干燥后用适量无菌ddh2o溶解沉淀的dna,
‑
20℃保存备用。
41.2、以待测样品为dna为模板,分别采用两对引物进行pcr扩增;
42.3、扩增产物琼脂糖凝胶电泳分析。结果如图1所示,引物d.sp
‑
29/d.sp
‑
485(图1a)和引物d.sp
‑
140/d.sp
‑
506(图1b)均只在拟茎点霉属中扩增出条带(第1和第2泳道),其他种属中未扩增出条带。且两对引物的目标条带单一,无杂带,说明这两对引物特异性非常好。
43.二、检验引物准确性
44.为了验证引物在猕猴桃果实上检测病原菌的准确性,我们从市场上购买16个猕猴桃软腐病病果,取病果果肉组织提取dna,分别用4对引物进行pcr检测,健康果实的dna作为空白对照,以人工接种已知病菌的果实dna作为阳性对照进行pcr验证。同时对发病猕猴桃进行传统的病原菌分离鉴定,将pcr结果与分离鉴定结果对比,验证pcr检测结果准确性。
45.检测结果如图2所示,图a为引物d.sp
‑
29/d.sp
‑
485的检测结果,图b为引物d.sp
‑
140/d. sp
‑
506的检测结果。由pcr检测结果可以推测第2、3、7、8、9、10、11、13、14、15个果实的致病菌为拟茎点霉菌,第1、4、5、6、12和第16个果实应为其他致病菌引起。同时对 16个病果进行病原菌分离,并进行its测序,测序结果在ncbi网站进行blast分析,以初步判定病原菌的分类,1
‑
16号样品its序列见序列表。表1为从16个病果上分离得到的病原菌its序列比
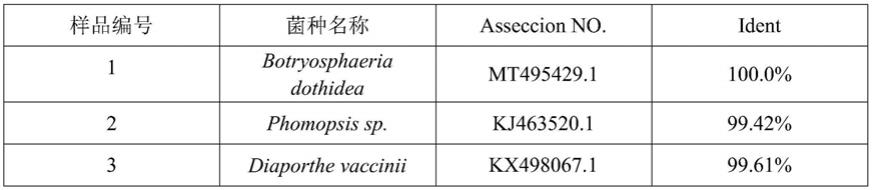
对结果。由表1可知,its测序结果与pcr检测结果一致,第2、3、7、8、 9、10、11、13、14、15个果实的致病菌为拟茎点霉菌,第1、4、5、6、12和第16个果实的软腐病分别由葡萄座腔菌、灰霉菌、青霉菌和链格孢菌所引起。由此证明,引物检测结果与病原菌分离结果一致,检测结果准确可信。
46.表1 16个病果的病原菌its序列比对结果
[0047][0048][0049]
三、检验引物灵敏性
[0050]
为了验证引物在猕猴桃果实上检测病原菌的灵敏性,采用离体接种法接种健康的猕猴桃果实。从市面购买大小、硬度相近的健康徐香猕猴桃,用1%naclo浸泡10min进行表面消毒,用无菌水冲洗干净,在超净工作台中晾干后在果实赤道部位用无菌接种针制造伤口。用无菌接种钉制造直径为2mm,深度为3mm的接种孔。每个接种孔加入10μl浓度为1
×
10
6 cfu/ml的拟茎点霉菌(diaporthe nobilis)孢子悬浮液,接种无菌ddh2o为对照组。接种后,猕猴桃果实室温(22~25℃)下放置于干净的塑料筐中,用塑料袋密封并保持湿度90%以上。接种后每间隔12h,取接种点周围直径为15mm,深度为10mm的果肉,样品放入液氮中冷冻后放入
‑
80℃冰箱中保存备用。同时采用十字交叉法对猕猴桃病斑直径进行测量并统计。分别用2对引物进行pcr检测,接种无菌ddh2o的果实dna作为空白对照,以拟茎点霉菌dna 作为阳性对照,对引物检测灵敏性进行pcr验证。
[0051]
从接种后表型观察可以看出,拟茎点霉菌(diaporthe nobilis)接种后48小时可观察到病斑,60小时后病斑开始出现扩展,72小时后病斑扩展速度加快,到96小时形成直径
约为24mm 的病斑。pcr检测结果如图4所示,图a为d.sp
‑
140/d.sp
‑
506引物的检测结果,图b为引物 d.sp
‑
29/d.sp
‑
485的检测结果,图中c表示对照,t表示接种拟茎点霉菌的处理组,m为marker;数字代表接种后时间。如:c
‑
12代表接种后12h的对照组,t
‑
12代表接种拟茎点霉菌后12 小时的处理组。由pcr检测结果可以看出,d.sp
‑
140/d.sp
‑
506在接种后24小时已经可以检测到条带,而d.sp
‑
29/d.sp
‑
485则在接种后60小时可以检测到条带,d.sp
‑
140/d.sp
‑
506相较于d.sp
‑
29/d.sp
‑
485灵敏性更高。
[0052]
以上所述仅为本发明的较佳实施例,对本发明而言仅仅是说明性的,而非限制性的。本专业技术人员理解,在本发明权利要求所限定的精神和范围内可对其进行许多改变,修改,甚至等效,但都将落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1