QGK三肽及其应用
qgk三肽及其应用
技术领域
1.本发明属于生物技术领域,具体涉及生物活性肽领域,特别涉及qgk三肽及其应用。
背景技术:
2.溃疡性结肠炎(uc)是一种慢性、特发性结肠粘膜炎症性疾病,起始于直肠,通常以连续性方式向近端直肠甚至结肠蔓延,临床症状以血性腹泻为典型。相比于克罗恩病,uc更为普遍。据统计,北美地区和北欧地区患病率最高,每10万人中就有9~20例溃疡性结肠炎患者,而南半球和东部地区国家患病率相对较低。近年来,随着饮食习惯西式化、人们生活压力增加,uc患病率显著上升,呈逐年递增趋势,这给公共卫生事业带来了沉重的负担。溃疡性结肠炎的发病率呈双峰型,主要发病高峰在15
‑
30岁之间,第二个较小的发病高峰在50
‑
70岁之间。
3.肠上皮细胞是抵御外来病原体的第一层物理屏障。正常状态下,上皮层被黏液层覆盖,黏膜层是宿主免疫细胞和腔内微生物之间的物理屏障,并结合抗菌肽(防御素)一起来帮助宿主抵御病原微生物入侵。而uc患者体内,某些结肠黏蛋白亚型(mucin
‑
2)硫化物的合成减少,上皮屏障受损,通透性增加,黏膜反应异常。炎症期间持续的上皮损伤及防御素降低导致肠道菌群的暴露和炎症的放大(frank,amand,feldman,boedeker,harpaz,&pace,2007;simms,doecke,walsh,huang,fowler,&radford
‑
smith,2008)。肠道固有层由树突状细胞和巨噬细胞组成,它们将抗原呈递给b细胞和t细胞,进而激活获得新免疫反应。在uc患者中,激活和成熟的树突状细胞数量随着外部刺激的增加而增加,它们的数量与疾病的发展息息相关。
4.在本发明中,申请人公开了一种抗炎三肽的氨基酸序列,并检测了其在体外炎症模型和体内炎症模型中表现的抗炎效果,结果表明该三肽在体内体外均能抑制促炎因子的表达,具有良好的抗炎效果。
技术实现要素:
5.本发明的目的是解决现有技术的不足,提供一种qgk三肽,其氨基酸序列为gln
‑
gly
‑
lys,分子量为331da。该qgk三肽通过固相合成法获得,能够有效预防并缓解炎症性肠病,可以应用在制备预防和/或缓解炎症性肠病的食品或药物中。
6.本发明的另一目的是提供一种药物组合物,其活性成分包括qgk三肽,用于预防和/或缓解炎症性肠病。该药物组合物还可以包括溶剂或可药用辅助剂。
7.本发明采用tnf
‑
α诱导人肠上皮细胞(ht
‑
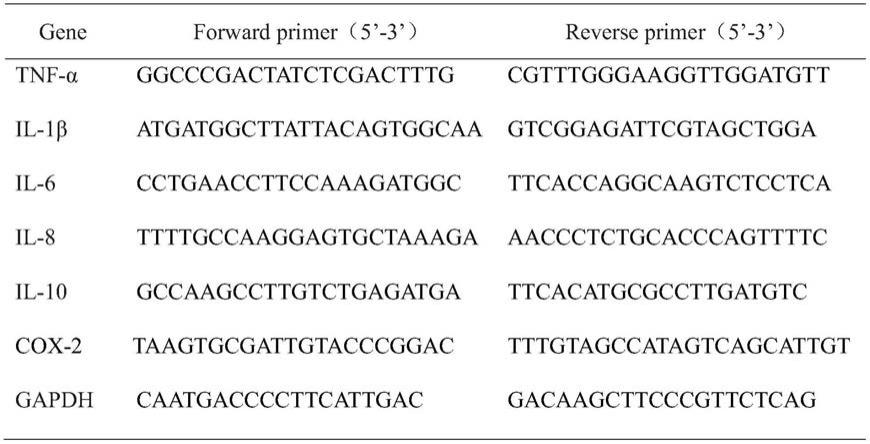
29)体外炎症模型来研究在2、4、8、16mm的浓度该三肽的抗炎活性。测定典型细胞因子il
‑
8的含量,同时运用wst
‑
1试剂盒测定细胞活力。本发明采用rt
‑
pcr结合western
‑
blot,验证其抗炎作用机制。本发明采用dss诱导balb/c小鼠急性结肠炎模型,研究该三肽在体内的抗炎活性。
8.本发明的有益效果为:本发明提供了一种qgk三肽,通过试验验证发现本发明的
qgk三肽能够有效降低促炎因子mrna表达水平,具有一定的医学价值,可用于开发预防和/或辅助治疗炎症性肠病的食品或药物。
附图说明
9.图1所示为qgk对tnf
‑
α诱导的ht
‑
29细胞il
‑
8的分泌影响及其对细胞活力的影响情况图;
10.图2所示为qgk对tnf
‑
α诱导的ht
‑
29细胞因子mrna表达水平的影响情况图;
11.图3所示为qgk对tnf
‑
α诱导的ht
‑
29细胞nf
‑
κb通路中关键蛋白表达水平的影响情况图;
12.图4所示为qgk对小鼠的综合影响情况图,其中,(a)为qgk对dss诱导的小鼠体重减轻的影响情况图,(b)为第14天各组小鼠体重变化情况图,(c)为qgk对dss诱导的小鼠临床症状的影响情况图,(d)为qgk对dss诱导的结肠长度的影响情况图;
13.图5所示为qgk对小鼠病变程度的影响情况图和个组小鼠结肠组织评分图,其中,(a)为qgk对dss诱导的小鼠结肠组织病变程度的影响情况图,(b)为各组小鼠结肠组织评分图;
14.图6所示为qgk对dss诱导的小鼠结肠组织中mpo表达水平的影响情况图;
15.图7所示为qgk对dss诱导的小鼠结肠组织中促炎细胞因子tnf
‑
α和il
‑
6含量的影响情况图;
16.图8所示为qgk对dss诱导的小鼠结肠组织中促炎细胞因子mrna表达水平的影响情况图。
具体实施方式
17.以下将结合实施例和附图对本发明的构思及产生的技术效果进行清楚、完整的描述,以充分地理解本发明的目的、方案和效果。
18.一、三肽qgk在体外炎症模型中抗炎活性的验证及其作用机制的探讨
19.1.炎症模型建立
20.以3
×
105cells/ml的密度将细胞种于细胞培养板上,每隔24h换液,培养5
‑
7天待细胞融合到85%左右,弃去培养液,用hbss缓冲液洗2次。首先加入用含5%fbs的dmem
‑
f12新鲜培养液配置的不同浓度的三肽样品预孵育2h,其次再向培养板中加入tnf
‑
α(使其终浓度为5ng/ml)继续孵育4h。孵育结束后,收集细胞上清液用于elisa测定,下层细胞可根据不同实验要求进行处理。
21.2.细胞活力测定
22.参考mengya zhang(zhang et al.,2017;m.zhang et al.,2018)等人所述方法对处理后细胞进行活力测定。实验细胞经hbss清洗三次后,每孔加入等量wst
‑
1稀释液均匀铺满细胞培养板,放入细胞培养箱中避光孵育15分钟左右,待溶液颜色变化显著时在450nm处测定od值,按照如下公式计算细胞活力:
23.细胞活率(%)=(as450/ac450)x100%,其中,as450代表样品处理组,ac450代表阴性未处理组。
24.3.il
‑
8含量测定
25.参考史雅凝等人(史雅凝,2015)的方法对il
‑
8含量进行测定。将样品稀释五倍后用于检测。
26.4.rna
‑
pcr检测
27.实验细胞经冰冷的hbss清洗三次后,去除表面液体后加入适量transzol裂解液,充分裂解后根据transzol up plus rna kit试剂盒提取ht
‑
29中总rna。通过测定a260/a280nm处比率评估rna的浓度和纯度。采用easy script one
‑
step gdnaremoval and cdna synthesis supermix试剂盒合成cdna。rt
‑
pcr使用perfect starttm green qpcr supermix试剂盒进行扩增,其条件为94℃变性5s,60℃退火15s和72℃延伸10s。整个反应保持40个扩增循环,测定关键基因的表达变化,使用gapdh作为内部参考基因,并以pos阳性模型组做对照,计算其他组fold change值表达百分比,引物序列如表1。
28.表1
[0029][0030]
5.蛋白免疫印迹
[0031]
对培养好的细胞进行预处理获得变性总蛋白。细胞蛋白经10%sds
‑
pag胶分离后转移至用甲醇激活的pvdf膜上,5%脱脂奶粉室温封闭1.5h。经洗涤后,将膜充分浸入一抗稀释液中4℃过夜孵育。经用洗涤后,再将膜充分浸入二抗稀释液中孵育1h。经洗涤后,取出pvdf膜至chemidoctmtouch仪器中,用移液器滴入ecl显色液进行显色,并拍照记录。采用image j软件进行灰度分析,计算各组蛋白相对表达量。
[0032]
二、采用体内模型对三肽qgk进行体内抗炎活性验证,并探讨其作用机制
[0033]
1.小鼠急性结肠炎模型
[0034]
将由湖南斯克莱景达公司提供的80只6
‑
8周龄,平均体重为18
‑
20g的健康雌性balb/c小鼠圈养并饲养一周后进行试验。圈养温度为25
‑
27℃,湿度为74%,12h周期的光照与黑暗交替,并自由获取食物和水。将小鼠随机分为10组,如下表2所述,其中每组10只小鼠。表2
[0035][0036]
2.小鼠结肠炎临床症状评估
[0037]
参照cooper(cooper,murthy,shah,&sedergran,1993)提出的疾病活动指数评分标准如表3,每日观察并评估小鼠体重变化,大便黏稠度和大便出血情况。
[0038]
表3
[0039][0040]
dai=(体重指数评分+大便性状评分+出血情况)/3。
[0041]
3.结肠组织he评分
[0042]
用生理盐水清洗远端结肠并用4%多聚甲醛固定,石蜡包埋并切片,用苏木精和伊红染色液进行染色,在光学显微镜下拍照并评估组织学评分。
[0043]
4.结肠组织tnf
‑
α、il
‑
6测定
[0044]
用生理盐水清洗结肠组织,根据动物组织全蛋白提取试剂盒按照说明书提取结肠组织总蛋白,并用bca蛋白定量试剂盒测定上清蛋白浓度,按照小鼠elisa试剂盒测定tnf
‑
α和il
‑
6促炎因子浓度,结果以pos作为对照计算相对百分比。
[0045]
5.抗氧化酶mpo测定
[0046]
用生理盐水清洗结肠组织,并进行组织匀浆,按照mpo试剂盒说明测定酶活,结果以pos作为对照计算相对百分比。
[0047]
6.结肠组织中基因表达测定
[0048]
用生理盐水清洗结肠组织,经液氮研磨后加入1ml trizol裂解液裂解5min,12000rpm 4℃离心10min,根据试剂盒提取组织总rna。采用easy script one
‑
stepgdna removal and cdna synthesis supermix试剂盒合成cdna。rt
‑
pcr使用perfect starttm green qpcr supermix试剂盒进行扩增,其条件为94℃变性5s,60℃退火15s和72℃延伸10s。整个反应保持40个扩增循环。测定关键基因的表达变化,并使用gapdh作为内部参考基因,并以pos阳性模型组做对照,计算其他组fold change值表达百分比,引物序列如表4所示。
[0049]
表4
[0050][0051]
三、体外试验结果
[0052]
1.三肽qgk的抗炎活性验证
[0053]
il
‑
8是一种中性粒细胞引诱剂,可诱导中性粒细胞从外周血迁移到炎症组织,与健康人群相比,ibd患者的组织中il
‑
8的显著增加。因此选用il
‑
8作为炎症标志物,初步筛选可能具有抗炎活性的三肽(mahida,ceska,effenberger,kurlark,lindley,&hawkey,1992)。如图1所示,采用tnf
‑
α诱导ht
‑
29细胞炎症模型,通过对炎症标志物il
‑
8的测定,研究在2、4、8、16mm浓度下三肽qgk的抗炎活性。结合wst
‑
1法测定其细胞活力,发现模型组与空白对照组之间细胞活力无显著性差异。经三肽预处理的ht
‑
29炎症细胞有效抑制il
‑
8的分泌(p<0.05)且无细胞毒性。与模型组相比,当qgk浓度高达16mm时,il
‑
8分泌量分别下降了99%。
[0054]
2.三肽qgk对tnf
‑
α诱导的ht
‑
29细胞细胞因子mrna表达水平的影响
[0055]
基于前期研究,发现qgk具有抗炎作用。为了进一步探讨其抗炎机制,采用rt
‑
pcr技术对经三肽qgk(16mm)处理后的ht
‑
29细胞内mrna表达进行分析。如图2显示,qgk能够有效抑制促炎因子tnf
‑
α、il
‑
6、il
‑
8、il
‑
1β、il
‑
12和环氧化酶(cox
‑
2)mrna的表达。
[0056]
3.三肽qgk对nf
‑
κb信号通路的影响
[0057]
nf
‑
kb是一种关键的转录因子,调节编码促炎介质的基因的表达。采用western
‑
blot检测各试验组细胞p
‑
p65、p
‑
iκbα蛋白水平。结果表明(如图3所示),qgk通过阻断tnf
‑
α诱导ht
‑
29细胞的iκbα的磷酸化和p65的磷酸化发挥其抗炎作用。
[0058]
四、体内试验结果
[0059]
1.三肽qgk对dss诱导的小鼠急性结肠炎临床症状及体重减轻的影响
[0060]
如图所示4(a),各处理组初始体重无显著性差异,经dss诱导炎症模型之前,各组小鼠体重未见显著下降,说明三肽qgk既不影响体重,也不导致腹泻。除空白组外各组小鼠体重在第10天发生显著下降,直至第14天呈持续下降趋势。如图4(b),与空白组相比,模型组小鼠体重下降最为显著,施用50mg/ml和150mg/ml浓度的qgk有效减缓dss诱导的急性结肠炎小鼠的体重减轻。
[0061]
众多学者指出,dss诱导小鼠急性结肠炎模型会出现小鼠体重下降、大便粘稠、直肠出血,精神状态萎靡等症状(zhao,yao,xu,wang,wang,&tu,2017)。我们根据前人建立的dai评分系统对小鼠状态进行评价。如图4(c)所示,除空白组外,各组dai值随病程加重而升高。与模型组相比,经qgk灌胃后各组小鼠dai值均小于模型组,临床症状相对较轻。
[0062]
在dss诱导的小鼠结肠炎模型中,小鼠结肠缩短与结肠炎的严重程度密切相关。如图4(d)所示,在本研究中,模型组的结肠长度为(4.56
±
0.22)cm,而空白组结肠长度为
(7.58
±
1.04)cm。qgk(50mg/ml和150mg/ml)干预能够有效改善结肠缩短程度(p<0.05)。
[0063]
2.三肽qgk对急性结肠炎小鼠结肠组织病变的影响
[0064]
为继续探究三肽qgk对dss诱导的小鼠急性结肠炎组织损伤的影响,对其结肠组织进行he切片染色分析。与其他学者研究相似的是,对仅用dss诱导的小鼠结肠组织进行病理组织学评估,其结肠表现为结肠组织结构重度异常,粘膜层隐窝结构几乎全部消失;大量及纤维组织增生,如图5(a)pos中黑色箭头所示;部分粘膜上皮细胞缺失,固有层裸露,如红色箭头所示;粘膜下层水肿并可见炎症细胞浸润,如黄色箭头所示。根据前人所述病理组织学评分方法对各组小鼠结肠组织进行评分,结果如图5(b)所示,与模型组相比,经qgk干预后的小鼠结肠组织组织学评分显著下降。证实了qgk对预防和干预小鼠急性结肠炎发挥有益的作用。
[0065]
3.三肽qgk对dss诱导的小鼠结肠组织mpo活性的影响
[0066]
据报道,mpo含量与炎症的发展息息相关,中性粒细胞的聚集可导致大量mpo的释放(joh&kim,2011)。通过对mpo酶活的测定,以探究三肽qgk对dss诱导的小鼠急性结肠炎结肠组织中中性粒细胞聚集的影响。如图6所示,与空白对照组相比,经dss诱导后模型组mpo含量显著上升。而与模型组相比,qgk
‑
50下降了64%,qgk
‑
150下降了44%,因此qgk能够有效抑制dss诱导的急性结肠炎小鼠结肠组织中mpo的分泌。
[0067]
4.三肽qgk对小鼠结肠组织促炎细胞因子tnf
‑
α、il
‑
6含量的影响
[0068]
测定小鼠结肠中tnf
‑
α和il
‑
6的含量,探究三肽qgk在小鼠体内的抗炎活性。结果以模型组作为对照,观察其他组促炎因子分泌情况。如图7所示,与空白组相比,仅以dss诱导的小鼠结肠组织中tnf
‑
α和il
‑
6表达显著上升(p<0.05)。与模型组相比,三肽qgk能够有效抑制tnf
‑
α(p<0.05)和il
‑
6(p<0.05)的分泌,其中qgk
‑
50分别下降了57.15%和58.64%,qgk
‑
150分别下降了45.61%和35.1%。
[0069]
5.三肽qgk对促炎细胞因子mrna表达的影响
[0070]
为进一步探讨qgk在体内的抗炎活性,对结肠组织中炎症细胞因子mrna进行测定。结果以模型组做对照,观察其他组促炎因子mrna表达情况。如图8所示,与模型组相比,三肽qgk呈剂量依赖式有效抑制促炎因子tnf
‑
α(p<0.05)、il
‑
1β(p<0.05)、il
‑
6(p<0.05)、il
‑
17(p<0.05)、mcp
‑
1(p<0.05)、ifn(p<0.05)mrna的表达水平。
[0071]
综上,三肽qgk在体内和体外均具有良好的抗炎活性。因此,三肽qgk可以用于预防或减缓炎症性肠病保健品或药品的研发。
[0072]
以上所述,只是本发明的较佳实施例而已,本发明并不局限于上述实施方式,只要其以相同的手段达到本发明的技术效果,都应属于本发明的保护范围。在本发明的保护范围内其技术方案和/或实施方式可以有各种不同的修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1