一种阿糖胞苷的纯化方法与流程
本发明涉及医药技术领域,尤其涉及一种阿糖胞苷的纯化方法。
背景技术:
阿糖胞苷化学名为1-β-d-阿拉伯呋喃糖基-4-氨基-2(1h)-嘧啶酮,阿糖胞苷最早在1959年由加州大学伯克利分校的richardwalwick、waldenroberts和charlesdekker合成。
注射用阿糖胞苷最早由upjohn(现属pfizer)与1969年6月在美国上市,上市商品名为
法国:1985年,pfizer在法国上市注射用阿糖胞苷,上市商品名为
意大利:pfizer在意大利上市注射用阿糖胞苷,上市商品名为
西班牙:1970年,pfizer在西班牙上市注射用阿糖胞苷,上市规格为100mg,1984年又新增500mg规格。
日本pmda最早于1971年4月批准日本新薬株式会社上市商品名为キロサイド注20mg的注射剂,后陆续上市本品40mg,60mg,100mg,200mg,400mg及1g规格制剂,均为注射剂。2013年批准武田テバファーマ株式会社上市规格为400mg及1g的静脉注射液。
适应症:可以单用或联合其他化疗药物,适用于白血病的又到环节,尤其适用于成人或儿童的急性粒细胞白血病。也可用于急性淋巴细胞性白血病,慢性粒细胞性白血病及红白血病的诱导缓解,可用于脑膜白血病及其它脑膜恶性肿瘤的治疗和维持治疗
作用机制:本品为主要作用于细胞s增殖期的嘧啶类抗代谢药物,通过抑制细胞dna的合成,干扰细胞的增殖。阿糖胞苷进入人体后经激酶磷酸化后转为阿糖胞苷三磷酸及阿糖胞苷二磷酸,前者能强有力地抑制dna聚合酶的合成,后者能抑制二磷酸胞苷转变为二磷酸脱氧胞苷,从而抑制细胞dna聚合及合成。
合成路线:文献报道的合成路线适合于制备阿糖胞苷原料,但是根据文献1(浙江海正药业股份有限公司.一种阿糖胞苷的制备方法.cn1302004c.2006.01;)文献2([24.synthesisof(15n2)[17o]urea,(15n2)[o2,o4-17o2]uridineand(15n3)[o2-17o]cytidine.byantonioamanteal),matthiashenz2),andpeterstrazewsk*.helveticachimicaacta~vol.79(1996))报道,阿糖胞苷制备分两部分:1)惰性有机溶液作为溶剂,采用氨水氨解后采用甲醇氨进行氨解,浓缩反应体系,得到浓缩残留物(阿糖胞苷粗品);2)该残留物(阿糖胞苷粗品)采用阳离子交换树脂柱纯化,去离子水洗脱,稀氨水洗脱,收集产品洗脱液,真空浓缩洗脱液,得到阿糖胞苷粗品。
阿糖胞苷粗品后处理均需要进行树脂纯化,产生大量的氨水洗脱液,氨水洗脱液需要进行快速低温浓缩,中和,耗时,耗能,收率较低。
因此,本发明开发改进更适合工业化生产的阿糖胞苷纯化工艺,并发现一种适用于阿糖胞苷工业化纯化的方法,对阿糖胞苷工业化生产具有重要的实践意义。
技术实现要素:
有鉴于此,本发明提供了一种阿糖胞苷的纯化方法。该方法获得的阿糖胞苷性状稳定、粒度均匀,纯度和收率较高,纯度可达到99.9%以上,具有操作简单,能耗低,安全环保,生产周期短,生产成本低的特点,更适合工业化生产。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供一种阿糖胞苷的纯化方法,包括:
将阿糖胞苷粗品与碱性物质混合、搅拌反应;
将反应液减压浓缩至干,向浓缩物中加入有机溶剂分散,过滤;
所得滤渣经干燥获得阿糖胞苷;
所述碱性物质为氨水、三乙胺、dipea、碳酸钠、碳酸钾中的至少一种。
一些实施方案中,所述碱性物质为氨水。本发明一些具体实施例中,所述碱性物质为25~36wt%氨水、2mol/l碳酸钾或2mol/l碳酸钠。本发明中,可将浓度为25~36wt%氨水与水按照体积比为1:1~1:3的比例稀释后使用。
一些实施方案中,所述碱性物质与阿糖胞苷粗品的体积质量比以ml/g计为5:1。
一些实施方案中,所述搅拌反应为30~40℃搅拌反应10~15h。一些具体实施例中,所述搅拌反应的温度为30℃、35℃或40℃,时间为10h、12.5h或15h。
本发明中,所述干燥优选为鼓风干燥。具体地,所述鼓风干燥的温度为55~65℃,具体可为55℃、60℃或65℃,鼓风干燥的时间为6-8h,具体可为6h、7h或8h。
一些实施方案中,所述浓缩物与所述有机溶剂的体积质量比为2:1。
一些实施方案中,所述分散所用溶剂为乙酸乙酯、乙醇和水中的一种或多种。一些具体实施例中,所述分散所用溶剂为有机溶剂,具体为乙酸乙酯或乙醇。
本发明提供的阿糖胞苷的纯化方法包括将阿糖胞苷粗品与碱性物质混合、搅拌反应;将反应液减压浓缩至干,向浓缩物中加入有机溶剂分散,过滤;所得滤渣经干燥获得阿糖胞苷;所述碱性物质为氨水、三乙胺、dipea、碳酸钠、碳酸钾中的至少一种。利用该方法对阿糖胞苷粗品进行纯化,批间一致性好,质量可控,纯度可达到99.9%以上。相比传统的树脂柱纯化工艺,大大简化了纯化操作,不需要进行树脂柱层析纯化和浓缩,避免了使用大型浓缩设备,也减少了大量废液的产生,使阿糖胞苷原料的纯化操作更简单,收率更高,降低了生产成本,更适合工业化生产,最主要是提供了一种稳定的适用于阿糖胞苷工业化纯化的方法。
附图说明
图1示实施例1纯化后的阿糖胞苷液相色谱图;
图2示实施例2纯化后的阿糖胞苷液相色谱图;
图3示实施例3纯化后的阿糖胞苷液相色谱图;
图4示实施例4纯化后的阿糖胞苷液相色谱图;
图5示对比例1纯化后的阿糖胞苷液相色谱图。
具体实施方式
本发明提供了一种阿糖胞苷的纯化方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
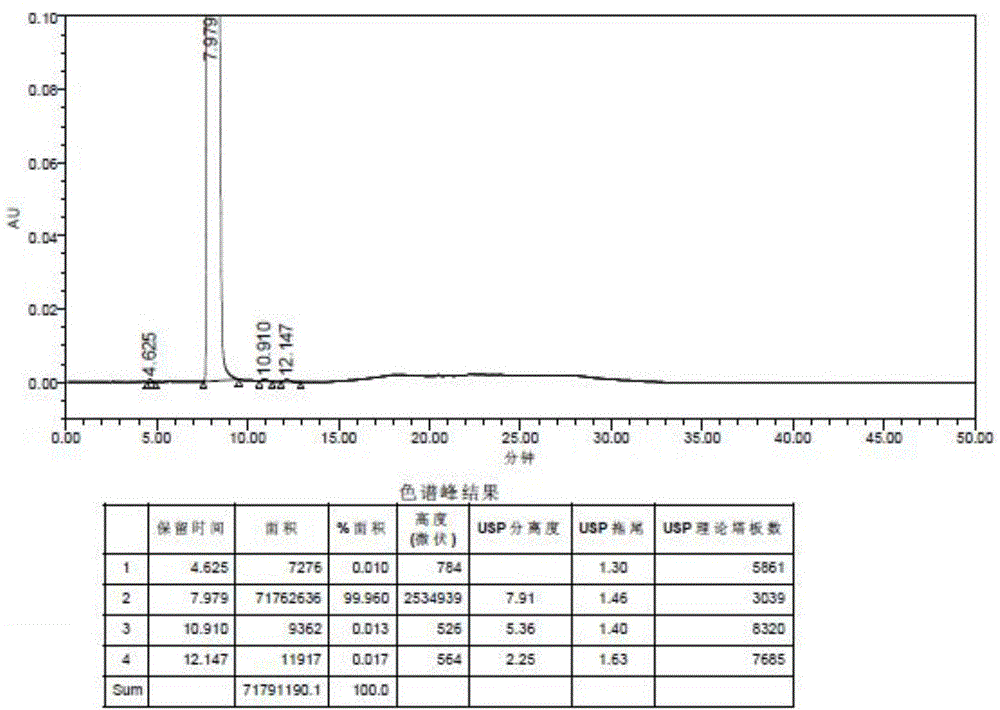
反应釜中加入氨水(v稀氨水:m阿糖胞苷粗品=5:1,搅拌,加入阿糖胞苷粗品15kg,控制体系温度30-40℃搅拌反应15h,减压浓缩上述体系至干,固体采用乙酸乙酯(v乙酸乙酯:m阿糖胞苷=2:1)搅拌分散,过滤,固体65℃鼓风干燥6h,得到纯化后的阿糖胞苷13.5kg,收率90.0%,色谱检测结果见图1。
实施例2
反应釜中加入氨水(v稀氨水:m阿糖胞苷粗品=5:1,搅拌,加入阿糖胞苷粗品15kg,控制体系温度30-40℃搅拌反应15h,减压浓缩上述体系至干,固体采用乙醇(v乙醇:m阿糖胞苷=2:1)搅拌分散,过滤,固体55℃鼓风干燥8h,得到纯化后的阿糖胞苷13.6kg,收率90.7%,,色谱检测结果见图2。
实施例3
反应釜中加入2mol/l碳酸钾水溶液(v碳酸钾水溶液:m阿糖胞苷粗品=5:1,搅拌,加入阿糖胞苷粗品10kg,控制体系温度30-40℃搅拌反应15h,减压浓缩上述体系至干,固体采用乙醇/水(v乙醇/水:m阿糖胞苷=2:1)搅拌分散,过滤,固体60℃鼓风干燥7h,得到纯化后的阿糖胞苷8.1kg,收率81%,,色谱检测结果见图3。
实施例4
反应釜中加入2mol/l碳酸钠水溶液(v碳酸钠水溶液:m阿糖胞苷粗品=5:1,搅拌,加入阿糖胞苷粗品10kg,控制体系温度30-40℃搅拌反应15h,减压浓缩上述体系至干,固体采用乙醇/水(v乙醇:m阿糖胞苷=2:1)搅拌分散,过滤,固体60℃鼓风干燥8h,得到纯化后的阿糖胞苷8.3kg,收率83%,,色谱检测结果见图4。
对比例1
阿糖胞苷粗品100g离子交换树脂纯化,先用去离子水洗脱,后用5%氨水洗脱,收集产品洗脱液500ml,减压真空浓缩至干,得到阿糖胞苷粗品,用水乙醇回流溶解,趁热过滤,滤液结晶,过滤,结晶用少量乙醇洗涤后,固体60℃鼓风干燥6-8h,得到阿糖胞苷60g,收率60%。色谱检测结果见图5。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!