一种用于处理淀粉废水的微生物菌剂的制作方法
本发明属于水处理技术领域,具体是涉及一种用于淀粉废水的微生物菌剂,尤其涉及一种用于多方面处理马铃薯淀粉废水的微生物菌剂。
背景技术:
马铃薯淀粉加工废水呈酸性,该废水中含有淀粉、蛋白质等有机物,具有高泡沫、高浓度、高浊度的“三高”特点,利用传统工艺处理难度高,消耗成本大,且难以达到排放标准,成为马铃薯淀粉行业亟待解决的问题。如用微生物菌剂处理马铃薯淀粉废水,可以大大降低氨氮、总磷、cod含量,达到国家排放标准。
芽孢杆菌是一种革兰氏阳性菌,生长旺,传代速度快,蛋白酶和淀粉酶活性高,有机物降解能力强,有些芽孢杆菌还可以降解产生臭味、异味的氮化物和硫化物等,减少有害气体的产生,改善人们的生活环境。芽孢杆菌是一种重要的资源微生物,在应用中常用来防治有害微生物的生长、水体净化、生产酶和抗生素等,如苏云金芽孢杆菌常用来保护植物、枯草芽孢杆菌和地衣芽孢杆菌用来水体净化和饲料添加等。酵母菌是一类单细胞的真菌,细胞中具有丰富的蛋白质和各种酶,所以在马铃薯淀粉废水的处理中,人们常用酵母菌生产单细胞蛋白和进行动物饲料的发酵。使用复合酵母菌液对马铃薯淀粉废水进行处理,废水处理分离后能获得较多的菌体蛋白,不仅对废水进行了净化,还创造一定的经济效益。
使用微生物复合菌剂处理后的废水氨氮、总磷以及cod以及ss值都降低。一方面,从工业废水处理的角度看,氨氮、总磷以及cod的降低有利于马铃薯废水的后续处理。另一方面,从肥料应用的方面看,利用其中的氮元素以及磷元素等,以马铃薯废水作为水溶肥原料进行进一步研究,实现马铃薯淀粉废水的资源化利用,这不仅可以减少马铃薯淀粉废水对环境的影响,还能缓解西北地区水资源短缺的现状。此方法响应了国家倡导的可持续发展号召,具有重大的经济、社会和环境效益,为解决马铃薯淀粉加工行业发展的“瓶颈”问题提供科学参考。
技术实现要素:
本发明提供了一种用于淀粉废水的微生物菌剂,可大大降低淀粉废水中的氨氮、总磷、cod含量,达到国家排放标准。进一步的,本发明提供的微生物菌剂尤其适用于处理马铃薯淀粉废水的微生物菌剂,通过所述微生物菌剂去处理马铃薯淀粉废水,可以大大降低氨氮、总磷、cod含量,达到国家排放标准。处理过后的废水既可以灌溉农田,又可以将废水中有经济价值的物质进行回收利用,或将其作为产品的原料,进行资源化利用。
本发明所述淀粉废水包括但不限于如下种类的淀粉废水,红薯淀粉废水、木薯淀粉废水等甘薯类淀粉废水、玉米淀粉废水、小麦淀粉废水、大米淀粉废水、燕麦淀粉废水等植物淀粉废水。
本发明提供了一种用于处理淀粉废水的微生物菌剂,包括枯草芽孢杆菌,短小芽孢杆菌和酵母菌,所述酵母菌为安琪酵母和融合酵母。
优选的是,枯草芽孢杆菌、短小芽孢杆菌、安琪酵母和融合酵母按照如下体积比混合,枯草芽孢杆菌1到2份,短小芽孢杆菌1到3份,安琪酵母1到3份,融合酵母1到2份。
因为淀粉废水的cod含量偏高,普通单一菌株不容易在高cod废水中存活,单独种菌的使用在废水处理后期cod跟氨氮量降到一定水平后很难继续再降低至排放标准,所以需要多菌株协同处理废水。本发明通过对多种菌剂进行组合筛选,最后确定的微生物菌剂中包括枯草芽孢杆菌、短小芽孢杆菌、安琪酵母、融合酵母。更加优选的微生物菌剂是由枯草芽孢杆菌1到2份,短小芽孢杆菌1到3份,安琪酵母1到3份,融合酵母1到2份组成的。本发明所提供的微生物菌剂能够有效抑制常见致病菌如大肠杆菌和金黄葡萄球菌。安琪酵母和融合酵母的联合使用具有更好的cod降解能力。
上述任一项优选的是,所述微生物菌剂的培养基包括质量比例为0.7份~0.9份的果葡糖浆,0.3份~0.5份的氯化铁,豆粕和尿素,豆粕和尿素的质量比例为3比1。
上述任一项优选的是,所述微生物菌剂培养条件为,在温度37~39℃、转速180~200r/min条件下震荡培养,至od600达到0.8~1.0。进一步优选的,od600达到0.948时所获得的微生物菌剂具有更好的污水处理效果。
上述任一项优选的是,所述微生物菌剂处理淀粉废水的方法为,调节淀粉废水的ph为5~7,向淀粉废水中添加1~1.5%的微生物菌剂,添加的微生物菌剂的od600为0.8~1.0,微生物菌剂作用于淀粉废水的时间为8~11天,处理时的环境温度为20~23℃。优选的,用硫酸溶液和氢氧化钠溶液调节所述淀粉废水的ph值至5、6或7。优选的,处理的环境温度为20、21、22、23℃。优选的,处理天数为9~10天。优选的淀粉废水的ph调节至5、6、7。
上述任一项优选的是,所述微生物菌剂作用于用聚谷氨酸絮凝剂絮凝出蛋白的废水,中加入1%的微生物菌剂,配合气泡发生器处理。优选的,聚谷氨酸絮凝剂絮凝出淀粉废水中蛋白的方法为:在ph在3~7的淀粉废水中加入聚谷氨酸溶液,聚谷氨酸相对于淀粉废水添加的量为20~60mg/l,在25~40℃、100~250r/min的条件下快速搅拌10min,静置30~40min,使絮体沉降。絮体沉降后回收处理后的废水,再由所述微生物菌剂进行处理。所述气泡发生器为常规设备,现有技术中的气泡发生器均适用于本发明。优选的,所述气泡发生器的配合使用方法为:经过絮凝处理的马铃薯蛋白废水排入带有气泡发生器的蓄水池,并在蓄水池中加入一定量的菌剂,经过3到4日处理后的废水可达到排放标准用于灌溉等用途。
本发明还提供了一种淀粉废水的处理方法,利用上述任一项的微生物菌剂对淀粉废水进行处理。
优选的是,所述处理方法用于处理马铃薯淀粉废水。
上述任一项优选的是,对所述微生物菌剂处理后的废水进行检测,包括化学需氧量的测定、氨氮含量测定和总磷含量测定。化学需氧量(cod)的测定采用化学需氧量快速测定仪进行测定;氨氮含量测定参照cj/t75-1999纳氏试剂比色法测定。总磷含量测定参照gb11893-89钼酸铵分光光度计法测定。
上述任一项优选的是,其特征在于,处理后的废水排放标准满足gb50892《农田灌溉水质标准》和gb8978-1996《污水综合排放标准》。
本发明的有益效果具体为:
自然界中,微生物的种类多、数量大、分解能力强,许多微生物都能够将复杂、稳定的有机物降解为简单的物质。用微生物菌剂处理马铃薯淀粉废水这种方法经济、清洁、高效、节能,在未来有着广阔的发展前景。
使用微生物复合菌剂处理后的废水氨氮、总磷以及cod以及ss值都降低,并且比单一菌剂处理淀粉废水效果要好。一方面,从工业废水处理的角度看,氨氮、总磷以及cod的降低有利于马铃薯废水的后续处理。另一方面,从肥料应用的方面看,利用其中的氮元素以及磷元素等,以马铃薯废水作为水溶肥原料进行进一步研究,实现马铃薯淀粉废水的资源化利用,这不仅可以减少马铃薯淀粉废水对环境的影响,还能缓解西北地区水资源短缺的现状。此方法响应了国家倡导的可持续发展号召,具有重大的经济、社会和环境效益,为解决马铃薯淀粉加工行业发展的“瓶颈”问题提供科学参考。
本发明所涉及的枯草芽孢杆菌、短小芽孢杆菌、安琪酵母、融合酵母均由天津北洋百川生物技术有限公司提供,可通过商业购买的方式获得。
附图说明
图1为本发明优选实施例2中对淀粉降解能力的检测结果。
图2为本发明优选实施例2中对蛋白质降解能力的检测结果。
图3为本发明优选实施例4中对金黄葡萄球菌拮抗能力的检测结果。
图4为本发明优选实施例4中对大肠杆菌拮抗能力的检测结果。
具体实施方式
本发明通过以下实施例进行更加清晰、完整的描述,但所描述的实例仅是本发明一部分实施例,并非全部。所述实施例为帮助理解本发明,不应依此来局限本发明的保护范围。
实施例1
实施例1为四种菌的制备和扩大培养。
本发明所述菌种制备培养基为:
枯草芽孢杆菌和短小芽孢杆菌的液体培养基为lb培养基,该培养基的配方为酵母浸粉0.5%,胰蛋白胨1%,nacl1%,ph7.2~7.4,(质量百分比)。
枯草芽孢杆菌和短小芽孢杆菌的斜面培养基为lb固体培养基,该培养基的配方为酵母浸粉0.5%,胰蛋白胨1%,nacl1%,琼脂2.5%,ph7.2~7.4,(质量百分比)。
安琪酵母和融合酵母的培养基为液体yepd培养基,该培养基的配方为酵母浸粉1%,葡萄糖2%,蛋白胨2%,ph6.0,(质量百分比)。
安琪酵母和融合酵母的固体培养基为yepd固体培养基,该培养基的配方为酵母浸粉1%,葡萄糖2%,蛋白胨2%,琼脂2.5%,ph6.0,(质量百分比)。
本发明所述菌种的培养方法:
斜面菌种培养:将菌种从-80℃的超低温冰箱取出备用,采用划线接种法接种于斜面培养中,然后置28~37℃培养箱中暗培养24~48h,即可获得单菌落,如不直接使用,优选将试管保存在4℃冰箱中。
液体一级菌种培养:将液体培养基分装入100ml三角瓶中,每瓶装40~50ml,蘸取斜面培养菌种得到的单菌落,用接种环接入三角瓶中,置摇床上进行培养,培养温度28~37℃,转速180~200rpm,培养时间24~48h即可得到一级菌种。
液体二级菌种培养:在选取本发明中所述菌种相应的培养基,按配方配制,分装入1000ml大三角瓶中,每瓶装300~400ml,接入培养好一级菌种,接种量1.0%~1.5%,置摇床上进行培养,培养温度28~37℃,转速180~200rpm,培养时间24~48h即可得到二级液体菌种。
得到的二级菌种可单独用于下一步的检测,或将四种单独菌种混合为微生物菌剂。所述微生物菌剂是将所得到的二级菌液按照枯草芽孢杆菌1到2份,短小芽孢杆菌1到3份,安琪酵母1到3份,融合酵母1到2份的体积比混合后得到所述微生物菌剂。进一步优选的混合体积比为枯草芽孢杆菌1份,短小芽孢杆菌1份,安琪酵母1份,融合酵母1份。混合得到的微生物菌剂所述微生物菌剂的培养基中,在温度37~39℃、转速180~200r/min条件下震荡培养,至od600达到0.948,所得到的微生物菌剂可用于下一步的淀粉废水的处理也可用于微生物菌剂产品性能的检测。
实施例2
菌株分解酶能力培养基的制备方法:
酪素固体培养基:酪素0.4%,mgso4·h2o0.05%,feso40.0002%,k2hpo40.036%,na2hpo4·7h2o0.107%,nacl0.016%,zncl20.0014%,cacl20.0002%,琼脂2%,ph6.5~7.0,琼脂2.5%,121℃灭菌20min,(质量百分比)。
果胶固体培养基:k2hpo40.1%,mgso4·h2o0.05%,nano30.3%,feso40.001%,果胶0.2%,琼脂2%,ph7.0,(质量百分比)。
淀粉固体培养基:牛肉膏0.5%,蛋白胨0.5%,nacl0.5%,可溶性淀粉2%,琼脂2%,ph7.2,琼脂2.5%,121℃灭菌30min,(质量百分比)。
羧甲基纤维素钠固体培养基:羧甲基纤维素钠2%,蛋白胨0.25%,kh2po40.15%,na2hpo40.25%,琼脂2.5%,ph7.0~7.5,121℃灭菌20min,(质量百分比)。
菌株分解酶能力的检测方法:
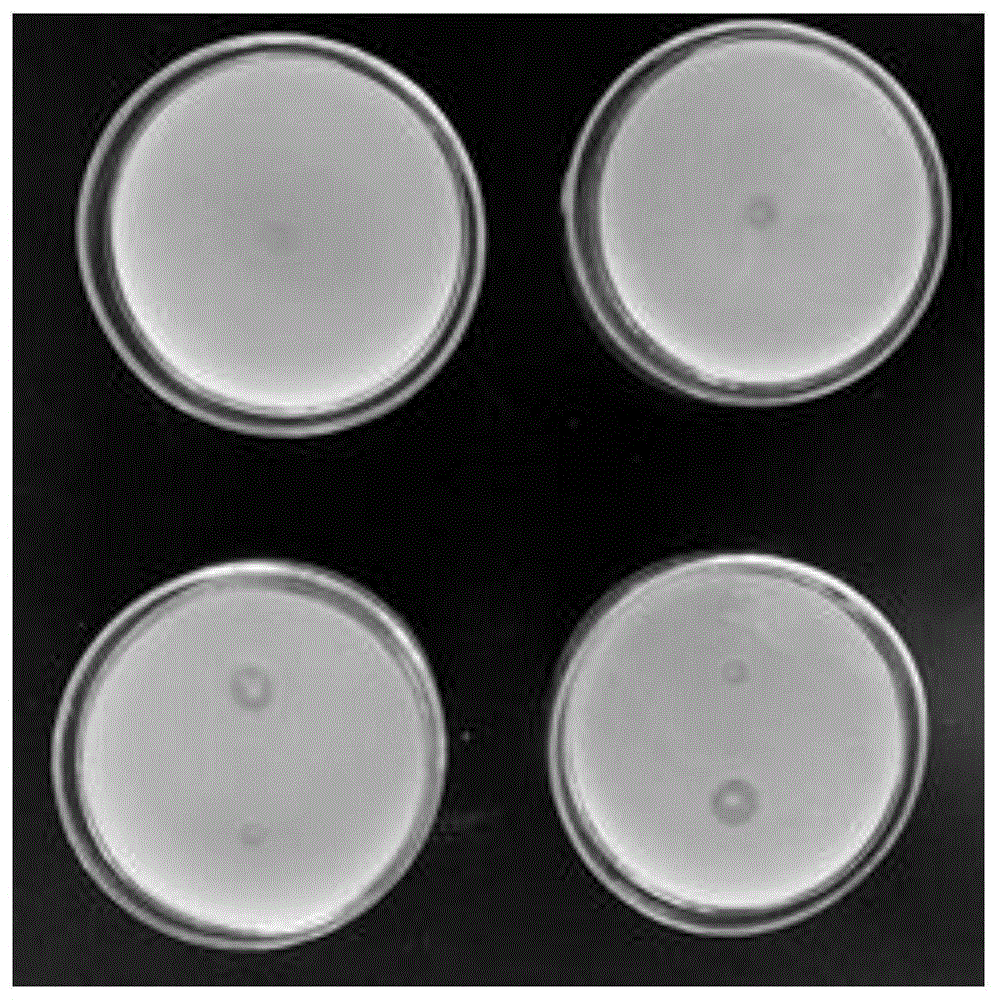
在淀粉培养基、羧甲基纤维素钠培养基、酪素培养基和果胶养基平板上使用牛津杯留孔。然后加入0.1ml单一菌株的菌液(实施例1中制备得到的单独菌种的二级菌液),在37℃的培养箱中正置培养18h。其中,酪素培养基直接使用游标卡尺直接测定其透明圈直径(dh)与菌株直径(dc)的大小;淀粉培养基需要使用鲁哥氏碘液喷淋平板表面,待其显现出透明圈后测定其大小;羧甲基纤维素钠培养基和果胶培养基先用5ml0.2%的刚果红溶液进行染色4h,然后用5ml1mol/l的nacl溶液进行脱色洗涤1h,对光即可见明显的绛红色水解圈,测定其透明圈(dh)和菌落直径(dc)大小。挑选在培养基上透明圈直径与菌株直径之比较大的菌株,用于判断产生的酶活力的大小,表明该微生物菌剂有一定的降解淀粉、蛋白质、纤维素和果胶的能力。如图所示,图1为菌株降解淀粉(淀粉培养基)能力的效果图,图2为菌株降解蛋白质(酪素培养基)能力的效果图。
实施例3
实施例3验证了菌株之间是否有拮抗,实验方法如下:
将灭过菌的lb和yepd培养基(琼脂添加量2%)倒平板,每个平板倒15ml至20ml,其凝固后为下层培养基,然后将灭过菌牛津杯置于下层培养基表面,另取琼脂添加量1.5%的lb或yepd培养基,加入3%的指示菌,混匀倒在下层培养基上,其凝固后为上层培养。将牛津杯取出,露出凹槽,把0.1ml被试菌菌液注入凹槽内,正置于37℃或30℃生化培养箱中培养18h,观察并记录有无透明圈或菌体稀薄现象的平板编号。验证四种菌株之间并无拮抗作用,可复配成微生物菌剂。
指示菌和被试菌分别选自枯草芽孢杆菌、短小芽孢杆菌、安琪酵母或融合酵母的一种。结果显示没有透明圈形成,证明四种菌之间无拮抗作用。
实施例4
实施例4验证了所述微生物菌剂对致病菌之间是否有拮抗作用,实验方法如下:
大肠杆菌和金黄葡萄球菌的培养基为lb培养基。
将灭过菌的lb和yepd培养基(琼脂添加量2%)倒平板,每个平板倒15ml至20ml,其凝固后为下层培养基,然后将灭过菌牛津杯置于下层培养基表面,另取琼脂添加量1.5%的lb或sp培养基,加入3%的致病指示菌(大肠杆菌和金黄葡萄球菌中的一种),混匀倒在下层培养基上,其凝固后为上层培养。将牛津杯取出,露出凹槽,把0.1ml被试菌菌液(实施例1混合得到的微生物菌剂)注入凹槽内,正置于37℃或30℃生化培养箱中培养18h,观察并记录有无透明圈或菌体稀薄现象的平板编号。实验结果发现对三种致病菌均有抑制作用。如所示,图3为所述微生物菌剂对金黄葡萄球菌拮抗能力的检测结果,图4为所述微生物菌剂对大肠杆菌拮抗能力的检测结果。
实施例5
本发明所述微生物菌剂的培养基优化方法:
不同碳源和添加量的确定:选取葡萄糖、蔗糖、麦芽糖、果葡糖浆、糖蜜为选择性碳源。以lb培养基为优化起始培养基,分别添加相同碳质量分数的葡萄糖、蔗糖、麦芽糖、果葡糖浆、糖蜜,接入筛选得到的2%复合菌液(实施例1混合得到的微生物菌剂),于37℃、200r/min的培养箱中培养18h,测定od600值(菌液用生理盐水稀释10倍);选取合适的碳源后,选取0.1%、0.3%、0.5%、0.7%、0.9%的不同添加比例确定出最优添加量。
不同氮源的确定:选择酵母膏、玉米浆、豆粕粉作为有机氮来源。将已确定好的碳源在最优添加比例下,分别添加相同氮质量分数的酵母膏、玉米浆、豆粕粉,接种筛选得到的2%复合菌液(实施例1混合得到的微生物菌剂),于37℃、200r/min的培养箱中培养18h,测定od600值(菌液用生理盐水稀释10倍),确定出最优有机氮源。选取硫酸铵、尿素、氯化铵作为无机氮源。选取最优的有机氮源,将不同的无机氮源与该最优有机氮源进行复配,接入筛选得到的2%复合菌液(实施例1混合得到的微生物菌剂),于37℃、200r/min的培养箱中培养18h,测定od600值(菌液用生理盐水稀释10倍),确定出最优无机氮源。
有机氮源与无机氮源的复配比例:将最优有机氮源和无机氮源按照1:1、2:1、3:1、4:1、5:1、6:1的比例进行复配,然后接入筛选得到的2%复合菌液(实施例1混合得到的微生物菌剂),于37℃、200r/min的培养箱中培养18h,测定od600值(菌液用生理盐水稀释10倍),确定出最优的复配比例。
不同无机盐及添加量的确定选取硫酸钾、氯化钠、氯化镁、硫酸锌、氯化铁、硫酸锰。在最优碳源和氮源的条件下添加2%的金属元素化合物,接入筛选得到的1%复合菌液(实施例1混合得到的微生物菌剂),于37℃、200r/min条件下培养18h,测定od600值(菌液用生理盐水稀释10倍),确定出最优的金属元素。该金属元素按照0.1%、0.3%、0.5%、0.7%、0.9%、1.1%的不同添加比例,确定其最优添加量。
最终确定的微生物菌剂的培养基为:果葡糖浆的添加量为0.7份~0.9份,氯化铁的添加量为0.3份~0.5份,豆粕与尿素按照3比1的复合比例添加。所述份数均为质量份数。
实施例6
实施例6为菌剂处理马铃薯淀粉废水的方法:
微生物菌剂在处理马铃薯淀粉废水时,加入1%复合菌液(实施例1混合得到的微生物菌剂培养至od600=0.948)、30℃、200r/min。在利用微生物菌剂处理马铃薯淀粉废水的过程中,选取微生物菌剂处理时间、废水初始ph值、复合菌剂添加量、菌剂处理环境温度为研究对象,以氨氮(nh4+-n)、总磷(tp)、cod含量为指标,并计算去除率,对废水处理过程进行优化,最终确定出处理马铃薯淀粉废水的最佳条件:处理时间在9~10天,废水初始ph在5~7之间,微生物菌剂添加量在1~1.5%之间,环境温度在20~23℃之间。
处理结果如表1所示。
表1马铃薯淀粉废水的指标变化
本发明用的菌剂为微生物菌剂,降低了废水的有害指标。为进一步研究马铃薯淀粉废水用于灌溉用水提供思路,能为马铃薯淀粉废水的进一步处理提供借鉴。
以上所述,仅为本发明用以说明本发明的实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!