抗GARP蛋白及其用途的制作方法
抗garp蛋白及其用途
1.本技术是申请号为201480043607.6的中国专利申请的分案申请,原申请是2014年8月1日提交的pct国际申请pct/ep2014/066650于2016年2月1日进入中国国家阶段的申请。
技术领域
2.本发明涉及抑制tgf
‑
β信号转导的人抗garp蛋白。本发明还涉及治疗免疫病症以及疾病,例如癌症。
背景技术:
3.自从20世纪90年代早期分子鉴定了第一个人肿瘤抗原,已经完成了多个临床试验来评估治疗性疫苗接种对具有共有肿瘤特异性抗原之癌症患者的作用(boon,t.等annu.rev.immunol.2006,24:175
‑
208)。在约20%的患者中观察到肿瘤消退的证据,在5
‑
10%中具有客观的临床应答。因此,具有肿瘤特异性抗原的疫苗接种是一种新的有前景的用于治疗癌症的疗法。
4.需要来提高响应于疫苗接种之患者比例的策略。目前治疗性癌症疫苗之临床效力的主要限制性因素似乎不是疫苗本身,而是控制抗肿瘤t细胞不得不在其中工作之肿瘤微环境的局部因子。
5.调节性t细胞(regulatory t cell)或treg,是特化的抑制免疫应答的cd4+t淋巴细胞亚群。treg功能不足导致自身免疫病理(autoimmune pathology),而treg功能过度可以抑制癌症患者中的抗肿瘤免疫应答。treg抑制免疫应答的精确机制还未被完全理解。
6.由于其免疫抑制功能,treg代表了自发的或疫苗诱导的抗肿瘤免疫应答的潜在抑制剂。在鼠模型中,treg的损耗可提高针对实验性肿瘤的免疫应答(colombo等nat.rev.cancer 2007,7:880
‑
887)。因此,靶向人中的treg可以提高针对癌症之免疫治疗的效力。
7.按照本发明人之前所示,由人treg而非其他类型人t淋巴细胞产生有活性的tgf
‑
β(stockis,j.等eur.j.immunol.2009,39:869
‑
882),所以tgf
‑
β可以成为目的靶标。
8.然而,未发现针对htgf
‑
β的抗体是有前景的。在局灶性节段性肾小球硬化(focal segmental glomerulosclerosis,fsgs),特发性肺纤维化(idiopathic pulmonary fibrosis,ipf)和晚期恶性黑素瘤或肾细胞癌(renal cell carcinoma,rcc)中进行了一期临床试验(lonning s等current pharmaceutical biotechnology 2011,12:2176
‑
2189)。根据所述试验,在一些患者中观察到了不良事件。报道的主要不良反应包括在黑素瘤患者中形成角化棘皮瘤(keratoacanthoma,ka)和鳞状细胞癌(squamous cell carcinoma,scc)。黑素瘤患者中ka或scc损伤有可能来自其增殖受内源性tgf
‑
β抑制的癌前细胞(lonning s等current pharmaceutical biotechnology 2011,12:2176
‑
2189)。因此,在癌症情况下使用抗tgf
‑
β抗体的主要顾虑是它们可能促进新赘生物损伤的出现,原因是抑制了由内源性tgf
‑
β对癌前细胞所施加的肿瘤抑制作用。
9.本发明的一个目的是提供用于通过靶向经其产生tgf
‑
β的treg来改进癌症治疗的
新策略。
10.之前示出tgf
‑
β的产生受到多步过程的严密调控。在被原蛋白(pro
‑
protein)转变酶furin切割之前的前体称作原tgf
‑
β1同源二聚体。所产生的产物被称为潜伏(latent)tgf
‑
β1,其中c末端片段或成熟tgf
‑
β1保持与称作潜伏相关肽(latency associated peptide)或lap的n末端片段非共价结合。因为lap阻止成熟tgf
‑
β1与其受体结合,所以这种潜伏复合物是无活性的。
11.在本发明中,本发明人示出潜伏tgf
‑
β通过跨膜蛋白garp(glycoprotein a repetitions predominant,以糖蛋白a为主的重复序列)与treg的表面结合。
12.因此,本发明旨在提供基于抗garp蛋白抑制tgf
‑
β信号转导来靶向treg的新策略。
技术实现要素:
13.本发明的一个目的是在tgf
‑
β存在的情况下与以糖蛋白a为主的重复序列(garp)结合的蛋白质。在一个实施方案中,所述蛋白质仅在tgf
‑
β存在的情况下与garp结合。在另一个实施方案中,所述蛋白质在garp与tgf
‑
β复合时与garp结合。在另一个实施方案中,所述蛋白质与garp和tgf
‑
β的复合物结合。
14.在一个实施方案中,所述蛋白质是选自以下的抗体分子:全抗体(whole antibody)、人源化抗体、单链抗体、二聚单链抗体、fv、fab、f(ab)’2、脱岩藻糖基化抗体(defucosylated antibody)、双特异性抗体、双抗体(diabody)、三抗体(triabody)、四抗体(tetrabody)。
15.在另一个实施方案中,所述蛋白质是选自以下的抗体片段:单片式抗体(unibody)、结构域抗体(domain body)和纳米抗体(nanobody)。
16.在另一个实施方案,所述蛋白质是选自以下的抗体模拟物(antibody mimetic):亲合体(affibody)、affilin、affitin、adnectin、atrimer、evasin、darpin、anticalin、avimer、fynomer、versabody和duocalin。
17.本发明的另一个目的是本文以上所述的蛋白质或者结合garp并抑制tgf
‑
β信号转导的蛋白质。
18.在一个实施方案中,所述蛋白质是与以下表位结合的抗体或其抗原结合片段:包含garp之一个或更多个氨基酸的构象表位或者由于garp与潜伏tgf
‑
β复合而被修饰的garp表位。
19.在另一个实施方案中,所述抗体或其抗原结合片段还结合潜伏tgf
‑
β的一个或更多个氨基酸。在另一个实施方案中,所述抗体或其抗原结合片段结合包含一个或更多个残基的表位,所述一个或更多个残基来自seq id no:1所示之garp的101至141残基。
20.本发明的另一个目的是蛋白质,所述蛋白质具有包含至少一个以下cdr的重链可变区:
21.vh
‑
cdr1:gfsltgygin(seq id no:2)或gygin(seq id no:52):
22.vh
‑
cdr2:miwsdgstdynsvlts(seq id no:3);和
23.vh
‑
cdr3:drnyydydgamdy(seq id no:4),
24.或具有与seq id no:2
‑
4或52共有至少60%同一性之氨基酸序列的任意cdr;
25.或者具有包含至少一个以下cdr的轻链可变区:
26.vl
‑
cdr1:kasdhiknwla(seq id no:5);
27.vl
‑
cdr2:gatslea(seq id no:6);和
28.vl
‑
cdr3:qqywstpwt(seq id no:7),
29.或具有与seq id no:5
‑
7共有至少60%同一性之氨基酸序列的任意cdr;
30.或者重链可变区包含至少一个以下cdr:
31.vh
‑
cdr1:syyid(seq id no:13);
32.vh
‑
cdr2:ridpedggtkyaqkfqg(seq id no:14);或
33.vh
‑
cdr3:newetvvvgdlmyeyey(seq id no:15),
34.或具有与seq id no:13
‑
15共有至少60%同一性之氨基酸序列的任意cdr;
35.或者其中轻链可变区包含至少一个以下cdr:
36.vl
‑
cdr1:qasqx1i x2s x3la(seq id no:16),其中x1为s或t,x2为s或v,x3为y或f;
37.vl
‑
cdr2:x1x2sx3x4x5t(seq id no:17),其中x1为g或r,x2为a或t,x3为r或i,x4为l或p,x5为q或k;
38.vl
‑
cdr3:qqyx1sx2px3t,其中x1为d、a、y或v,x2为a、l或v,x3为v或p(seq id no:18);
39.或者具有与seq id no:16
‑
18共有至少60%同一性之氨基酸序列的任意cdr。
40.在一个实施方案中,重链可变区包含至少一个以下cdr:
41.vh
‑
cdr1:gfsltgygin(seq id no:2)或gygin(seq id no:52);
42.vh
‑
cdr2:miwsdgstdynsvlts(seq id no:3);和
43.vh
‑
cdr3:drnyydydgamdy(seq id no:4),
44.或具有与seq id no:2
‑
4或52共有至少60%同一性之氨基酸序列的任意cdr;
45.并且轻链可变区包含至少一个以下cdr:
46.vl
‑
cdr1:kasdhiknwla(seq id no:5);
47.vl
‑
cdr2:gatslea(seq id no:6);和
48.vl
‑
cdr3:qqywstpwt(seq id no:7),
49.或具有与seq id no:5
‑
7共有至少60%同一性之氨基酸序列的任意cdr;
50.或者重链可变区包含至少一个以下cdr:
51.vh
‑
cdr1:syyid(seq id no:13);
52.vh
‑
cdr2:ridpedggtkyaqkfqg(seq id no:14);或
53.vh
‑
cdr3:newetvvvgdlmyeyey(seq id no:15);
54.或具有与seq id no:13
‑
15共有至少60%同一性之氨基酸序列的任意cdr;
55.并且轻链可变区包含至少一个以下cdr:
56.vl
‑
cdr1:qasqx1i x2s x3la(seq id no:16),其中x1为s或t,x2为s或v,x3为y或f;
57.vl
‑
cdr2:x1x2sx3x4x5t(seq id no:17),其中x1为g或r,x2为a或t,x3为r或i,x4为l或p,x5为q或k;
58.vl
‑
cdr3:qqyx1sx2px3t,其中x1为d、a、y或v,x2为a、l或v,x3为v或p(seq id no:18);
59.或者具有与seq id no:16
‑
18共有至少60%同一性之氨基酸序列的任意cdr。
60.在另一个实施方案中,重链可变区包含以下cdr:gfsltgygin(seq id no:2)、
miwsdgstdynsvlts(seq id no:3)、drnyydydgamdy(seq id no:4),并且轻链可变区包含以下cdr:kasdhiknwla(seq id no:5)、gatslea(seq id no:6)、qqywstpwt(seq id no:7),或者具有与所述seq id no:2
‑
7共有至少60%同一性之氨基酸序列的任意cdr;
61.或者重链可变区包含以下cdr:gygin(seq id no:52)、miwsdgstdynsvlts(seq id no:3)、drnyydydgamdy(seqid no:4),并且轻链可变区包含以下cdr:kasdhiknwla(seq idno:5)、gatslea(seq id no:6)、qqywstpwt(seq id no:7),或者具有与所述seq id no:52和3
‑
7共有至少60%同一性之氨基酸序列的任意cdr;
62.或者其中重链可变区包含以下cdr:syyid(seq id no:13)、ridpedggtkyaqktqg(seq id no:14)或newetvvvgdlmyeyey(seq id no:15),并且轻链可变区包含以下cdr:qasqx1i x2s x3la(seq id no16),其中x1为s或t,x2为s或v,x3为y或f;x1x2sx3x4x
s
t(seq id no:17),其中x1为g或r,x2为a或t,x3为r或i,x4为l或p,x5为q或k;qqyx1sx2px3t,其中x1为d、a、y或v,x2为a、l或v,x3为v或p(seq id no:18);或者具有与所述seq id no:16
‑
18共有至少60%同一性之氨基酸序列的任意cdr。
63.在另一个实施方案中,重链可变区的氨基酸序列为seq id no:8或seq id no:50并且轻链可变区的氨基酸序列为seq id no:9或seq id no:51,或者重链可变区的氨基酸序列为seq id no:34并且轻链可变区的氨基酸序列为seq id no:35
‑
39,或者具有与所述seq id no:8
‑
9、50
‑
51或34
‑
39共有至少60%同一性之氨基酸序列的任意序列。
64.本发明的另一个目的是如本文以上所限定的蛋白质,其与具有氨基酸序列seq id no:1之多肽上的表位结合,所述表位被以下抗体识别:所述抗体包含seq id no:8或seq id no:50所示的重链可变区和seq id no:9或seq id no:51所示的轻链可变区,或者所述抗体包含seq id no:34所示的重链可变区和seq id no:35
‑
39所示的轻链可变区之一。
65.本发明的另一个目的是抗体或抗原结合片段,其由在2013年5月30日以登录号lmbp10246cb登记的杂交瘤产生。
66.本发明的另一个目的是多核苷酸序列,其编码本文以上所述的抗体或抗原结合片段。
67.本发明的另一个目的是表达载体,其包含本文以上所述的多核苷酸。
68.本发明的另一个目的是产生针对garp之抗体的杂交瘤细胞系,其在2013年5月30日以登录号lmbp 10246cb登记。
69.本发明的另一个目的是药物组合物,其包含可药用赋形剂和本文以上所述的蛋白质。
70.本发明的另一个目的是本文以上所述的药物组合物,其用于在有此需要的对象中治疗tgf
‑
β相关的病症。在一个实施方案中,所述tgf
‑
β相关的病症选自:炎性疾病、慢性感染、癌症、纤维化、心血管疾病、脑血管疾病(例如缺血性中风)以及神经变性疾病。
71.在另一个实施方案中,本文以上所述的药物组合物与其他癌症治疗或其他免疫治疗剂例如肿瘤疫苗或免疫刺激性抗体(immunostimulatory antibody)组合施用。在另一个实施方案中,本文以上所述的药物组合物作为用于治疗癌症患者的免疫刺激性抗体施用。
72.定义
73.在本发明中,下列术语具有以下含义:
[0074]“抗体”或“免疫球蛋白
”‑
本文中所使用的术语“免疫球蛋白”包括具有两条重链和
两条轻链之组合的多肽,无论其是否具有任何相关的特异免疫反应性。“抗体”指这样的装配,其对目的抗原(例如人garp)具有显著的已知特异免疫反应活性。本文所用的术语“garp抗体”指对人garp蛋白表现出免疫学特异性的抗体。如本文其他地方所解释的,对人garp“特异”并不排除与garp之物种同源物的交叉反应。此外,其也并不排除识别跨越garp蛋白残基和tgf
‑
蛋白残基之表位的抗体。抗体和免疫球蛋白包含轻链和重链,它们之间有或者没有链间共价键。对脊椎动物系统的基本免疫球蛋白结构理解得相对充分。通用术语“免疫球蛋白”包含可在生物化学方面区分的五类不同抗体。所有五类抗体都在本发明的范围内,以下讨论将一般涉及免疫球蛋白分子的igg类。关于igg,免疫球蛋白包含两个相同的分子量约为23,000道尔顿的轻多肽链,以及两个相同的分子量为53,000
‑
70,000道尔顿的重链。这四条链通过二硫键连接成y构型,其中轻链从“y”的口处开始围住(bracket)重链并持续整个可变区。抗体的轻链被分类为κ或λ([k],[λ])。每一类重链可与κ或λ轻链键合。一般而言,当免疫球蛋白由杂交瘤、b细胞或经遗传改造的宿主细胞产生时,轻链和重链相互共价键合,并且两条重链的“尾”区通过共价二硫键或非共价键相互键合。在重链中,氨基酸序列从位于y构型之分叉端的n末端直至位于每条链之底部的c末端。本领域技术人员应了解将重链分类为γ,μ、α、δ或ε,以及它们中的一些亚类(例如γ1
‑
γ4)。正是这条链的性质决定了抗体各自的“类”,如分别为igg、igm、iga、igg或ige。免疫球蛋白亚类(同种型)例如igg1、igg2、igg3、igg4、iga1等被充分表征并且已知赋予功能特化。鉴于本公开内容,这些类和同种型的各经修饰形式对于技术人员而言是易于辨别的,因此也在本发明的范围内。如上所指出的,抗体的可变区允许抗体选择性识别并特异性结合抗原上的表位。即,抗体的vl结构域和vh结构域组合形成了限定三维抗原结合位点的可变区。这种四级抗体结构形成了在每条y臂之末端存在的抗原结合位点。更具体地,抗原结合位点由各个vh和vl链上的三个互补决定区(complementarity determining region,cdr)限定。
[0075]“分离的抗体
”‑
本文所使用的“分离的抗体”是已经从其天然环境分离和/或回收的抗体。其天然环境的污染物组分是会干扰抗体的诊断或治疗用途的物质,并且可以包括酶、激素、和其他蛋白质组分或非蛋白质组分。在一些优选的实施方案中,将抗体纯化至:(1)如通过劳里法(lowry method)测定的按重量计大于抗体的95%,并且最优选按重量计大于99%;(2)足以通过使用转杯式测序仪(spinning cup sequenator)获得至少15个n末端或内部氨基酸序列之残基的程度;或(3)在还原性或非还原性条件下通过sds
‑
page并使用考马斯蓝或优选银染色示出的同质性(homogeneity)。分离的抗体包括抗体天然环境的至少一种组分不存在之后的重组细胞内的原位抗体。然而,一般来说,分离的抗体将通过至少一个纯化步骤制备。
[0076]“亲和力变体(affinity variant)
”‑
本文所使用的术语“亲和力变体”指在氨基酸序列中与参照garp抗体相比表现出一个或更多个改变的变体抗体,其中与参照抗体相比,亲和力变体对于人garp蛋白或garp/tgf
‑
β复合物表现出改变的亲和力。通常来说,与参照garp抗体相比,亲和力抗体对人garp或garp/tgf
‑
β复合物将表现出改进的亲和力。改进可以是对人garp更低的kd,或者对人garp更快的解离率(off
‑
rate)或者改变与非人garp同源物之交叉反应性的模式。与参照garp抗体相比,亲和力变体通常表现出cdr中氨基酸序列的一个或更多个改变。这样的替换可以用不同的氨基酸残基取代cdr中给定位置处存在的原始氨基酸来实现,所述不同的氨基酸残基可以是天然存在的氨基酸残基或非天然存在的氨
基酸残基。氨基酸替换可以是保守的或者非保守的。
[0077]“结合位点
”‑
本文所使用的术语“结合位点”包含负责与目的靶抗原(例如人garp)选择性结合的多肽区。结合结构域或结合区包含至少一个结合位点。示例性的结合结构域包括抗体可变结构域。本发明的抗体分子可以包含单个抗原结合位点或多个(例如,2个、3个或4个)抗原结合位点。
[0078]“保守氨基酸替换
”‑
本文所使用的“保守氨基酸替换”是其中氨基酸残基被具有类似侧链之氨基酸残基替代的氨基酸替换。本领域已经限定了具有类似侧链的氨基酸残基家族,包括碱性侧链(例如,赖氨酸、精氨酸、组氨酸),酸性侧链(例如,天冬氨酸、谷氨酸),不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸),非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸),β
‑
支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸,组氨酸)。因此,可以用来自相同侧链家族的另一个氨基酸残基替代免疫球蛋白多肽中的非必需氨基酸残基。在另一个实施方案中,氨基酸串(string)可以用侧链家族成员的次序和/或组成不同的结构上类似的串替代。
[0079]“嵌合
”‑
本文所使用的“嵌合”蛋白包含与第二氨基酸序列在自然界中不天然连接的第一氨基酸序列。氨基酸序列通常可以存在于集合在融合多肽中的不同蛋白质中或者它们通常可以存在于相同蛋白质中但以新的排列置于融合多肽中。可以例如通过化学合成或通过产生并翻译其中以期望的关系编码多肽区的多核苷酸来产生嵌合蛋白。示例性嵌合garp抗体包括包含源自骆驼科动物(camelid)之vh和vl结构域的融合蛋白,或者其与人抗体(例如人igg1、igg2、igg3或igg4)之恒定结构域融合的人源化变体。
[0080]“cdr
”‑
本文所使用的术语“cdr”或“互补决定区”意指在重链多肽和轻链多肽二者的可变区内发现的不连续的抗原结合位点。这些特定区域已经由kabat等,j.biol.chem.252,6609
‑
6616(1977)和kabat等,sequences of protein of immunological interest.(1991),以及chothia等,j.mol.biol.196:901
‑
917(1987)和maccallum等,j.mol.biol.262:732
‑
745(1996)所描述,其中的定义相互比较时包括氨基酸残基的重叠或氨基酸残基的子集。示出了涵盖以上所列参考文献中各自定义之cdr的氨基酸残基以进行比较。优选地,术语“cdr”是由基于序列比较由kabat限定的cdr。
[0081]
表1:cdr定义
[0082][0083]
(1)残基编号按照kabat等的命名法,如上
[0084]
(2)残基编号按照chothia等的命名法,如上
[0085]
(3)残基编号按照maccallum等的命名法,如上
[0086]“ch2结构域
”‑
本文所使用的术语“ch2结构域”包括例如从使用常规编号方案的抗
体之约244位残基延伸至360位残基的重链分子区(244位至360位残基,kabat编号系统;以及231
‑
340位残基,eu编号系统,kabat ea等sequences of proteins of immunological interest.bethesda,us department of health and human services,nih.1991)。ch2结构域的独特之处在于不与另一个结构域紧密配对。相反地,两个n连接的支链碳水化合物链插入到完整天然igg分子的两个ch2结构域之间。还充分证实了ch3结构域从igg分子的ch2结构域延伸至c末端并包含约108个残基。
[0087]“源自骆驼科动物的
”‑
在某些优选的实施方案中,本发明的garp抗体分子包含源自通过用garp抗原主动免疫接种骆驼科动物所产生的骆驼科动物常规抗体的框架氨基酸序列和/或cdr氨基酸序列。然而,包含源自骆驼科动物之氨基酸序列的garp抗体可以被改造以包含源自人氨基酸序列或其他非骆驼科动物之哺乳动物物种的框架区序列和/或恒定区序列。例如,人或非人灵长类动物框架区、重链区和/或铰链区可以包含在本发明的garp抗体中。在一个实施方案中,“源自骆驼科动物的”garp抗体之框架区中可以存在一个或更多个非骆驼科动物的氨基酸,例如骆驼科动物框架区氨基酸序列可以包含一个或更多个氨基酸突变,其中存在相应的人或非人灵长类动物氨基酸残基。此外,可以将源自骆驼科动物的vh和vl结构域或其人源化变体与人抗体的恒定结构域连接以产生嵌合分子,如广泛地在本文其他部分所描述的。
[0088]“源自
”‑
本文所使用的术语“源自”指定蛋白质(例如garp抗体或其抗原结合片段)指多肽的起源。在一个实施方案中,源自特定起始(starting)多肽的多肽或氨基酸序列是cdr序列或与其相关的序列。在一个实施方案中,源自特定起始多肽的氨基酸序列不连续。例如,在一个实施方案中,源自起始抗体的1个、2个、3个、4个、5个或6个cdr。在一个实施方案中,源自特定起始多肽或氨基酸序列的多肽或氨基酸序列具有与起始序列或其区域之氨基酸序列基本相同的氨基酸序列,其中所述区域由至少3
‑
5个氨基酸、5
‑
10个氨基酸、至少10
‑
20个氨基酸、至少20
‑
30个氨基酸、或至少个30
‑
50个氨基酸组成,或者其可被本领域普通技术人员以其他方式鉴定为具有其在起始序列中的起源。在一个实施方案中,源自起始抗体的一个或更多个cdr序列被改变以产生变体cdr序列,例如亲和力变体,其中所述变体cdr序列保持garp结合活性。
[0089]“双抗体
”‑
本发明所使用的术语“双抗体”指通过以下制备的小抗体片段,用vh和vl结构域之间的短接头(约5
‑
10个残基)构建sfv片段(参见sfv段落)以使得v结构域的链间而非链内配对,得到二价体、片段(即具有两个抗原结合位点的片段)。双特异性双抗体是两个“交叉”sfv片段的异源二聚体,其中两个抗体的vh和vl结构域位于不同的多肽链上。在例如ep 404,097、wo 93/11161和holliger等,proc.natl.acad.sci.,90:6444
‑
6448(1993)中更全面的描述了双抗体。
[0090]“改造的
”‑
本文所使用的术语“改造的”包括通过合成手段(例如通过重组技术、体外肽合成、通过肽的酶促或化学偶联或者这些技术的一些组合)操作核酸或多肽分子。优选地,本发明的抗体是经改造的,包括例如人源化和/或嵌合抗体,并且已经改造抗体来改善一种或更多种性质,例如抗原结合、稳定性/半衰期或效应物功能。
[0091]“表位
”‑
本文所使用的术语“表位”指位于肽或蛋白质或抗体结合的蛋白质之上的特定氨基酸排列。表位通常由一组分子(例如氨基酸或糖侧链)的化学活性表面组成,并且具有特定三维结构特征以及特定电荷特征。表位可以是线性的或构象的,即包含抗原之多
个区域中的的两个或更多个氨基酸序列,其不一定连续。
[0092]“框架区
”‑
本文所使用的术语“框架区”或“fr区”包括是可变区的一部分但不是cdr一部分的氨基酸残基(例如使用cdr的kabat定义)。因此,可变区框架的长度为约100
‑
120个氨基酸,但仅包括cdr之外的那些氨基酸。对于由kabat等限定的cdr和重链可变区的特定实例,框架区1对应于涵盖1
‑
30位氨基酸的可变区结构域;框架区2对应于涵盖36
‑
49位氨基酸的可变区结构域;框架区3对应于涵盖66
‑
94位氨基酸的可变区结构域;并且框架区4对应于从103位氨基酸到可变区末端的可变区结构域。轻链框架区类似地被各轻链可变区cdr所隔开。类似地,使用chothia等或mccallum等的cdr定义,框架区边界由以上所述的各cdr终点隔开。在一些优选的实施方案中,cdr由kabat定义。在天然存在的抗体中,在各单体抗体上存在的6个cdr是短的、不连续的氨基酸序列,其特异性定位以形成抗原结合位点,如抗体在水性环境中呈现了其三维构型。氨基酸序列中重可变结构域和轻可变结构域的剩余部分显示出较小的分子间可变性并且被称作框架区。框架区主要采用[β]片层构象,并且cdr形成与其连接的环,在一些情况下形成[β]片层结构的一部分。因此,这些框架区的作用是形成支架,其通过链间非共价相互作用为6个cdr提供了正确方向的定位。由所定位的cdr形成的抗原结合位点限定了与免疫反应性抗原上之表位互补的表面。这一互补性表面促进了抗体与免疫反应性抗原表位的非共价结合。本领域普通技术人员可以容易地鉴定cdr的位置。
[0093]“片段
”‑
本文所使用的术语“片段”指抗体或抗体链的一部分或区域,其比完整或整个抗体或抗体链包含更少的氨基酸残基。术语“抗原结合片段”指结合抗原或与完整抗体(即与其源自的完整抗体)竞争抗原结合(即与人garp特异性结合)的免疫球蛋白或抗体的多肽片段。本文所使用的术语抗体分子的“片段”包括抗体的抗原结合片段,例如抗体轻链可变区(vl)、抗体重链可变区(vh)、单链抗体(scfv)、f(ab
′
)2片段、fab片段、fd片段、fv片段、单结构域抗体片段(dab)、单臂(单价)抗体、双抗体或通过此类抗原结合片段的组合、装配或缀合形成的任何抗原结合分子。可以例如通过化学或酶促处理完整或整个抗体或抗体链或者通过重组手段来获得片段。
[0094]“fv
”‑
本文所使用的术语“fv”是含有完整抗原识别和结合位点的最小抗体片段。该片段由一个重链可变区结构域和一个轻链可变区结构域紧密、非共价缔合的二聚体组成。从这两个结构域的折叠发出6个高变环(来自h和l链的各三个环),其有助于氨基酸残基的抗原结合并向抗体赋予抗原结合特异性。然而,即使单个可变结构域(或fv的一半,其包含对抗原特异的仅3个cdr)能够识别和结合抗原,尽管与整个结合位点相比亲和力较低。
[0095]“重链可变区
”‑
本文所使用的术语“重链可变区”包括源自免疫球蛋白重链之恒定结构域的氨基酸序列。包含重链区的多肽包含以下的至少一个:ch1结构域,铰链(例如,上、中和/或下铰链区)结构域,ch2结构域、ch3结构域,或者其变体或片段。在一个实施方案中,本发明的结合分子可以包含免疫球蛋白重链的fc区(例如,铰链部分、ch2结构域和ch3结构域)。在另一个实施方案中,本发明的结合分子缺少至少一部分恒定结构域(例如,ch2结构域的所有或部分)。在某些实施方案中,至少一个(并且优选所有)恒定结构域源自人免疫球蛋白重链。例如,在一个优选的实施方案中,重链区包含完整的(fully)人铰链结构域。在另一些优选的实施方案中,重链区包含完整的人fc区(例如,来自人免疫球蛋白的铰链、ch2和ch3结构域序列)。在某些实施方案中,重链区的组成型恒定结构域来自不同的免疫球蛋白
分子。例如,多肽的重链区可包含源自igg1分子的ch2结构域和源自igg3或igg4分子的铰链区。在另一些实施方案中,恒定结构域是包含不同免疫球蛋白分子之区域的嵌合结构域。例如,铰链可包含来自igg1分子的第一区和来自igg3或igg4分子的第二区。如上所示,本领域普通技术人员应理解,可以对重链区的恒定结构域进行修饰以使得它们在氨基酸序列上与天然存在(野生型)免疫球蛋白分子不同。即,本文公开的本发明多肽可包含对重链恒定结构域(ch1、铰链、ch2或ch3)和/或轻链恒定结构域(cl)的一个或更多个改变或修饰。示例性的修饰包括一个或更多个结构域中之一个或更多个氨基酸的添加、缺失或替换。
[0096]“铰链区
”‑
本文所使用的术语“铰链区”包括将ch1结构域连结至ch2结构域的重链分子的区域。该铰链区包含大约25个残基并且是柔性的,因此允许两个n末端抗原结合区独立地移动。铰链区可以细分成三个不同的结构域,上铰链结构域、中铰链结构域和下铰链结构域(roux等j.immunol.1998161:4083)。
[0097]
术语“高变环”和“互补决定区”不是严格意义上的同义词,因为高变环(hv)是基于结构定义的,而互补决定区(cdr)是基于序列可变性定义的(kabat等,sequences of proteins of immunological interest,第五版,public health service,national institutes of health,bethesda,md.,1983),并且hv和cdr的限制在一些vh和vl结构域中可以不同。vl和vh结构域的cdr通常可限定为包含以下氨基酸:轻链可变结构域中的24
‑
34位残基(cdrl1)、50
‑
56位残基(cdrl2)和89
‑
97位残基(cdrl3)以及重链可变结构域中的31
‑
35或31
‑
35b位残基(cdrh1)、50
‑
65位残基(cdrh2)和95
‑
102位残基(cdrh3)(kabat等,sequencesof proteins of immunological interest,第五版public health service,national institutes of health,bethesda,md.(1991))。因此,hv可以包括在相应的cdr内并且本文提及vh和vl结构域的“高变环”应当被解释为还涵盖相应的cdr,反之亦然,除非另有说明。可变结构域之更加高度保守的区域被称为框架区(fr),如下文所定义。天然重链和轻链的可变结构域各自包含四个fr(分别为fr1、fr2、fr3和fr4),主要采用[β]片层构象,并被三个高变环连接。各条链中的高变环通过fr近距离地聚在一起,与来自其他链的高变环一起促进抗体之抗原结合位点的形成。抗体的结构分析揭示由互补决定区形成之结合位点的序列和形状之间的关系(chothia等,j.mol.biol.227:799
‑
817(1992);tramontano等,j.mol.biol,215:175
‑
182(1990))。尽管其序列高度可变,6个环中的5个仅采用小的主链构象库(repertoire),称作“典型结构(canonical structure)”。这些构象由以下决定,首先是环的长度,其次是环中和框架区中某些位置处存在的关键残基,其通过其包装、氢键键合或呈现不寻常主链构象的能力来决定构象。
[0098]“人源化替换(humanising substitution)
”‑
本文所使用的术语“人源化替换”指这样的氨基酸替换,其中存在于vh或vl结构域抗体garp抗体(例如骆驼科动物来源的garp抗体)之特定位置的氨基酸残基被参照人vh或vl结构域之等同位置处存在的氨基酸残基替代。参照人vh或vl结构域可以是由人种系编码的vh或vl结构域,其中经替换的残基可以称作“种系化替换”。人源化/或种系化替换可以在本文所限定的garp抗体之框架区和/或cdr中进行。
[0099]“高人同源性
”‑
如果将vh结构域和vl结构域一起考虑,表现出与最匹配的人种系vh序列和vl序列具有至少90%氨基酸序列同一性,则认为包含重链可变结构域(vh)和轻链可变结构域(vh)的抗体具有高人同源性。具有高人同源性的抗体可以包括包含表现出与人
种系序列具有足够高的序列同一性%的天然非人抗体之vh和vl结构域的抗体,包括例如包含骆驼科动物常规抗体之vh和vl结构域的抗体,以及经改造的,特别是人源化的此类抗体的变体,以及“全人(fully human)”抗体。在一个实施方案中,具有高人同源性之抗体的vh结构域可以表现出与跨框架区fr1、fr2、fr3和fr4之一个或更多个人vh结构域具有80%或更高的氨基酸序列同一性或序列同源性。在另一些实施方案中,本发明之多肽的vh结构域和最匹配的人种系vh结构域序列之间的氨基酸序列同一性或序列同源性可以为85%或更高、90%或更高、95%或更高、97%或更高,或者高达99%或甚至100%。在一个实施方案中,与最匹配的人vh序列相比,具有高人同源性之抗体的vh结构域跨框架区fri、fr2、fr3和fr4可含有一个或更多个(例如1个至10个)氨基酸序列错配。在另一个实施方案中,具有高人同源性之抗体的vl结构域与跨框架区frl、fr2、fr3和fr4的一个或更多个人vl结构域可以表现出80%或更高的序列同一性或序列同源性。在另一些实施方案中,本发明多肽的vl结构域和最匹配的人种系vl结构域序列之间的氨基酸序列同一性或序列同源性可以为85%或更高、90%或更高、95%或更高、97%或更高,或者高达99%或甚至100%。
[0100]
在一个实施方案中,与最匹配的人vl序列相比,具有高人同源性之抗体的vl结构域跨框架区frl、fr2、fr3和fr4可含有一个或更多个(例如1个至10个)氨基酸序列错配。在分析具有人高同源性之抗体和人种系vh和vl之间的百分比序列同一性之前,可以确定典型折叠(canonical fold),这允许鉴定具有与h1和h2或l1和l2(以及l3)典型折叠之相同组合的人种系片段的家族。随后,选择与目的抗体的可变区具有最高程度序列同源性的人种系家族成员以用于给序列同源性进行评分。可以使用在网页www.bioinf.org.uk/abs/chothia.html.page上公开可得的生物信息学工具进行高变环l1、l2、l3、h1和h2之chothia典型类别的确定。程序的输出示出数据文件中所需的关键残基。在这些数据文件中,用在每个位置允许的氨基酸示出关键残基位置。给出目的抗体的可变区序列作为输入并且首先与共有抗体序列比对以指定kabat编号方案。典型折叠的分析使用通过由martin和thornton开发的自动化方法(martin等,j.mol.biol.263:800
‑
815(1996))衍生的一组关键残基模板。对于已知的具体人种系v区段(其使用h1和h2或者l1和l2(以及l3)之典型折叠的同一组合),可以确定在序列同源性方面的最佳匹配家族成员。使用生物信息工具,可以确定目的抗体之vh和vl结构域框架区氨基酸序列和由人种系编码的相应序列之间的百分比序列统一性,但实际上也可以应用序列的人工比对。可以从多种蛋白质数据库,例如vbase(http://vbase.mrc
‑
cpe.cam.ac.uk/)或pluckthun/honegger数据库(http://www.bioc.unizh.ch/antibody/sequences/germlines)鉴定人免疫球蛋白序列。为了比较人序列与目的抗体中vh或vl结构域的v区,可以使用例如经网站像www.expasy.ch/tools/#align可得的序列比对算法,也可以进行有限组序列的人工比对。选择具有典型折叠之同一组合并且与每条链之框架区1、2和3具有最高程度同源性之家族的人种系轻链和重链序列,并与目的可变区进行比较,还针对人种系jh和jk或jl区检查fr4。注意到,使用具有典型折叠之同一组合的来自人种系家族的最匹配序列来评估fr1、fr2和fr3之残基的总百分比序列同源性的计算。仅对不同于最匹配或者具有典型折叠之相同组合的相同家族的其他成员的残基进行评分(nb
‑
排除任何引物编码的差异)。然而,出于人源化目的,与其他人种系家族的成员相同的框架区中的残基(其不具有典型折叠的相同组合)可被认为是“人”的,尽管事实上根据上述严格条件这些被评分为“阴性”。这一假设是基于用于人源化的“混合和匹
配”方法,其中fr1、fr2、fr3和fr4中的每一个分别与其最匹配的人种系序列进行比较并且因此人源化分子含有不同fr的组合,如qu和同事(qu等,clin.cancerres.5:3095
‑
3100(1999))以及ono和同事(ono等,mol.immunol.36:387
‑
395(1999))所完成的。单个框架区的边界可以使用imgt编号方案指定,其是chothia之编号方案的改良(lefranc等,nar27:209
‑
212(1999);http://im.gt.cines.fr)。具有高人同源性的抗体可以包含具有人或人样典型折叠的高变环或cdr,如下详细讨论的。在一个实施方案中,具有高人同源性之抗体的vh结构域或vl结构域任一中的至少一个高变环或cdr可以获自或源自非人抗体的的vh或vl结构域,例如来自骆驼科(camelidae)物种的常规抗体,表现出预期的或实际的典型折叠结构,其基本上与在人抗体中发生的典型折叠结构相同。本领域公认的,尽管在由人种系编码的vh结构域和vl结构域二者中都存在之高变环的一级氨基酸序列从定义上讲是高度可变的,但是所有的高变环(例外的是vh结构域的cdrh3)仅采用几种不同的结构构象,称为典型折叠(chothia等,j.mol.biol.196:901
‑
917(1987);tramontano等proteins6:382
‑
94(1989)),其取决于以下二者:高变环的长度和所谓典型氨基酸残基的存在(chothia等,j.mol.biol.196:901
‑
917(1987))。可以通过结构分析(例如x射线结晶学)来确定完整vh或vl结构域中高变环的实际典型结构,但还可基于表征特定结构的关键氨基酸残基来预测典型结构(以下进一步讨论)。本质上,决定每个典型结构之残基的特定模式形成了“标识(signature)”,其使得能够在未知结构之vh或vl结构域的高变环中识别典型结构,因此可以仅根据一级氨基酸序列预测典型结构。可以使用从www.bioinf.org.uk/abs/chothia.html,www.biochem.ucl.ac.uk/~martin/antibodies.html和www.bioc.unizh.ch/antibody/sequences/germlines/vbasehvk.html公开可得的算法分析具有高人同源性之抗体中任意给定vh或vl序列之高变环的预测的典型折叠结构。这些工具允许查询vh或vl序列以针对已知典型结构的人vh或vl结构域序列进行比对,并对所查询序列的高变环进行典型结构预测。在vh结构域的情况下,如果满足以下标准的至少第一条,优选二者,则h1和h2环可被评为具有与已知在人抗体中存在的典型折叠结构域“基本相同”的典型折叠结构:
[0101]
1.与最匹配的人典型结构类别长度(由残基的数目决定)相同。
[0102]
2.与描述对应h1和h2典型结构类别的关键氨基酸残基有至少33%同一性,优选至少50%同一性(注意,出于前述分析的目的,分开处理h1和h2环并各自针对其最匹配的人典型结构类别进行比较)。前述分析依赖于目的抗体的h1和h2环之典型结构的预测。如果目的抗体中h1和h2环的实际结构是已知的(例如基于x射线结晶学),那么如果环与最匹配的人典型结构类别(通常为+1或+2氨基酸)不同,但目的抗体中h1和h2环的实际结构匹配人典型折叠的结构,那么目的抗体中的h1和h2环可以被评为具有与人抗体中存在的已知典型折叠结构“基本相同的”典型折叠结构。用于人vh结构域之第一和第二高变环(h1和h2)的人典型结构类别中发现的关键氨基酸残基由chothia等,j.mol.biol.227:799
‑
817(1992)描述,其内容通过引用整体并入本文。具体的,在chothia等的802页上的表3(其通过引用明确地并入本文)列出了在人种系中发现的h1典型结构之关键位点处的优选氨基酸残基,而803页的表4(也通过引用明确地并入)列出了在人种系中发现的cdr h2典型结构之关键位点处的优选氨基酸残基。在一个实施方案中,具有高人同源性之抗体的vh结构域中h1和h2二者均表现出预测的或实际的典型折叠结构,其基本上与人抗体中存在的典型折叠结构相同。具有
高人同源性的抗体可以包含vh结构域,其中高变环h1和h2形成与在至少一种人种系vh结构域中存在的已知典型结构的组合相同的典型折叠结构的组合。已经观察到由人种系编码的vh结构域中实际上在h1和h2处仅存在某些典型折叠结构的组合。在一个实施方案中,在具有人高同源性之抗体的vh结构域的h1和h2可获自非人物种(例如骆驼科物种)的vh结构域,形成与已知在人种系或体细胞突变的vh结构域中存在典型折叠结构的组合相同的预测或实际典型折叠结构的组合。在一些非限制性实施方案中,具有高人同源性之抗体的vh结构域中的h1和h2可从非人物种(例如骆驼科物种)获得,并形成以下的典型折叠组合之一:1
‑
1、1
‑
2、1
‑
3、1
‑
6、1
‑
4、2
‑
1、3
‑
1和3
‑
5。具有高人同源性的抗体可含有表现出与人vh具有高统一性/序列同源性二者的vh结构域,并且其含有表现出与人vh具有结构同源性的高变环。具有高人同源性的抗体之vh结构域中在h1和h2处存在典型折叠及其组合可以是有利的,其对于代表与在整个一级氨基酸序列同一性方面具有高人同源性的抗体之vh结构域最匹配的人vh种系序列进行“矫正(correct)”。举例来说,如果最接近序列与人种系vh3结构域匹配,那么其可以有利于h1和h2形成典型折叠之组合,所述典型折叠之组合也天然存在于人h3结构域中。这在具有高人同源性之抗体来源于非人物种的情况下特别重要,例如含有源自骆驼科动物常规抗体之vh和vl结构域的抗体,特别是含有人源化骆驼科动物vh和vl结构域的抗体。因此,在一个实施方案中,具有高人同源性之garp抗体的vh结构域可以表现出与跨框架区fr1、fr2、fr3和fr4的人vh结构域具有80%或更高、85%或更高、90%或更高、95%或更高、97%或更高、或高达99%或甚至100%的序列同一性或序列同源性,此外同一抗体中的h1和h2获自非人vh结构域(即,源自骆驼科物种),但形成与已知在相同人vh结构域中天然存在的典型折叠组合相同的预测或实际典型折叠结构的组合。在另一些实施方案中,具有高人同源性之抗体的vl结构域中的l1和l2各自获自非人物种的vl结构域(例如,源自骆驼科动物的vl结构域),并且各自表现出与在人抗体中存在的典型折叠结构域基本相同的预测或实际典型折叠结构。与vh结构域相似,vλ和vκ型二者的vl结构域之高变环都可采用有限数目构象或典型结构,部分地由长度决定并且也由在某些典型位置处存在的关键氨基酸残基决定。在具有高人同源性的目的抗体内,如果满足以下标准的至少第一条(并优选二者),获自非人物种(例如骆驼科物种)之vl结构域的l1、l2和l3环可以被评为具有与已知人抗体中存在的典型折叠结构“基本相同”的典型折叠结构:
[0103]
1.与最匹配的人结构类别长度(由残基的数目决定)相同。
[0104]
2.与描述来自vλ或vκ库的对应人l1或l2典型结构类别的关键氨基酸残基有至少33%同一性,优选至少50%同一性(注意,出于前述分析的目的,分开处理l1和l2环并各自针对其最匹配的人典型结构类别进行比较)。前述分析依赖于目的抗体的vl结构域中l1、l2和l3环之典型结构的预测。如果l1、l2和l3环的实际结构是已知的(例如基于x射线结晶学),那么如果环的长度与最匹配的人典型结构类别(通常为+1或+2氨基酸)不同,但骆驼科环的实际结构匹配人典型折叠,则源自目的抗体的l1、l2或l3环也可以被评为具有与已知存在于人抗体中的典型折叠结构“基本相同的”典型折叠结构。在人典型结构类别中发现的人vλ和vκ结构域之cdr的关键氨基酸残基由morea等methods,20:267
‑
279(2000)和martin等,j.mol.biol.,263:800
‑
815(1996)描述。人vκ结构域的结构库还由tomlinson等embo j.14:4628
‑
4638(1995)描述,并且vλ结构域的结构库由williams等j.mol.biol.,264:220
‑
232(1996)描述。所有这些文件的内容通过引用并入本文。具有高人同源性之抗体的vl结构
域中的l1和l2可以形成与已知存在于人种系vl结构域中的典型折叠结构之组合相同的预测或实际典型折叠结构的组合。在一些非限制性实施方案中,具有高人同源性之抗体(例如,含有源自骆驼科的vl结构域的抗体或其人源化变体)的vλ结构域中的l1和l2可形成以下典型折叠组合之一:11
‑
7、13
‑
7(a、b、c)、14
‑
7(a、b)、12
‑
11、14
‑
11和12
‑
12如williams等j.m0l.bi0l.264:220
‑
32(1996)所限定的并且在http://www.bioc.uzh.ch/antibody/sequences/germlines/vbase_hvl.html上示出)。在一些非限制性实施方案中,vκ结构域中的l1和l2可形成以下典型折叠组合之一:2
‑
1、3
‑
1、4
‑
1和6
‑
1(如在tomlinson等,embo j.14:4628
‑
38(1995)中所限定的,并且在http://www.bioc.uzh.ch/antibody/sequences/germlines/vbase_hvk.html上示出)。
[0105]
在另一个实施方案中,具有高人同源性之抗体的vl结构域中的所有三个l1、l2和l3都可以表现出基本上的人结构。优选的,具有高人同源性之抗体的vl结构表现出与人vl具有高序列同一性/序列同源性二者,并且vl结构域中的高变环也可表现出与人vl的结构同源性。
[0106]
在一个实施方案中,具有高人同源性的garp抗体的vl结构域可以表现出与跨框架区fr1、fr2、fr3和fr4的人vl结构域具有80%或更高、85%或更高、90%或更高、95%或更高、97%或更高、或高达99%或甚至100%的序列同一性,此外高变环l1和高变环l2可形成与已知天然存在于相同人vl结构域中的典型折叠组合相同的预测或实际典型折叠结构的组合。当然,设想表现出与人vh具有高序列同一性/序列同源性并且还与人vh的高变环有结构同源性的vh结构域将与表现出与人vl具有高序列同一性/序列同源性并且还与人vl的高变环有结构同源性的vl结构域组合以提供具有高人同源性的抗体,其含有与人编码的vh/vl配对具有最大的序列和结构同源性的vh/vl配对(例如,源自骆驼科的vh/vl配对)。
[0107]
本文所用的“免疫特异的”、“对
……
特异”或“特异性结合
”‑
如果抗体与抗原在可检测的水平下反应,优选亲和常数,ka为大于或等于约104m
‑1,或者大于或等于约10
5 m
‑1,大于或等于约10
6 m
‑1,大于或等于约10
7 m
‑1,或者大于或等于10
8 m
‑1,或者大于或等于10
9 m
‑1,或者大于或等于10
10 m
‑1,则称其对所述抗原“免疫特异的”,“对所述抗原特异”,或抗体与抗原“特异性结合”。抗体对其同源抗原(cognate antigen)的亲和力通常还可表示为解离常数kd,并且在某些实施方案中,如果结合的kd小于或等于10
‑4m,小于或等于约10
‑
5 m,小于或等于约10
‑6m,小于或等于10
‑7m,或者小于或等于10
‑8m,或者小于或等于5.10
‑9m,或者小于或等于10
‑9m,或者小于或等于5.10
‑
10
m,或者小于或等于10
‑
10
m,则抗体与抗原特异性结合。可以使用常规技术容易地确定抗体的亲和力,例如由scatchard g等(the attractions 0f proteins for small molecules and ions.ann nyacad sci 1949;51:660
‑
672)所描述的那些技术。通常可以使用包括例如基于免疫荧光的测定,例如免疫组织化学(immuno
‑
histochemistry,ihc)和/或荧光活化的细胞分选(fluorescence
‑
activated cell sorting,facs)来确定和评估抗体对抗原、其细胞或组织的结合特性。
[0108]
本文所使用的“分离的核酸”是与其他基因组dna序列以及天然伴随天然序列的蛋白质或复合物(例如核糖体和聚合酶)基本分离的核酸。该术语包括已经从其天然存在的环境移出的核酸序列,并且包括重组或克隆的dna分离物以及化学合成的类似物或者通过异源系统生物合成的类似物。基本上纯的核酸包括所属核酸的分离形式。当然,这指的是作为最初分离的核酸,并不排除之后人工向分离的核酸添加的基因或序列。以其常规含义使用
术语“多肽”,即作为氨基酸序列。多肽不受限于产物的具体长度。肽、寡肽和蛋白质都包括在多肽的定义中,并且这样的术语在本文中可以互换使用,除非另有明确的说明。该术语也并非指或排除多肽的表达后修饰,例如糖基化、乙酰化、磷酸化等,以及本领域已知的其他修饰(天然存在的和非天然存在的)。多肽可以是整个蛋白质,或其子序列。在本发明的上下文中特定的目的多肽是包含cdr并能够结合抗原的氨基酸序列。“分离的多肽”是已经被鉴定并且从其天然环境组分分离和/或回收的多肽。在一些优选的实施方案中,分离的多肽将被纯化至:(1)如通过劳里法测定的按重量计大于多肽的95%,并且最优选的按重量计大于99%;(2)足以通过使用转杯式测序仪获得至少15个n末端或内部氨基酸序列之残基的程度;或(3)在还原性或非还原性条件下通过sds
‑
page并使用考马斯蓝或优选银染色的同质性。分离的多肽包括重组细胞内的原位多肽,因为多肽天然环境的至少一种组分将不存在。然而,一般来说将通过至少一个纯化步骤来制备分离的多肽。
[0109]“同一性”或“相同
”‑
当在两个或更多个多肽之间的关系中使用本文所使用的术语“同一性”或“相同”时,指多肽之间序列相关的程度,如通过两个或更多个氨基酸残基串之间匹配的数目确定。“同一性”指使用通过特定数学模型或计算机程序(即“算法”)寻址的空位比对(如果有的话)来测量两个或更多个序列的较小者之相同匹配的百分比。可以通过已知方法容易地鉴定相关多肽的同一性。这样的方法包括但不限于computational molecular biology,lesk,a.m.,编辑,oxford university press,new york,1988;biocomputing:informatics and genome projects,smith,d.w.,编辑,academic press,new york,1993;computer analysis of sequence data,part 1,griffin,a.m.,和griffin,h.g,编辑,humana press,new jersey,1994;sequence analysis in molecular biology,von heinje,g.,academic press,1987;sequence analysis primer,gribskov,m.和devereux,j.,编辑.,m.stockton press,new york,1991;以及carillo等,siam j.applied math.48,1073(1988)中所描述的那些方法。用于测定同一性的一些优选方法被设计成给出所测试序列之间最大的匹配。在公开可得的计算机程序中描述了测定同一性的方法。用于测定两条序列之间同一性的优选计算机程序方法包括gcg程序包,包括gap(devereux等,nucl.acid.res.\2,387(1984);genetics computer group,university of wisconsin,madison,wis.)、blastp、blastn和fasta(altschul等,j.m0i.biol.215,403
‑
410(1990))。blastx程序可从美国生物技术信息中心(national center for biotechnology information,ncbi)或其他资源(blast manual,altschul等ncb/nlm/nih bethesda,md.20894;altschul等,同上)公开获得。还可以使用公知的smith waterman算法来确定同一性。
[0110]“经修饰的抗体
”‑
本文所使用的术语“经修饰的抗体”包括被改变以使得其不是天然存在的抗体合成形式,例如包含至少两个重链区而非两个完整重链的抗体(例如缺失结构域的抗体或微抗体(minibody));经改变以结合两个或更多个不同抗原或单个抗原上不同表位之抗体的多特异性形式(例如双特异性,三特异性等);连结scfv分子的重链分子等。scfv分子是本领域已知的并且在例如美国专利5,892,019中描述。此外,术语“经修饰的抗体”包括抗体的多价形式(例如,三价、四价等,结合三个或更多个拷贝之相同抗原的抗体)。在另一个实施方案中,本发明的经修饰抗体是包含至少一个缺少ch2结构域之重链区且包含多肽之结合结构域的融合多肽,所述多肽的结合结构域包含受体配体对的一个成员的结
合区。
[0111]“哺乳动物
”‑
本文所使用的术语“哺乳动物”是指任何哺乳动物,包括人、圈养动物和农场动物、以及动物园动物、运动动物或宠物动物,例如狗、猫、牛、马、绵羊、猪、山羊、兔等。优选地,所述哺乳动物是人。
[0112]“单克隆抗体
”‑
本文所使用的术语“单克隆抗体”指从基本上同源的抗体群获得的抗体,即除了可在少量中存在的可能天然发生的突变,包含在所述群中的单个抗体是相同的。单克隆抗体针对单个抗原位点是高度特异的。此外,相比于包括针对不同决定簇(表位)之不同抗体的多克隆抗体制备物,每个单克隆抗体针对抗原上的单个决定簇。除了其特异性,单克隆抗体的益处在于其可通过其他抗体无污染的合成。不能将修饰词“单克隆”解释为通过需要任何特定方法生产抗体。例如,本发明中可用的单克隆抗体可以通过由kohler等,nature,256:495(1975)首次描述的杂交瘤方法制备,或者可以在细菌、真核动物或植物细胞中使用重组dna方法进行(参见例如美国专利no 4,816,567)。例如,还可以使用在clackson等,nature,352:624
‑
628(1991)和marks等,j.mol.biol.,222:581
‑
597(1991)中所述的技术从噬菌体抗体文库分离“单克隆抗体”。
[0113]“天然序列
”‑
本文所使用的术语“天然序列”指与源自自然界的多核苷酸具有相同核苷酸序列的多核苷酸。“天然序列”多肽是与源自自然界(例如来自任何物种)的多肽(例如抗体)具有相同氨基酸序列的多肽。可以从自然界分离或通过重组或合成方法产生此类天然序列多核苷酸和多肽。本文中所用的术语多核苷酸“变体”是通常与本文所公开的具体多核苷酸不同的多核苷酸,不同之处在于一个或更多个替换、缺失、添加和/或插入。这样的变体可以是天然存在的或者可以是合成产生的,例如通过修饰本发明的一个或更多个多核苷酸序列,并如本文所述和/或使用本领域公知的任意多种技术评估所编码多肽的一种或更多种生物学活性。本文所使用的术语多肽“变体”是通常与本文所公开的具体多肽不同的多肽,不同之处在于一个或更多个替换、缺失、添加和/或插入。这样的变体可以是天然存在的或者可以是合成产生的,例如通过修饰本发明的一个或更多个以上多肽序列,并如本文所述和/或使用本领域公知的任意多种技术评估多肽的一种或更多种生物学活性。可以在本发明多核苷酸和多肽的结构中进行修饰并仍然获得编码具有期望特征之变体或衍生多肽的功能性分子。当期望改变多肽的氨基酸序列以产生等同的(或者甚至改进的)变体或本发明多肽的区域,本领域技术人员通常将改变编码dna序列的一个或更多个密码子。例如,某些氨基酸可以替换蛋白质结构中的另一些氨基酸而不明显损失其与其他多肽(例如抗原)或细胞结合的能力。因为蛋白质的结合能力和性质限定了蛋白质的生物功能活性,所以可以在蛋白质序列中进行某些氨基酸序列替换(当然,其基本dna编码序列)并仍然获得具有类似性质的蛋白质。因此考虑在所公开组合物的肽序列或编码所述肽的对应dna序列中产生多种改变而不明显损失其生物效用或活性。在多种情况中,多肽变体将含有一种或更多中保守替换。“保守替换”是其中一个氨基酸被具有类似性质的另一个氨基酸所替换的替换,以使得肽化学领域的技术人员可以预期多肽的二级结构和亲水性质将基本不变。如上所述,因此氨基酸替换通常基于氨基酸侧链取代基的相对相似性,例如其疏水性,亲水性、电荷、大小等。考虑数个前述特征的示例性替换是本领域技术人员所公知的并且包括:精氨酸和赖氨酸,谷氨酸和天冬氨酸,丝氨酸和苏氨酸,谷氨酰胺和天冬酰胺,以及缬氨酸、亮氨酸和异亮氨酸。还可以根据残基之极性、电荷、溶解度、疏水性、亲水性和/或两亲性质的相
似性进行氨基酸替换。例如,带负电荷的氨基酸包括天冬氨酸和谷氨酸;带正电荷的氨基酸包括赖氨酸和精氨酸;以及拥有相似亲水性值的具有不带电极性头基团的氨基酸包括亮氨酸、异亮氨酸和缬氨酸;甘氨酸和丙氨酸;天冬酰胺和谷氨酰胺;以及丝氨酸、苏氨酸、苯丙氨酸和酪氨酸。代表保守改变的另一些氨基酸基团包括(1)ala、pro、gly、glu、asp、gln、asn、ser、thr;(2)cys、ser、tyr、thr;(3)val、ile、leu、met、ala、phe;(4)lys、arg、his;和(5)phe、tyr、trp、his。变体还可以或者替选地含有非保守改变。在一个优选的实施方案中,通过替换、缺失或添加五个氨基酸或更少使变体多肽与天然序列不同。还可以(或者替选地)通过例如缺失或添加对多肽的免疫原性、二级结构和亲水特性的影响最小的氨基酸来修饰变体。
[0114]“可药用赋形剂
”‑
本文所使用的术语“可药用赋形剂”包括任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。当施用至动物(优选人)时,所述赋形剂不产生不良反应、变态反应或其它不适反应。对于人施用,制品应当满足fda生物制品标准办公室要求的无菌、致热原性以及一般安全性和纯度标准。
[0115]“特异性
”‑
本文所使用的术语“特异性”指特异性结合给定靶标(例如garp),例如与给定靶标免疫反应的能力。多肽可以是单特异性的并含有一个或更多个特异性结合靶标的结合位点,或者多肽可以是多特异性的并含有两个或更多个特异性结合相同或不同靶标的结合位点。在一个实施方案中,本发明的抗体对于一个以上的靶标有特异性。例如,在一个实施方案中,本发明的多特异性结合分子与garp以及在肿瘤细胞上表达的第二分子结合。包含与在肿瘤细胞上表达之抗原结合的抗原结合位点的示例性抗体是本领域已知的,并且来自此类抗体的一个或更多个cdr可包括在本发明的抗体中。
[0116]“合成的
”‑
本文相对于多肽使用的术语“合成的”包括包含非天然存在之氨基酸序列的多肽。例如,非天然存在的多肽是天然存在多肽的经修饰形式(例如包含突变,例如添加、替换或缺失)或者是这样的多肽,其包含在氨基酸的线性序列中与第二氨基酸序列(其可以是或者可以不是天然存在的)连接的第一氨基酸序列(其可以是或者可以不是天然存在的),所述第一氨基酸序列在自然情况下不天然连接所述第二氨基酸序列。
[0117]“单链fv”也简称为“sfv”或“scfv
”‑
本文所使用的术语“单链fv”、“sfv”或“scfv”是包含连接到单个多肽链中的vh和vl抗体结构域的抗体片段。优选地,sfv多肽还包含vh和vl结构域之间的多肽接头,其使得sfv能够形成用于抗原结合的期望结构。对于sfv的综述,参见pluckthunin the pharmacology of monoclonal antibodies,113卷,rosenburg和moore编辑,springer
‑
verlag,new york,269
‑
315页(1994);borrebaeck 1995,参见下文。
[0118]“可变区”或“可变结构域
”‑
本文所使用的术语“可变”指以下事实,抗体之间的可变结构域vh和vl的某些区域在序列上广泛不同并且用在每种具体抗体对其靶抗原的结合和特异性中。然而,可变性不是在整个抗体的可变结构域平均分布的。其集中在每个vl结构域和vh结构域中三个被称为“高变环”的区段中,其形成抗原结合位点的一部分。vλ轻链结构域的第一、第二和第三高变环在本文称为l1(λ)、l2(λ)和l3(λ),并且可定义为包含vl结构域中的24
‑
33位残基(l1(λ),由9、10、11个氨基酸残基组成)、49
‑
53位残基(l2(λ),由3个残基组成)和90
‑
96位残基(l3(λ),由6个残基组成)(morea等,methods 20:267
‑
279(2000))。vκ轻链结构域的第一、第二和第三高变环在本文称为l1(κ)、l2(κ)和l3(κ),并且可定义为包含vl结构域中的25
‑
33位残基(l1(κ),由6、7、9、11、12或13个氨基酸残基组成)、
49
‑
53位残基(l2(κ),由3个残基组成)和90
‑
97位残基(l3(λ),由6个残基组成)(morea等,methods 20:267
‑
279(2000))。vh结构域的第一、第二和第三高变环在本文称为h1、h2和h3并且可定义为包含vh结构域中25
‑
33位残基(hi,由7、8或9个残基组成),52
‑
56位残基(h2,由3或4个残基组成)以及91
‑
105位残基(h3,长度变化极大)(morea等,methods20:267
‑
279(2000))。除非另有说明,术语l1、l2和l3分别指vl结构域的第一、第二和第三高变环,并且涵盖从vκ和vλ同种型二者获得的高变环。术语h1、h2和h3分别指vh结构域的第一、第二和第三高变环,并且涵盖从任意已知重链同种型(包括[γ]、[ε]、[δ]或[μ])获得的高变环。高变环l1、l2、l3、h1、h2和h3可各自包含如下所定义的“互补决定区”或“cdr”的一部分。
[0119]“价(valency)
”‑
本文所用的术语“价”指多肽中潜在的靶标结合位点的数目。每一个靶标结合位点特异性地结合一个靶标分子或靶标分子上的特定位点。当多肽包含一个以上靶标结合位点时,每一个靶标结合位点可特异性地结合相同或不同的分子(例如可结合不同的配体或抗原,或者相同抗原上的不同表位)。本发明的结合分子优选具有至少一个人garp分子的特异性结合位点。在一些具体的实施方案中,本文中提供的garp抗体可以为至少二价。
[0120]“治疗”或“缓解
”‑
本文所使用的术语“治疗”或“缓解”指治疗性治疗和预防性或防范性措施,其中目的是预防或减缓(减轻)靶向的病理状况或病症。需要治疗的那些包括已经患有病症的那些以及倾向于患上病症的那些或者其中的病症待被预防的那些。如果在接受治疗量的根据本发明方法的抗体之后,患者表现出以下一种或更多种的可观察和/或可测量的降低或者不存在,则对象或哺乳动物被成功地治疗了感染:病原性细胞数目的减少;总细胞中病原性细胞的百分比降低;和/或与特定疾病或病症相关的一种或更多种症状一定程度上的缓解;降低的发病率和死亡率,并改善生活质量问题。以上用于评估疾病的成功治疗和改善的参数可通过医师熟悉的常规流程容易地测量。
[0121]“tgf
‑
β
”‑
本文所使用的术语“tgf
‑
β”指命名为tgf
‑
β1、tgf
‑
β2和tgf
‑
β3三个同工型。tgf
‑
β同工型的肽结构是高度相似的(同源性在70
‑
80%的量级)。它们都被编码为大的蛋白质前体;tgf
‑
β1(genbank登录号:nm_000660)含有390个氨基酸,以及tgf
‑
β2(genbank登录号:nm_001135599和nm_003238)和tgf
‑
β3(genbank登录号:xm_005268028)各自含有412个氨基酸。它们各自具有20
‑
30个氨基酸的n末端信号肽,原区域(pro
‑
region)(称为潜伏相关肽或lap)和112
‑
114氨基酸c末端区,所述信号肽是它们从细胞分泌所需的,在通过蛋白水解切割将所述c末端区从原区域释放后,变成成熟的tgf
‑
β分子。
附图说明
[0122]
图1.识别细胞表面上人garp的新单克隆抗体。用自制的(in
‑
house)生物素化的>hgarp抗体(mhgarp1至9)和链霉亲和素
‑
pe(sa
‑
pe,上图),或者用市售抗hgarp抗体(克隆plato
‑
1)继而用与alexafluor488(af488,底部图)偶联的抗小鼠igg2b染色经转染或未经转染人garp(hgarp)的鼠bw5147 t细胞。
[0123]
图2.mhgarp8抑制由人treg克隆产生活性tgf
‑
β。单独用>cd3/cd28抗体或在指定的>hgarp mab(20μg/ml)存在下用>cd3/cd28抗体刺激克隆trega1,持续24小时。(a)通过用>psmad2和>β
‑
肌动蛋白抗体的wb分析细胞裂解物。(b)对来自a中所示wb的ecl信号进行定量。
[0124]
图3a hgarp蛋白中被>hgarp抗体结合所需的区。用>hgarp(mhgarp1至9,如图的顶部所指示的)或>ha抗体染色在左侧图示的表达ha标记之蛋白质的鼠bw5147t细胞,并通过流式细胞术分析。对活细胞上设门的直方图。根据facs结果,鉴定了被各种mhgarp mab结合所需的区域并且通过代表ha标记的嵌合体之上的水平条指示。图3b在过表达tgf
‑
β1后,被mhgarp
‑
8识别的表位的丰度增加。如a中,或用>mlap
‑
af647或>hlap
‑
apc抗体染色亲代bw5147t细胞(未经转染的bw)或用hgarp单独稳定转染的克隆(bw+hgarp)或用hgarp和htgfb1稳定转染的克隆(bw+hgarp+htgf
‑
b1),并通过流式细胞术分析。
[0125]
图3cmhgarp
‑
1、mhgarp
‑
2、mhgarp
‑
3、mhgarp
‑
4和mhgarp
‑
5识别游离hgarp,但不识别与tgf
‑
β1结合的hgarp。用>hgarp mab(mhgarp1至9,如图的顶部所指示的)免疫沉淀来自亲代bw5147t细胞或用hgarp和htgfb1稳定转染之克隆的细胞裂解物。通过western印记用市售>hgarp mab(克隆plato
‑
1,顶部图)和用针对tgf
‑
β1之c端表位的抗体(底部图)分析细胞裂解物(30%输入)或ip产物,所述针对tgf
‑
β1之c端表位的抗体检测作为50kda条带的原tgf
‑
β1(pro
‑
tgf
‑
β1)和作为13kda条带的成熟tgf
‑
β1。*在未转染细胞中检测到的非特异性产物。
[0126]
图3d在hgarp转染的293t细胞中过表达htgfb1降低了mhgarp
‑
1、mhgarp
‑
2、mhgarp
‑
3、mhgarp
‑
4和mhgarp
‑
5的结合,但提高了mhgarp
‑
8的结合。用编码hgarp的质粒(0.25μg),指定量的编码htgfb1的质粒共转染293t细胞,并且在所有情况下用空质粒将转染dna的总量补足到2.5μg。用>hgarp mab(mhgarp1至9,如图的顶部所指示的)染色经转染细胞,并通过流式细胞术分析。
[0127]
图3e在转导hgarp的jurkat细胞中沉默htgfb1降低了mhgarp
‑
8的结合。用对tgfb1 mrna特异性的sirna(sitgfb1)或不规则(scramble)sirna对照转染(经hgarp转导的或未经hgarp转导的)jurkat细胞。用>hgarp mab(mhgarp1至9,如图的顶部所指示的)或用>hlap抗体染色经转染细胞,并通过流式细胞术分析。
[0128]
图4.细胞表面上htgf
‑
β1的呈现不足以被mhgarp8结合。如下所示,用>hlap抗体或用mgarp8转染293t细胞,然后通过流式细胞术分析。
[0129]
(a)用左侧图示的编码ha标记之蛋白的构建体转染,没有htgfb1构建体。
[0130]
(b)用左侧图示的编码ha标记之蛋白的构建体与htgfb1构建体共转染。
[0131]
图5.mhgarp
‑
2、mhgarp
‑
3和mhgarp
‑
8的结合需要hgarp的137
‑
138
‑
139位氨基酸。用所指出的>hgarp或>ha抗体染色亲代bw5147t细胞(未转染的bw)或用编码hgarp之ha标记形式的质粒稳定转染的克隆,并通过流式细胞术分析。本文所测试的hgarp之ha标记形式包含hgarp(野生型,wt)的20
‑
662位aa,或其中位于区域101
‑
141的3氨基酸组被mgarp的相应区域中存在的氨基酸替换的hgarp的20
‑
662位aa(mut i、mut ii和mut iii)。在左侧指出了hgarp
‑
wt、hgarp
‑
mut i、hgarp
‑
mut ii、hgarp
‑
mut iii和mgarp的101
‑
141区域的氨基酸序列。在人和小鼠garp之间不同的氨基酸通过灰色垂直框突出,并且在mut i、mut ii和mut iii中突变的氨基酸通过黑色的水平框指出。
[0132]
图6.mhgarp8在体内抑制treg功能。在第0天,指定组的nsg小鼠接受人pbms(与人treg组合或不与人treg组合)的静脉注射(i.v.injection)。从
‑
1天开始,腹腔内注射(injected i.p.)mhgarp8抗体来处理组iii和iv的小鼠,每周一次。每两周监测在接受者小鼠中gvhd发生的客观标志。基于以下建立gvhd评分:体重减少(0:<10%,1:10%
‑
20%,2:
>20%,3:>30%),贫血(0:红色或粉红色的尾;1:白色的尾),姿势(0:正常,1:驼背),一般活动(0:正常,1:受限),脱发(0:无脱发,1:脱发)和黄疸(0:白色或红色的尾,1:黄色的尾)。最大疾病严重程度或死亡对应于7分。(a)实验1.代表平均评分的值。(b)实验2.代表平均评分+sem的值。
[0133]
图7a
‑
图7b.新的抗hgarp mab。图7a用于得到抗hgarp mab的实验策略的示意图。图7b在用生物素化的mhg
‑
1至
‑
14mab和pe偶联的链霉亲和素(sa
‑
pe),用lhg
‑
1至
‑
17mab和与pe偶联的抗higg1二抗,或者用市售可得的小鼠抗hgarp mab(克隆plato
‑
1)和与af647偶联的抗migg2b二抗染色后,流式细胞术分析克隆tha2(不表达hgarp的人cd4+th细胞)或用hgarp转导的tha2细胞。
[0134]
图8.来自免疫接种的美洲驼(llama)的免疫应答。(a)示出了来自dna免疫接种的美洲驼的免疫应答。(b)示出了来自用表达hgarp/htgfβ之bw细胞免疫接种的美洲驼的免疫应答。
[0135]
图9.通过facs在细胞上测量对食蟹猴(cynomolgus)garp
‑
tgfβ的交叉反应性。用人/食蟹猴(cyno)garp和人/食蟹猴tgfb转染293e细胞。lhg
‑
10
‑
d和亲和力优化的变体与食蟹猴garp
‑
tgfb交叉反应。
[0136]
图10.lhg
‑
10抗体及其改组变体(shuffle variant)的序列。
[0137]
图11a
‑
图11b.mhgarp8和lhg
‑
10抑制人treg产生活性tgf
‑
β。在短暂的体外复制后,在指定的mab(10μg/ml)存在或不存的情况下,用包被抗cd3/cd28的珠再刺激人cd4+cd25hicd127lo细胞(treg),持续24小时。通过western印迹用针对磷酸化的smad2(psmad2)的抗体分析细胞裂解物,读出活性tgf
‑
β产生或β
‑
肌动蛋白(上样对照)。
[0138]
图12.mhgarp8和lhg
‑
10在体外抑制人treg的抑制活性(suppressive activity)。(a)将新鲜分离的人cd4+cd25
‑
cd127hi细胞(th;每微孔2
×
104个)单独或与克隆treg a1一起以1/1的treg/th比率接种(stockis,j.等eur.j.immunol.2009,39:869
‑
882)。在指定的抗hgarp mab(10μg/ml)存在或不存在的情况下,用包被的抗cd3和可溶性抗cd28刺激细胞。在4天的培养的最后16小时期间添加3h
‑
胸苷(3h
‑
thy)并在闪烁计数器中测量的掺入作为增殖的读数(read
‑
out)。条状直方图指示kcpm(一式三份的均值+sd)。克隆treg a1在不存在th细胞的情况下不增值(单独treg:0.5
±
0.04kcpm)。每个黑条上指出在treg的存在下th的增殖被抑制,并且通过如下计算:抑制%=1
‑
(kcpm(th单独)/kcpm(th+treg)。(b)克隆tha2细胞(th;每微孔1
×
104个)与克隆treg a1一起以指定的treg/th比率接种,在mhgarp8(mhg
‑
8)存在或不存在的情况下,抗htgf
‑
β1 mab(克隆1d11)或同种型对照(migg1)。如a中的进行刺激、测量增殖并计算抑制。
[0139]
图13.被抗garp mab结合的garp的形式和区域。(a)garp和garp/tgf
‑
β复合物的示意图。粗的灰色曲线代表蛋白garp。数字指示氨基酸位置。如下表示tgf
‑
β,粗的黑色线为潜伏相关肽,粗的灰色直线为成熟的tgf
‑
β1肽。细的黑色线代表链间二硫键。(b)基于其结合必要条件将抗hgarp mab分类。
[0140]
图14a
‑
图14b.三组抗hgarp mab分别地仅结合游离garp,游离garp和garp/tgf
‑
β1复合物,或仅garp/tgf
‑
β1复合物。图14a用指定的抗hgarp mab免疫沉淀经hgarp和htgfb1转染的bw细胞的细胞裂解物。通过western印迹用针对hgarp(克隆plato
‑
1)、lap或成熟tgf
‑
β肽的抗体分析总裂解物(bw+hgarp+htgfb1或未经转染的对照)和ip产物。图14b未经
转染的或者用hgarp、htgfb1或二者转染的293t细胞的流式细胞术分析,如所指示的,用抗lap
‑
apc、生物素化mhg mab和链霉亲和素
‑
pe、克隆plato
‑
1和>migg2b
‑
af647或者lhg mab和>higg1
‑
pe染色。
[0141]
图15a
‑
图15b.被mhg和lhg mab结合所需的hgarp的氨基酸。图15a用编码在左侧图示的ha标记之mgarp/hgarp嵌合体的质粒转染的293t细胞的流式细胞术分析(数字代表在hgarp中的氨基酸位置)。用生物素化mhg mab和链霉亲和素
‑
pe,lhg mab和>higg1
‑
pe,或者抗ha和>migg1
‑
af647染色细胞。为了分析仅结合hgarp/htgf
‑
β1复合物的mab(lhg
‑
3、mhgarp8(mhg
‑
8)、lhg
‑
10),htgfb1与mgarp/hgarp嵌合体共转染。图15b如上所述,不同之处在于用编码全长ha标记之hgarp的突变形式的质粒转染293t细胞。在每个突变体中,hgarp的3个氨基酸被mgarp中发现的3个氨基酸替换,如在左侧的比对中所示出的(数字代表在hgarp中的氨基酸位置)。
[0142]
图16a
‑
图16c.在体内通过抗hgarp抑制人treg功能。图16a示出在第0天的方案,指定组的nsg小鼠接受(与人treg组合或不与人treg组合的)人pbmc的静脉注射。图16b示出用来自具有指定数目之小鼠/组(n)的供体a、b或c的细胞进行的4个独立实验的结果(i至iv)。疾病发作的日期就是当平均疾病评分变成≥1时,并且指定了3个实验组,其中的小鼠仅移植有pbmc(组a),移植有pbmc和treg(组b),或者移植有pbmc和treg且用mhgarp8(mhg
‑
8)处理(组c)。图16c来自实验iv的详细结果,示出指定的小鼠组中平均疾病评分(左)和生存曲线(右)的演化。为了给疾病进展评分,使用双因素anova分析计算组b(pbmc+treg)和c(pbmcs+tregs+mhg
‑
8)之间的差异的统计学显著性(p=0.0001),并且对于存活进行对数秩(mantel
‑
cox)测试(p=0.0027)。
具体实施方式
[0143]
本发明的一个目的是在tgf
‑
β存在的情况下与garp结合的蛋白质。
[0144]
本发明的另一个目的是包含抗原结合结构域的蛋白质,其中所述抗原结合结构域在tgf
‑
β存在的情况下特异性地与garp结合。
[0145]
在一个实施方案中,所述蛋白质仅在tgf
‑
β存在的情况下与garp结合。
[0146]
garp还被称为富含亮氨酸重复序列32(leucin rich repeatcontaining 32,lrrc32),并且属于富含亮氨酸重复序列家族。本发明的人garp蛋白转录本变体2的完整氨基酸序列(seq id no:1)(genbank登录号nm_001128922)为:
[0147][0148]
在一个实施方案中,本发明的蛋白质在garp与tgf
‑
β复合时与garp结合。
[0149]
在另一个实施方案中,本发明的蛋白质在garp和潜伏tgf
‑
β复合时与garp结合。
[0150]
在另一个实施方案中,本发明的蛋白质与garp和tgf
‑
β的复合物结合。
[0151]
在一个实施方案中,本发明的蛋白质与garp和tgf
‑
β1;tgf
‑
β2,同工型1;tgf
‑
β2,同工型2;tgf
‑
β3的复合物结合。优选地,本发明的蛋白质与garp和tgf
‑
β1的复合物结合。
[0152]
在另一个实施方案中,本发明的蛋白质与garp和潜伏tgf
‑
β的复合物结合。
[0153]
本文使用的术语“潜伏tgf
‑
β”包括这样的复合物,其c末端片段(或成熟的tgf
‑
β1)保持与被称为lap的n末端非共价结合。
[0154]
在另一个实施方案中,本发明的蛋白质与garp和潜伏tgf
‑
β的复合物结合,kd(抗体和其抗原之间的平衡解离常数)小于10
‑
10
m。
[0155]
在一个实施方案中,所述蛋白质是选自以下的抗体分子:全抗体、人源化抗体、单链抗体、二聚单链抗体、fv、fab、f(ab)’2、脱岩藻糖基化抗体、双特异性抗体、双抗体、三抗体、四抗体。
[0156]
在另一个实施方案中,所述蛋白质是选自以下的抗体片段:单片式抗体、结构域抗体和纳米抗体。
[0157]
在另一个实施方案中,所述蛋白质是选自以下的抗体模拟物:亲合体、affilin、affitin、adnectin、atrimer、evasin、darpin、anticalin、avimer、fynomer、versabody和duocalin。
[0158]
结构域抗体在本领域中公知,指的是抗体的最小功能结合单位,对应于抗体的重链可变区或轻链可变区。
[0159]
纳米抗体在本领域中公知,指的是抗体衍生的治疗性蛋白质,其含有自然存在的重链抗体的独特结构和功能特性。这些重链抗体含有一个可变结构域(vhh)和两个恒定结构域(ch2和ch3)。
[0160]
单片式抗体在本领域中公知,指的是缺失igg4抗体铰链区的抗体片段。铰链区的
缺失导致了分子基本上是传统igg4抗体一半的大小并具有单价结合区而不是igg4抗体的二价结合区。
[0161]
亲合体在本领域中公知,指的是基于有58个氨基酸残基蛋白质结构域的亲和性蛋白质,所述结构域衍生自葡萄球菌蛋白a的一个igg结合结构域。
[0162]
darpin(designed ankyrin repeat protein,设计的锚蛋白重复蛋白)在本领域中公知,指的是开发出的用来探究非抗体多肽之结合能力的抗体模拟drp(设计的重复蛋白)技术。
[0163]
anticalin在本领域中公知,指的是另一种抗体模拟技术,其中结合特异性来源于lipocalin。anticalin也可被排列成双靶向蛋白,称为duocalins。
[0164]
avimer在本领域中公知,指的是另一种抗体模拟技术。
[0165]
versabody在本领域中公知,指的是另一种抗体模拟技术。它们是含有>15%半胱氨酸的3
‑
5kda小蛋白质,半胱氨酸构成了高二硫密度的支架,替代了典型蛋白质拥有的疏水核。
[0166]
在另一个实施方案中,所述蛋白质是包含了与治疗剂缀合之抗体或其片段的免疫缀合物。
[0167]
在另一个实施方案中,所述蛋白质是包含与成像剂缀合的本发明蛋白质的缀合物。所述蛋白质可以例如用在成像应用中。
[0168]
本发明的另一个目的是结合garp并抑制tgf
‑
β信号转导的蛋白质。
[0169]
在一个实施方案中,所述蛋白质在garp与tgf
‑
β复合时与garp结合。
[0170]
在另一个实施方案中,所述蛋白质在garp与潜伏tgf
‑
β复合时与garp结合。
[0171]
在另一个实施方案中,所述蛋白质与garp和tgf
‑
β的复合物结合。
[0172]
在另一个实施方案中,所述蛋白质与garp和潜伏tgf
‑
β的复合物结合。
[0173]
在一个实施方案中,所述蛋白质是选自以下的抗体分子:全抗体、人源化抗体、单链抗体、二聚单链抗体、fv、fab、f(ab)’2、脱岩藻糖基化抗体、双特异性抗体、双抗体、三抗体、四抗体。
[0174]
在另一个实施方案中,所述蛋白质是选自以下的抗体片段:单片式抗体、结构域抗体和纳米抗体。
[0175]
在另一个实施方案,所述蛋白质是选自以下的抗体模拟物:亲合体、affilin、affitin、adnectin、atrimer、evasin、darpin、anticalin、avimer、fynomer、versabody和duocalin。
[0176]
在一个实施方案中,所述蛋白质是抑制tgf
‑
β信号转导的抗
‑
hgarp(抗人garp)抗体或者其抗原结合片段。
[0177]
在一个实施方案中,所述蛋白质阻止或者抑制活性tgf
‑
β被释放或者抑制成熟tgf
‑
β从treg释放。
[0178]
在另一个实施方案中,所述蛋白质抑制或者阻止成熟tgf
‑
β与tgf
‑
β受体结合。
[0179]
在另一个实施方案中,所述蛋白质抑制tgf
‑
β活性和/或tgf
‑
β受体信号转导通路之分子的活化。
[0180]
在本文中使用的术语“抑制”意指蛋白质能够阻断、降低、阻止或者中和tgf
‑
β信号转导或者成熟tgf
‑
β从treg释放或者成熟tgf
‑
β与tgf
‑
β受体的结合或者tgf
‑
β的活性和/或
tgf
‑
β受体信号转导通路之分子的活化。
[0181]
在一个实施方案中,所述蛋白质是单克隆抗体。
[0182]
在另一个实施方案中,所述蛋白质是多克隆抗体。
[0183]
在一个实施方案中,所述蛋白质与构象表位结合。
[0184]
在一个实施方案中,所述构象表位包含一个或者更多个hgarp的氨基酸。
[0185]
在另一个实施方案中,所述构象表位包含由于garp与潜伏tgf
‑
β复合所产生的经修饰的garp表位。在另一个实施方案中,所述构象表位包含hgarp的氨基酸和潜伏tgf
‑
β的氨基酸。
[0186]
在另一个实施方案中,所述构象表位是混合的构象表位,并且包含garp和tgf
‑
β二者的氨基酸。
[0187]
在另一个实施方案中,所述构象表位是结合诱导的构象表位并且仅包含garp氨基酸,但是其在tgf
‑
β存在的情况下采取了不同的构象。
[0188]
在一个实施方案中,所述表位包含了来自hgarp氨基酸序列(seq_id no:1)中101至141位残基的一个或者更多个残基。
[0189]
101至141位的这些残基如seq id no:12所示:hlslahnrlamatalsagglgplprvtsldlsgnslysgll。
[0190]
在本发明的另一个实施方案中,所述表位包含了hgarp氨基酸序列(seq id no:1)的137、138和139位残基:ysg。
[0191]
在本发明的另一个实施方案中,所述表位包含了hgarp氨基酸序列(seq id no:1)的137、138和139位残基:ysg,并且需要tgf
‑
β的存在。
[0192]
在本发明的另一个实施方案中,所述表位包含hgarp氨基酸序列(seq id no:1)的137、138和139位残基:ysg和在seq id no:1的137、138和139位残基:ysg的n端和/或c端的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个连续残基。
[0193]
在本发明的另一个实施方案中,所述表位包含hgarp氨基酸序列(seq id no:1)的137、138和139位残基:ysg和在seq id no:1的137、138和139位残基:ysg的n端和/或c端的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个连续残基,并且需要tgf
‑
β的存在。
[0194]
在本发明的一个实施方案中,本发明的蛋白质优选地与hgarp101
‑
141区域内的表位结合并且抑制潜伏tgf
‑
β从garp的释放。
[0195]
本领域技术人员可以通过测量例如tgf
‑
β受体信号转导通路分子的活化来确定蛋白质抑制tgf
‑
β信号传导的能力。这种测试的一个代表性实例通常是测量smad2的磷酸化(如本发明的实施例2所示)。
[0196]
本发明的一个目的是针对人garp的抗体或其抗原结合片段,其中重链可变区包含至少一个以下cdr:
[0197]
vh
‑
cdr1:gfsltgygin(seq id no:2)或gygin(seq id no:52);
[0198]
vh
‑
cdr2:miwsdgstdynsvits(seq id no:3);和
[0199]
vh
‑
cdr3:drnyydydgamdy(seq id no:4)。
[0200]
本发明的另一个目的是抗hgarp抗体或抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0201]
vl
‑
cdr1:kasdhiknwla(seq id no:5);
[0202]
vl
‑
cdr2:gatslea(seq id no:6);和
[0203]
vl
‑
cdr3:qqywstpwt(seq id no:7)。
[0204]
本发明的另一个目的是针对人garp的抗体或其抗原结合片段,其中重链可变区包含至少一个以下cdr:
[0205]
vh
‑
cdr1:syyid(seq id no:13);
[0206]
vh
‑
cdr2:ridpedggtkyaqkfqg(seq id no:14);和
[0207]
vh
‑
cdr3:newetvvvgdlmyeyey(seq id no:15)。
[0208]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0209]
vl
‑
cdr1:qasqx1i x2s x3la(seq id no:16),其中x1为s或t,x2为s或v,x3为y或f;
[0210]
vl
‑
cdr2:x1x2sx3x4x5t(seq id no:17),其中x1为g或r;x2为a或t;x3为r或i;x4为l或p;x5为q或k;和
[0211]
vl
‑
cdr3:qqyx1sx2px3t,其中x1为d、a、y或者v;x2为a、l或者v;x3为v或p(seq id no:18)。
[0212]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中重链可变区包含seq id no:13的vh
‑
cdr1,seq id no:14的vh
‑
cdr2以及seq id no:15的vh
‑
cdr3并且轻链可变区包含至少一个seq idno:19、seq id no:22、seq id no:25、seq id no:28或者seq id no:31所示的vl
‑
cdr1;至少一个seq id no:20、seq id no:23、seq id no:26、seq id no:29或seq id no:32所示的vl
‑
cdr2以及至少一个seq id no:21、seq id no:24、seq id no:27、seq id no:30或seq id no:33所示的vl
‑
cdr3。
[0213]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0214]
vl
‑
cdr1:qasqsissyla(seq id no:19);
[0215]
vl
‑
cdr2:gasrlqt(seq id no:20);和
[0216]
vl
‑
cdr3:qqydslpvt(seq id no:21)。
[0217]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0218]
vl
‑
cdr1:qasqsivsyla(seq id no:22);
[0219]
vl
‑
cdr2:gasrlqt(seq id no:23);和
[0220]
vl
‑
cdr3:qqyasapvt(seq id no:24)。
[0221]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0222]
vl
‑
cdr1:qasqsissyla(seq id no:25);
[0223]
vl
‑
cdr2:gtsrlkt(seq id no:26);和
[0224]
vl
‑
cdr3:qqyysapvt(seq id no:27)。
[0225]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0226]
vl
‑
cdr1:qasqtissfla(seq id no:28);
[0227]
vl
‑
cdr2:rasipqt(seq id no:29);和
[0228]
vl
‑
cdr3:qqyvsappt(seq id no:30)。
[0229]
本发明的另一个目的是抗hgarp抗体或其抗原结合片段,其中轻链可变区包含至少一个以下cdr:
[0230]
vl
‑
cdr1:qasqsissyla(seq id no:31);
[0231]
vl
‑
cdr2:gasrlkt(seq id no:32);和
[0232]
vl
‑
cdr3:qqyasvpvt(seq id no:33)。
[0233]
在本发明的一个实施方案中,所述抗hgarp抗体或其抗原结合片段可以包含人抗体(特别是igg1、igg2、igg3或igg4)的ch1结构域、铰链区、ch2结构域和ch3结构域。
[0234]
在本发明的一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其重链中包含以下cdr:vh
‑
cdr1 gfsltgygin(seq id no:2),vh
‑
cdr2 miwsdgstdynsvits(seq id no:3)和vh
‑
cdr3drnyydydgamdy(seq id no:4)。
[0235]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其重链中包含以下cdr:vh
‑
cdr1 gygin(seq id no:52),vh
‑
cdr2 miwsdgstdynsvits(seq id no:3)和vh
‑
cdr3drnyydydgamdy(seq id no:4)。
[0236]
在本发明的另一个实施方案中,抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1 kasdhiknwla(seq id no:5),vl
‑
cdr2 gatslea(seq id no:6)和vl
‑
cdr3 qqywstpwt(seq id no:7)。
[0237]
在本发明的一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其重链中包含以下cdr:vh
‑
cdr1 syyid(seq id no:13),vh
‑
cdr2 ridpedggtkyaqkfqg(seq id no:14)和vh
‑
cdr3newetvvvgdlmyeyey(seq id no:15)。
[0238]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1:qasqx1i x2s x3la(seq id no:16),其中x1为s或t,x2为s或v,x3为y或f;vl
‑
cdr2:x1x2sx3x4x5t(seq id no:17),其中x1为g或r;x2为a或t;x3为r或i;x4为l或p;x5为q或k;和vl
‑
cdr3:qqyx1sx2px3t,其中x1为d、a、y或者v;x2为a、l或者v;x3为v或p(seq id no:18)。
[0239]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1 qasqsissyla(seq id no:19),vl
‑
cdr2 gasrlqt(seq id no:20)和vl
‑
cdr3 qqydslpvt(seq id no:21)。
[0240]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1 qasqsivsyla(seq id no:22);vl
‑
cdr2 gasrlqt(seq id no:23)和vl
‑
cdr3:qqyasapvt(seq id no:24)。
[0241]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1 qasqsissyla(seq id no:25);vl
‑
cdr2 gtsrlkt(seq id no:26)和vl
‑
cdr3 qqyysapvt(seq id no:27)。
[0242]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段在其轻链中包含以下cdr:vl
‑
cdr1 qasqtissfla(seq id no:28);vl
‑
cdr2 rasipqt(seq id no:29)和vl
‑
cdr3 qqyvsappt(seq id no:30)。
[0243]
在本发明的另一个实施方案中,抗hgarp抗体或其抗原结合片段在其轻链中包含
以下cdr:vl
‑
cdr1 qasqsissyla(seq id no:31);vl
‑
cdr2 gasrlkt(seq id no:32)和vl
‑
cdr3 qqyasvpvt(seq id no:33)。
[0244]
根据本发明,重链和轻链的任意cdr1、2和3可以表征为具有与在相应seq id no中所列的特定cdr或者cdr组共有至少60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性的氨基酸序列。
[0245]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段选自具有以下特征的抗体:
[0246]
(i)重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列示于seq id no:2、3和4;并且
[0247]
(ii)轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列分别示于seq id no:5,6和7;
[0248]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0249]
在本发明的另一个实施方案中,所述抗hgarp抗体或抗原结合片段选自具有以下特征的抗体:
[0250]
(i)重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列示于seq id no:52、3和4;并且
[0251]
(ii)轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列分别示于seq id no:5、6和7;
[0252]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0253]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段选自具有以下特征的抗体:
[0254]
(i)重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列示于seq id no:13、14和15;并且
[0255]
(ii)轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列分别示于seq id no:16,17和18;
[0256]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0257]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含:
[0258]
(i)seq id no:13、14和15所示的重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列;和
[0259]
(ii)seq id no:19、20和21分别所示的轻链cdr1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列;
[0260]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0261]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含:
[0262]
(i)seq id no:13、14和15所示的重链cdr1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列;和
[0263]
(ii)seq id no:22,23和24分别所示的轻链cdr1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列;
[0264]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0265]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含:
[0266]
(i)seq id no:13,14和15所示的重链cdr1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列;和
[0267]
(ii)seq id no:25、26和27分别所示的轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
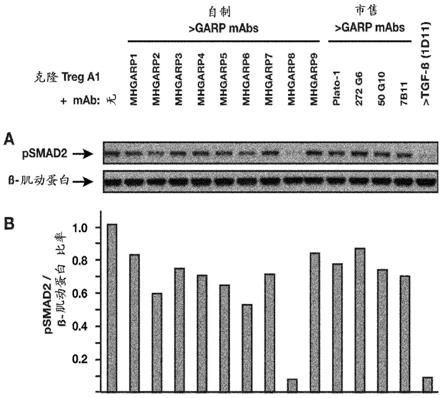
‑
cdr3)的氨基酸序列;
[0268]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0269]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含:
[0270]
(i)seq id no:13、14和15所示的重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列;和
[0271]
(ii)seq id no:28、29和30分别所示的轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列;
[0272]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0273]
在本发明的另一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含:
[0274]
(i)seq id no:13,14和15所示的重链cdr 1、2和3(vh
‑
cdr1,vh
‑
cdr2,vh
‑
cdr3)的氨基酸序列;和
[0275]
(ii)seq id no:31,32和33分别所示的轻链cdr 1、2和3(vl
‑
cdr1,vl
‑
cdr2,vl
‑
cdr3)的氨基酸序列;
[0276]
任选地,其中任何所述序列中的一个、两个、三个或者更多个氨基酸可以被不同的氨基酸替换。
[0277]
在一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含可变的重链cdr3,其包含seq id no:4(drnyydydgamdy)的氨基酸序列或者其序列变体,其中所述序列变体包含在所列举序列中的一个、两个或三个氨基酸替换。
[0278]
在一个实施方案中,所述抗hgarp抗体或其抗原结合片段包含可变的重链cdr3,其包含seq id no:15的氨基酸序列或者其序列变体,其中所述序列变体包含所列举序列中的一个、两个或三个氨基酸替换。
[0279]
本发明的另一个目的是抗hgarp抗体mhgarp8或者抗原结合片段,其包含重链可变区的序列seq id no:8和轻链可变区的序列seq idno:9。
[0280][0281]
本发明的另一个目的是抗hgarp抗体mhgarp8或者其抗原结合片段,其包含重链可变区的序列seq id no:50和轻链可变区的序列seqid no:51,其中seq id no:50和seq id no:51分别对应于seq idno:8和seq id no:9,其中信号肽序列被移除。
[0282][0283]
本发明的另一个目的是抗hgarp抗体lhg10或者其抗原结合片段,其包含序列重链可变区的seq id no:34和轻链可变区的序列seq_id no:35。
[0284][0285]
本发明的另一个目的是抗
‑
hgarp抗体lhg10.3或者其抗原结合片段,其包含重链可变区的序列seq id no:34和轻链可变区的序列seqid no:36。
[0286][0287]
本发明的另一个目的是抗hgarp抗体lhg10.4或者其抗原结合片段,其包含重链可变区的序列seq id no:34和轻链可变区的序列seqid no:37。
[0288][0289]
本发明的另一个目的是抗hgarp抗体lhg10.5或者其抗原结合片段,其包含重链可变区的序列seq id no:34和轻链可变区的序列seq_id no:38。
[0290][0291]
本发明的另一个目的是抗hgarp抗体lhg10.6或者其抗原结合片段,其包含重链可变区的序列seq id no:34和轻链可变区的序列seqid no:39。
[0292][0293]
在本发明的一个实施方案中,如上文所描述的重链可变区或轻链可变区的一个、两个、三个或更多个氨基酸也可以被不同的氨基酸替换。
[0294]
在另一个实施方案中,本发明的抗体包含重链和轻链可变区,其包含与本文所述mhgarp8抗体之氨基酸序列同源的氨基酸序列,并且其中所述抗体保留本发明的蛋白质所期望的功能特性。
[0295]
在本发明的一个实施方案中,本发明的抗hgarp的重链可变区序列涵盖与seq id no:8或seq id no:50有60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性的序列。
[0296]
在本发明的一个实施方案中,本发明的抗hgarp的轻链可变区序列涵盖与seq id no:9或seq id no:51有60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性的序列。
[0297]
在另一个实施方案中,本发明的抗体包含重链和轻链可变区,其包含与本文所述lhg10抗体之氨基酸序列同源的氨基酸序列,并且其中所述抗体保留本发明蛋白质所期望的功能特性。
[0298]
在本发明的一个实施方案中,本发明的抗hgarp的重链可变区序列涵盖与seq id no:34有60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性的序列。
[0299]
在本发明的一个实施方案中,本发明的抗hgarp的轻链可变区序列涵盖与seq id no:35,36,37,38或39有60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性的序列。
[0300]
在本发明的任何抗体(例如mhgarp8或lhg10)中,特定的可变区和cdr序列可以包含保守的序列修饰。保守的序列修饰指的是不会显著影响或者改变含有此氨基酸序列之抗体的结合特性的氨基酸修饰。此类保守的修饰包括氨基酸的替换、添加和缺失。可以通过本领域已知的标准技术(例如,位点定向诱变和pcr
‑
介导的诱变)将修饰引入到本发明的抗体中。保守的氨基酸替换通常是其中氨基酸残基被有着相似理化性质之侧链的氨基酸所替代的那些替换。特定的可变区和cdr序列可包含一个、两个、三个、四个或者更多个氨基酸的插入、缺失或是替换。替换发生的地方,优选的替换将是保守的修饰。本领域已经定义了具有相似侧链的氨基酸残基家族。这些家族包括有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸),有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸),有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸),有β
‑
分支
侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)以及有芳香族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,本发明抗体的cdr区内的一个或更多个氨基酸残基可以用来自相同侧链家族的其他氨基酸残基替代,并且可以用本文中描述的测定来测试经改变抗体保留的功能(即本文所述的特性)。抗
‑
hgarp抗体也可以是cdr
‑
移植(graft)的抗体,其中的cdr源自骆驼科动物抗体,例如通过hgarp的主动免疫接种产生的骆驼科动物抗
‑
hgarp抗体。
[0301]
在一个实施方案中,本发明提供了结合与mhgarp8或者lhg10抗体基本上一样表位的抗体。
[0302]
在本发明的一些实施方案中,抗hgarp抗体包含vh和vl结构域,或者其cdr可包含ch1结构域和/或cl结构域,其氨基酸序列全部或基本上是人的序列。其中本发明的抗原结合多肽是旨在用于人治疗用途的抗体,所述抗体的整个恒定区(或者其至少一部分)通常具有全部或者基本上的人氨基酸序列。因此,ch1结构域、铰链区、ch2结构域、ch3结构域和cl结构域(以及ch4结构域,如果存在的话)的一个或者更多个或任意组合就其氨基酸序列而言可完全地或者基本上是人的序列。有利地,ch1结构域、铰链区、ch2结构域、ch3结构域和cl结构域(以及ch4结构域,如果存在的话)都可以具有完全或者基本上的人氨基酸序列。在人源化或者嵌合抗体的恒定区或者抗体片段的背景下,术语“基本上是人的”指的是氨基酸序列与人恒定区有至少90%,或至少95%或至少97%或至少99%的同一性。在这个背景下术语“人氨基酸序列”指的是由人免疫球蛋白基因(包括种系、重排的和体细胞突变的基因)编码的氨基酸序列。本发明还考虑了包含已经改变的“人”序列之恒定结构域的多肽,这些改变是通过相对于人序列的一个或者更多个氨基酸的添加、缺失或替换,例外是那些表述上要求“完全是人的”铰链区存在的实施方案。在本发明的抗hgarp抗体中“完全是人的”铰链区的存在可有益于使抗体的免疫原性最小化和优化抗体稳定性二者。认为一个或者更多个氨基酸的替换、插入或缺失可发生在重链和/或轻链的恒定区内,尤其是在fc区内。氨基酸的替换可导致用不同的天然存在的氨基酸或者用非天然的或经修饰的氨基酸替代被替换的氨基酸。其他结构上的修饰也是允许的,例如糖基化模式的改变(例如通过添加或缺失n
‑
或o
‑
连接的糖基化位点)。根据抗体的预期用途,对于本发明抗体与fc受体之结合特性的修饰是可期望的,例如来调整效应物的功能。例如,可以将半胱氨酸残基引入到fc区中,从而允许该区中形成链间二硫键。因此这种同源二聚抗体可以具有改善的效应物功能。参见caron等,j.exp.med.176:1191
‑
1195(1992)和shopes,b.j.immun0l.148:2918
‑
2922(1992)。或者,garp抗体可以被改造成具有双fc区并且因此可以具有增强的补体裂解和adcc能力。参见stevenson等,anti
‑
cancer drug design3:219
‑
230(1989)。本发明还考虑了包含与细胞毒剂缀合的本文所述抗体的免疫缀合物,所述细胞毒剂例如化学治疗剂、毒素(例如细菌、真菌、植物或者动物来源的酶促活性毒素或其片段)或者放射性同位素(即放射性缀合物)。也可以改造fc段以使得半衰期延长,如chan和carter,2010nature reviews:immunology,10:301
‑
316所述,其通过引用并入本文。如本文所述的其中fc区被蛋白质工程修饰的变体抗hgarp抗体,与没有fc修饰的等同抗体(即等同的抗原结合特性)相比,也可显示出效力(例如治疗/诊断)的改善。
[0303]
在另一个实施方案中,修饰fc区来提高抗体介导抗体依赖性细胞毒性(antibody dependent cellular cytotoxicity,adcc)的能力和/或通过修饰一个或更多个氨基酸来
提高抗体对于fcγ受体的亲和力。在另一个实施方案中,修饰抗体的糖基化。例如,可制得去糖基化抗体(aglycoslated antibody)(即抗体缺乏糖基化)。可以改变糖基化以例如提高抗体对garp靶标抗原的亲和力。这样的碳水化合物修饰可以通过例如改变抗体序列中一个或者更多个位点的糖基化来完成。例如,可以进行导致一个或者更多个可变区框架的糖基化位点消除的一个或更多个氨基酸替换,从而使得该位点处的糖基化消除。这样的去糖基化可提高抗体对抗原的亲和力。还设想了变体抗hgarp抗体具有改变的糖基化类型,例如具有减少数量的岩藻糖残基的低岩藻糖基化抗体或者无岩藻糖基化抗体(如natsume等,2009drug design development and therapy,3:7
‑
16所述)或者具有增加的二等分之glcnac结构的抗体。已经证明此类改变的糖基化模式可以提高抗体的adcc活性,相对于包含“天然”人fc结构域的等同抗体,通常产生10倍增加的adcc。这样的碳水化合物修饰可以通过例如在具有改变的糖基化酶促机构的宿主细胞中表达抗体来完成(如yamane
‑
ohnuki and satoh,2009mabs 1(3):230
‑
236)所述)。
[0304]
在本发明的一个实施方案中,所述抗
‑
hgarp抗体包含具有seq idno:47序列的fc区。
[0305][0306]
在本发明的另一个实施方案中,所述抗hgarp抗体包含了具有序列seq id no:48的重链恒定结构域区,其中x为n或突变为q来抑制adcc。
[0307][0308]
在本发明的一个实施方案中,seq id no:48的297位残基去糖基化。
[0309]
在本发明的另一个实施方案中,seq id no:48的297位n残基突变成q。
[0310]
在本发明的一个实施方案中,所述抗hgarp抗体包含具有序列id no:49的轻链恒定结构域区。
[0311][0312]
在本发明的另一些实施方案中,抗hgarp可缺乏效应物功能,原因是抗体的fc区是天然缺乏效应物功能之同种型的fc区或其与人igg1相比表现出显著更低效力的效应物功
能,例如人igg2或人igg4,或者因为抗体的fc区已经被改造以降低或基本上消除效应物功能,如在armourkl等,eur.j.immunol.,1999,29:2613
‑
2624中所述。
[0313]
在另一些实施方案中,可以改造抗hgarp抗体的fc区以促进双特异性抗体的优先形成,其中包含不同可变结构域对的两个抗体重链形成双特异性抗体的fc区。此类修饰的实例包括由ridgway jb,presta lg,carter p.,1996protein eng.jul;9(7):617
‑
21和merchant am,等1998nat biotechnol.jul;16(7):677
‑
81所描述的“knobs
‑
into
‑
hole”修饰。
[0314]
在本发明的一个实施方案中,本发明的抗hgarp抗体可以表现出选自以下的一种或更多种效应物功能:针对在细胞表面上表达人garp蛋白之细胞的抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(complement dependent cytotoxicity,cdc)和抗体依赖性细胞介导的吞噬作用(antibody
‑
dependent cell
‑
mediated phagocytosis,adcp)。抗体可以表现出针对garp相关功能紊乱之细胞的adcc。与是包含天然人fc结构域之等同抗体的参照抗体相比,该抗体可表现出增强的adcc功能。在一个非限制性实施方案中,与包含天然人fc结构域的参照抗体相比,adcc功能可至少增强10
×
。在该背景下可采用“等同”意指具有增强的adcc功能的抗体展示出与参照抗体基本上相同的抗原结合特异性和/或与参照抗体共有相同的氨基酸序列,不同之处在于为了增强adcc的目的所进行的任意修饰(相对于天然人fc)。抗体可含有人igg(最优选人igg1)的铰链区、ch1结构域、ch2结构域和ch3结构域。抗体可包含fc区中的修饰,例如替换、缺失或插入或其他结构修饰以增强或降低fc依赖性功能。
[0315]
本发明的一个目的涉及抑制tgf
‑
β信号转导的抗hgarp抗体或其抗原结合片段,并且其还特别适用于受益于抗体效应物功能(即adcc、cdc、adcp)以及特别是增强的效应物功能的治疗应用。因此,本文所述的表现出效应物功能(或增强的效应物功能)并且抑制tgf
‑
β的garp抗体对于受益于抗体效应物功能的某些治疗应用(例如癌症、慢性感染、纤维化治疗)可以特别有利。
[0316]
本发明的另一个目的是编码重链可变区之序列seq id no:8或seq id no:50的分离的多核苷酸序列。优选地,所述核酸序列是seq id no:10:
[0317][0318]
本发明的另一个目的是编码轻链可变区之序列seq id no:9或seq id no:51的分离的多核苷酸序列。优选地,所述核酸序列是seq id no:11:
[0319][0320]
本发明的另一个目的是包含编码本发明之抗hgarp抗体的核酸序列的表达载体。在一个实施方案中,本发明的表达载体包含以下的至少一个:seq id no:10和seq id no:11,或者具有与seq id no:10和seq id no:11共有至少60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%同一性之核酸序列的任意序列。
[0321]
本发明的另一个目的是包含所述载体的分离的宿主细胞。所述宿主细胞可用于本发明抗体的重组生产。在一个实施方案中,宿主细胞可以是原核生物细胞、酵母细胞或真核生物细胞,优选哺乳动物细胞,例如:被sv40转化的猴肾cv1系(cos
‑
7,atcc crl1651);人胚肾系(用于悬浮培养的293或293细胞亚克隆,graham等,j.gen.virol.36:59(1977));幼仓鼠肾细胞(bhk,atcc ccl 10);中国仓鼠卵巢细胞/
‑
dhfr(cho,urlaub等,proc.natl.acad.sci.usa 77:4216(1980));小鼠塞尔托利细胞(mouse sertoli cell,tm4,mather, biol.reprod.23:243
‑
251(1980));小鼠骨髓瘤细胞sp2/0
‑
ag14(atcc crl 1581;atcc crl 8287)或nso(hpa培养物保藏编号85110503);猴肾细胞(cvl atcc ccl 70);非洲绿猴肾细胞(vero
‑
76,atcc crl
‑
1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl34);buffal0大鼠肝细胞(buffalo rat liver cell)(brl 3a,atcc crl1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl 51);tri细胞(mather等,annals n.y.acad.sci.383:44
‑
68(1982));mrc 5细胞;fs4细胞;和人肝细胞瘤系(hep g2)以及dsm的perc
‑
6细胞系。适合在每一种这些宿主细胞中使用的表达载体也是本领域通常已知的。应当注意,术语“宿主细胞”通常指培养的细胞系。向其中引入编码根据本发明之抗原结合多肽的表达载体的整个人被明确地排除在“宿主细胞”的定义之外。
[0322]
本发明的另一个目的是产生抗hgarp抗体或其抗原结合片段的方法,其包括在适于表达抗hgarp抗体的条件下,培养含有编码抗hgarp抗体之分离的多核苷酸序列的宿主细胞,以及回收所表达的抗hgarp抗体。这一重组方法可用于大规模生产根据本发明的garp抗体,包括旨在用于体外、离体或体内治疗、诊断用途的单克隆抗体。这些方法是本领域可得的并且为技术人员所知。
[0323]
本发明的另一目的是产生本发明之所述抗体的杂交瘤细胞系。
[0324]
根据本发明的优选杂交瘤细胞系保藏在bccm/lmbp质粒保藏中心(plasmid collection),根特大学生物医学分子生物学系(ghent university,department of biomedical m0lecular biology),
′
fiers
‑
schell
‑
van montagu
′
building,technologiepark 927,b
‑
9052gent
‑
zwijnaarde belgium(表2):
[0325]
表2
[0326][0327]
可以通过本领域已知的技术来产生本发明抗体的片段或衍生物(其包含在本技术所使用的术语“抗体”内,除非另有说明或与上下文明显矛盾),优选mhgarp8样抗体。“片段”包含完整抗体的区域,通常是抗原结合位点或可变区。抗体片段的实例包括fab、fab’、fab'
‑
sh、f(ab')2和fv片段,二抗体,是具有由连续氨基酸残基的一条不间断序列组成之一级结构的多肽的任意抗体片段(本文中称作“单链抗体片段”或“单链多肽”),包括但不限于(1)单链fv分子(2)仅含一条轻链可变结构域的单链多肽,或其含有所述轻链可变结构域之3个cdr的片段,而没有相连的重链部分以及(3)仅含有一个重链可变区的单链多肽,或其含有所述重链可变区之3个cdr的片段,而没有相连的轻链部分;以及从抗体片段形成的多特异性抗体。可以使用标准方法获得本发明抗体的片段。例如,根据常规技术,通过蛋白酶消化分离的抗体可产生fab或f(ab')2片段。应当理解,可以使用已知方法修饰免疫反应性片段,例如来减缓体内清除以及可以用聚乙二醇(peg)修饰片段获得更期望的药代动力学谱。将peg偶联或位点特异性缀合至fab’片段的方法描述在例如leong等,cytokines 16(3):106
‑
119(2001)和delgado等,br.j.cancer 73(2):175
‑
182(1996)中,其公开内容通过引用并入本文。
[0328]
或者,可以修饰生产本发明抗体(优选mhgarp8样或lhg10样抗体)的杂交瘤dna以使得能够编码本发明的片段。然后将经修饰的dna插入到表达载体中并用于转化或转染适当的细胞,然后其表达期望的片段。
[0329]
在某些实施方案中,可以在插入表达载体前修饰产生本发明抗体(优选mhgarp8样或lhg10样抗体)的杂交瘤dna,例如通过人重链和轻链恒定结构域的编码序列替换同源的非人序列(例如morrison等,pnas 6851页(1984)),或通过将免疫球蛋白的编码序列共价连接至非免疫球蛋白多肽的全部或部分编码序列。以这种方式,制备具有原始抗体之结合特异性的“嵌合”或“杂合”抗体。通常,这样的非免疫球蛋白多肽替换本发明抗体的恒定结构域。
[0330]
因此,根据另一个实施方案,本发明的抗体(优选mhgarp8样或lhg10样抗体)是人源化的。根据本发明之抗体的“人源化”形式是特异性嵌合免疫球蛋白,免疫球蛋白链或其片段(例如fv、fab、fab
′
、f(ab')2或抗体的其它抗原结合序列),其含有最小的源自鼠免疫球蛋白的序列。人源化抗体的绝大部分是人免疫球蛋白(接受者抗体),其中来自接受者之互补决定区(cdr)的残基被来自原始抗体(供体抗体)之cdr的残基所替代,同时保持原始抗体的期望特异性、亲和力和能力。
[0331]
在一些情况下,人免疫球蛋白的fv框架(fr)残基可以被对应的非人残基替代。此外,人源化抗体可包含不存在于接受者抗体也不存在于输入的cdr或框架序列中的残基。进行这些修饰以进一步改进和优化抗体性能。一般而言,人源化抗体基本上将包含所有至少一个(并且通常是两个)可变结构域,其中所有或基本上所有cdr区对应于原始抗体的那些cdr区,并且所有或基本上所有fr区是人免疫球蛋白共有序列的那些fr区。人源化抗体最佳
地还包含免疫球蛋白恒定区(fc)的至少一个区,通常是人免疫球蛋白的恒定区。进一步的详细内容参见jones等,nature,321,522页(1986);reichmann等,nature,332,323页(1988);presta,curr.op.struct.biol.,3,394页(1992);verhoeyen等science,239,1534页;和美国专利号4,816,567,其全部公开内容通过引用并入本文。用于人源化本发明之抗体的方法是本领域公知的。
[0332]
选择在制造人源化抗体中使用的人(轻链和重链二者)可变结构域对降低免疫原性是非常重要的。根据所谓的“最匹配(best
‑
fit)”方法,针对已知人可变结构域序列的整个文库筛选本发明之抗体的可变结构域序列。然后接受与小鼠序列接近的人序列作为人源化抗体的人框架(fr)(sims等,j.immunol.151,2296页(1993);chothia和lesk,j.mol.biol.196,901页)。另一种方法使用来自轻链或重链之特定亚群的所有人抗体之共有序列的特定框架。相同的框架可用于数种不同的人源化抗体(carter等,pnas 89,4285页(1992);presta等j.immunol.,151(1993))。被人源化的抗体保留对garp的高亲和力和其他有利的生物学特性也是重要的。为实现这一目的,根据一种优选的方法,通过使用亲本和人源化序列的三维模型分析亲本序列和多种概念性人源化产物的过程来制备人源化抗体。三维免疫球蛋白模型是本领域技术人员通常可得的并且是其熟悉的。说明或展示选定的候选免疫球蛋白序列之可能三维结构的计算机程序是可得的。审查这些展示允许分析残基在候选免疫球蛋白序列之功能中的可能作用,即,分析影响候选免疫球蛋白结合其抗原之能力的残基。以这种方式,可以选择来自共有序列和输入序列的fr残基并将其组合,从而实现期望的抗体特性,例如对于靶抗原的亲和力提高。一般来说,cdr残基直接并且基本上大多数涉及影响抗原结合。制造“人源化”单克隆抗体的另一种方法是使用xenomouse(abgenix,fremont,ca)作为用于免疫接种的小鼠。xenomouse是根据本发明的一种鼠宿主,其免疫球蛋白基因已经被功能性人免疫球蛋白基因所替代。因此,由该小鼠或在由该小鼠之b细胞制得的杂交瘤中产生的抗体已经是人源化的。xenomouse描述于美国专利号6,162,963,其通过引用整体并入本文。
[0333]
还可以根据多种其他技术产生人抗体,例如通过使用对已经改造为表达人抗体库的其他转基因动物免疫接种(jakobovitz等nature 362(1993)255)或通过使用噬菌体展示方法选择抗体库。这样的技术是技术人员已知的并且可以从本技术中所公开的单克隆抗体开始实施。
[0334]
在一个实施方案中,可通过用期望的靶抗原主动免疫接种骆驼科物种来获得骆驼科高变环(或cdr)。如在本文中详细讨论和示例的,在用靶抗原免疫接种骆驼科(天然动物或经改造以表达骆驼科动物物种之免疫球蛋白库的转基因动物)后,可鉴定产生对期望抗原具有特异性之抗体(常规骆驼科)的b细胞并可使用已知技术分离编码此类抗体之vh和vl结构域的多核苷酸。
[0335]
在一个实施方案中,本发明提供了与靶抗原免疫反应的重组抗原结合多肽,所述多肽包含vh结构域和vl结构域,其中vh结构域或vl结构域中的至少一个高变环或互补决定区获自骆驼科物种的vh或vl结构域,通过包含以下步骤的方法可获得所述抗原结合多肽:
[0336]
(a)用靶抗原或用编码所述靶抗原的多核苷酸免疫接种骆驼科物种并产生针对所述靶抗原的抗体;
[0337]
(b)确定编码与所述靶抗原免疫反应的骆驼科常规抗体之vh和/或vl结构域的至
少一个高变环或互补决定区(cdr)的核苷酸序列;
[0338]
以及
[0339]
(c)表达与所述靶抗原免疫反应的抗原结合多肽,所述抗原结合多肽包含vh和vl结构域,其中vh结构域或vl结构域的至少一个高变环或互补决定区(cdr)具有由部分(a)中确定的核苷酸序列编码的氨基酸序列。
[0340]
可将通过主动免疫获得的经分离骆驼科vh和vl结构域用作改造根据本发明之抗原结合多肽的基础。从完整骆驼科vh和vl结构域起始,有可能改造一个或更多个氨基酸替换、插入或缺失,其脱离起始骆驼科序列。
[0341]
在一个实施方案中,这样的替换、插入或缺失可以存在于vh结构域和/或vl结构域的框架区中。一级氨基酸序列中此类改变的目的可以是减少可能的不利特性(例如,在人宿主中的免疫原性(所谓的人源化),有效产物异质性的位点和或不稳定性(糖基化、脱酰胺化、异构化等)或者增强分子的一些其它有利性质(例如溶解性、稳定性、生物利用度等)。
[0342]
在另一个实施方案中,在通过主动免疫获得的骆驼科vh和/或vl结构域的一个或更多个高变环(或cdr)中改造一级氨基酸序列的改变。可以引入这样的改变以增强抗原结合亲和力和/或特异性,或降低可能的不利性质,例如在人宿主中的免疫原性(所谓的人源化),有效产物异质性的位点和或不稳定性、糖基化、脱酰胺化、异构化等,或者增强分子的一些其他有利性质,例如溶解度、稳定性和生物利用度等。
[0343]
本发明的抗体(优选mhgarp8或lhg10样抗体)还可以衍生为“嵌合”抗体(免疫球蛋白),其中重/轻链区与原始抗体中的相应序列相同或同源,同时链的剩余部分与源自另一物种的抗体或者属于另一抗体类别或亚类以及此类抗体的片段中的对应序列相同或同源,只要它们表现出期望的生物学活性和结合特异性(cabilly等,同上;morrison等,proc.natl.acad.sci.,6851页(1984))。
[0344]
本发明的一个目的是组合物,其包含至少一种上文所述的本发明的蛋白质。
[0345]
本发明的另一目的是药物组合物,其包含可药用赋形剂和至少一种上文所述的本发明蛋白质。
[0346]
可在这些组合物中使用的可药用赋形剂包括但不限于:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白(例如人血清白蛋白),缓冲物质(例如磷酸盐、甘氨酸、山梨酸、山梨酸钾),饱和植物脂肪酸的偏甘油酯混合物(partial glycerid mixture),水,盐或电解质(例如鱼精蛋白硫酸盐、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅(colloidal silica)、三硅酸镁),聚乙烯吡咯烷酮,基于纤维素的物质(例如羧甲基纤维素钠),聚乙二醇,聚丙烯酸酯,蜡,聚乙烯
‑
聚氧丙烯嵌段聚合物,聚乙二醇和羊毛脂。
[0347]
本发明的另一个目的是用于在有此需要的对象中抑制tgf
‑
β活性的本发明蛋白质。
[0348]
本发明的另一个目的是在有此需要的对象中抑制tgf
‑
β活性的方法,其包括向所述对象施用有效量的本发明蛋白质。
[0349]
本发明的另一个目的是用于在有此需要的对象中治疗tgf
‑
β相关病症的上文所限定的药物组合物或本发明蛋白质。
[0350]
本发明的另一个目的是用于在有此需要的对象中治疗tgf
‑
β相关病症的方法,其包括向所述对象施用有效量的本发明蛋白质。
[0351]
其中可使用本发明之方法的疾病或病症包括其中可受益于tgf
‑
β之抑制的所有疾病。
[0352]
所述tgf
‑
β相关病症包括但不限于炎性疾病、慢性感染、癌症、纤维化、心血管疾病、脑血管疾病(例如缺血性中风)以及神经变性疾病。
[0353]
为了用于施用至对象,将组合物配制成用于施用至所述对象。本发明的组合物可以经口、肠胃外、通过吸入喷雾、经表面、经直肠、经鼻、经口腔、经阴道或经植入的储器(reservoir)施用。本文使用的术语施用包括皮下、静脉内、肌内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内和颅内注射或输注技术。
[0354]
本发明组合物的无菌可注射形式可以是水性或油性混悬液。可根据本领域中已知的技术使用合适的分散剂或湿润剂和悬浮剂来配制这些混悬液。无菌可注射制剂还可以是在无毒的肠胃外可接受稀释剂或溶剂中的无菌可注射溶液或混悬液。其中可采用的可接受载剂和溶剂是水、林格溶液(ringer
‘
s solution)和等渗氯化钠溶液。此外,无菌的不挥发油通常用作溶剂或悬浮介质。为了此目的,可以使用任何温和的不挥发油,包括合成的单甘油酯或二甘油酯。脂肪酸(例如油酸及其甘油酯衍生物)因为是天然的可药用油(例如橄榄油或蓖麻油,尤其是其聚氧乙烯化形式),所以可用于可注射剂的制备。这些油溶液或混悬液也可以含有长链醇稀释剂或分散剂,例如通常在包括乳剂和混悬剂的可药用剂型的制剂中使用的羧甲基纤维素或类似的分散剂。在可药用固体、液体或其它剂型的制造中经常使用的另一些经常使用的表面活性剂(例如tween、span)和其他乳化剂或生物利用度增强剂也可以用于配制的目的。
[0355]
根据用于这些产品的已知方法可确定用于施用本发明药物组合物中之抗体的时间表和剂量,例如使用制造商的说明书。例如,存在于本发明药物组合物中的抗体可以以10mg/ml的浓度在100mg(10ml)或500mg(50ml)的单次用小瓶中提供。以9.0mg/ml氯化钠、7.35mg/ml柠檬酸钠二水合物、0.7g/ml聚山梨醇酯80和注射用无菌水配制成用于静脉内(iv)施用的产品。将ph调整为6.5。应当理解,这些时间表是示例性的,并且考虑到必须在临床试验中确定的药物组合物中特定抗体的亲和力和耐受性,可以调整最优的时间表和方案。
[0356]
在本发明的另一个目的是用于在有此需要的对象的肿瘤环境中降低免疫抑制的方法,其包括向所述对象施用治疗有效量的本发明蛋白质。
[0357]
本发明的另一个目的是用于在有此需要的对象中加强免疫系统的方法,其包括向所述对象施用治疗有效量的本发明蛋白质。
[0358]
本发明的另一个目的是用于在有此需要的对象中抑制人treg的免疫抑制功能的方法,其包括向所述对象施用治疗有效量的本发明蛋白质。
[0359]
本发明的另一个目的是用于在有此需要的对象中治疗癌症的方法,其包括向所述对象施用治疗有效量的本发明蛋白质。
[0360]
本发明的另一个目的是用于在有此需要的对象中治疗癌症的方法,其中本发明的药物组合物作为用于治疗癌症患者的免疫刺激性抗体施用。
[0361]
本发明的另一个目的是用于在有此需要的对象中治疗癌症的方法,其包括向所述对象施用与其他癌症治疗或免疫治疗剂组合的治疗有效量的本发明蛋白质。
[0362]
本发明的另一个目的是本发明蛋白质与其他癌症治疗或者用于治疗或在治疗癌
症中使用的其他免疫治疗剂的组合。
[0363]
在本发明的一个实施方案中,所述免疫治疗剂是肿瘤疫苗。
[0364]
在本发明的另一个实施方案中,所述免疫治疗剂是免疫刺激性抗体。
[0365]
不希望受到理论的限制,本发明人认为本发明的蛋白质将阻止肿瘤环境中的免疫抑制,从而增加免疫治疗剂的效力。
[0366]
通过本发明可以治疗多种癌症,例如肾上腺皮质癌、肛门癌、膀胱癌、脑肿瘤、神经胶质瘤、乳腺癌、类癌瘤、宫颈癌、结肠癌、子宫内膜癌、食道癌、肝外胆管癌、尤因肉瘤(ewings tumor)、颅外生殖细胞肿瘤、眼癌、胆囊癌、胃癌、生殖细胞肿瘤、妊娠滋养细胞肿瘤、头颈癌、下咽癌、胰岛细胞癌、肾癌、喉癌、白血病、唇和口腔癌、肝癌、肺癌、淋巴瘤、黑素瘤、间皮瘤、梅克尔细胞癌、转移性鳞状头颈癌、骨髓瘤、赘生物、鼻咽癌、神经母细胞瘤、口腔癌、口咽癌、骨肉瘤、卵巢癌、胰腺癌、鼻窦和鼻癌、甲状旁腺癌、阴茎癌、嗜铬细胞瘤癌、垂体癌、浆细胞赘生物、前列腺癌、横纹肌肉瘤、直肠癌、肾细胞癌、唾液腺癌、皮肤癌、卡波西肉瘤、t细胞淋巴瘤、软组织肉瘤、胃癌、睾丸癌、胸腺瘤、甲状腺癌、尿道癌、子宫癌、阴道癌、外阴癌或维尔姆斯瘤(wilm's tumor)。
[0367]
在本领域中已知的适合用作肿瘤疫苗的肿瘤抗原包括例如:(a)睾丸癌抗原例如ny
‑
eso
‑
1、ssx2、scp1以及rage、bage、gage和mage家族多肽,例如gage
‑
1、gage
‑
2、mage
‑
1、mage
‑
2、mage
‑
3、mage
‑
4、mage
‑
5、mage
‑
6和mage
‑
12(其可用于例如进行黑素瘤、肺、头颈、nsclc、乳腺、胃肠和膀胱肿瘤),(b)突变的抗原,例如p53(与多种实体瘤相关,例如结直肠癌、肺癌、头颈癌),p21/ras(与例如黑素瘤、胰腺癌和结直肠癌相关),cd4(与例如黑素瘤相关),mum1(与例如黑素瘤相关),胱天蛋白酶
‑
8(与例如头颈癌相关),cia 0205(与例如膀胱癌相关),hla
‑
a2
‑
r1701,β联蛋白(与例如黑素瘤相关),tcr(与例如t细胞非霍奇金淋巴瘤相关),bcr
‑
abl(与例如慢性髓性白血病相关),磷酸丙糖异构酶,ia 0205,cdc
‑
27和ldlr
‑
fut,(c)过表达的抗原,例如半乳凝素4(galectin 4)(与例如结直肠癌相关),半乳凝素9(与例如霍奇金病相关),蛋白酶3(与例如慢性髓细胞性白血病相关),wt 1(与例如多种白血病相关),碳酸酐酶(与例如肾癌相关),醛缩酶a(与例如肺癌相关),prame(与例如黑素瘤相关),her
‑
2/neu(与例如乳腺癌、结肠癌、肺癌和卵巢癌相关),α甲胎蛋白(与例如肝细胞瘤相关),sa(与例如结直肠癌相关),胃泌素(与例如胰腺癌和胃癌相关),端粒酶催化蛋白,muc
‑
1(与例如乳腺癌和卵巢癌相关),g
‑
250(与例如肾细胞癌相关),和癌胚抗原(与例如乳腺癌、肺癌和胃肠道的癌症如结肠直肠癌相关),(d)共有抗原,例如黑素瘤
‑
黑素细胞分化抗原例如mart
‑
i/melan a、gp100、mc1r,黑素细胞
‑
刺激激素受体,酪氨酸酶,酪氨酸酶相关蛋白
‑
1/trapl和酪氨酸酶相关蛋白
‑
2/trp2(与例如黑素瘤相关),(e)前列腺相关抗原例如pap、psa、psma、psh
‑
p1、psm
‑
p1、psm
‑
p2,与例如前列腺癌相关,(f)免疫球蛋白独特型(例如,与骨髓瘤和b细胞淋巴瘤相关),和(g)其它肿瘤抗原,例如含多肽和含糖抗原,包括(i)糖蛋白,如唾液酸tn和唾液酸le<x>(与例如乳腺癌和结直肠癌相关)以及多种粘蛋白;可以偶联至载体蛋白的糖蛋白(例如,可偶联至lh的muc
‑
1);(ii)脂多肽(如连接至脂质部分的muc
‑
1);(iii)多糖(例如,globp h合成多聚己糖),其可以偶联至载体蛋白(例如,klh),(iv)神经节苷脂如gm2、gm12、gd2、gd3(与例如脑、肺癌、黑素瘤相关),其也可以偶联至载体蛋白(例如,klh)。另一些肿瘤抗原包括pi 5、hom/mel
‑
40、h
‑
ras、e2a
‑
prl、h4
‑
ret、igh
‑
igk、myl
‑
rar、eb病毒抗原、ebna、人乳头瘤病毒(hpv)抗原(包括e6和e7)、乙型和丙型肝炎
antibody),例如hrp、荧光标记、放射性同位素、β
‑
半乳糖苷酶和碱性磷酸酶。
[0381]
实施例
[0382]
通过以下实施例进一步举例说明本发明。
[0383]
实施例1:针对人garp的新单克隆抗体(>hgarp单克隆)
[0384]
用经人garp转染的鼠p1htr细胞免疫接种dba/2或balb/c小鼠。通过facs筛查与表达hgarp之bw细胞的结合,来测试来自经免疫接种之小鼠的血清中>hgarp抗体的存在。将来自具有高滴度之>hgarp抗体的小鼠的脾细胞与sp2/neo细胞融合。在hat培养基中选择杂交瘤并在有限稀释下克隆。针对与表达hgarp之bw细胞结合之抗体的存在,通过facs筛选+/
‑
1600个杂交瘤克隆的上清液。在这次筛选中,鉴定了38种产生>hgarp之单克隆抗体(monoclonal)的克隆。选择9个克隆,并且进行扩增以用于大规模生产,并纯化了9种新>hgarp单克隆抗体(mhgarp1至9)。
[0385]
如图1所示,mhgarp1至9结合用hgarp转染的鼠bw5147细胞,但不结合未经转染的细胞。mhgarp1至9还结合用hgarp转染的293t细胞和用编码hgarp之慢病毒转导的两种人t细胞系(克隆th a2和jurkat),但不结合对应的亲代细胞(未示出)。这种识别模式与本文中用作阳性对照的市售可得的>hgarp mab(克隆plato
‑
1)相同。这些结果表明mhgarp1至9识别细胞表面上的hgarp。
[0386]
如图7a
‑
图7b中所示,生产并纯化5种另外的mhgarp抗体。mhgarp抗体(图中的mhg
‑
1至
‑
14)不结合克隆tha2(人cd4+t辅助细胞,其不表达hgarp),但结合用hgarp转导的tha2。
[0387]
实施例2:mhgarp8(而非12中另外的>hgarp单克隆抗体中的任一)抑制人treg细胞产生活性tgf
‑
β
[0388]
在20μg/ml的>hgarp单克隆抗体存在或不存在的情况下,在无血清培养基中用包被的抗cd3(1μg/ml)和溶解性抗cd28(1μg/ml)抗体刺激人treg克隆(1e+06个细胞/ml)。在这一测定中测试13种>hgarp单克隆抗体:我们的9种新单克隆抗体(mhgarp1至9),和市售可得的抗体克隆plato
‑
1(enzo life sciences,货号alx
‑
804
‑
867),272g6(synaptic systems,货号221111),50g10(synaptic systems,货号221011)和7b11(biolegend,货号352501)。24小时后收集细胞,裂解并经受还原条件下的sds
‑
page。用iblot系统(life technologies)将凝胶印记到硝酸纤维素膜上。封闭之后,使膜与针对磷酸化smad2的一抗(psmad2,cell signaling technologies)或针对β
‑
肌动蛋白的一抗(sigma)杂交,然后与hrp偶联的二抗杂交,并且用增强的化学发光(chemiluminescent,ecl)底物(thermofisher scientific)显影。psmad2的存在表明经刺激的treg克隆产生了活性tgf
‑
β。通过使用image j软件测量放射自显影上55kda psmad2和40kdaβ
‑
肌动蛋白条带的密度来定量ecl信号。
[0389]
为了检验hgarp是否是经tcr刺激的treg细胞产生活性tgf
‑
β所必需的,我们通过其t细胞受体(tcr)(单独或在>hgarp mab存在的情况下)刺激人treg克隆。经刺激的treg产生的活性tgf
‑
β开启了自分泌信号,这导致转录因子smad2和smad3的磷酸化和活化。我们通过western印迹(wb)测定了磷酸化smad2(psmad2)的存在,作为对于由经刺激的treg克隆产生活性tgf
‑
β的读出(read
‑
out)。如图2所示,在mhgarp8存在的情况下,psmad2减少超过10倍。这一减少与存在抗tgf
‑
β mab(本文用作阳性对照)的情况下观察到的减少类似。12种另外的>hgarp mab(8种另外的自制mhgarp和4中市售可得的抗garp抗体)中没有一种抑制treg克隆产生活性tgf
‑
β。总之,我们的数据证明garp是人treg产生活性tgf
‑
β所需的,如针
对hgalp的抗体mhgarp8阻止活性tgf
‑
β产生。
[0390]
实施例3:mhgarp8(而非其他>hgarp mab)识别构型表位需要tgf
‑
β的存在
[0391]
对>hgarp单克隆抗体识别的区域作图。
[0392]
用编码在图3a中示意的ha标记之蛋白(对应于hgarp、mgarp或mgarp/hgarp嵌合体)的质粒电穿孔鼠bw5147 t细胞。用以下染色在新霉素中选择的稳定克隆:生物素化抗hgarp抗体(>hgarp1至9)和链霉亲和素
‑
pe,市售抗hgarp抗体(克隆plato
‑
1)和抗migg2b
‑
af488的二抗,或者抗ha抗体和抗鼠igg1
‑
af488的二抗。对活细胞设门的直方图。黑色的直方图示出未经转染的bw细胞上的信号,白色直方图示出表达ha标记之hgarp之bw细胞上的信号,并且灰色直方图示出表达ha标记之mgarp或mgarp/hgarp嵌合体的bw细胞上的信号。
[0393]
用以下染色亲代bw5147 t细胞(未经转染的bw)或用hgarp单独稳定转染的克隆(bw+hgarp)或用hgarp和htgfb1稳定转染的克隆(bw+hgarp+htgf
‑
b1):生物素化的抗hgarp抗体(>hgarp1至9)和链霉亲和素
‑
pe,市售抗hgarp抗体(克隆plato
‑
1)和抗migg2b
‑
af488的二抗,或者>mlap
‑
af647或>hlap
‑
apc抗体。
[0394]
我们研究了mhgarp8(而非其他>hgarp mab)抑制treg产生活性tgf
‑
β的机制。我们假设mhgarp8可以识别hgarp中的一个表位,该表位与被其他>hgarp mab识别的表位不同。
[0395]
除了mhgarp
‑
1,我们的mhgarp mab不识别鼠garp(mgarp)。因此我们构建了编码ha标记之hgarp、mgarp或hgarp/mgarp嵌合体的质粒来对被我们的mab识别的hgarp区进行作图。我们转染鼠bw细胞并且得到表达ha标记之蛋白的稳定克隆(在图3中示意性地示出)。在用>ha mab染色后通过类似荧光强度指示在表面上表达类似水平的ha标记之蛋白的所有克隆(图3a)。如所预期的,所有的mhgarp mab结合表达ha标记之hgarp的克隆,而除mhgarp
‑
1以外,没有一个结合表达ha标记之mgarp的克隆。从结合ha标记之hgarp/mgarp嵌合体的分析归并了四组mab(图3a)。在不结合嵌合体的第一组中的单克隆抗体(mhgarp
‑
6、mhgarp
‑
7和mhgarp
‑
9),表明它们识别位于hgarp的20和101位氨基酸之间的表位(区域20
‑
101)。第二组中的mab(mhgarp
‑
2、mhgarp
‑
3和mhgarp
‑
8)仅结合5个嵌合体中的一个,因此识别区域101
‑
141中的表位。第三组包含mhgarp
‑
5,其结合两种嵌合体,因此识别区域141
‑
207。这一组还可能含有mhgarp
‑
1,其有交叉反应性,但结合这2种嵌合体比其结合mgarp或另外3种嵌合体更高效。最后,第四组中的mab(mhgarp
‑
4和plato
‑
1)结合5种嵌合体中的4种,因此识别区域265
‑
333。
[0396]
基于以上,我们将>hgarp mab分组成识别hgarp蛋白之4个不同区域的4个抗体家族。mhgarp
‑
8(其表现出中和活性)结合区域101
‑
141.这一区域还被非中和的mhgarp
‑
2和mhgarp
‑
3识别。因此,结合区域101
‑
141的能力不足以赋予中和活性。
[0397]
为了进一步限定被mhgarp
‑
2、mhgarp
‑
3和mhgarp
‑
8识别的表位,我们比较了>hgarp抗体与仅表达hgarp之bw细胞(bw+hgarp)的克隆或表达hgarp和htgf
‑
β1之bw细胞(bw+hgarp+htgf
‑
β1)的克隆的结合。值得注意的是除了mhgarp8,所有>hgarp抗体染色的bw+hgarp+htgf
‑
β1与bw+hgarp具有相同的强度,表明两种克隆在细胞表面上表达相同的hgarp水平。相反,mhgarp8抗体染色的bw+hgarp+htgf
‑
β1比bw+hgarp更强(图3b)。这表明,尽管两种克隆上的hgarp水平类似,bw+hgarp+htgf
‑
β1细胞上被mhgarp8识别的表位比bw+hgarp细胞上的丰富的多。
[0398]
这种观察的一种合理解释是被mhgarp8识别的表位仅在当hgarp与鼠(m)或人(h)tgf
‑
β1结合时出现。这可能是由于以下两种机制中的一种:该表位包含来自hgarp和tgf
‑
β1二者的氨基酸(混合的构象表位),或者其仅包含来自hgarp的氨基酸,但在tgf
‑
β1存在的情况下采用了不同的构象(结合诱导的构象表位)。bw细胞表达鼠tgf
‑
β1,并且鼠tgf
‑
β1结合hgarp(图3b)。因此,mhgarp8与bw+hgarp的结合(在不存在经转染的htgf
‑
β1的情况下)可能是由于hgarp/mtgf
‑
β1复合物的识别。
[0399]
为了探索mhgarp8识别结合tgf
‑
β1时的garp的假设,我们进行了共免疫沉淀实验。我们使用不同的抗garp抗体来免疫沉淀来自bw+hgarp+htgf
‑
β1细胞的garp,然后检查tgf
‑
β与garp是否共免疫沉淀。如在图3c中所示,所有抗garp抗体有效地免疫沉淀garp(图3c,顶部图)。观察到tgf
‑
β1与mhgarp
‑
6、
‑
7、
‑
8和
‑
9mab的共免疫沉淀,表明这些抗体结合与tgf
‑
β1结合的garp。相比之下,mhgarp
‑
1、
‑
2、
‑
3、
‑
4和
‑
5与其他抗garp mab一样有效地免疫沉淀garp,但它们不共免疫沉淀tgf
‑
β(图3c,底部图)。这表明mhgarp
‑
1、
‑
2、
‑
3、
‑
4和
‑
5识别游离的garp,但不识别与tgf
‑
β结合的garp。重要的是注意到mhgarp
‑
2和
‑
3(其需要用于结合的garp101
‑
141区域)仅识别游离的garp,而中和性mhgarp8(其也需要garp101
‑
141)识别与tgf
‑
β结合的garp。
[0400]
为了确认这一观察结果,我们使用293t细胞(其表达低水平的内源性tgf
‑
β1)将hgarp和增加量的htgfb1共转染(图3d)。当htgfb1与hgarp共转染时,mhgarp
‑
1、
‑
2、
‑
3、
‑
4和
‑
5的结合剂量依赖性地降低。其在最高剂量的htgfb1完全消失。这确认了mhgarp
‑
1至
‑
5仅结合游离garp。mhgarp
‑
6、
‑
7和
‑
9的结合不被htgfb1的共转染修饰,表明这些mab结合hgarp,而无论hgarp是否结合tgf
‑
β1(即它们结合游离的garp和与tgf
‑
β1结合的garp二者)。形成鲜明的对比,当htgfb1与hgarp共转染时,mhgarp8的结合剂量依赖性地增加。这也表明,相对于所有其他抗体,mhgarp8不结合游离的garp,而仅结合与tgf
‑
β1结合的garp。
[0401]
为了证明mhgarp8结合需要tgf
‑
β1的存在,我们使用sirna来沉默用hgarp转导的jurkat细胞中的tgfb1的表达(图3e)。针对tgfb1 mrna的sirna充分地降低了tgf
‑
β1的表达,如通过在jurkat+hgarp细胞上检测的表面lap的降低所示出的(图3e,右图)。jurkat+hgarp中的tgf
‑
β1表达降低减少了mhgarp8抗体的结合,但其不改变其他抗garp抗体的结合(图3e,前景直方图(foreground histogram))。这确认了相对于其他抗garp抗体,mhgarp8不结合游离的garp,而仅在tgf
‑
β1存在的情况下结合garp。
[0402]
最终,我们寻求排除不太可能的假设,即不考虑hgarp表达,细胞表面上tgf
‑
β的存在足以被mhgarp8结合。换句话说,我们寻求证明mhgarp8识别需要hgarp和tgf
‑
β二者都表达的混合的或结合诱导的构象表位。为了这一点,我们用以上所述之编码hgarp、mgarp或hgarp/mgarp嵌合体的构建体转染293t细胞,带有或不带有编码htgf
‑
β1的构建体。通过facs用>hlarp抗体分析经转染的细胞来测量mhgarp8抗体的结合,以及细胞表面上htgf
‑
b1的存在(图4)。通过与未经转染的细胞比较,单独转染hgarp、mgarp或hgarp/mgarp构建体(无htgfb1)诱导低水平的表面lap,原因是低水平的内源性htgfb1表达(图4的a,左)。在转染hgarp、mgarp、或任意hgarp/mgarp构建体的细胞中,转染htgfb1后,表面lap水平急剧升高(图4的b,左直方图)。这表明htgf
‑
β1通过hgarp,通过mgarp以及通过所有hgarp/mgarp嵌合体来呈现在细胞表面上。重要的是,mhgarp8仅结合用hgarp转染之细胞的表面,或用编码hgarp之101至141位氨基酸的hgarp/mgarp构建体转染的细胞的表面(图4的a和b,右)。其不
结合用htgfb1和mgarp转染的细胞,也不结合用htgfb1和不编码hgarp之101至141位氨基酸的hgarp/mgarp构建体转染的细胞(图4的b,右),尽管这些细胞在其表面呈现高水平的lap(图4的b,左)。这证明细胞表面上tgf
‑
β1的呈现(通过mgarp或hgarp/mgarp嵌合体)不足以使得被mhgarp8结合。mhgarp8的结合需要细胞表面上hgarp(区域101
‑
141)和tgf
‑
β1二者的存在。
[0403]
如上所指出的,mhgarp8不结合mgarp。其与hgarp结合需要包含101至141位氨基酸的区域。为了进一步限定被mhgarp8识别的表位,我们比较了人和鼠garp中区域101
‑
141的序列。在这一区域中,hgarp和mgarp之间仅13个氨基酸不同(图5,通过灰色框突出的氨基酸)。我们构建了3种hgarp的ha标记之突变体形式。在每一种突变体中(mut i、mut ii和mut iii),用mgarp蛋白的相应氨基酸替换3个连续氨基酸(图5,黑色框)。我们得到了用这些野生型(wt)或突变型hgarp的ha标记形式转染的bw细胞的稳定克隆。所有克隆在表面上表达类似水平的ha标记之蛋白,如通过用>ha抗体染色证明的(图5,右边的直方图)。然后,在用mhgarp
‑
2,
‑
3和
‑
8(即,需要hgarp的区域101
‑
141用于结合的抗体)染色之后我们分析了克隆。这三种抗体结合表达hgarp的wt、mut i和mut ii形式的细胞。相对的,表达hgarp之mut iii形式的细胞上的结合极大降低,表明mhgarp
‑
2,
‑
3和
‑
8需要hgarp的137
‑
138
‑
139位氨基酸以用于结合。
[0404]
总之,我们的数据示出mhgarp8是唯一可用的抑制人treg产生活性tgf
‑
β1的抗garp抗体。这种中和活性与mhgarp8结合与所有其他抗garp抗体所结合之那些表位不同的表位有关:mhgarp8的结合需要hgarp的区域101
‑
141和htgf
‑
β的存在二者,而非中和抗体的结合需要hgarp的其他区域(mhgarp
‑
1,
‑
4,
‑
5,
‑
6,
‑
7和
‑
9),或者仅在tgf
‑
β1不存在的情况下发生(mhgarp
‑
2和
‑
3)。在区域hgarp101
‑
141中,mhgarp
‑
2,
‑
3和
‑
8的结合需要137至139位氨基酸。
[0405]
通过biacor分析测量mhgarp8抗体与固定的shgarp
‑
tgfβ的亲和力:所述抗体的kd为0.2nm。
[0406]
实施例4:mhgarp8在体内抑制人treg细胞功能
[0407]
为了检验mhgarp8是否还在体内抑制人treg,我们使用通过将人pbmc(外周血单核细胞(peripheral blood mononuclear cell))转移到免疫受损的nod
‑
scid
‑
il2rg
‑
/
‑
(nsg)小鼠中诱导的异种gvhd的模型。nsg小鼠缺乏功能性t细胞、b细胞和nk细胞。这使得人类造血干细胞(hs()有效的植入,其在接受者小鼠中增殖并产生功能性人免疫系统。当使用人pbmc来代替hsc,发生了t细胞的有效植入,但很快伴随着异种移植物抗宿主病(xenogeneic graft
‑
versus
‑
host disease,gvhd)的发生。在这一模型中,由将接受者nsg小鼠的组织视为外来物的人供体细胞毒t淋巴细胞的活性导致了gvhd(shultz,等nature 2012,12:786
‑
798)。可以通过将人treg细胞与人pbmc共转移来降低gvhd的严重程度(hannon等transfusion2014)。
[0408]
从血色素沉着病供体的总血液通过密度梯度离心分离人pbmc(lymphopreptm),并冷冻供以后使用。如下产生自体treg:使用rosetteseptm人cd4+t细胞富集混合物(stemcell technologies)从同一供体的血液分离cd4+t细胞并用与荧光染料偶联的抗cd4、抗cd25和抗cd127抗体染色。通过流式细胞术分选cd4+cd25hicd127lo细胞(纯度>99%),然后在il
‑
2(120iu/ml)的存在下用抗cd3/cd28包被的珠子刺激(用
于t细胞扩增和活化的人t
‑
activatorcd3/cd28,life technologies),持续14天。将所扩增的treg细胞冷冻供以后使用。
[0409]
在第
‑
1天辐照(2.5gy)nsg小鼠,然后在第0天,尾静脉注射仅人pbmc(每只小鼠2.7
×
106),或与扩增的人treg(每只小鼠1.4
×
106)混合的人pbmc(每只小鼠2.7
×
106)。小鼠每周还接受mhgarp8抗体(在第
‑
1天400μg,在以后的时间点200μg)或对照pbs的腹腔注射。按照文中所指示的,每两周监测小鼠的gvhd发生。
[0410]
我们将带有或不带有treg的人pbmc转移到nsg小鼠中,并用mhgarp8抗体或对照pbs的腹腔注射处理小鼠。通过用流式细胞术从人pbmc分选的cd4+cd25+cd127lo细胞的短期体外扩增获得转移所需的大量人treg细胞。每两周监测在接受者小鼠中发生gvhd的客观标志。我们进行了两个独立的实验,它们产生了类似的结果。在实验1中(图6的a),注射人pbmc后29天出现了gvhd的标志(平均评分≥1)(组i,n=2)。疾病的严重性增加很快,出于伦理学的原因在第55天将2只小鼠中的一只安乐死。在注射有pbmc和treg的小鼠中(组ii,n=3),与仅pbmc相比,gvhd的出现延迟(在58天后达到了平均评分≥1)。这表明如所预期的,treg部分地保护nsg小鼠免受gvhd。重要的是,用mhgarp8抗体处理接受pbmc和treg的小鼠(组iii,n=6)加重了疾病:gvhd的标志比组ii中的小鼠出现的更早(第36天)。mhgarp8的作用似乎依赖于treg的存在,由于在接受仅pbmc的小鼠(组i)或接受pbmc和mhgarp8的小鼠(组iv,n=4)之间未观察到疾病评分的差异。我们用每组更多数目的小鼠重复该实验(图6的b)。再一次,与仅pbmc相比,treg与pbmc的共注射延迟了gvhd的出现(组ii中第46天和组i中的第28天),并且与未经处理的小鼠(组ii中第46天)相比,用mhgarp8抗体处理加重了接受pbmc和treg的小鼠中的gvhd(组iii中第28天)。总之,这示出mhgarp8在体内抑制人treg的免疫抑制功能。
[0411]
实施例5:使用美洲驼的免疫接种方案的新抗hgarp单克隆抗体(mab)
[0412]
生产重组可溶性garp
‑
tgfβ1复合物
[0413]
使用截短的garp表达构建体生产作为可溶性复合物的人和鼠garp
‑
tgfβ1复合物。在628位亮氨酸后截断人garp蛋白,后接可切割的tev
‑
3x strep标签(eaaenlyfqgaawshpqfekgaawshpqfekgaawshpqfekgaa*)(seq id no:40)。在629位亮氨酸后截断鼠garp蛋白,后接相同的可切割tev
‑
3xstrep标签。通过在hek293e中共表达截短的garp和tgfβ1来生产garp
‑
tgfβ1复合物,随后通过strep
‑
标签纯化。
[0414]
美洲驼的免疫接种
[0415]
如de haard和同事(de haard h,等,j.bact.187:4531
‑
4541,2005)所述进行美洲驼的免疫接种并收获外周血淋巴细胞(pbl),以及随后进行rna的提取和抗体片段的扩增。用通过使用本专利申请中所述的单克隆抗体mhgarp8(mhg
‑
8)的流式细胞术确认的过表达人garp和tgfβ1的bw细胞免疫接种4只美洲驼(图7a)。每周一次用颈部肌内注射免疫接种美洲驼,持续6周。在颈部肌肉中注射约107个细胞,并且在位于距细胞注射位点几厘米的第二区域注射弗氏不完全佐剂。用人garp cdna和人tgfβ1 cdna表达载体的混合物免疫接种另4只美洲驼,每两周一次,重复注射4次。
[0416]
在免疫接种前和接种后收集10ml的血液样品以研究免疫应答。最后的免疫接种后3至4天,收集400ml血液用于从使用ficoll
‑
paque梯度和由chomczynskip,等,anal.biochem.162:156
‑
159,1987所描述的方法制备的pbl提取总rna。平均下来,实现了
450μg的rna产量,其用于重链和轻链的v区(vλ和vκ)的随机cdna合成与pcr扩增,以用于构建如de haard h等(j biol chem.1999jun 25;274(26):18218
‑
30)所述的含fab的噬菌粒文库,以获得多样性良好的多样化文库(1
‑7×
108)。
[0417]
通过在包被的重组可溶性garp
‑
tgf β1复合物(1μg/ml)上的elisa研究对garp
‑
tgf β1复合物的免疫应答。从10%血清开始制备五倍连续稀释的血清,并且将100μl经稀释的血清添加到包被的孔并在rt孵育1小时。用3
×
pbs/tween清洗后,用补充有1%酪蛋白的pbs封闭板(图8)。在elisa中测量常规美洲驼igg1与其靶标garp
‑
tgfβ的结合,使用小鼠抗美洲驼igg1抗体(克隆27e10,daley lp,等clin.diagn lab immunol.12,2005)和hrp
‑‑
缀合的驴抗小鼠抗体(jackson)用于检测。
[0418]
garp
‑
tgfβ1特异性fab的选择和筛选
[0419]
根据标准方案生产表达fab的噬菌体并根据标准的噬菌体展示方案,在固定的重组可溶性garp
‑
tgfβ1上进行选择,用胰蛋白酶全部洗脱结合garp
‑
tgfβ1的噬菌体。
[0420]
进行两轮或三轮选择以富集通过噬菌体表达的人garp
‑
tgfβ1特异性fab。使用hgarp和htgfβ1(lap)反向选择(counterselection)来富集结合fab的hgarp
‑
tgfβ1复合物。分离单独的克隆并在96孔板中通过iptg诱导从根据标准方案的所有文库生产周质级分(peris)。
[0421]
使用elisa进行hgarp
‑
tgfβ特异性fab的筛选。将hgarp
‑
tgfβ1固定在maxisorb板上。用pbs中1%酪蛋白封闭1小时之后,允许来自20μl周质提取物的fab能够结合hgarp
‑
tgfβ1。
[0422]
单克隆抗体的表征
[0423]
对garp
‑
tgfβ1/garp特异性克隆的vh和vl区进行测序并基于vh中cdr3的序列分成vh家族。鉴定出17个家族。对于所鉴定的每个vh家族,我们克隆至少一个代表性克隆到全人igg1(lhg1
‑
lhg17)中。在biacore上分析这些单克隆抗体对可溶性人garp
‑
tgfβ1复合物的结合特征。以大约4,000ru将重组可溶性人garp
‑
tgfβ1固定在cm5芯片(gehealthcare)上。
[0424]
通过facs分析单克隆抗体与在hek
‑
293细胞上表达的人和食蟹猴garp
‑
tgfβ1复合物的结合。从来自食蟹猴外周血淋巴细胞(pbmc)的cdna样品克隆编码食蟹猴garp和食蟹猴tgfβ1的序列。通过基于食蟹猴garp的预测序列(xm_005579140.1;seq id no:41)和食蟹猴tgfβ1的预测序列(xm_005589338.1;seq id no:42)的引物扩增全长序列的重叠部分。对于食蟹猴garp和食蟹猴tgfβ1二者的三个分离的pcr扩增子进行dna序列分析。将它们与预测序列完全比对。将食蟹猴garp和食蟹猴tgfβ1克隆到pcdna3.1以用于在hek293e细胞中瞬时过表达。在facs上比较与食蟹猴garp
‑
tgfβ1的结合和与人garp
‑
tgfβ1的结合。可认为lhg
‑
10和改组变体(lhg
‑
10.3至lhg
‑
10.6)与食蟹猴garp
‑
tgfβ1交叉反应(图9)。
[0425]
所使用的引物:
[0426]
>cynotgfbs1:cgcctc ccccatgccg ccctccg(seq id no:43)
[0427]
>cynotgfbs2:acaattcctg gcgatacctc(seq id no:44)
[0428]
>cynotgfbas1:ctcaaccactgccgcacaac(seq id no:45)
[0429]
>cynotgfbas2:tcagctgcatttgcaggagc(seq id no:46)
[0430]
进行vk改组以改进亲和力
[0431]
对vk链进行改组来改进mab lhg
‑
10的亲和力(图10)。在这一方法中,将亲代克隆
的重链(lhg
‑
10的vhch1)重新引入嗜菌粒轻链文库。从表达载体(其缺乏展示所必须的细菌噬菌体来源的基因3)提取重链,以进一步避免选择性步骤中亲本轻链的污染。将重链克隆到嗜菌粒轻链文库并且将连接的dna电穿孔到大肠杆菌(e.coli)tg1细胞中以建立轻链改组文库。文库的大小为108以上。
[0432]
结合洗涤解离速率,进行亲和力选择,以选择对人garp
‑
tgfβ1具有改进的亲和力的链改组fab。选择设定,其中表达fab的噬菌体与直接包被到microsorb板的不同浓度的重组可溶性人garp
‑
tgfβ1孵育。
[0433]
通过在包被的重组可溶性人garp
‑
tgfβ1上过量添加重组可溶性人garp
‑
tgfβ1,倾向于与更高亲和力噬菌体的结合。增加每一轮的清洗时间(表3),通过清洗掉较低亲和力的变体来选择具有更好解离速率的噬菌体。用胰蛋白酶洗脱噬菌体并将其用于感染大肠杆菌tg1细胞。总之,进行5轮选择。此外,在随后的轮次中减少输入噬菌体的量,一方面降低背景,另一方面降低mab浓度从而增加选择的严格性。
[0434]
表3:用于vk改组的每一轮选择的不同参数
[0435][0436]
对来自选择轮次iii、iv和v的至少24个克隆进行筛选。在深孔板中培养克隆(1ml表达物)并制备周质级分。在biocore上分析这些周质提取物的改进的解离速率。将解离速率提高的前四个fab克隆克隆到higg1中(lhg
‑
10系列),还克隆到在fc区中具有n297q替换的效应物致死变体higg1(lhg
‑
10
‑
d系列)中,并且在biocore上分析所得igg的改进的结合特征(表4)。此外,在基于facs的测定中使用用食蟹猴garp/食蟹猴tgfβ1或人garp/人tgfβ1转染的hek
‑
293e来检查lhg
‑
10
‑
d igg对食蟹猴garp/食蟹猴tgf
‑
β1的交叉反应性。还在这个交叉反应性测定中测试了mhgarp8。所有lhg
‑
10
‑
d和mhg
‑
8针对食蟹猴garp/食蟹猴tgfβ1有交叉反应(图9)。
[0437]
表4:经改组克隆的结合特征
[0438][0439]
实施例6:两种抗hgarp mab(mhgarp8和lhg
‑
10)抑制人treg产生活性tgf
‑
β1
[0440]
经刺激的人treg产生活性tgf
‑
β1,靠近其细胞表面。自分泌和旁分泌tgf
‑
β1活性诱导treg自身和与treg共培养的th细胞中的smad2磷酸化(stockis,j.等eur.j.immunol.2009,39:869
‑
882)。为了测试garp是否是treg活化tgf
‑
β1所需要的,我们在抗hgarp mab存在或不存在的情况下刺激人treg并通过western印迹测量smad2的磷酸化。我们使用的人treg源是从pbmc分选并在体外扩增12
‑
14天的cd4+cd25hicd127lo细胞(gauthy e等plos one.2013sep 30;8(9):e76186)。如通过甲基特异性qpcr测定的,经扩增的细胞群中44至82%的细胞具有去甲基化的foxp3i1等位基因,表明它们仍然是treg高度富集的。
[0441]
如预期的,在经刺激trer中检测到磷酸化的smad2,而在未经刺激的treg或在抗tgf
‑
β1中和抗体的存在下的经刺激treg中未检测到磷酸化的smad2(图11)。在mhgarp8(在图11a上命名为mhg
‑
8)或lhg
‑
10(图11b)的存在下的经刺激treg中的磷酸化smad2显著降低,表明这两种抗hgarp mab阻断活性tgf
‑
β产生。另外29种新的抗hgarp mab,以及4中市售可得的抗hgarp mab不阻断treg产生tgf
‑
β(图11)。
[0442]
mhgarp8和lhg
‑
10的抑制活性示出人treg产生活性tgf
‑
β需要garp。
[0443]
实施例7:mhgarp8和lhg
‑
10在体外抑制人treg的抑制活性
[0444]
我们先前示出了人treg通过生产活性tgf
‑
β1至少部分地抑制其他t细胞(stockis,j.等eur.j.immunol.2009,39:869
‑
882)。因此我们在体外抑制测定中测试mhgarp8(mhg
‑
8)和lhg
‑
10是否也抑制人treg功能。我们使用treg克隆作为treg源,以及新鲜分离的cd4+cd25
‑
cd127hi细胞或cd4+t细胞克隆(th细胞)作为抑制的靶标。在各种额外的mab存在或不存在的情况下,用>cd3和>cd28刺激treg和th细胞。如图12所示,在抗hgarp mab不存在的情况下,克隆treg a1抑制cd4+cd25
‑
cd127hi th细胞的增殖的66%。在mhg
‑
8或lhg
‑
10存在的情况下,抑制分别降低至36%和32%,但在6种另外的抗hgarp mab存在的情况下抑制未降低。我们还测量了在mhgarp8、抗htgf
‑
β1 mab或同种型对照存在的情况下,克隆treg a1对另一个th靶标(克隆th a2)的抑制。mhgarp8(mhg
‑
8)以类似于抗tgf
‑
β1抗体的方式抑制treg a1的体外抑制活性,而同种型对照示出无影响(图12)。
[0445]
实施例8:被抑制性抗hgarp mab识别的表位
[0446]
仅少数(2/35)抗hgarp mab阻断treg产生活性tgf
‑
β及其抑制。这可能是由于其结
合与被非抑制性mab结合的那些表位不同之表位结合的能力。因此,我们对抑制性和非抑制性mab结合所需的区域进行作图。
[0447]
garp与原tgf
‑
β1或潜伏tgf
‑
β1结合形成二硫键链接的garp/tgf
‑
β1复合物(图13和stockis 2009b eur.j.immun0l.2009.39:3315
‑
3322和gauthy e等)。首先我们试图在用hgarp和htgfb1转染的鼠bw细胞中使用共免疫沉淀(ip)实验确定抗hgarp mab是否也结合garp/tgf
‑
β1复合物。我们测试了32种抗hgarp mab:我们的31种新mab和市售可得的plato
‑
1mab。所有mab有效地免疫沉淀garp(图14a的上图,示出与12种代表性mab的ip)。原tgf
‑
β1,以及lap和成熟tgf
‑
β1(即潜伏tgf
‑
β1)与24种mab共免疫沉淀表明它们结合garp/tgf
‑
β1复合物(在图14a中示出6种mab,中间和下图)。相反,8种mab(在图14a中示出3种)未共免疫沉淀原tgf
‑
β1或潜伏tgf
‑
β1,表明它们结合游离garp,但不结合garp/tgf
‑
β1复合物。
[0448]
我们通过经转染293t细胞的facs分析确认了这一点(图14b)。未经转染的293t细胞不表达garp并且表达非常低水平的内源tgf
‑
β1。用抗lap抗体未在其表面上检测到潜伏tgf
‑
β。garp或tgfb1分别单独的转染不诱导或诱导低的表面lap,而garp和tgfb1的共转染由于潜伏tgf
‑
β1结合和由garp呈递导致诱导高的表面lap(图14b,左侧直方图)。从经转染293t细胞的分析归类了3组抗hgarp mab,并分类在图13b的3列。第一组(左列)包含不与原tgf
‑
β1或潜伏tgf
‑
β1免疫共沉淀的8种mab:它们与仅用hgarp转染的293t细胞结合,而不与用hgarp和htgfb1转染的293t细胞结合。这确认了这些mab仅结合游离garp,因为在tgf
‑
β1存在的情况下与表面garp的结合消失(图14b示出这一组的3种代表性mab)。第二组包含大多数其他mab(19种mab,图13的b的中间列):它们一样好的结合仅用hgarp转染或者用hgarp和htgfb1转染后的293t细胞,表明它们结合游离garp和garp/tgf
‑
β1复合物二者(图14b示出了这一组中的6种mab)。有意思的是,第三组的5种mab结合用hgarp和htgfb1转染的293t细胞,但不结合仅用hgarp转染的293t细胞(图13的b的右列)。这些mab结合garp/tgf
‑
β1复合物,而不结合游离garp,并且包括抑制性mhgarp8(mhg
‑
8)和lhg
‑
10(图14b示出了这一组中的3种mab)。
[0449]
我们从以上得出结论,大多数mab仅结合游离garp(8/32)或者结合游离garp和garp/tf
‑
β1复合物(19/32)。仅5种mab(包括抑制性mhgarp8(mhg
‑
8)和lhg
‑
10)以及3种非抑制性mab结合garp/tgf
‑
β1复合物,但不结合游离garp。这种识别模式没有解释为什么仅mhgarp8和lhg
‑
10是抑制性的。
[0450]
接下来我们寻求限定被各种mab结合所需要的hgarp区域。大多数抗hgarp mab不与小鼠garp(mgarp)交叉反应。因此,我们构建了编码ha标记的mgarp/hgarp嵌合体的质粒(图15a,左图)并将其转染到293t细胞中,有或没有htfgb1取决于以上确定的结合需要。所有嵌合体在293t细胞表面上的表达水平类似,如通过用抗ha mab染色证明的(图15a,右侧的直方图)。mgarp/hgarp嵌合体的结合模式(图15a,10种代表性mab)使得能够鉴定被各种抗hgarp mab结合所需的hgarp区域。这总结在图15b中,其中对应于hgarp的不同区的mab按行分布的:第一行中的mab需要包含20至101位氨基酸(hgarp20
‑
101)的区域,在第二行中的mab需要hgarp101
‑
141,第三行中的那些需要hgarp141
‑
207,第四行的需要hgarp265
‑
332,以及最后,第五组的需要hgarp332
‑
628。然而,即使考虑结合所需的区域时,不能将抑制性mhgarp8(图中称为mhg
‑
8)和lhg
‑
10识别的表位与非抑制性mab识别的表位区分开:mhgarp8和lhg
‑
10,像lhg
‑
3,
‑
12和
‑
13一样结合含有hgarp
101
‑
141
的garp/tgf
‑
β复合物。
[0451]
小鼠和人garp
101
‑
141
的序列在14个氨基酸(aa)位置不同,包含3簇3个连续位置(图15b,左图)。我们构建了hgarp的3种突变形式。在每一种突变中,来自区域101
‑
141的一系列3个连续aa被在mgarp中发现的aa替代。我们仅用ha标记的突变体,或根据所测试的mab的结合需求用ha标记的突变体和htgfb1转染293t细胞。突变体的结合模式揭示了mab的3种类型(图15b,右图),其结合分别需要氨基酸hgarp
111
‑
113
、hgarp
126
‑
127
或hgarp
137
‑
139
。6种mab(包括mhgarp8(图中称为mhg
‑
8)和lhg
‑
10)需要hgarp
137
‑
139
(图13的b)。而6种中的4种可结合游离hgarp,仅mhg
‑
8和lhg
‑
10是需要在garp/tgf
‑
β1复合物的背景下的hgarp
137
‑
139
。
[0452]
从以上我们可以得出结论,mhgarp8和lhg
‑
10抑制tgf
‑
β产生与结合与所有其他非抑制性抗hgarp mab识别的那些表位不同的表位的能力有关。
[0453]
实施例9:通过抗hgarp体内抑制人treg
[0454]
接着,我们寻求评估抑制性抗hgarp mab是否可在体内抑制人treg功能。我们使用通过将人外周血单核细胞(pbmc)转移到免疫损伤的nod/scid/il2rg
‑
/
‑
(nsg)小鼠中诱导的异种移植抗宿主病(gvhd)模型。nsg小鼠具有缺陷型细胞因子信号转导并缺乏功能性t、b和nk细胞,使得能够在i.v.注射pbmc之后非常有效地移植人t细胞。在pbmc转移后30至40天,由于人细胞毒性t淋巴细胞针对鼠组织的活性,接受者小鼠发生异种gvhd,shultz,nat rev immunol.2012nov;12(11):786
‑
98。在这种模型中,人treg与人pbmc的共转移减弱gvhd(hannon等transfusion.2014feb;54(2):353
‑
63),提供了用于测试抗hgarp mab在体内对人treg的抑制活性的模型。
[0455]
我们将有或无自体treg(1.5
×
106/小鼠)的人pbmc(3
×
106/小鼠)转移到nsg小鼠中(图16a)。作为人treg的来源,我们使用如上所述的已经在体外短期扩增的血cd4+cd25hicd127lo细胞。此外,在移植前一天和之后每周,用mhgarp8(图中称为mhg
‑
8)、抗tgf
‑
β1、同种型对照或pbs注射小鼠。每两周监测gvhd的客观标志,以根据体重减轻、行动减少、贫血或黄疸、以及脱发来建立疾病评分。我们进行4个独立的实验(图16b),示出了一个的详细结果作为例子(图16c)。根据实验,在未接受mab或接受同种型对照的小鼠的组中,转移pbmc后28至41天观察到疾病发作(平均gvhd评分≥1)。treg的共转移延迟了疾病,其在转移后46至72天出现,表明人treg能够抑制针对异种抗原的人t细胞应答。向转移了pbmc和treg的小鼠施用mhgarp8抵消了treg的保护作用:疾病与仅接受pbmc中的小鼠发生的一样早(转移后28至44天)。通过mhgarp8抑制treg的抑制功能类似于用抗tgf
‑
β1中和抗体观察到的。同种型对照没有作用。
[0456]
总之,这表明mhgarp8在体内抑制人treg的免疫抑制功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1