一种生物酶催化的羟丙基四氢吡喃三醇的合成方法与流程
1.本发明属于有机合成、精细化学品、日用化学品领域,具体涉及一种生物酶催化的化妆品活性物羟丙基四氢吡喃三醇的合成方法。
背景技术:
2.羟丙基四氢吡喃三醇(cas号439685
‑
79
‑
7)是一种生物活性物质,可以对抗皮肤老化、脱水等症状,被广泛应用于食品、生物、医药、化妆品等诸多领域。对于羟丙基四氢吡喃三醇的合成方法,目前公开的文献主要通过丙酮基四氢吡喃三醇(cas号439685
‑
73
‑
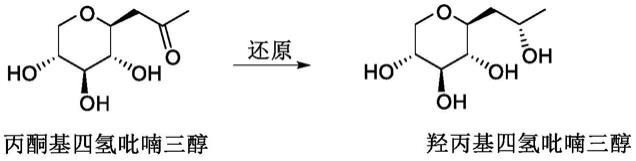
1)的还原实现(如下式)。其中,主要的还原条件包括硼氢化钠还原和过渡金属催化下的氢化反应等。这些常规化学还原反应存在以下的一些问题:立体选择性不高;三废排放较高,环境污染严重;一些试剂较为昂贵;一些反应需要高压氢气,存在安全隐患等。特别值得提出的是,一些使用过渡金属催化的反应,在产品中会存在金属残留,这对于医药和化妆品活性物尤为不利。
[0003][0004]
本发明提供一种生物酶催化的化妆品活性物羟丙基四氢吡喃三醇的合成方法。该方法的特点在于使用包含醛酮还原酶(akr)和乙醇脱氢酶(adh)的双酶循环催化系统,在氧化型辅酶ii(nadp)的存在下,以异丙醇为还原剂,实现羟丙基四氢吡喃三醇的高选择性、高效合成。该生物酶催化的方法,条件温和,操作简便,污染小,绿色安全,无金属残留,产物的非对映异构体比例高,特别适合医药和化妆品活性物的合成,具有良好的工业应用前景。
技术实现要素:
[0005]
本发明的目的在于提供一种生物酶催化的羟丙基四氢吡喃三醇的合成方法,该方法使用包含醛酮还原酶(akr)和乙醇脱氢酶(adh)的双酶循环催化系统,在氧化型辅酶ii(nadp) 的存在下,以异丙醇为还原剂,实现羟丙基四氢吡喃三醇的合成。其中,akr主导丙酮基四氢吡喃三醇的还原,adh主导nadph的循环反应,示意式如下:
[0006]
454ml去离子水,搅拌使充分溶解,抽滤出去颗粒。室温避光保存。
[0021]
(7)蛋白质电泳脱色液:50ml无水乙醇,75ml冰醋酸,875ml去离子水,混匀,须现配现用。
[0022]
(8)16%sds
‑
page分离胶(10ml):3.3ml去离子水,4ml acr(40%),2.5ml 1m tris
‑
hcl (ph 8.8),100μl 10%sds,100μl 10%aps,10μl temed。
[0023]
(9)5%sds
‑
page浓缩胶(5ml):2.42ml去离子水,0.5ml acr(40%),1.0ml,0.5m tris
‑ꢀ
hcl(ph 6.8),40μl 10%sds,40μl 10%aps,5μl temed。
[0024]
(10)0.2mol
·
l
‑1,ph=7.0的pbs(磷酸盐缓冲液):
[0025]
a试液:0.2mol
·
l
‑1磷酸二氢钠水溶液:31.20g nah2po4
·
2h2o,去离子水定容至1l。
[0026]
b试液:0.2mol
·
l
‑1磷酸氢二钠水溶液:28.40g na2hpo4
·
2h2o,去离子水定容至1l。最终将a试液加入至b试液中调至ph至7.0。
[0027]
(11)0.2mol
·
l
‑1,ph=8.0的pbs(磷酸盐缓冲液):
[0028]
a试液:0.2mol
·
l
‑
1磷酸二氢钠水溶液:31.20g nah2po4
·
2h2o,去离子水定容至1l。
[0029]
b试液:0.2mol
·
l
‑1磷酸氢二钠水溶液:28.40g na2hpo4
·
2h2o,去离子水定容至1l。最终将a试液加入至b试液中调至ph至8.0。
[0030]
实施例2(目的基因的扩增)
[0031]
设计醛酮还原酶akr和乙醇脱氢酶adh的pcr所需的引物,通过pcr方法在目标基因的碳端和氮端分别插入ndei以及xhoi酶切位点。
[0032]
引物的设计
[0033][0034]
设计引物并进行pcr操作,pcr操作时,采用50μl的总反应体系,体系组成如下
[0035]
pcr条件:
①
预变性98℃,2min;
[0036]
②
变性98℃,10s;退火58℃,5s;延伸72℃,5s/kb;循环35次;
[0037]
③
延伸72℃,5min;
[0038]
④
4℃,1h(此阶段可随时终止pcr)。
[0039]
实施例3(pet
‑
28a(+)
‑
adh和pet
‑
28a(+)
‑
akr重组质粒的构建)
[0040]
pcr产物(adh基因和akr基因))经双酶切(ndeii和xhoi)后,与同样双酶切的质粒pet
‑ꢀ
28a(+)在22℃条件下连接2h;运用热激法将酶连产物转入e.coli dh5α感受态,经测序鉴定正确后,接着将重组质粒转入e.coli bl21(de3),重组质粒命名为pet
‑
28a(+)
‑
adh和 pet
‑
28a(+)
‑
akr,之后将菌种放至
‑
80℃冰箱中保存。
[0041]
实施例4(菌种的诱导表达及保存)
[0042]
(1)醛酮还原酶的诱导
[0043]
挑取并过夜培养测序正确的菌种,待其过夜摇菌后加入1
‰
的抗性卡那霉素以及1%的过夜培养菌种,37℃、220rpm振荡培养至od600值为0.6
‑
0.8后,加入36μl的iptg诱导剂 (异丙基
‑
β
‑
d
‑
硫代吡喃半乳糖苷),再迅速降温到22℃,以180rpm的振荡速度连续振荡培养15h。
[0044]
(2)乙醇脱氢酶的诱导
[0045]
挑取并过夜培养测序正确的菌种,待其过夜摇菌后加入1
‰
的抗性卡那霉素以及1%的过夜培养菌种,37℃、220rpm振荡培养至od600值为0.6
‑
0.8后,加入60μl的iptg诱导剂 (异丙基
‑
β
‑
d
‑
硫代吡喃半乳糖苷),再迅速降温到18℃,以220rpm的振荡速度连续振荡培养8h。
[0046]
(3)诱导产物的保存
[0047]
首先将诱导后的酶液平均分成四小管,在8000rpm,5min条件下离心,去掉上清液,在试管中加入4ml的水,进行重旋和超声波破壁,在10000rpm,20min条件下离心操作后,通过过滤得到上清液,放置在
‑
20℃条件下保存。
[0048]
实施例5(酶蛋白的纯化)
[0049]
重组菌因构建在pet
‑
28a中,产生的目标蛋白带有his
‑
tag标签,因此目的蛋白(醛酮还原酶和乙醇脱氢酶)可以采取镍柱进行亲和层析纯化。具体纯化过程如下。
[0050]
(1)冲洗:在进行纯化前先用低浓度咪唑以v=1000μl/min冲洗镍柱1小时。
[0051]
(2)过滤:将实施例4破壁及离心后的菌液加入带有0.22μm过滤膜的50ml注射器
中,滤液过滤至离心管,准备上样。
[0052]
(3)上样:上样前先用止水夹夹住橡皮管,后暂停仪器,将已过滤好的上清液代替低浓度咪唑,调节流速至v=239μl/min,再开启机器,打开止水夹进行上样。注意计算好上样的时间,防止柱子吸空影响纯化。
[0053]
(4)静置:待上样完全,夹紧止水夹,关闭开关,静置1小时,让酶吸附充分。
[0054]
(5)冲洗蛋白:用低浓度咪唑以v=1000μl/min冲洗柱子,观察核酸蛋白检测仪的读数从而判断杂蛋白是否洗脱干净。待冲洗干净后,换高浓度咪唑进行冲洗,观察核酸蛋白显示仪指数,收集高浓度蛋白。
[0055]
(6)透析:将收集好的蛋白置于透析袋中,在纯净的冰水中进行透析。每隔3h换一次水,一共透析12h。
[0056]
通过以上方法可分别获得醛酮还原酶(akr)、乙醇脱氢酶(adh);而氧化型辅酶 ii(nadp)可商业购买获得。
[0057]
经过基因和蛋白测序,上述述醛酮还原酶(akr)的基因序列为:
[0058]
atgctgtacaaagaactgggccgtaccggtgaagaaattccggccttaggc ttaggcacctggggtattggcggctttgaaaccccggattattctcgcgatg aagaaatggtggaactgttaaaaaccgcaattaaaatgggctatacccata ttgataccgcagaatattatggcggcggtcataccgaagaactgattggtaa agccattaaagattttcgtcgcgaggatctgtttattgtgtctaaagtgtgg ccgacccatctgcgccgtgatgatctgctgcgctctctggaaaataccctg aaacgtttagataccgattatgtggatctgtatctgattcattggccgaatcc ggaaattccgctggaagaaaccctgagtgcaatggcagaaggcgtgcgtc agggcttaattcgctatattggtgtgagtaattttgatcgtcgcctgctgga agaagccatttctaaatcacaggaaccgattgtttgtgatcaggttaaatat aatattgaagatcgcgatccggaacgcgatggtttactggaattttgtcag aaaaatggcgtgaccttagttgcctatagtccgttacgtcgtaccttactga gtgaaaaaaccaaacgcaccttagaagaaattgccaaaaatcatggtgcc accatataccagattatgttagcatggctgttagccaaaccgaatgtggttg caattccgaaagcaggtcgtgttgaacatctgcgcgaaaatctgaaagca accgaaattaaactgagcgaagaagagatgaaactgctggatagtctggg ttaa;
[0059]
akr蛋白质序列为:
[0060]
mlykelgrtgeeipalglgtwgiggfetpdysrdeemvellktaikmgythid taeyyggghteeligkaikdfrredlfivskvwpthlrrddllrslentlkrl dtdyvdlylihwpnpeipleetlsamaegvrqgliryigvsnfdrrlleeaisk sqepivcdqvkyniedrdperdgllefcqkngvtlvaysplrrtllsektkrtl eeiaknhgatiyqimlawllakpnvvaipkagrvehlrenlkateiklseeem klldslg
[0061]
adh基因序列为:
[0062]
atgagcaatcgtctggatggtaaagttgcaattattaccggcggaactttag gtattggtctggccattgcaaccaaatttgtggaagaaggtgccaaagtta tgattaccggtcgtcatagcgatgtgggtgaaaaagcagccaaatcagtgg gcaccccggatcagattcagtttttccagcatgatagtagcgatgaagatg gttggaccaaactgtttgatgcaaccgaaaaagcctttggtccggtgagt accttagttaacaacgcaggcattgccgttaacaagtcagtggaagaaac caccaccgcagaatggcgtaaactgctggccgtgaacttagatggtgtgtt tttcggcacccgcttaggcattcagcgtatgaaaaataagggtttaggcgc ctcaattattaatatgtctagcattgaaggctttgtgggcgatccgagctta ggtgcctataatgcaagtaaaggcgccgttcgcattatgtctaaatccgcag ccctggattgtgcactgaaagattatgatgttcgcgttaataccgttcatcc gggctatattaaaaccccgctggttg
atgatctgccgggcgcagaagaagc catgtcacagcgtaccaaaaccccgatgggtcatattggcgaaccgaatga tattgcctatatttgtgtgtatctggcctctaatgagtctaaatttgccaccg gtagtgaatttgttgttgatggcggctataccgcacagtaa;
[0063]
adh蛋白质序列为:
[0064]
msnrldgkvaiitggtlgiglaiatkfveegakvmitgrhsdvgekaaksvgt pdqiqffqhdssdedgwtklfdatekafgpvstlvnnagiavnksveetttae wrkllavnldgvffgtrlgiqrmknkglgasiinmssiegfvgdpslgaynas kgavrimsksaaldcalkdydvrvntvhpgyiktplvddlpgaeeamsqrtk tpmghigepndiayicvylasneskfatgsefvvdggytaq
[0065]
实施例6(羟丙基四氢吡喃三醇的合成)
[0066]
于100ml三口烧瓶中,依次加入0.1m ph 7.0pbs缓冲溶液40ml,丙酮基四氢吡喃三醇5克、异丙醇3克、醛酮还原酶(akr)0.3克、乙醇脱氢酶(adh)0.3克、以及氧化型辅酶ii(nadp)0.3克,于25℃,200rpm搅拌桨搅拌,0.01mpa氮气吹扫的条件下,反应24h, hplc检测转化率95%。加入盐酸调节ph至2
‑
3,硅藻土过滤,加入等体积乙酸乙酯萃取两次,旋转蒸发得到产物4.2克。
[0067]
实施例7(羟丙基四氢吡喃三醇的合成)
[0068]
于100ml三口烧瓶中,依次加入0.1m ph 8.0pbs缓冲溶液40ml,丙酮基四氢吡喃三醇5克、异丙醇3克、醛酮还原酶(akr)0.5克、乙醇脱氢酶(adh)0.3克、以及氧化型辅酶ii(nadp)0.3克,于25℃,200rpm搅拌桨搅拌,0.01mpa氮气吹扫的条件下,反应24h, hplc检测转化率95%。加入盐酸调节ph至2
‑
3,硅藻土过滤,加入等体积乙酸乙酯萃取两次,旋转蒸发得到产物4.4克。
[0069]
实施例8(羟丙基四氢吡喃三醇的合成)
[0070]
于100ml三口烧瓶中,依次加入0.1m ph 7.0pbs缓冲溶液40ml,丙酮基四氢吡喃三醇5克、异丙醇3克、醛酮还原酶(akr)0.5克、乙醇脱氢酶(adh)0.5克、以及氧化型辅酶ii(nadp)0.3克,于25℃,200rpm搅拌桨搅拌,0.01mpa氮气吹扫的条件下,反应24h, hplc检测转化率95%。加入盐酸调节ph至2
‑
3,硅藻土过滤,加入等体积乙酸乙酯萃取两次,旋转蒸发得到产物4.5克。
[0071]
实施例9(羟丙基四氢吡喃三醇的合成)
[0072]
于100ml三口烧瓶中,依次加入0.1m ph 7.0pbs缓冲溶液40ml,丙酮基四氢吡喃三醇5克、异丙醇3克、醛酮还原酶(akr)0.5克、乙醇脱氢酶(adh)0.5克、以及氧化型辅酶ii(nadp)0.5克,于25℃,200rpm搅拌桨搅拌,0.01mpa氮气吹扫的条件下,反应24h, hplc检测转化率95%。加入盐酸调节ph至2
‑
3,硅藻土过滤,加入等体积乙酸乙酯萃取两次,旋转蒸发得到产物4.6克。
[0073]
实施例10(所合成羟丙基四氢吡喃三醇的非对映异构体比例的测定)
[0074]
1.1仪器和设备
[0075]
高效液相色谱仪(hplc),四元泵,自动进样器,柱温箱,蒸发光散射检测器(elsd)。分析天平,精度0.1mg,超声波清洗器,移液器,容量瓶10ml。
[0076]
1.2试剂和材料
[0077]
流动相的配制:超纯水。
[0078]
1.3分析步骤
[0079]
1.3.1样品处理
[0080]
1.3.1.1供试品溶液配制:
[0081]
精密称取上述实施例制备的羟丙基四氢吡喃三醇100.00mg(精确至0.01mg),置于10ml 容量瓶中,用超纯水超声溶解并稀释至刻度,0.45μm过滤膜过滤。
[0082]
1.3.2色谱条件
[0083]
色谱柱:astec chirobiotic t手性柱786615(0.46mm
×
250mm,5μm)
[0084]
柱温:35℃;
[0085]
流速:0.5ml/min
[0086]
流动相:a乙腈,b水
[0087]
洗脱程序:0
‑
20min,98%a
‑
2%b等度洗脱
[0088]
1.3.3测定
[0089]
取供试品溶液5μl注入高效液相色谱仪,记录色谱图,按外标法以峰面积大概计算s和r非对映异构体的含量。
[0090]
如说明书附图1所示,其中s构型的非对映异构体含量达94.6%,表明本发明提供的合成方法具有优异的非对映选择性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1