一种降低抗体半乳糖基化的方法与流程
1.本发明涉及生物技术领域,尤其是涉及一种降低抗体半乳糖基化的方法。
背景技术:
2.糖基化是一种最常见的蛋白翻译后修饰,是在糖基转移酶作用下将糖类分子转移至蛋白质的特定位置。起始于细胞内质网,结束于细胞高尔基体。常见的糖基化修饰为甘露糖基化、岩藻糖基化、半乳糖基化和唾液酸化。糖链上的结构和组成会显著影响蛋白的稳定性、安全性和有效性。
3.单克隆抗体作为一种典型的糖蛋白治疗药物,其fc段的糖基化是抗体蛋白翻译后修饰的重要指标,单克隆抗体在体内的生理活性受2种独立的机制调节:靶向并中和抗原或者引发细胞凋亡以及抗体fc效应功能,其中抗体fc效应功能包括抗体依赖的细胞毒作用(adcc)和补体依赖的细胞毒作用(cdc)。
4.研究发现,抗体的fc段效应功能与位于该区域的寡糖链有关。而半乳糖基化为糖基化中的常见类型之一,其对抗体的活性也有影响。尽管它似乎不影响抗体与抗原的结合,但据报道,提高igg抗体半乳糖修饰比例会显著增强cdc效应。并且,半乳糖增加可能会提高抗体唾液酸化水平,唾液酸化水平增强可以提高糖蛋白在血清中的半衰期;但是,半乳糖增加也会降低adcc效应,因此,降低抗体半乳糖可能防止adcc效应降低。这样就要求在细胞构建中获得符合要求的细胞株或者在细胞培养过程中开发出一种可调控抗体半乳糖基化至合适水平的工艺方法。
5.另外,在抗体生物类似药的开发过程中,往往需要和原研药保持较为一致的产品质量要求。糖型作为抗体的关键质量属性之一,需要控制在与原研药较为相似的水平,而半乳糖基化作为糖基化修饰的一种,其可影响糖谱中的多个糖型比例,如g0f、g1f、g2f、g1等。故,在上游工艺开发时需要开发出一种合适的细胞培养工艺方法进行抗体的糖型调控,以保证糖谱中各糖型与原研药可比。
6.常见抗体糖谱中的糖型为man5、g0f、g1f、g2f、g0、g1等。在抗体的生产过程中,使用的细胞株、细胞培养工艺参数以及培养基成分等均可影响单克隆抗体的半乳糖基化。因此对细胞株改造、细胞培养工艺参数优化和培养基成分优化等可以调控半乳糖基化。
7.在现有技术中,主要是采用以下几种手段调控半乳糖基:(1)在细胞构建中采用基因工程技术敲除半乳糖基化修饰过程中如半乳糖转移酶等关键酶的编码基因以降低半乳糖基化比例,或者降低关键酶的活性;(2)优化细胞培养基成分,如加入mn
2+
、zn
2+
等离子;(3)改变细胞培养中的工艺参数,如降低细胞培养过程中的溶氧(do)控制(kunkel等,1998)、调整细胞培养过程中ph的控制范围(m
ü
thing等,2003)、降低培养过程中的培养温度(sou等,2015);在培养过程中添加谷丙二肽(ala
‑
gln)降低半乳糖基化比例;在培养过程中添加全乙酰基半乳糖(α
‑2‑
f全乙酰基半乳糖或β
‑2‑
f全乙酰基半乳糖),降低半乳糖基化比例。这些方法主要的缺陷在于:在基因水平上敲除关键酶基因或下调关键酶基因表达的方法:一方面可能涉及相关基因技术专利壁垒,另一方面是要把半乳糖基化控制到目标水平
的难度系数较大,且开发周期长。优化培养基成分:不仅受商业化培养基限制,而且调控效果有限,亦有可能影响到其他质量属性。改变细胞培养中的工艺参数:降低do控制,不利于细胞生长和产品表达及产品质量控制,并且在放大生产中较难稳定地控制;ph控制不是一个共性调控方法,因为在不同细胞和不同抗体产品中可能会有较大差异,因此调控效果不确定;降低培养温度,会明显降低细胞生长和代谢速率,会显著降低蛋白产量,且对半乳糖基化的调控效果有限;添加谷丙二肽(ala
‑
gln):因为此添加物是氨基酸二肽,因此在不同培养基效果差异较大,另一方面由于此添加物会涉及到氨基酸代谢并且会导致代谢中铵的积累,从而影响细胞生长及代谢,甚至影响抗体的某些质量属性;全乙酰基半乳糖在浓度高于60μm时就对细胞生长、代谢及蛋白表达有负面影响,并且工艺稳定性未知,是否能进行商业化生产也是不确定的。因此,有必要提供一种新的抗体半乳糖基的调控方法。
8.鉴于此,特提出本发明。
技术实现要素:
9.本发明的目的在于提供一种降低抗体半乳糖基化的方法,所述方法在细胞培养过程中添加一定浓度的半乳糖类似物,能够有效、稳定地调控半乳糖基化,使各糖型比例控制在目标水平附近。
10.本发明提供的技术方案如下:
11.一种降低抗体半乳糖基化的方法,包括:在培养表达所述抗体的细胞的过程中使用半乳糖类似物,所述半乳糖类似物选自式(1)的化合物或其生物学可接受的盐:
[0012][0013]
其中,r1、r2和r4分别独立地选自卤素或oh中的一种;r3选自
‑
oh和
‑
oac。
[0014]
本发明方法基于在半乳糖类似物存在的情况下,其会与udp结合形成复合物,与udp
‑
gal竞争性争夺半乳糖转移酶的结合位点,从而抑制该酶的活性,阻断半乳糖基化修饰,因此,在在细胞培养过程中,添加一定浓度的半乳糖类似物以降低半乳糖基化修饰水平,从而调控n
‑
糖谱中各糖型的比例。
[0015]
在一个实施方案中,所述卤素包括f、cl、br和i。
[0016]
在一个实施方案中,所述半乳糖类似物包括2
‑
脱氧
‑2‑
氟
‑
d
‑
半乳糖(2fg)、4
‑
脱氧
‑4‑
氟
‑
d
‑
半乳糖(4fg)和/或6
‑
脱氧
‑6‑
氟
‑
d
‑
半乳糖(6fg)。
[0017]
在一个优选实施方案中,所述半乳糖类似物为2
‑
脱氧
‑2‑
氟
‑
d
‑
半乳糖(2fg)。d
‑
半乳糖的结构式如下式a)所示,2
‑
脱氧
‑2‑
氟
‑
d
‑
半乳糖的结构式如式b)所示。
[0018][0019]
在一个实施方案中,所述抗体为已知的单克隆抗体;优选地,所述单克隆抗体包括利妥昔单抗、阿达木单抗、曲妥珠单抗、奥马珠单抗、贝伐单抗和雷珠单抗。
[0020]
在一个实施方案中,所述抗体包括igg1、igg2、igg4,优选igg1。
[0021]
在一个实施方案中,所述半乳糖类似物在反应器培养阶段接种表达所述抗体的细胞的当天添加,和/或在接种后的第3~4天添加。
[0022]
在一个实施方案中,所述半乳糖类似物的添加终浓度为50~200μm,包括但不限于50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm和200μm;优选地,所述半乳糖类似物的添加终浓度为100μm。
[0023]
在本发明方法中,添加2fg的浓度和时间会对降低半乳糖基化产生影响,本发明优化了添加的时间和浓度,使得可以实现生产的抗体的各糖型比例调控在和对照参考品基本一致的水平。
[0024]
在一个实施方案中,在反应器培养之前,还包括种子细胞培养,所述种子细胞培养在不含所述半乳糖类似物的基础培养基中进行。
[0025]
在一个实施方案中,所述培养为批次培养、补料流加批次培养、强化流加补料培养和灌流培养;补料流加批次培养中,定期添加补料,例如为期14天的培养周期内,在培养的第0、3、4、5、6、8、10、12天流加补料培养基。
[0026]
在一个具体实施方案中,在补料流加培养方法中,种子细胞以0.5~5
×
106cells/ml的密度接种到反应器中进行培养,优选0.9
±
0.1
×
106的密度接种。
[0027]
在一个实施方案中,在所述培养的过程中,根据每日葡萄糖残留浓度进行葡萄糖添加。培养过程中每日取样检测活细胞密度和细胞代谢生化值,根据每日葡萄糖残留浓度用300g/kg的葡萄糖母液进行葡萄糖添加从而维持细胞在培养中的正常葡萄糖代谢。
[0028]
在一个具体的实施方案中,种子细胞是在不含2fg的基础培养基(含4mm谷氨酰胺)中培养,以0.5
±
0.1
×
106cells/ml密度接种进行扩增,在摇床培养。当种子密度达到4.5
‑
6.5
×
106cells/ml时进行3l或10l反应器培养接种,接种密度为0.9
±
0.1
×
106cells/ml(10l反应器中的培养需要进行溶氧控制)。初始培养温度为36.5℃,在细胞密度达到15
‑
19
×
106cells/ml时降温继续培养。在培养的第0、3、4、5、6、8、10、12天流加补料培养基,培养周期为14天。
[0029]
在一个实施方案中,还可以在500l的一次性反应器进行放大培养,培养需要进行溶氧控制,do保持在50%。
[0030]
有益效果:
[0031]
(1)本发明提供的方法简单,操作方便,工艺开发周期短,并且能有效,稳定地调控半乳糖基化,使各糖型比例控制在目标水平附近;
[0032]
(2)对细胞生长和代谢,抗体产量及糖型以外的其他质量属性影响极小;
[0033]
(3)开发的细胞培养工艺方法稳定、可靠,可成功放大到生产规模;
[0034]
(4)本发明方法降低半乳糖基化修饰水平,从而调控n
‑
糖谱中各糖型的比例,在糖型中的主要体现为降低g1f和g2f比例,提高g0f比例。
附图说明
[0035]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0036]
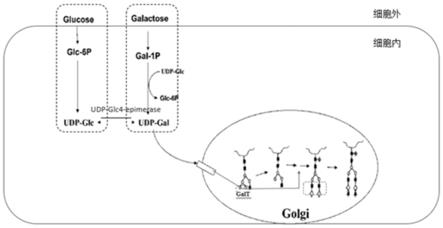
图1为细胞内的半乳糖基化途径(其中,glucose
‑
葡萄糖;galactose
‑
半乳糖;glc
‑
6p
‑
6磷酸葡萄糖;gal
‑
1p
‑
1磷酸半乳糖;udp
‑
glc
‑
尿苷二磷酸葡萄糖;udp
‑
gal
‑
尿苷二磷酸半乳糖;galt
‑
半乳糖转移酶;udp
‑
glc4
‑
epimerase:尿苷二磷酸葡萄糖
‑
4异构酶);
[0037]
图2为实施例1中3l反应器培养中细胞生长曲线;
[0038]
图3为实施例1中3l反应器培养中细胞代谢曲线;
[0039]
图4为实施例1中3l反应器培养中抗体表达曲线;
[0040]
图5为实施例2中10l反应器培养中细胞生长曲线;
[0041]
图6为实施例2中10l反应器培养中抗体表达曲线;
[0042]
图7为实施例3中500l反应器培养中细胞生长曲线;
[0043]
图8为实施例3中500l反应器培养中抗体表达曲线。
具体实施方式
[0044]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0045]
实验材料:
[0046]
1.稳定表达抗硬骨素的单克隆抗体的cho细胞株(chok1sv,美国lonsa),gs筛选系统;
[0047]
2.商业化基础培养基(thermo,美国)和补料培养基(ge,美国);
[0048]
3.2fg,2
‑
脱氧
‑2‑
氟
‑
d
‑
半乳糖(carbosynth,英国)
[0049]
4.对照参考品(礼来临床原液标准品,美国)
[0050]
检测方法:
[0051]
1.活细胞密度检测:用vi
‑
cell(beckman,德国)进行活细胞密度检测;
[0052]
2.细胞代谢生化值检测:用cedex bio(roche,瑞士)检测培养过程中的细胞代谢生化值,如葡萄糖、乳酸、氨、igg等;
[0053]
3.培养过程中抗体含量检测:用cedex bio(roche,瑞士)检测培养过程中的抗体含量;
[0054]
4.n
‑
糖型检测:利用pngasef酶释放糖蛋白的n
‑
寡聚糖,2
‑
ab标记试剂对释放的n
‑
寡聚糖进行荧光标记,采用超高效液相色谱
‑
亲水层析色谱进行分离寡聚糖,在荧光检测器λex=330nm,λem=420nm下分析,采用面积归一化法进行分析各个峰的比例。通过lc
‑
ms系统(thermo,美国),使用质荷比和保留时间检测得到的荧光色谱图鉴定样品蛋白的寡糖种类。
[0055]
技术原理:图1为细胞内的细胞内的半乳糖基化途径,通常蛋白的半乳糖基化修饰发生在细胞的高尔基上,在半乳糖转移酶(galt)的作用下,将尿苷二磷酸半乳糖(udp
‑
gal)转移到糖链上。这在过程中底物尿苷二磷酸半乳糖和半乳糖转移酶起着至关重要的作用,其中底物udp
‑
gal的有两个来源,一个是从头合成途径,一个是补救合成途径,而在半乳糖类似物存在的情况下,其会与udp结合形成复合物,与udp
‑
gal竞争性争夺半乳糖转移酶的结合位点,从而抑制该酶的活性,阻断半乳糖基化修饰。
[0056]
基于以上原理,在细胞培养过程中,添加一定浓度的半乳糖类似物,如2fg(2
‑
脱氧
‑2‑
氟
‑
d
‑
半乳糖),4fg(4
‑
脱氧
‑4‑
氟
‑
d
‑
半乳糖),6fg(6
‑
脱氧
‑6‑
氟
‑
d
‑
半乳糖),降低半乳糖基化修饰水平,从而调控n
‑
糖谱中各糖型的比例。
[0057]
实施例1. 3l反应器中用补料流加批次培养工艺
[0058]
3l反应器培养工艺:
[0059]
在3l反应器(thermo
‑
finesse g3lab,美国)中通过补料流加批次培养种子细胞(稳定表达抗硬骨素的单克隆抗体的cho细胞株)。
[0060]
培养在不含2fg的商业化基础培养基(thermo,美国)(含4mm谷氨酰胺)中进行,以0.5
±
0.1
×
106cells/ml密度接种进行扩增,在摇床(infors,瑞士)中培养3天,转速110rpm,温度36.5℃,co2浓度5%,湿度80%。
[0061]
当种子细胞的密度达到4.5~6.5
×
106cells/ml时,进行3l反应器培养接种,接种密度为0.9
±
0.1
×
106cells/ml,初始工作体积为1.6l。初始培养温度为36.5℃,在细胞密度达到15~19
×
106cells/ml时降温继续培养。
[0062]
在接种后的第4天,在其中4个反应器中加入终浓度分别为50μm、100μm、150μm、200μm的2fg,对照组不加入2fg,另外一个反应器在接种后的第0天加入终浓度为100μm的2fg。在培养的第0、3、4、5、6、8、10、12天流加补料培养基,培养周期为14天。
[0063]
培养过程中每日取样检测活细胞密度和细胞代谢生化值,根据每日葡萄糖残留浓度,用300g/kg的葡萄糖母液进行葡萄糖添加从而维持细胞在培养中的正常葡萄糖代谢。在培养的第14天将细胞培养液离心收集上清,送分析部门进行抗体质量的分析。
[0064]
3l反应器实验结果:
[0065]
图2为3l反应器培养中细胞生长曲线,图3为3l反应器培养中细胞代谢曲线,图4为3l反应器培养中抗体表达曲线。在3l反应器的测试中可以看出,即使2fg的终浓度高达200μm,其对细胞生长、代谢和抗体产量几乎无影响。
[0066]
在降低半乳糖基化方面,半乳糖基化的降低效果和添加2fg的浓度和时间均有关系。在培养的第0天加入2fg优于第4天加入,100μm浓度下第0天加入可降低半乳糖基化比例约8.8%而第4天加入降低比例为6.1%;半乳糖基化比例在培养第4天加入2fg浓度为50μm、100μm、150μm和200μm时分别降低约4.8%、6.1%、6.8%、7.7%。
[0067]
通过在培养的第0天加入100μm 2fg可以使生产的抗体的各糖型比例调控在和对照参考品基本一致的水平。
[0068]
表1. 3l反应器培养中抗体糖型结果汇总
[0069][0070]
实施例2. 10l生物反应器中补料流加批次培养
[0071]
10l反应器培养工艺:
[0072]
种子细胞以0.9
±
0.1
×
106cells/ml的密度分别接种到10l玻璃反应器(thermo
‑
finesse g3lab,美国)和10l sub即一次性生物反应器(ge
‑
xdr10,美国)上进行补料流加批次培养。
[0073]
反应器溶氧控制在50%,ph控制在6.9
±
0.3。10l玻璃反应器的搅拌速度为112
‑
130rpm,10l sub一次性反应器的搅拌速度为75
‑
85rpm。初始培养温度为37℃,在细胞密度达到15~19
×
106cells/ml时降温继续培养。
[0074]
在接种当天(第0天)加入100μm的2fg,在培养的第0、3、4、5、6、8、10、12天流加补料培养基,培养周期为14天。
[0075]
培养过程中每日取样检测活细胞密度和细胞代谢生化值,根据每日葡萄糖残留浓度用300g/kg的葡萄糖母液进行葡萄糖添加从而维持细胞在培养中的正常葡萄糖代谢。在培养结束收获细胞液,然后取下游纯化后得到的原液送质量分析部门进行抗体质量的分析。
[0076]
10l反应器实验结果:
[0077]
图5为10l反应器培养中细胞生长曲线,图6为10l反应器培养中抗体表达曲线。可以看出,在2个不同类型的10l反应器上进行3l反应器上工艺的确认,结果显示该工艺重复性和放大性较好,细胞生长和抗体表达基本一致,且抗体的n
‑
糖谱与对照参考品基本一致。
[0078]
表2. 10l反应器培养中抗体糖型结果汇总
[0079][0080]
实施例3. 3批生产规模(500l sub)补料流加批次培养工艺
[0081]
在500l的一次性反应器(美国ge公司)上进行3批放大培养。培养工艺和实施例2中
一致,反应器参数设置为:搅拌速度为90
‑
105rpm,溶氧控制在50%,ph控制在6.9
±
0.3。在接种当天加入100μm的2fg。培养周期为14天,培养结束后细胞液经下游纯化后得到原液后送qc部门进行抗体质量的分析。
[0082]
3批500l生产结果:
[0083]
图7为500l反应器培养中细胞生长曲线,图8为500l反应器培养中抗体表达曲线。如图7、图8和表3显示,3批500l规模的细胞生长和抗体表达一致,且n
‑
糖谱与对照参考品也基本一致。这表明,该工艺具有很好的稳健性。
[0084]
表3. 10l反应器培养中抗体糖型结果汇总
[0085][0086]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1