黄瓜内源启动子及其应用
1.本发明涉及植物生物技术领域,具体涉及一种黄瓜内源启动子及其应用。
背景技术:
2.黄瓜(cucumis sativus)为葫芦科(cucurbitaceae)黄瓜属(cucumis)植物,广泛分布于世界各地,是主要的蔬菜品种,也是重要的双子叶植物基因组结构及功能研究模式材料。但由于黄瓜本身具有的遗传基础狭窄及育种年限较长的特点,使得常规遗传操作技术在黄瓜中难以取得突破性的进展,极大影响了黄瓜功能基因组基础研究及分子育种实践。
3.随着转基因及基因组编辑等基因组工程技术快速发展,黄瓜功能基因组研究及种质创新实践迎来了新的机遇和挑战。转基因技术通过将人们预先设计好的外源dna通过生物技术手段导入受体细胞并整合于受体基因组上,使外源基因得以在受体内稳定表达并且还具备代代遗传能力。基因组编辑技术则通过将人工序列特异性核酸酶导入受体细胞后在基因组选定位置切割或结合,进而实现特异基因的敲除或下游基因的表达调控。相较于传统的杂交育种,转基因技术及基因组编辑技术是实现黄瓜遗传性状的快速定向改良的有力工具。
4.启动子(promoter)是调控下游基因转录表达的一类重要功能元件,是位于基因起始密码子(atg)上游的一段dna,能够与rna聚合酶结合并启动基因的转录,相当于基因转录的“开关”。启动子是驱动目标基因在细胞中进行表达与翻译的关键因子,无论是何种基因工程技术,都需要应用启动子进行实现。在基因工程操作中,同时使用同一类型启动子驱动多个外源基因可能导致基因沉默或共抑制现象,因此需要不同的启动子元件,目前黄瓜基因工程中普遍使用的启动子主要为花椰菜花叶病毒camv35s启动子,可选择性较少,关于黄瓜内源高效启动子分离的研究工作仍相对较少,因此分离活性优良的黄瓜内源启动子对黄瓜功能基因研究和遗传育种改良具有重要意义。
技术实现要素:
5.发明的目的是提供一种黄瓜内源高活性启动元件。本发明解决技术问题的技术方案是提供一种dna分子。该dna分子为如下a)或b)或c)所示:
6.a)、核苷酸序列如seq id no.1所示的dna分子;
7.b)、与a)限定的核苷酸序列具有90%以上、95%以上、97%以上或者99%以上同源性,且具有启动子功能的dna分子;
8.c)、与a)或b)限定的核苷酸序列能互补配对,且具有启动子功能的dna分子。
9.进一步的,本发明提供了含有上述dna分子的基因表达框或者含有上述dna分子的重组质粒。
10.本发明也提供了含有上述dna分子的重组微生物、转基因植物细胞系或转基因动物细胞系。
11.另一方面,本发明也提供了上述dna分子作为启动子的应用。
12.同时,本发明也提供了上述的dna分子、表达框或重组质粒在启动目的基因表达中的应用。
13.其中,上述应用种所述启动目标基因表达为在微生物、植物细胞或动物细胞中启动表达。
14.其中,上述应用中所述的植物为双子叶植物或单子叶植物。
15.进一步的,所述双子叶植物为葫芦科植物。优选的,所述葫芦科植物为黄瓜属植物。进一步的,所述的黄瓜属植物为黄瓜。
16.其中,上述应用中所述的单子叶植物为禾本科植物。其中,所述禾本科植物为稻属植物。进一步的,所述的稻属植物为水稻。
17.本发明也提供了表达目的基因的方法。该方法以上述dna分子作为启动子来启动目的基因的表达。
18.其中,上述方法中是将上述dna分子可操作地连接在待表达的目的基因的上游,启动目的基因的表达。
19.本发明从黄瓜中得到了一种具有启动子功能的核苷酸片段,命名为cscre02。通过实验证明启动子cscre02不仅可高效稳定地在黄瓜中驱动基因表达,还可以在水稻等其他植物种高效稳定地驱动基因表达。尤其是在黄瓜原生质体中,驱动基因转录的活性明显优于其他候选启动子元件,且明显优于目前植物基因组工程中常用的camv 35s及zmubi1启动子。同时,本发明也通过实验证明该启动子元件在还能在黄瓜基因组编辑上得到很好的效果。本发明为使用转基因技术或基因组编辑技术等现代生物学技术进行黄瓜遗传定向改良提供了一个好的工具,在黄瓜的生物学研究中具有很大的价值。
附图说明
20.图1、黄瓜启动子挖掘及表达检测实验中所用骨架载体与表达载体示意图。
21.图2、基于本发明中不同黄瓜候选启动子元件构建的荧光报告载体瞬时转化水稻原生质体,绿色荧光蛋白表达情况(物镜10
×
)。
22.图3、基于本发明中不同黄瓜候选启动子元件构建的荧光报告载体瞬时转化黄瓜原生质体,绿色荧光蛋白表达情况(物镜10
×
)。
23.图4、基于本发明中cscre02、cscre10、cscre11启动子元件构建的gfp
‑
gus重组表达载体进行黄瓜毛状根转化,得到的黄瓜毛状根绿色荧光蛋白表达情况(比例尺=1cm)。
24.图5、基于本发明中cscre02、cscre10、cscre11启动子元件构建的gfp
‑
gus重组表达载体进行黄瓜毛状根转化,得到的黄瓜毛状根进行gus组织化学染色的结果(比例尺=1cm)。
25.图6、基于本发明中cscre02、cscre10启动子元件的黄瓜csga20ox1
‑
sgrna01、 csga20ox3
‑
sgrna01基因编辑表达载体进行黄瓜毛状根转化,提取毛状根基因组dna,进行pcr
‑
rflp及sanger测序分析的结果。
26.图7、图2结果对应的相对荧光强度定量分析结果(水稻原生质体)。
27.图8、图3结果对应的相对荧光强度定量分析结果(黄瓜原生质体)。
具体实施方式
28.启动子是一类调控基因转录表达的重要功能元件,目前黄瓜基因工程中普遍使用的启动子主要为花椰菜花叶病毒camv35s启动子,可选择性较少。因此鉴定出黄瓜内源活性优良的启动子将为黄瓜基因功能研究和遗传育种改良等工作创造很大价值。但目前黄瓜内源启动子分离的研究报道极少,启动子挖掘工作造成困难。
29.本发明结合黄瓜rna
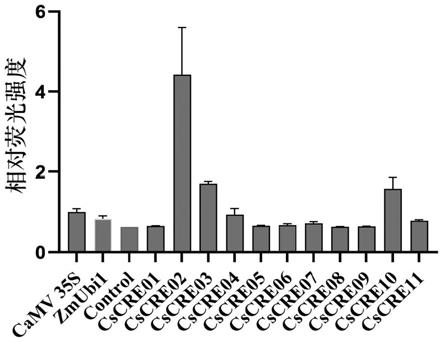
‑
seq和atac
‑
seq数据,从黄瓜基因组中初步筛选了11个具有潜在转录活性的候选启动子元件。在11个候选启动子中发现有6个候选启动子在水稻原生质体中具有一定的转录功能活性,编号分别为cscre02、cscre04、cscre07、cscre09、cscre10、 cscre11。进一步的,在黄瓜原生质体中发现有4个cscre02、cscre04、cscre10、cscre11 有转录功能活性。其中,cscre02启动子的转录活性明显优于目前植物基因组工程中常用的 camv35s及zmubi1启动子。然后在黄瓜毛状根中进一步验证了cscre02、cscre04、 cscre10启动子的转录功能活性,成功在毛状根中驱动了gfp和gus的转录。最后,构建 cscre02、cscre10启动子驱动的基因编辑表达载体,成功实现了黄瓜内源基因csga20ox01、 csga20ox03的编辑。总的说来,cscre02总体的启动能力更强,尤其是在黄瓜子黄瓜原生质体中,驱动基因转录的活性明显优于其他候选启动子元件,且明显优于目前植物基因组工程中常用的camv 35s及zmubi1启动子。
30.因此,本发明提供了一种新的黄瓜来源的启动子。该启动子的核苷酸序列为如下a)或b) 或c)所示:
31.a)、核苷酸序列如seq id no.1所示的dna分子;
32.b)、与a)限定的核苷酸序列具有90%以上、95%以上、97%以上或者99%以上同源性,且具有启动子功能的dna分子;
33.c)、与a)或b)限定的核苷酸序列能互补配对,且具有启动子功能的dna分子。
34.通过本发明的实例可知,该启动子不仅可高效稳定地在黄瓜中驱动基因表达,还可以在水稻等其他植物种稳定地驱动基因表达。进一步的,该启动子元件可应用于黄瓜基因组编辑。
35.因此可以,用于制备含有上述启动子的基因表达框或者含有上述启动子的重组质粒。并进一步制备含有上述启动子的重组微生物、转基因植物细胞系或转基因动物细胞系。
36.自然的,本领域技术人员可以将上述启动子、表达框或重组质粒用于启动目的基因表达。可以根据具体的使用要求,在微生物、植物细胞或动物细胞中启动目的基因表达。
37.上述植物可为双子叶植物或单子叶植物。进一步的,所述双子叶植物为葫芦科植物。优选的,所述葫芦科植物为黄瓜属植物。进一步的,所述的黄瓜属植物为黄瓜。上述单子叶植物可为禾本科植物。其中,所述禾本科植物可为稻属植物。进一步的,所述的稻属植物可为水稻。
38.使用上述dna分子作为启动子来启动目的基因的表达的方法一般包括上述启动子可操作地连接在待表达的目的基因的上游,启动目的基因的表达的步骤。而如何将启动子可操作地连接在待表达的目的基因的上游则是本领域技术人员根据本领域的已发表文献、教科书、手册等现有技术资料容易实现的。
39.以下通过具体实施例对本发明进行更进一步的说明。
40.实施例1黄瓜候选启动子的挖掘与分析
41.利用黄瓜7天幼苗的子叶构建了rna
‑
seq(3个生物学重复)及atac
‑
seq文库(3个生物学重复)。为了丰富黄瓜不同时期、组织中基因表达情况,在ncbi公共数据库中下载了另外12组rna
‑
seq数据。首先针对rna
‑
seq数据进行分析,原始数据经质控去除低质量reads、去除测序接头流程后,将其比对到黄瓜参考基因组上,评估每个基因的表达情况,计算每个基因在各个样品中的表达量平均值,将表达值排前100位其中方差最小的30个基因取出,挑选出其中的26个基因作为下步重点研究对象。进一步针对atac
‑
seq数据进行分析,首先对 atac
‑
seq文库进行质控,包括去除低质量reads、去除测序接头,之后将其比对回基因组,最后进行call peak步骤鉴定开放染色质区域。开放染色质区域通常是顺势调控元件的富集区域并与调控蛋白结合,和基因表达呈正相关关系。观察到上述26个基因转录起始位置附近几乎都存在开放染色质区域。这些开放染色质区域存在一些重要的组成型顺式调控元件导致这些基因在不同时空中都高表达,而这些区域就可能是需要挖掘的潜在高活性启动子。进一步从中选取了11个基因的开放染色质区域作为候选启动子元件,依次命名为cscre01~cscre11,随后对其转录活性进行比较分析。
42.实施例2黄瓜候选启动子转录活性比较分析
43.为了验证上述11个黄瓜候选启动子元件的转录活性,选择荧光报告载体ptx1101(该载体为gfp荧光报告载体,由来源于花椰菜花叶病毒(camv)的35s启动子启动gfp基因转录,由豌豆核酮糖
‑
1,5
‑
二磷酸羧化酶小亚基(rbcs)e9基因的终止子来终止gfp基因转录)作为骨架载体(如图1所示)。采用含有与骨架载体同源序列的特异性引物从黄瓜基因组dna中分别扩增出cscre01
‑
cscre11候选启动子片段,经胶回收后的片段与骨架载体ptx1101经 asci和sbfi酶切后的片段进行gibson组装,替换原骨架载体上的camv 35s启动子后分别得到11个候选启动子启动的荧光报告载体。
44.引物序列如下表所示:
45.表1
46.pcscre01
‑
f(seq id no.7)cgcccacctgctttttcccggcgcgccaaggtgttgaagaaattacttccaapcscre01
‑
r(seq id no.8)gtgcttggactgggccattcctgcaggcaaaacctgcacaaaacgtgttaaaaatagapcscre02
‑
f(seq id no.9)cgcccacctgctttttcccggcgcgccacgtaatatggtgagtgtgtgapcscre02
‑
r(seq id no.10)gtgcttggactgggccattcctgcaggctgccagataagaaaaagaaaataaacaaacapcscre03
‑
f(seq id no.11)cgcccacctgctttttcccggcgcgcctcccatttaattgccactccapcscre03
‑
r(seq id no.12)gtgcttggactgggccattcctgcagggatcaatactttcaagaagcaaaggcttapcscre04
‑
f(seq id no.13)cgcccacctgctttttcccggcgcgccttgataacccttttgaatgtatgtagapcscre04
‑
r(seq id no.14)gtgcttggactgggccattcctgcaggtttagactgcgcgttcacaaagcapcscre05
‑
f(seq id no.15)cgcccacctgctttttcccggcgcgcctgaatggagcggcaatggapcscre05
‑
r(seq id no.16)gtgcttggactgggccattcctgcagggatgaatcctgcagatagagggapcscre06
‑
f(seq id no.17)cgcccacctgctttttcccggcgcgccactttgtaagacaatccaacggtpcscre06
‑
r(seq id no.18)gtgcttggactgggccattcctgcagggactaaagattgatttcgttcttctacapcscre07
‑
f(seq id no.19)cgcccacctgctttttcccggcgcgccggattaaaaatgtaaaaccgaccatcgpcscre07
‑
r(seq id no.20)gtgcttggactgggccattcctgcagggggtatgaaaaaaactagttgagaagapcscre08
‑
f(seq id no.21)cgcccacctgctttttcccggcgcgccaggtgacttgacacacagttgtpcscre08
‑
r(seq id no.22)gtgcttggactgggccattcctgcaggtgtgtttgaaattccggcgapcscre09
‑
f(seq id no.23)cgcccacctgctttttcccggcgcgcctgcttgtggtgaggtgtctcpcscre09
‑
r(seq id no.24)gtgcttggactgggccattcctgcaggtgtagaggatttagagtttttagggta
pcscre10
‑
f(seq id no.25)cgcccacctgctttttcccggcgcgccggtggaaggatgctatgtttaaaagapcscre10
‑
r(seq id no.26)gtgcttggactgggccattcctgcaggtccggaaaaacttgtgtgattgtgapcscre11
‑
f(seq id no.27)cgcccacctgctttttcccggcgcgcctccgtctatgcaaccctaaaapcscre11
‑
r(seq id no.28)gtgcttggactgggccattcctgcaggcttttctgggttcaacggtga
47.首先将构建好的荧光报告载体依次进行水稻原生质瞬时转化,具体水稻原生质体操作步骤参照tang x,zheng x,qi y,et al.a single transcript crispr
‑
cas9 system for efficientgenome editing in plants.mol plant.2016;9(7):1088
‑
1091中公开报道的实验方法,经黑暗培养48h后,使用倒置荧光显微镜观察绿色荧光蛋白的表达情况,以判断候选启动子转录活性。检测结果如图2所示;经过imagej软件计算相对荧光强度分析的数据,图2对应的相对荧光强度定量分析如图7所示。结果发现:11个候选启动子中有6个在水稻原生质体细胞有效驱动了绿色荧光蛋白的瞬时表达,具有一定的转录功能活性,这6个候选启动子编号分别为 cscre02(seq id no.1)、cscre04(seq id no.2)、cscre07(seq id no.3)、cscre09 (seq id no.4)、cscre10(seq id no.5)、cscre11(seq id no.6)。
48.进一步的,为验证这11个候选启动子在黄瓜中的转录活性,将上述11个构建好的荧光报告载体依次进行黄瓜原生质体瞬时转化,经经黑暗培养48h后,使用倒置荧光显微镜观察绿色荧光蛋白的表达情况,以判断候选启动子转录活性。检测结果如图3所示,图3对应的相对荧光强度定量分析如图8所示。结果表明:在黄瓜原生质体中,11个候选启动子中有4 个成功驱动了绿色荧光蛋白的瞬时表达,这4个启动子编号分别为cscre02、cscre04、 cscre10、cscre11。其中,cscre02启动子的转录活性明显优于其他候选启动子元件,且明显优于目前植物基因组工程中常用的camv 35s及zmubi1启动子。
49.cscre02的核苷酸序列如下所示(seq id no.1):
50.acgtaatatggtgagtgtgtgaataaataaatatctattccccacctttgtttataaaaagaaaagaaaagaaaaaggttttaaaatattg gaaatgtattattattattgaggaaattgcgtgatttgggcatcgttcttatcgcttccaatagaggagagggccgtttccctccaccact atttccaacttgccttttgtacctttccacacctatattacacgtgtctttaatctaatggaccttcattctactatatttttaccccaaa tgacgatattctccttctcatccacatataaatatacctctccgctcccttcatttcattcacttttcctctaattcttctctgtatctgt catattcgtttctttcttccaaggttcggcctcctctttcttttttctttcttttgccttctttctttttcatttctttgggtttttgttc atctaatttgattcgtttatttttgtgttatatggtattgtgatatttgttgaattgagatgttttagggtttcgatttaggttttatttc ttatcatcgcgtgatttacaggttgttgtgattttggagaaaggggttcttatttgtttgtttattttctttttcttatctggcag。
51.cscre04的核苷酸序列如下所示(seq id no.2):
52.ttgataacccttttgaatgtatgtagataaaagattaatacagtaatgtatatgtatgaatttcctagaacaagtgtaatttgaggaatat tgatatactaattaattaattaacaaattaatttgaggaagggggtatctctatccgtctctctccggctttttagcttcttttgttttga caatttcaacgctctcggatgagctacagctatgttggctactattgggccgtgtattctgtttgggcctgtccaaacaggtaatccaagc ccacatctgaagcttcaataaaatcccaatttttgagtgctttcccaaaccctagaacatccctgcgcagtgaagaacgcccgtttcgatct ggtctagaatctctccccctcaactttcctgcttttcttcttgtttgattttctttaatttctaatacttcgtgctttctgttgatcatctgcgtt tcttcttccctgatttcgaaactgctttgtgaacgcgcagtctaaa。
53.cscre07的核苷酸序列如下所示(seq id no.3):
54.ggattaaaaatgtaaaaccgaccatcggtctcctatggcctcatagaacgtgagaatcttatacataa
cgtacagcttccaatatattcaa taatatgcccttccaccgactctctcctttcaaaaaccgaaaccaaaacccaataccctaaacacccttcattgggccccactcttgccga ccttcaacgttttcatccaatcaataccgacaccaccggctccacttctatcatcttcctccacgttgcactctctcattggtccatccag aaccttcgtacaccctctcttactttcttcttttgactacagtccgcgactacccatatctcccccactcgctcacattccccgccacgtc gagtaaactcacaacctgtcagcgagtggtccatgcgtgggaaatccgcgtcggggattcagatctgacgaaaaaggcaaaaaagaagaaa tgatttatttttcgctttcttcttttattttatttattttaataaagaaattaaatgcttttctttccattgaatccaccacgtcggttct ctgccagaacaaataaataaattaatattgtgttaggatttttgatttggccaatttttggcgttacgatcaggatgaggcgcgttggata cgtgtggcgcgttttctttgtacctataaaatggtacacttggagtcccactaagcaacttaactaagtctattcacaataatacacaaag cagcttattcattctcaacacctcactagtaactgcccagtatctctctcttttttttctgattcatcttctcaactagtttttttcatac cc。
55.cscre09的核苷酸序列如下所示(seq id no.4):
56.tgcttgtggtgaggtgtctctagggctcacttcaagtttttgattttataatttaaagggaaaatagtaatttgaataaacaacaatgaat agtaaaaatgaaaacataagaaggaaggggaccattttccaaaatttctcaaacaaaaacaaaacaaacaataactccatcaagagccgtt ggtggcgggaactgggtcccattgctagctcaatcaagctcattgggcggttcataattaataatcttaatctcatttcccccccttctaa tttcatttatcattatacacttcaacactaaaaaaaactaaattaaattttaaaaaaaattataatcatcactcaaatccatctccttcct tctggtactttcttccccactccttaaatacccttttcttcccccttcttcttcctcactactactctcccactccaaatatttctcatcc ccaaattctccataccctaaaaactctaaatcctctaca。
57.cscre10的核苷酸序列如下所示(seq id no.5):
58.ggtggaaggatgctatgtttaaaagaaagatgaaatagagaaatttgtagtaaaatggaataatgttataatttggaaatatttgtaaata aaagtaaagagtgaaataaagatgaaaataggaattaaagagtagaaagaaagaaaaaggtggaaaaatagatagttatatatattgataa tggaaggaggaagtaaagatgatatttgtacagcgctgcgacattgttttgtccacaaacatatccaggcaaaccaatcacgtaacctcca cgtggatgtccaacccctccatttcctctattaccccttaaaaattaaaatacaaatcctgaacttatcacaatcacttcaccatctggtc cacatggacggtgggcgcctgactcccattctccactctctacctctcctttgtggctaatctttcgccacgtgccccaataattgtacgc caacccgaccgccccttctgtcattttccacctattctccagaaaattctacaaaaatcattggtcggttttctctatttttatttttctt tctttttaactgcctgggtccctttggtttttcactaaattcactctacattgctatataacctactccttctcttcactttcctcactac tactctactacatacacaaccgccctcttccgctctcaactgctctcacaatcacacaagtttttccgga。
59.cscre11的核苷酸序列如下所示(seq id no.6):
60.tccgtctatgcaaccctaaaatttttggaaaattttaattttttagagaatctcaatggtcgatcttacctaaaatcaatgatcaatcgag ataaatattcttaccgtgctttgagaaatgtgttgttttagacatgaaaaccagaattttgtcgattttcccaaattcttcatatttgtct tcttaatttaatatactttttatttgacagtatgattgaattgtaatacgtgcaggcacatttttacggacttctgatgagacgtggcctt caattgggccagttatgcatgttattctaaccatggcccacttttattcatgattgggccttcgtgggccagggcaagcccaactgtagga cccaatcgtattattctaaagtaaataattattcgtgatagcgtgagtatttcagtcagtcgtggcgaggcgagaaaggagtggaggaaga gagagattgagagcggttcgagatctgatctaatcggagaccttcttcttcatcttcaccgttgaacccagaaaag。
61.实施例3黄瓜毛状根转化验证候选启动子的转录活性
62.上述实施例中,成功在细胞水平验证了11个候选启动子的转录功能活性,为进一步验证候选启动子在植物中的功能,选取在水稻和黄瓜原生质体中均存在转录活性的cscre02、 cscre10、cscre11启动子元件,考虑到4、10、11在黄瓜中表达的情况相差不大,因此毛状根转化验证活性时去掉了4。通过替换构建的植物表达载体plb42上的camv 35s启动子元件,分别得到由cscre02、cscre10、cscre11启动子驱动β
‑
葡萄糖苷酸酶基因(gus) 与绿色荧光蛋白基因(gfp)表达的植物双元表达载体。
63.具体操作为以黄瓜基因组dna为模板,通过使用含有与骨架载体同源序列的特异性引物分别扩增出cscre02、cscre10、cscre11启动子片段,经胶回收后的片段与载体plb42 经avrii和psti酶切后的片段进行gibson组装,替换原骨架载体上的zmubi1启动子后分别得到由cscre02、cscre10、cscre11启动子驱动β
‑
葡萄糖苷酸酶基因(gus)与绿色荧光蛋白基因(gfp)表达的植物双元表达载体plb_cscre02、plb_cscre10、plb_cscre11。
64.将上述植物双元表达载体经冻融法导入农杆菌k599中,然后进行黄瓜毛状根转化。具体操作可参考fan y,xu f,zhou h,et al.a fast,simple,high efficient and one
‑
step generation ofcomposite cucumber plants with transgenic roots by agrobacterium rhizogenes
‑
mediatedtransformation.plant cell,tissue and organ culture(pctoc).2020;141(1):207
‑
216中公开报道的实验方法。经培养3周后,检测黄瓜毛状根中的绿色荧光蛋白蛋白表达情况。通过手持荧光检测设备观察发现,cscre02、cscre10、cscre11启动子在黄瓜毛状根中仍具有较高的转录活性,如图4所示,证明cscre02、cscre10、cscre11启动子具有基因组工程应用潜力。
65.通过gus组织化学染色对转化所得到的黄瓜毛状根进行检测,检测结果如图5所示,相较于野生型黄瓜毛状根组织没有颜色变化,转入plb_cscre02、plb_cscre10、 plb_cscre11载体的黄瓜毛状根被染为蓝色如图5所示,证明cscre02、cscre10、cscre11 启动子可以在黄瓜毛状根中启动gus基因稳定表达。
66.实施例4 cscre02、cscre10启动子在基因组编辑上的应用
67.进一步将挖掘所得到的的黄瓜内源启动子cscre02、cscre10应用于黄瓜基因组编辑中,通过替换构建的stu
‑
cas9植物基因组编辑骨架载体ptx1129上的camv 35s启动子为 cscre02、cscre10启动子,得到由cscre02、cscre10驱动cas9和sgrna共同转录表达的黄瓜基因组编辑骨架载体。
68.针对黄瓜csga20ox01、csga20ox03基因分别设计编辑位点csga20ox01
‑
sgrna01 (5
’‑
atccggacaagtcgattaat
‑3’
seq id no.29)、csga20ox03
‑
sgrna01(5
’‑
ctcatgta aacttccatgga
‑3’
seq id no.30),通过合成引物克隆至黄瓜编辑骨架载体,得到针对 csga20ox01
‑
sgrna01、csga20ox03
‑
sgrna01的定向编辑表达载体。
69.将上述定向编辑表达载体经农杆菌介导的黄瓜毛状根转化转入黄瓜毛状根,得到转基因的黄瓜毛状根材料。接下来,针对csga20ox1
‑
sgrna01和csga20ox3
‑
sgrna01位点进行片段扩增和酶切检测。野生型黄瓜csga20ox1基因的pcr扩增产物经过vspi酶切后,会呈现大小约为550bp的凝胶电泳条带。而如果黄瓜基因组编辑系统成功工作,那经过编辑的 csga20ox1基因,会因限制性内切酶vspi的识别位点附近,产生插入或缺失突变,导致识别位点改变而丧失切割能力。最终经过编辑的csga20ox1基因相较于野生型,会于651bp 处产
生因vspi无法特异性切割而留下的抗性条带。而野生型的黄瓜csga20ox3基因的pcr 扩增产物经过ncoi酶切后,会呈现大小约为484bp的凝胶电泳条带。同样,经过编辑的 csga20ox3基因,会因限制性内切酶ncoi的识别位点附近,产生插入或缺失突变,导致识别位点改变而丧失切割能力。最终经过编辑的csga20ox3基因相较于野生型csga20ox3基因,会于670bp处产生因ncoi无法特异性切割而留下的抗性条带。具体结果如图6所示
70.随后,切胶回收了分别于651bp和670bp处产生的抗性条带,分别使用特异性检测引物扩增富集,对产物进行sanger测序。如图6结果所示:csga20ox1和csga20ox3基因于cas9 切割位置处(pam位点上游第3个碱基处)开始出现突变。
71.综合上述各实施例结果可见:本发明中挖掘所得到的黄瓜内源启动子不仅可高效稳定地在黄瓜中驱动基因表达,还可以在水稻等其他植物种稳定地驱动基因表达。进一步的,该启动子元件可应用于黄瓜基因组编辑,取得好的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1