一种液态稳定的5’-核苷酸酶校准品及检测试剂盒及其应用的制作方法
一种液态稳定的5
’‑
核苷酸酶校准品及检测试剂盒及其应用
技术领域
1.本发明属于体外诊断技术领域,涉及一种液态稳定的5
’‑
核苷酸酶校准品和检测试剂盒及其应用。
背景技术:
[0002]5’‑
核苷酸酶(5
’‑
nucleotidase,5
’‑
nt)是催化核苷酸分子中磷酸键水解的一种特异性磷酸酶,在细胞生长、运动、纤维蛋白合成、神经传递、提高表皮或内皮屏障功能及淋巴细胞的黏附、再循环、免疫应答等方面均发挥重要作用。人血清5
’‑
核苷酸酶作为一种糖蛋白,由两个分子量为70000d的亚基组成,是含有一个疏水结构的二聚体。最适ph为6.6
‑
7.0,受mg
2+
或mn
2+
激活,受ni
2+
抑制。
[0003]5’‑
核苷酸酶广泛存在于组织的细胞膜上,除存在于肝胆外,还常见于脑、心、肺、小肠、肾小管等。但释放入血循环中的5
’‑
nt仅来源于肝胆组织:在肝内5
’‑
nt分布于胆小管、肝窦和kupfer细胞,当肝细胞受损或肝内外梗阻时,肝细胞内质网的膜结构破坏明显,线粒体发生退行性改变甚至消失,合成机制发生障碍,肝细胞受到损伤,5
’‑
nt才释放入血液中,导致血清5
’‑
nt水平升高。
[0004]
由于血清中的5
’‑
核苷酸酶容易发生衰减无法进行长期保存,所以市面上所售的校准品均为冻干剂型。因此发明一种液态稳定的5
’‑
核苷酸酶校准品,将具有非常好的临床实用性,也非常利于临床的推广发展。同时5
’‑
核苷酸酶校准品的配方也可适用于液体状态下不稳定的其它酶类。
[0005]
目前临床上对于5
’‑
nt的测定多采用酶法,该方法简便快捷且结果相对可靠,对肝胆疾病的诊断具有较高的应用价值。但是该方法存在所使用的嘌呤核苷磷酸化酶和黄嘌呤氧化酶稳定性较差,同时还存在血清中的alp会对整体反应产生干扰现象。另一方面目前现有5
’‑
核苷酸酶校准品及其检测试剂盒的有效期一般为12个月,有效期相对不够长。
技术实现要素:
[0006]
为了解决现有技术存在的不足,本发明的目的是提供一种首创的液态稳定5
’‑
核苷酸酶校准品,突破了现有5
’‑
核苷酸酶校准品均为冻干剂型且效期较短的技术壁垒,同时也避免了在使用过程中需要溶解导致人为误差被放大的问题。
[0007]
本发明还提供了一种稳定性好、抗干扰能力强、重复性好,能真实反映5
’‑
核苷酸酶活性并能用于全自动生化分析仪的检测试剂盒。
[0008]
本发明提供的所述液态稳定5
’‑
核苷酸酶校准品是由缓冲液、稳定剂、防腐剂和5
’‑
核苷酸酶组成。
[0009]
所述缓冲液包括tris
‑
hcl缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、hepes缓冲液、pipes缓冲液、mops缓冲液、bes缓冲液中的一种或者多种的组合;优选地,为tris
‑
hcl缓冲液。
[0010]
所述缓冲液的摩尔浓度为10
‑
100mmol/l,ph为6.0
‑
9.0;优选地,所述缓冲液的摩
尔浓度为10
‑
50mmol/l,ph为7.50。
[0011]
所述稳定剂包括牛血清白蛋白(bsa)、甘油、海藻糖、prionex中的一种或多种;优选地,为prionex。
[0012]
所述稳定剂的质量浓度为0.1%
‑
20.0%;优选地,为1.0%
‑
10.0%。
[0013]
所述稳定剂主要可以使液态5
’‑
核苷酸酶校准品在保存期内性能保持稳定,保证各组分中酶的性能稳定。
[0014]
所述防腐剂包括nan3(叠氮化钠)、proclin 200、proclin 950、krovin100、krovin 500、krovin 750、尼泊金乙酯中的一种或多种;优选地,为nan3(叠氮化钠)。
[0015]
所述防腐剂的质量浓度为0.01%
‑
0.1%;优选地,为0.05%
‑
0.1%。
[0016]
所述校准品中,所述缓冲液、稳定剂、防腐剂、5
’‑
核苷酸酶的质量比为(1.21
‑
12.11):(1.0
‑
200.0):(0.1
‑
1.0):(0.01
‑
0.05);优选地,为2.42:10.0:1.0:0.025。
[0017]
本发明还提供了所述液态稳定5
’‑
核苷酸酶校准品在科学研究以及临床检验中的应用。
[0018]
本发明还提供了一种5
’‑
核苷酸酶检测试剂盒,包括5
’‑
核苷酸酶r1试剂、5
’‑
核苷酸酶r2试剂。
[0019]
本发明所述试剂盒是根据目前市售的5
’‑
核苷酸酶检测试剂盒进行优化改良,主要筛选了稳定剂的种类及使用浓度,同时也针对血清中潜在的alp干扰,筛选5
’‑
核苷酸酶r2试剂中的抗干扰物质及浓度,以达到提升试剂效期稳定性及抗alp干扰的目的。
[0020]
其中,所述5
’‑
核苷酸酶r1试剂为由第一缓冲液、稳定剂、第一防腐剂、4
‑
氨基安替比林(4
‑
aa)、酶激活剂、嘌呤核苷磷酸化酶(pnp)、黄嘌呤氧化酶(xod)和过氧化物酶(pod)组成的酶反应系统。
[0021]
其中,所述5
’‑
核苷酸酶r2试剂为由第二缓冲液、第二防腐剂、肌苷
‑5’‑
磷酸二钠盐(5
’‑
imp,2na)、β
‑
甘油磷酸钠和trinder显色底物组成的显色系统。
[0022]
所述r1试剂中的第一缓冲液是tris
‑
hcl缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、hepes缓冲液、pipes缓冲液、mops缓冲液、bes缓冲液中的一种或者多种的组合;优选地,为tris
‑
hcl缓冲液。
[0023]
所述r2试剂中的第二缓冲液是tris
‑
hcl缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、hepes缓冲液、pipes缓冲液、mops缓冲液、bes缓冲液中的一种或者多种的组合;优选地,为磷酸盐缓冲液。
[0024]
所述第一缓冲液或第二缓冲液的浓度均为10
‑
100mmol/l,ph为6.0
‑
9.0;所述第一缓冲液的优选摩尔浓度为10
‑
50mmol/l,所述第二缓冲液的优选摩尔浓度为50
‑
100mmol/l,优选ph均为7.50。
[0025]
上述方案中,所述第一、第二缓冲液的主要作用是保证在配制及使用试剂盒的过程中可以使ph值保持在一定的范围,使整个组分保持稳定,同时也给整个酶促反应提供较为适宜的ph值及较为适宜的离子强度。
[0026]
所述r1试剂中的酶激活剂在5
’‑
核苷酸酶测定过程中起到激活促进的作用,为mgcl2、mgso4、mncl2、cacl2、caso4中的一种或多种,优选地,为mgcl2;所述酶激活剂在所述r1试剂中的摩尔浓度为10
‑
100mmol/l,优选地,为10
‑
40mmol/l。
[0027]
所述稳定剂为牛血清白蛋白(bsa)、甘油、海藻糖、prionex中的一种或多种,优选
地,为牛血清白蛋白(bsa);所述稳定剂在所述5
’‑
核苷酸酶r1试剂中的质量浓度为0.1%
‑
10.0%,优选地,为0.1%
‑
1.0%。
[0028]
所述稳定剂主要可以使5
’‑
核苷酸酶检测试剂盒中的试剂r1在保存期内性能保持稳定,保证各组分中酶的性能稳定。
[0029]
所述第一防腐剂或第二防腐剂均为nan3(叠氮化钠)、proclin 200、krovin100、krovin 500、krovin 750、尼泊金乙酯中的一种或多种;优选地,第一防腐剂或第二防腐剂均为proclin 200;
[0030]
所述第一防腐剂在5
’‑
核苷酸酶r1试剂中质量浓度为0.01%
‑
0.1%,优选地,为0.05%
‑
0.1%;
[0031]
所述第二防腐剂在5
’‑
核苷酸酶r2试剂中质量浓度为0.01%
‑
0.1%,优选地,为0.05%
‑
0.1%。
[0032]
所述trinder显色底物为n
‑
乙基
‑
n
‑
(2
‑
羟基
‑3‑
磺丙基)
‑3‑
甲基苯胺钠盐(toos)、n
‑
乙基
‑
n
‑
(3
‑
磺丙基)
‑3‑
甲氧基苯胺钠盐(adps)、n,n
‑
二(4
‑
磺丁基)
‑3‑
甲基苯胺二钠盐(todb)、n
‑
乙基
‑
n
‑
(3
‑
磺丙基)
‑3‑
甲基苯胺钠盐(tops)中的一种,优选地,为n
‑
乙基
‑
n
‑
(2
‑
羟基
‑3‑
磺丙基)
‑3‑
甲基苯胺钠盐(toos);所述trinder显色底物在5
’‑
核苷酸酶r2试剂中摩尔浓度为1
‑
10mmol/l,优选地,为1
‑
5mmol/l。
[0033]
所述r1试剂中4
‑
氨基安替比林(4
‑
aa)摩尔浓度为0.1
‑
10mmol/l,优选地,为0.5
‑
5.0mmol/l;嘌呤核苷磷酸化酶(pnp)的酶活浓度为0.1
‑
5.0ku/l,优选地,为0.1
‑
2.0ku/l;黄嘌呤氧化酶(xod)的酶活浓度为0.1
‑
10ku/l,优选地,为0.2
‑
2.0ku/l;过氧化物酶(pod)的酶活浓度为1.0
‑
10ku/l,优选地,为1.0
‑
5.0ku/l;
[0034]
所述r2试剂中可以提升试剂抗血清alp干扰的物质为β
‑
甘油磷酸钠,所使用的摩尔浓度为50.0
‑
200.0mmol/l,优选地,为100.0
‑
200.0mmol/l。
[0035]
所述r2试剂中肌苷
‑5’‑
磷酸二钠盐的摩尔浓度为0.5
‑
5.0mmol/l,优选地,为1.0
‑
4.0mmol/l。
[0036]
本发明还提供了上述试剂盒在测定5
’‑
核苷酸酶中的应用。
[0037]
本发明与现有试剂相比具有如下有益效果:
[0038]
本发明中特别针对5
’‑
核苷酸酶,筛选了不同种类的稳定剂,调节各组分的浓度及ph值,在最优条件下还对防腐剂进行了筛选,进一步提升5
’‑
核苷酸酶校准品在液体状态下稳定性,使其在液体状态下可以稳定放置18个月,克服了5
’‑
核苷酸酶在液体状态下稳定性较差的问题,也是目前市售校准品中唯一液态稳定的5
’‑
核苷酸酶校准品。具有非常好的临床实用性,避免了在溶解冻干剂型校准品时出现的人为误差,增加了后续5
’‑
核苷酸酶测定的准确性,也非常利于临床的推广发展。
[0039]
本发明5
’‑
核苷酸酶检测试剂盒中,通过筛选嘌呤核苷磷酸化酶(pnp)以及黄嘌呤氧化酶(xod)的稳定剂,大大提升了试剂盒稳定性,其检测试剂盒可稳定24个月;同时试剂r2中添加的β
‑
甘油磷酸钠能够在反应过程中有效抵抗样本中携带alp的干扰。该方法能够满足临床实验应用需要的同时,具有选择性好、抗干扰能力强等特点。
附图说明
[0040]
图1是本发明实施例1中5
’‑
核苷酸酶的测定方法过程图。
[0041]
图2是本发明实施例1中不同稳定剂对5
’‑
核苷酸酶溶液热稳定性的影响测试图。
[0042]
图3是本发明实施例2中5
’‑
核苷酸酶液态校准品的热稳定性测试图。
[0043]
图4是本发明实施例3中5
’‑
核苷酸酶检测试剂盒的抗alp干扰性能测试图。
[0044]
图5是本发明实施例4中5
’‑
核苷酸酶液态校准品的效期稳定性测试图。
[0045]
图6是本发明实施例4中5
’‑
核苷酸酶临床检测试剂盒的线性测定结果图。
[0046]
图7是本发明实施例4中5
’‑
核苷酸酶测定试剂盒的效期稳定性测试图。
[0047]
图8是本发明实施例5中本发明与市售5
’‑
核苷酸酶检测试剂盒线性回归分析结果图。
具体实施方式
[0048]
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
[0049]
实施例1:液态稳定5
’‑
核苷酸酶校准品稳定剂的筛选
[0050]
1.1、液态稳定5
’‑
核苷酸酶溶液的制备:
[0051]
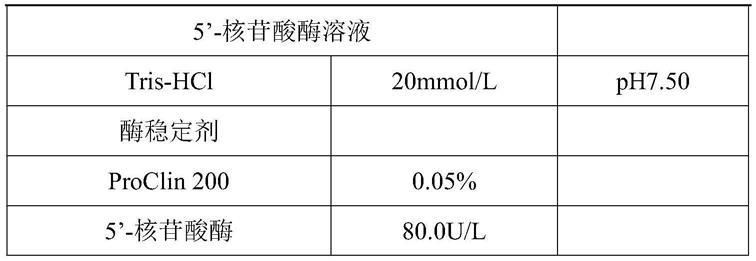
表1
[0052][0053]
下列物质1)~4)用作5
’‑
核苷酸酶溶液的稳定剂
[0054]
1)0.5%、1.0%、2.0%prionex
[0055]
2)1.0%、5.0%、10.0%甘油
[0056]
3)5.0%、10.0%、20.0%海藻糖
[0057]
4)0.5%、1.0%、2.0%牛血清白蛋白(bsa)
[0058]
1.2、5
’‑
核苷酸酶的测定方法如下:
[0059]5’‑
核苷酸酶的测试条件如下:
[0060]
表2
[0061]
波长546nm比色杯光径1.0cm温度37℃分析类型速率法检测扣除试剂空白
[0062]
使用的试剂及样品如下:
[0063]
r1(试剂1)(见表4)
[0064]
r2(试剂2)(见表5)
[0065]
s(校准品或样本)(见表1或3)
[0066]
仪器设备的操作流程如图1所示;
[0067]
校准程序如下:
[0068]
按照校准品的使用要求,用单水平校准品,并以9g/l氯化钠溶液为空白进行校准测定,计算空白样本及校准品的吸光度变化率并绘制校准曲线。
[0069]
实验结果的计算:
[0070]
在完成校准测试后,将待测样本的吸光度变化率带入到校准曲线中,计算出该样本的浓度。如计算结果在可报告范围内,即得到可靠的检测结果。
[0071]
1.3、不同稳定剂对5
’‑
核苷酸酶溶液热稳定性的影响
[0072]
如图2所示,不添加稳定剂的液态5
’‑
核苷酸酶溶液在37℃放置14天后,活性损失很快,仅剩余9.7%的相对活性,而添加稳定剂(如1.0%prionex、10%甘油、10%海藻糖及1.0%bsa等)的溶液其酶活性损失较少剩余活性均大于70%以上,可显著增加5
’‑
核苷酸酶在溶液中的稳定性,预期可以对于液态酶溶液的稳定性起到保存作用。
[0073]
实施例2:液态稳定5
’‑
核苷酸酶校准品的制备
[0074]
1.1、5
’‑
核苷酸酶校准品的制备:
[0075]
表3
[0076][0077]
1.2、5
’‑
核苷酸酶的测定方法同本发明实施例1。
[0078]
1.3、5
’‑
核苷酸酶液态校准品热稳定性:
[0079]
将配制完成的液态5
’‑
核苷酸酶校准品放至37℃贮存,在第0、4、7、14、21、28天后取出使用市售的5
’‑
核苷酸酶检测试剂盒进行测试,每个时间点的测定值均与37℃0天进行比较,记录每次测定值,具体结果如图3所示。
[0080]
图3结果表明,本发明液态5
’‑
核苷酸酶校准品在37℃加速28天后其酶活性损失均小于
±
3%,热稳定性较好。
[0081]
实施例3:5
’‑
核苷酸酶检测试剂盒抗alp干扰性能的优化
[0082]
1.1、5
’‑
核苷酸酶检测试剂盒的制备
[0083]
表4
[0084][0085][0086]
表5
[0087][0088]
1.2、5
’‑
核苷酸酶的测定方法同本发明实施例1。
[0089]
1.3、碱性磷酸酶(alp)干扰样本的制备:
[0090]
(1)吸取60μl定值alp纯品(已知浓度为15000u/l)加入至540μl的临床血清中,混匀后作为干扰样本;
[0091]
(2)吸取60μl生理盐水(0.9%nacl)加入至540μl的临床血清中,混匀后作为空白样本;
[0092]
(3)按照以下比例进行混匀,混匀后得到alp干扰样本,具体稀释比例操作方法如下表所示:
[0093]
表6
[0094]
alp浓度(u/l)空白样本(μl)干扰样本(μl)0.0200.00.0300.0160.040.0600.0120.080.0900.080.0120.0
1200.040.0160.01500.00.0200.0
[0095]
1.4、5
’‑
核苷酸酶检测试剂盒的抗alp干扰性能测试
[0096]
使用本发明的5
’‑
核苷酸酶检测试剂盒,分别测试现场准备完毕的alp干扰样本,记录测定值。将干扰样本所得到的测定值与空白样本的测定值进行比较,具体结果如图4所示。
[0097]
图4结果表明,使用本发明的5
’‑
核苷酸酶检测试剂盒测定alp浓度在1500u/l的血清样本其偏差为+5.9%,偏差小于
±
10%的要求,说明本发明的5
’‑
核苷酸酶检测试剂盒的抗alp干扰效果优于市售的其他厂家。
[0098]
实施例4:液态稳定5
’‑
核苷酸酶校准品及检测试剂盒的分析性能
[0099]
1.1、5
’‑
核苷酸酶液态校准品及检测试剂盒的配制
[0100]
1)5
’‑
核苷酸酶校准品:配方同本发明实施例2。
[0101]
2)5
’‑
核苷酸酶检测试剂盒:配方同本发明实施例3。
[0102]
1.2、5
’‑
核苷酸酶的测定方法同本发明实施例1。
[0103]
1.3、液态5
’‑
核苷酸酶校准品的效期稳定性
[0104]
校准品在2
‑
8℃放置,在放置的第3、6、9、12、18个月后取出,使用本发明5
’‑
核苷酸酶检测试剂盒进行测试,具体结果如图5所示。
[0105]
图5结果表明,5
’‑
核苷酸酶液态校准品在2
‑
8℃放置3、6、9、12、18个月后,其测定值的变化相对偏差均不超过
±
3%,液态校准品的效期稳定性可达18个月。
[0106]
1.4、5
’‑
核苷酸酶检测试剂盒的分析性能
[0107]
1.4.1、重复性
[0108]
在相同条件下,取定值为10
±
4.0u/l及30.0
±
6.0u/l的血清样本进行重复性测试,分别计算平均值、标准差(sd)以及变异系数(cv)。具体结果如下表所示:
[0109]
表7
[0110]
测试编号水平1(g/l)水平2(g/l)16.124.526.224.536.124.446.124.256.024.466.124.375.924.485.824.296.024.5106.124.2平均值6.024.4sd0.120.13cv1.9%0.5%
[0111]
本发明5
’‑
核苷酸酶检测试剂盒测定浓度约为6.0u/l以及24.0u/l的样本时,计算
得到cv为1.9%以及0.5%,说明本发明5
’‑
核苷酸酶检测试剂盒的精密度良好。
[0112]
1.4.2、线性
[0113]
取定值为300u/l以上的血清样本,按照1:2、1:4、1:8、1:16、1:32、1:64、1:128的比例稀释后再进行测试,结果如图6所示。
[0114]
图6结果表明,本发明5
’‑
核苷酸酶检测试剂盒的线性范围为2.5
‑
334.4u/l,相关系数r=0.999,10.0u/l以下浓度的样本测定值偏差均小于
±
1.0u/l,10.0u/l以上浓度的样本测定值偏差均小于
±
10.0%,线性结果良好。
[0115]
1.4.3、试剂盒的效期稳定性
[0116]
试剂在2
‑
8℃放置,在第6、12、15、18、21、24个月取出测定浓度在60.0
±
6.0u/l的血清样本,计算60.0u/l浓度下的吸光度变化率,每次所得出的吸光度变化率均与0个月进行比较,计算吸光度变化率的相对偏差,具体结果如图7所示。
[0117]
图7结果表明,计算吸光度变化率与0个月的吸光度变化率的相对偏差均不超过
±
10%,说明本发明5
’‑
核苷酸酶检测试剂盒在2
‑
8℃的稳定性可达24个月。
[0118]
实施例5:本发明液态稳定5
’‑
核苷酸酶及检测试剂盒与市售5
’‑
核苷酸酶检测试剂盒进行方法学比对测试
[0119]
1.1、5
’‑
核苷酸酶校准品及检测试剂盒的配制
[0120]5’‑
核苷酸酶校准品:配方同本发明实施例2。
[0121]5’‑
核苷酸酶检测试剂盒:配方同本发明实施例3。
[0122]
1.2、5
’‑
核苷酸酶的测定方法如下:
[0123]
1.2.1、液态稳定5
’‑
核苷酸酶校准品及检测试剂盒的测定方法:
[0124]
1)设置测定参数:同本发明实施例1的测定参数。
[0125]
2)使用本发明液态5
’‑
核苷酸酶校准品对本发明5
’‑
核苷酸酶检测试剂盒进行校准测试。
[0126]
1.2.2、市售5
’‑
核苷酸酶检测试剂盒的测定方法:
[0127]
1)设置测定参数:同本发明实施例1的测定参数。
[0128]
2)使用市售5
’‑
核苷酸酶校准品对市售5
’‑
核苷酸酶检测试剂盒进行校准测试。
[0129]
1.3、方法学比对方案
[0130]
(1)挑选一批覆盖线性范围的不同浓度的血清样本(本次为53例样本);
[0131]
(2)使用已完成校准测试的本发明试剂与市售试剂同时对样本进行测试;
[0132]
(3)根据所得结果作图,进行线性回归分析;
[0133]
(4)根据所得结果进行一致性kappa分析,计算公式如下:
[0134]
表8
[0135][0136]
[0137]
kappa系数计算公式如下:
[0138]
kappa=(p
a
‑
p
e
)/(1
‑
p
e
)
[0139]
其中,p
a
为实际一致率,p
e
为理论一致率。
[0140]
p
a
=(a+d)/(a+b+c+d)
[0141]
p
e
=(a+b)(a+c)+(c+d)(b+d)/(a+b+c+d)2[0142]
1.4、方法学比对结果
[0143]
本发明与市售5
’‑
核苷酸酶检测试剂盒测定结果和线性回归分析结果如图8所示:r=0.9999,斜率为0.95,相关性良好。
[0144]
使用本发明与市售5
’‑
核苷酸酶检测试剂盒测定结果,对样本的阴阳性进行判定,根据各自的判定结果进行kappa检验。如下表所示,统计分析后的kappa值为0.89。当kappa系数≥0.75,即认为高度一致。因此本发明(德赛)的5
’‑
核苷酸酶检测试剂盒与市售5
’‑
核苷酸酶检测试剂盒所测结果高度一致,两系统等效。
[0145]
表9
[0146][0147]
综上所述,通过筛选特殊的酶稳定剂以及防腐剂有效提高了5
’‑
核苷酸酶校准品在液体状态下的稳定性,改善了在溶解冻干剂型校准品时会出现的人为误差,增加了后续5
’‑
核苷酸酶测定的准确性。与此同时调整检测试剂盒中酶的稳定剂和使用浓度,克服了目前市售的5
’‑
核苷酸酶检测试剂盒效期相对短的问题。通过对抗干扰物质的筛选,克服了部分市售的检测试剂盒抵抗alp干扰能力差的问题。在能够满足临床应用需要的同时也利于临床的推广。
[0148]
本发明的保护内容不局限于以上实施例。在不背离本发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1