CRIg功能区蛋白变体及其应用的制作方法
crig功能区蛋白变体及其应用
技术领域
1.本发明涉及生物技术和生物医药领域,更具体地说,本发明涉及crig功能区蛋白变体及其应用。
背景技术:
2.补体系统是固有免疫系统的重要组成部分,也是获得性免疫的重要调节者,在清除病原体和体内废物方面发挥这重要的免疫监视和组织自稳作用。补体系统是由正常情况下以无活性的酶原形式存在的一系列血清糖蛋白构成的复杂酶级联,其主要通过三条途径激活:由抗原抗体复合物激活的经典途径、自动激活或通过补体识别外源物表面结构介导的替补(旁路)途径、以及主要由微生物表明多糖结构介导的凝集素途径。它们在c3水平合并,其中两种类似的c3转化酶将c3切割成c3a和c3b。
3.虽然补体系统发挥着重要的免疫监视作用,但越来越多的研究发现,人体许多疾病被证实与补体的过度激活有关,因此,以补体系统为治疗靶点的药物研发,包括补体系统抑制剂受到重视。首个补体特异性抑制剂依库珠单抗(eculizumab,商品名soliris)为一种阻断补体终末阶段成分c5激活的单抗,其临床上获得了巨大的成功。但是,依库珠单抗无法阻止补体更上游的c3成分的激活,使得补体仍然被激活,并产生致病效应。补体c3抑制剂比阻止更下游的补体激活(例如依库珠单抗阻止c5的激活)可能是一种更有效更全面的治疗策略。因此,研发更优的补体激活的药物仍然存在巨大的临床需求。
4.crig(也称vsig4,或z39ig)是一种仅仅表达于组织驻留的巨噬细胞(如肝脏库否氏细胞)表面的ig超家族补体受体,在发挥c3蛋白质的补体受体功能之外,通过结合c3b及抑制c3和c5的蛋白水解活化,从而在补体级联反应的早期产生抑制作用——这种抑制作用针对补体的替补激活途经。crig主要与c3b的β链结合,两者的接触面较大,c3的mg3、mg4、mg5、mg6和lnk结构域都与crig相互作用,其中mg3和mg6贡献最大,分别占总接触界面的30%和40%。
5.已有研究证明,crig融合蛋白通过对补体的抑制,可有效治疗多种疾病,如小鼠关节炎,但由于crig对补体的抑制活性较弱,因此,亟需经过研究来进一步增强它的补体抑制活性,以便于未来的临床应用。
技术实现要素:
6.本发明的目的在于提供了一种crig功能区蛋白变体,其相较于天然序列的crig功能区蛋白,所述变体对补体激活的抑制作用更强,可应用于制备靶向抑制补体激活的抑制剂或药物,以解决现有crig对补体的抑制活性弱的问题,提供疗效更高的药物,以应用于多种与补体异常激活有关疾病的预防和治疗。
7.基于上述,本发明的第一个目的是提供一种crig功能区蛋白变体,所述的crig功能区蛋白的氨基酸序列如seq id no:4所示;所述的crig功能区蛋白变体在seq id no:4序列的基础上进行氨基酸的取代,氨基酸的取代位点为17d、19n、28q、29g、80q、101p、102d中
的一个或多个;相较于seq id no:4所示的天然序列的crig功能区蛋白,所述的crig功能区蛋白变体是补体抑制活性更高的旁路补体途经抑制剂。
8.优选地,所述变体选自以下(a)~(e)中的任何一种:
9.(a)将seq id no:4所示的序列进行a17d位点的氨基酸取代得到的突变体,该突变体的核酸序列如seq id no:5所示,氨基酸序列如seq id no:6所示;
10.(b)将seq id no:4所示的序列进行a19n位点的氨基酸取代得到的突变体,该突变体的核酸序列如seq id no:7所示,氨基酸序列如seq id no:8所示;
11.(c)将seq id no:4所示的序列同时进行a28q和a29g两个位点的氨基酸取代得到的突变体,该突变体的核酸序列如seq id no:9所示,氨基酸序列如seq id no:10所示;
12.(d)将seq id no:4所示的序列进行a80 q位点的氨基酸取代得到的突变体,该突变体的核酸序列如seq id no:11所示,氨基酸序列如seq id no:12所示;
13.(e)将seq id no:4所示的序列同时进行a101p和a102d两个位点的氨基酸取代得到的突变体,该突变体的核酸序列如seq id no:13所示,氨基酸序列如seq id no:14所示。
14.本发明的另一个目的是提供一种核酸,所述的核酸序列编码权利要求1或2所述的crig功能区蛋白变体。
15.本发明的另一个目的是提供一种表达载体,其含有所述的核酸。
16.本发明的另一个目的是提供一种重组细胞,其含有所述的表达载体或其基因组中包含所述的核酸。
17.本发明的另一个目的是提供所述的crig功能区蛋白变体或编码其的核酸,或所述的表达载体,或所述的重组细胞在制备靶向抑制补体激活的抑制剂中的应用。
18.本发明的另一个目的是提供所述的crig功能区蛋白变体或编码其的核酸,或所述的表达载体,或所述的重组细胞在制备防治与补体异常激活有关疾病的药物中的应用。
19.本发明的另一个目的是提供一种制备所述的crig功能区蛋白变体的方法;
20.一些实施例中,所述方法包括:培养所述的重组细胞,从而重组表达所述的crig功能区蛋白变体。
21.本发明的另一个目的是提供一种用于靶向抑制补体激活的药物组合物,所述的药物组合物包括:前面任一所述的crig功能区蛋白变体或编码其的核酸,或所述的表达载体,或所述的重组细胞;以及药学上或生理学上可接受的载体。
22.相对于现有技术,本发明的有益效果是:根据crig与c3b复合物结构设计出crig胞外功能区的多个氨基酸取代位点,最终提供了多个crig功能区蛋白变体,相较于天然序列的crig功能区蛋白,这些变体对补体激活的抑制功能更强,可应用于制备靶向抑制补体激活的抑制剂或药物,以解决现有crig对补体的抑制活性弱的问题,提供疗效更高的药物,以应用于多种与补体异常激活有关疾病的预防和治疗。
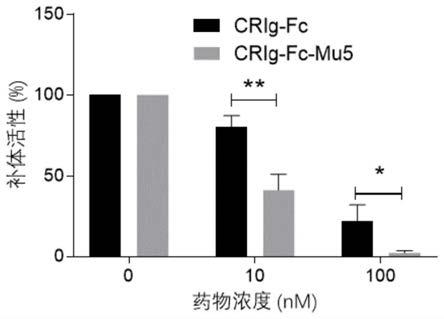
附图说明
23.图1为不同crig
‑
fc
‑
mutant重组蛋白的电泳鉴定结果图;
24.图2为测定crig
‑
fc
‑
mu1变体重组蛋白对补体激活的抑制效果图;
25.图3为测定crig
‑
fc
‑
mu2变体重组蛋白对补体激活的抑制效果图;
26.图4为测定crig
‑
fc
‑
mu3变体重组蛋白对补体激活的抑制效果图;
27.图5为测定crig
‑
fc
‑
mu4变体重组蛋白对补体激活的抑制效果图;
28.图6为测定crig
‑
fc
‑
mu5变体重组蛋白对补体激活的抑制效果图。
具体实施方式
29.以下将结合附图和实施例对本发明的技术方案做进一步说明。
30.本课题组根据crig与c3b复合物结构设计出crig胞外功能区的多个氨基酸取代位点,最终提供了多个crig功能区蛋白变体,相较于天然序列的crig功能区蛋白,这些变体对补体激活的抑制功能更强,可应用于制备靶向抑制补体激活的抑制剂或药物,以解决现有crig对补体的抑制活性弱的问题,提供疗效更高的药物,以应用于多种与补体异常激活有关疾病的预防和治疗。
31.术语
32.如本发明所用,所述“crig胞外功能区”、“crig胞外结构域”、“天然序列的crig胞外功能区”可以互换使用。
33.如本发明所用,所述“氨基酸取代”可以是保守氨基酸取代或非保守氨基酸取代。经取代后的crig胞外结构域仍具有与取代前相同或相近的功能活性。
34.例如,所述氨基酸取代可以为非保守取代。所述非保守取代可包括以非保守的形式改变目标蛋白或多肽中的氨基酸残基,例如将具有某种侧链大小或某种特性(例如,亲水性)的氨基酸残基变为具有不同侧链大小或不同特性(例如,疏水性)的氨基酸残基。
35.所述氨基酸取代也可以为保守取代。所述保守取代可包括以保守的形式改变目标蛋白或多肽中的氨基酸残基,例如将具有某种侧链大小或某种特性(例如,亲水性)的氨基酸残基变为具有相同或相似侧链大小或者相同或相似特性(例如,仍为亲水性)的氨基酸残基。这样的保守取代通常不会对所产生的蛋白质的结构或功能带来很大影响。在本技术中,所述crig胞外结构域的氨基酸序列变体可包括不显著改变蛋白质结构或其功能的保守氨基酸取代。
36.作为示例,下述各组中每组内各氨基酸间的相互取代在本发明中可被认为是保守取代:
37.(1)具有非极性侧链的氨基酸组:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸;
38.(2)不带电荷、具有极性侧链的氨基酸组:甘氨酸、丝氨酸、苏氨酸,半胱氨酸,酪氨酸,天冬酰胺和谷氨酰胺。
39.(3)负电荷、具有极性侧链的酸性氨基酸组:天冬氨酸和谷氨酸。
40.(4)带正电荷的碱性氨基酸组:赖氨酸、精氨酸和组氨酸。
41.(5)带苯基的氨基酸组:苯丙氨酸、色氨酸和酪氨酸。
42.如本发明所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。
43.本发明根据crig(核酸序列如seq id no:1所示;氨基酸序列如seq id no:2所示)与c3b复合物结构设计出crig胞外功能区的多个氨基酸取代位点,所述的crig胞外功能区
氨基酸序列为:rpilevpesvtgpwkgdvnlpctydplqgytqvlvkwlvqrgsdpvtiflrdssgdhiqqakyqgrlhvshkvpgdvslqlstlemddrshytcevtwqtpdgnqvvrdkitelrvqk(seq id no:4),对应的核酸序列如seq id no:3所示;并同时示例性的提供了5种crig功能区蛋白变体。其中:
44.(1)将天然的crig功能区蛋白序列进行a17d位点氨基酸取代得到的突变体1命名为crig
‑
mu1(氨基酸序列如seq id no:6所示);
45.(2)将天然的crig功能区蛋白序列进行a19n位点氨基酸取代得到的突变体2命名为crig
‑
mu2(氨基酸序列如seq id no:8所示);
46.(3)将天然的crig功能区蛋白序列同时进行a28q和a29g两个位点氨基酸取代得到的突变体3命名为crig
‑
mu3(氨基酸序列如seq id no:10所示);
47.(4)将天然的crig功能区蛋白序列进行a80q位点氨基酸取代得到的突变体4命名为crig
‑
mu4(氨基酸序列如seq id no:12所示);
48.(5)将天然的crig功能区蛋白序列同时进行a101p和a102d两个位点氨基酸取代得到的突变体5命名为crig
‑
mu5(氨基酸序列如seq id no:14所示)。
49.本发明“seq id no:4所示的crig胞外功能区”将g定义为第0位氨基酸,将r定义为第1位氨基酸,依次类推。本发明“进行a17d位点氨基酸取代”表示将氨基酸序列为seq id no:4所示的crig胞外功能区的第17位的天冬氨酸(d)突变成丙氨酸(a);本发明所述其他位点的氨基酸取代的表述依此类推。另外,
50.本发明还提供了编码本发明crig功能区蛋白变体的核酸序列。其中,编码示例性的5种crig功能区蛋白变体的核酸序列分别如seq id no:5、7、9、11、13所示。
51.本发明也涉及包含本发明的核酸的载体,以及用本发明的载体或crig功能区蛋白变体的编码序列经基因工程产生的宿主细胞(重组细胞),以及经重组技术产生本发明所述crig功能区蛋白变体的方法。
52.术语“表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
53.包含上述的适当核酸序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达crig功能区蛋白变体。
54.crig功能区蛋白变体的应用
55.本发明的主要贡献不仅在于公开了多个crig功能区蛋白变体,同时还在于验证了这些crig功能区蛋白变体的补体抑制活性。
56.实验证明,本发明公开的crig变体重组蛋白对补体激活的抑制功能比天然的crig重组蛋白更强,可应用于制备靶向抑制补体激活的抑制剂;也可应用于制备靶向抑制补体激活的药物,提供疗效更优的药物,以应用于多种与补体异常激活有关疾病的预防和治疗。
57.药物组合物
58.本发明还提供一种用于制备靶向抑制补体激活的药物组合物,所述的药物组合物包括:本发明所述的crig功能区蛋白变体或编码其的核酸,或含有该核酸的表达载体或表达该crig功能区蛋白变体的重组细胞;以及药学上或生理学上可接受的载体。
59.合适的药学上可接受的载体是本领域普通技术人员所熟知的。在remington’s pharmaceutical sciences中可找到关于药学上可接受的载体的充分说明。在组合物中药
学上可接受的载体可含有液体,如水、磷酸盐缓冲液、ringer溶液、生理盐水、平衡盐溶液、甘油或山梨醇等。另外,这些载体中还可能存在辅助性的物质,如润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质和稳定剂,如白蛋白等。
60.下面将结合附图1至图6以及具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
61.实施例1、crig
‑
fc
‑
mutant重组蛋白表达载体的构建、真核表达和纯化
62.1.仪器与材料
63.mastercycler pro
‑
eppendorf pcr仪(德国eppendorf公司),dk
‑
8d型电热恒温水槽(上海精宏实验设备有限公司),co2细胞培养箱(美国thermo scientific公司),离心机(eppendorf/beckman)。
64.2.实验方法
65.2.1基因克隆和载体构建
66.提取人淋巴瘤u937细胞的总rna,反转录为cdna,pcr扩增crig基因的胞外结构域;插入到pfuseigg4fc2真核表达载体中,双向测序鉴定插入序列,载体命名为crig
‑
pfuseigg4fc2。
67.2.1.1引物设计
68.设计引物,以构建表达crig
‑
fc
‑
mu1~5的表达载体,引物如下:
69.mu1
‑
f:gctgtgaatcttccctgcaccta(seq id no:15)
70.mu1
‑
r:ccctttccaaggtcctgttaca(seq id no:16)
71.mu2
‑
f:gctcttccctgcacctatgaccc(seq id no:17)
72.mu2
‑
r:cacatcccctttccaaggtcctgt(seq id no:18)
73.mu3
‑
f:gcagcctacacccaagtcttggtgaa(seq id no:19)
74.mu3
‑
r:cagggggtcataggtgcagggaag(seq id no:20)
75.mu4
‑
f:gcattgagcaccctggagatggatga(seq id no:21)
76.mu4
‑
r:gagggatacatctcctggaacct(seq id no:22)
77.mu5
‑
f:gctgctggcaaccaagtcgtga(seq id no:23)
78.mu5
‑
r:agtctgccaggtgacttcacac(seq id no:24)
79.2.1.2通过上述引物,利用toyobo kod
‑
plus
‑
mutagenesis kit构建质粒不同位点氨基酸取代的crig
‑
fc
‑
mutant重组蛋白的表达载体,即表达crig
‑
fc
‑
mu1~5的表达载体,且经测序鉴定,各突变型重组蛋白表达质粒均成功构建。
80.相关序列如下:
81.crig
‑
fc
‑
mu1变体重组蛋白的胞外功能区:核酸序列如seq id no:5;氨基酸序列如seq id no:6所示;
82.crig
‑
fc
‑
mu2变体重组蛋白的胞外功能区:核酸序列如seq id no:7;氨基酸序列如seq id no:8所示;
83.crig
‑
fc
‑
mu3变体重组蛋白的胞外功能区:核酸序列如seq id no:9;氨基酸序列如seq id no:10所示;
84.crig
‑
fc
‑
mu4变体重组蛋白的胞外功能区:核酸序列如seq id no:11;氨基酸序列如seq id no:12所示;
85.crig
‑
fc
‑
mu5变体重组蛋白的胞外功能区:核酸序列如seq id no:13;氨基酸序列如seq id no:14所示。
86.2.2蛋白表达及纯化
87.2.2.1实验试剂
88.结合/洗杂缓冲液:0.15m nacl,20mm na2hpo4,ph7.0;
89.洗脱液:0.1m甘氨酸,ph 3.0;
90.中和液:1m tris
‑
hcl,ph 8.5。
91.2.2.2实验步骤
92.1)蛋白表达:在15cm培养皿中铺板293ft细胞,细胞密度约为80%时转染,在1ml optimem中加入20ug表达野生型或突变型crig
‑
fc
‑
mutant的载体质粒,20μl tenfect dna transfection reagent(teye corporation,shanghai,china),混匀孵育30min后加入细胞培养基中。5h后换freestyle(gibco)培养基,72h后收集培养基上清。
93.2)浓缩:上清用0.22mm滤膜过滤后用30kd超滤管浓缩至约2ml。
94.3)将protein a agarose resin(yeasen)装入合适的层析空柱中,注意避免产生气泡。
95.4)平衡:用5倍柱体积的结合缓冲液平衡层析柱,使填料处于与目的蛋白相同的缓冲体系下,起到保护蛋白的作用。
96.5)上样:将样品加到平衡好的protein a agarose resin中,保证目的蛋白与树脂充分接触,提高目的蛋白的回收率,收集流出液,以待检测。
97.6)洗杂:用10
‑
15倍柱体积的洗杂缓冲液进行清洗,去除非特异性吸附的杂蛋白,收集洗杂液,以待检测。
98.7)洗脱:使用5倍柱体积的洗脱缓冲液,收集洗脱液,即目的蛋白组分。
99.8)置换:将目的蛋白加入含有15ml pbs的超滤管中浓缩,重复三次,使目的蛋白溶解于pbs中便于定量及后续实验。
100.9)清洗及保存:依次使用3倍柱体积的结合buffer和5倍柱体积的去离子水平衡填料,最后再用5倍柱体积的20%的乙醇平衡,然后保存在等体积的20%的乙醇中,置于4℃保存,防止填料被细菌污染。
101.10)sds
‑
page检测
102.将纯化过程中得到的样品(包括原始样品、流出组分、洗杂及洗脱组分等)利用sds
‑
page进行检测,判定其纯化效果
103.3.实验结果:
104.本实施例中,与igg4
‑
fc段偶联的野生型重组蛋白crig
‑
fc
‑
wt和5种突变型重组蛋白crig
‑
fc
‑
mu1~5的蛋白分子量大小均为39kda。结果如图1所示,考马斯亮蓝染色进一步证实各突变型重组蛋白的成功表达。
105.实施例2、不同crig
‑
fc
‑
mutant重组蛋白的补体抑制活性测定
106.1.仪器与材料
107.wieslab补体系统旁路途径试剂盒(svar),synergy h4全功能酶标仪(bio tek)。
108.2.实验方法
109.使用wieslab补体系统旁路途径试剂盒来评估不同crig
‑
fc
‑
mu1~5重组蛋白对补
体激活的抑制效果。
110.2.1洗涤液的配制
111.将装有浓缩洗涤液的小瓶置于37℃水浴中,直到晶体溶解后再稀释洗涤液。30ml的30
×
洗涤液用870毫升蒸馏水稀释。储存于2~8℃。
112.2.2建立阳性对照
113.将所有冻干的材料轻拍至瓶底,取下瓶盖,立即加入200μl蒸馏水。重新盖上瓶盖,在冰上放置5分钟,偶尔轻轻摇动或涡流,直至完全溶解。以与待测样本相同的方式稀释建立对照。
114.2.3稀释血清
115.将冷冻的血清轻轻放入37℃的水浴中,部分解冻后立即将试管放在冰上直到完全融化。在涡流混合器上混匀。用ap稀释液稀释血清(340μl稀释液+20μl血清)。稀释的血清在分析前可在室温下放置最多60分钟。
116.2.4孵化样本
117.吸液量100μl/孔,分别加入空白对照(稀释液)、阳性对照(pc)、阴性对照(nc)及待测样本。37℃烘箱孵育60
‑
70分钟。将板子倒空,用300μl洗涤液冲洗3次,最后一次洗完后,用吸水纸轻敲贴片,将孔清空。
118.2.5结合偶联
119.每孔加100μl conjugate buffer。室温孵育30分钟。洗涤3次。
120.2.6添加底物溶液
121.每孔加入100μl底物溶液,室温孵育30分钟。每孔加入100μl 5mm edta终止反应。
122.2.7读取结果并计算
123.在酶标仪上读出405nm处的吸光度。计算样品、pc和nc的平均od405nm值,并计算补体活性,计算公式如下:(样品-nc)/(pc-nc)
×
100%。
124.3.实验结果
125.结果如图2至图6所示,五种crig
‑
fc
‑
mutant重组蛋白在10nm和100nm浓度时补体抑制活性均明显优于野生型crig
‑
fc
‑
wt重组蛋白(*p<0.05;**p<0.01),其中,crig
‑
fc
‑
mu2、crig
‑
fc
‑
mu3和crig
‑
fc
‑
mu5重组蛋白的补体抑制活性更优,它们在100nm浓度时,能使补体活性降到很低。
126.综上所述,本发明公开了crig胞外功能区的多个氨基酸取代位点,并示例性的提供了多个crig功能区蛋白变体,相较于天然序列的crig功能区蛋白,这些变体对补体激活的抑制功能更强,可应用于制备靶向抑制补体激活的抑制剂或药物,从而预防、治疗多种与补体异常激活有关的疾病。
127.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1