一种抗病毒化合物及其制备方法与流程
1.本发明属于医药领域,具体涉及一种抗病毒化合物及其制备方法。
背景技术:
2.流行性感冒病毒简称流感病毒。它分为甲(a)、乙(b)、丙(c)三型,近年 来才发现的流感病毒将归为丁(d)型。流感病毒可引起人、禽、猪、马、蝙蝠等多 种动物感染和发病,是人流感、禽流感、猪流感、马流感等人与动物疫病的病原。
3.这些疫病典型的临床症状是急性高热、全身疼痛、显著乏力和呼吸道症状。流感 病毒主要通过空气中的飞沫、易感者与感染者之间的接触或与被污染物品的接触而传 播。一般秋冬季节是其高发期。人流感主要是甲型流感病毒和乙型流感病毒引起的。 甲型流感病毒经常发生抗原变异,可以进一步分为h1n1、h3n2、h5n1、h7n9等亚 型(其中的h和n分别代表流感病毒两种表面糖蛋白)。流感病毒对外界抵抗力不强。 动物流感病毒通常不感染人,人流感病毒通常不感染动物,但是猪比较例外。猪既可 以感染人流感病毒,也可以感染禽流感病毒,但它们主要感染的还是猪流感病毒。少 数动物流感病毒适应人后,可以引起人流感大流行。
4.人冠状病毒可对人造成普通感冒,严重急性呼吸综合征(sars)和中东呼吸综合 征(mers),在流行病学特征上存在一定差异。
[0005][0006]
甲型h1n1流感是猪的一种高度传染性急性呼吸道疾病,由一种或多种猪流感a 型病毒引起。发病率往往较高,但死亡率较低(1~4%)。通过浮质、直接和间接接触 以及携带病毒但无症状的猪,病毒在猪群中传播。全年都可发生猪群疫情。在温带的 秋季和冬季,发病率上升。人患甲型h1n1流感通常来自被感染的猪,但有些人患病例 没有与猪或猪所在环境接触的历史。在有些情况中发生了人际传播,但仅限于密切接 触者和封闭环境中的人群。
[0007]
冠状病毒(hcov
‑
229e)是冠状病毒的一种。冠状病毒属于套式病毒目、冠状病毒 科、冠状病毒属,是一个大型病毒家族,在自然界广泛存在。冠状病毒仅感染脊椎动 物,与人和动物的多种疾病有关,可引起人和动物呼吸道、消化道和神经系统疾病。
[0008]
因此,研究一种有效的抗病毒药物具有重要的现实意义。
技术实现要素:
[0009]
本发明的目的是提供一种式i所示的化合物及其药学上可接受的盐、溶剂合物。
[0010]
本发明所提供的化合物的结构通式如式i所示:
[0011][0012]
所述式(ⅰ)中,
[0013]
r1选自:单取代或多取代的h、f、甲基、三氟甲基,优选h;
[0014]
r2选自:h、直链或取代烷烃(c1
‑
c6),优选甲基,异丙基;
[0015]
r3选自:单取代或多取代的h、cl、br、f,优选cl;
[0016]
r4选自:直链或取代烷烃(c1
‑
c6),优选甲基,乙基或丙基。
[0017]
在本发明的一些实施方案中,本发明所述的式i所示化合物可以列举为如下所示 结构,但不局限于以下结构:
[0018][0019]
本发明还提供了上述式i所示的化合物的制备方法。
[0020]
根据文献med.chem.commun.,2016,7,1441
–
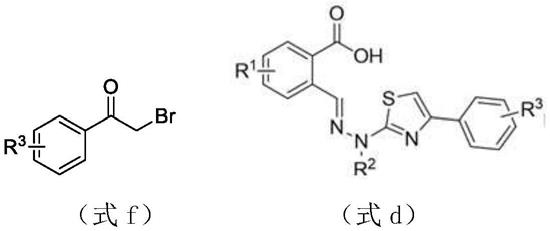
1448,化合物1(式a)烷基肼与硫 氰酸钠反应得到硫脲化合物2(式b),然后与r1取代的邻甲酸苯甲醛缩合得到化合 物3(式c),最后与r3取代溴苯乙酮关环,很容易得到噻唑类化合物4(式d);在 缩合剂作用下,得到式i所示的苯甲酰胺衍生物。具体步骤如下:
[0021]
1)将式a所示化合物与硫氰酸钠进行反应,得到式b所示化合物;
[0022][0023]
其中,式a中r2的定义同式i;式b中r2的定义同式a;
[0024]
2)将式b所示化合物与式e所示的r1取代的邻甲酸苯甲醛进行缩合反应,得到 式c所示化合物;
[0025][0026]
其中,式e中r1的定义同式i;式c中r1的定义同式e、r2的定义同式b;
[0027]
3)将式c所示化合物与式f所示的r3取代溴苯乙酮进行关环反应,得到式d所 示化合物;
[0028][0029]
其中,式f中r3的定义同式i,式d中r1、r2的定义同式c,r3的定义同式f;
[0030]
4)在缩合剂作用下,使式d所示化合物与式g所示化合物进行缩合反应,得到式 i所示化合物;
[0031][0032]
其中,式g中x、r4的定义同式i。
[0033]
上述步骤1)中,所述反应的反应条件为:反应温度50
‑
100℃,反应时间为24
‑
72 小时;反应在溶剂中进行,所述溶剂可为甲醇、乙醇、四氢呋喃、乙腈等,优选乙醇。
[0034]
上述步骤2)中,所述缩合反应的反应条件为:反应温度50
‑
100℃,反应时间为 1
‑
3小时;反应在溶剂中进行,所述溶剂可为甲醇、乙醇、四氢呋喃、乙腈等,优选 乙醇。
[0035]
上述步骤3)中,所述关环反应的反应条件为:反应温度50
‑
100℃,反应时间为 3
‑
6小时;反应在溶剂中进行,所述溶剂可为甲醇、乙醇、四氢呋喃、乙腈等,优选 乙醇。
[0036]
上述步骤4)中,所述缩合反应的反应条件为:反应温度0
‑
25℃,反应时间为2
‑
8 小时;反应在溶剂中进行,所述溶剂可为二氯甲烷、四氢呋喃、乙腈等,优选二氯甲 烷。
[0037]
参照本发明实施例的制备方法可以获得本发明权利要求中所保护的其它化合物。
[0038]
本发明另一个目的是提供上述式i所示化合物的应用。
[0039]
本发明所提供的应用是式i所示化合物或其药学上可接受的盐、酯、溶剂合物的 应用为下述(a)和/或(b)和/或(c):
[0040]
(a)式i所示化合物或其药学上可接受的盐、酯、溶剂合物在制备治疗病毒所致 疾病或病毒感染的产品中的应用;
[0041]
(b)式i所示化合物或其药学上可接受的盐、酯、溶剂合物在制备预防病毒所致 疾病或病毒感染的产品中的应用;
[0042]
(c)式i所示化合物或其药学上可接受的盐、酯、溶剂合物在制备病毒抑制剂中 的应用;
[0043]
(d)式i所示化合物或其药学上可接受的盐、酯、溶剂合物在制备镇痛药物中 的应用。
[0044]
所述产品可为药物或药物制剂。
[0045]
所述病毒抑制剂能够抑制病毒的复制。
[0046]
所述病毒包括流感病毒、冠状病毒。
[0047]
所述流感病毒具体可为甲型流感病毒(h1n1);
[0048]
所述冠状病毒可为α属冠状病毒和/或β属冠状病毒,具体选自hcov
‑
229e。
[0049]
本发明中,所述病毒所致疾病可为呼吸系统感染性疾病。
[0050]
所述呼吸系统感染为呼吸道感染和/或肺部感染;所述呼吸道感染可为鼻咽炎、 鼻炎、咽喉炎、气管炎和/或支气管炎;所述肺部感染可为肺炎。
[0051]
本发明中,所述流感病毒所致疾病通常包括流感病毒引起的急性呼吸道传染疾 病等。
[0052]
本发明中,所述冠状病毒所致疾病通常包括病毒性肺炎、严重急性呼吸综合征 等。
[0053]
本发明中,所述冠状病毒感染通常引起病毒性肺炎、严重急性呼吸综合征等疾 病。
[0054]
本发明化合物同时具有对冠状病毒和h1n1甲型流感病毒的抑制作用,并且对人正 常细胞没有毒性,能够抑制炎症反应发生的程度,减小肺炎对机体的伤害,促进机体 恢复。
[0055]
以式i所示的化合物为活性成分制备的抗病毒药物或镇痛药物也属于本发明的保 护范围。
[0056]
所述抗病毒药物可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导 的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹 后导入机体。
[0057]
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载 体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促 进剂、表面活性剂、吸附载体、润滑剂等。
[0058]
上述药物可以制成片剂、粉剂、颗粒剂、胶囊、口服液、膏剂、霜剂、注射液等 多种形式;上述各种剂型的药物均可以按照药学领域的常规方法制备。
[0059]
本发明还提供了一种药物或药物组合物,其活性成分为式i所示化合物或其药 学上可接受的盐、酯、溶剂合物。
[0060]
所述药物或药物组合物具有下述至少一种功效:
[0061]
1)治疗病毒所致疾病或病毒感染;
[0062]
2)预防病毒所致疾病或病毒感染;
[0063]
3)抑制病毒;
[0064]
4)镇痛。
[0065]
上述药物或药物组合物可以按照本领域技术人员已知的常规方法制成溶液剂、片 剂、胶囊或注射剂等剂型。
[0066]
利用本发明提供的式i所示化合物或其药学上可接受的盐预防和/或治疗病毒引 起的感染时,给予受试者生物体有效量的式i化合物或其药学上可接受的盐。
[0067]
本发明中所述化合物经过实验证实,不仅对于h1n1甲型流感病毒具有较好的抑制 作用,并且对于冠状病毒也具有较好的抑制作用,没有观察到对于人正常细胞的毒性, 且能够在抗病毒的同时抑制炎症反应的程度;此外,该化合物还具有显著的镇痛作用。
附图说明
[0068]
图1为本发明式i所示化合物的合成路线图。
具体实施方式
[0069]
下面结合具体实施例对本发明作进一步阐述,但本发明并不限于以下实施例。所 述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获 得。
[0070]
实施例1
‑
13
[0071]
1、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酰胺(zonk2003
‑
1) 的合成
[0072]
1)2
‑
甲基氨基硫脲(1
‑
2)
[0073][0074]
将甲基肼(23.0g,0.5mol)、硫氰酸铵(38.0g,0.5mol)、乙醇(200ml) 分别加入单口圆底烧瓶中,加热回流反应72h。反应液冷却浓缩,柱层析纯化得到灰 白色固体2
‑
甲基氨基硫脲(44.1g,84.0%)。1h nmr(dmso
‑
d6 400mhz)δ7.24(s,2 h),6.85(s,2h),3.14(s,3h).esi
‑
ms m/z:106.1[m+h]+.
[0075]
2)(e)
‑2‑
((2
‑
氨基甲硫杂酰
‑2‑
甲基亚肼基)甲基)苯甲酸(1
‑
3)
[0076][0077]
将2
‑
甲基氨基硫脲(40.0g,0.38mol)、2
‑
羰基苯甲酸(57.0g,0.38mol)、 乙醇(300ml)分别加入单口圆底烧瓶中,加热回流反应2h。反应液冷却浓缩,柱 层析纯化得到浅黄色固体(e)
‑2‑
((2
‑
氨基甲硫杂酰
‑2‑
甲基亚肼基)甲基)苯甲酸(85.6 g,95.0%)。1h nmr(dmso
‑
d6 400mhz)δ13.0(s,1h),8.12
‑
7.23(m,7h),2.47(s,3 h).esi
‑
ms m/z:238.1[m+h]+.
[0078]
3)(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酸(1
‑
4)(简称 zonk2003
‑
0)
[0079][0080]
将(e)
‑2‑
((2
‑
氨基甲硫杂酰
‑2‑
甲基亚肼基)甲基)苯甲酸(80.0g,0.34mol)、2
‑
溴
‑1‑
(2
‑ꢀ
氯苯基)乙酮(79.2g,0.34mol)、乙醇(400ml)分别加入单口圆底烧瓶中,加热回 流反应3h。反应液冷却浓缩,柱层析纯化得到浅黄色固体(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
ꢀ‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酸(124g,98.5%)。1h nmr(dmso
‑
d6 400mhz)δ13.23 (s,1h),8.60(s,1h),8.01
‑
7.34(m,9h),3.66(s,3h).esi
‑
ms m/z:372.1[m+h]+.
[0081]
4)(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑
n
‑
(甲磺酰基)苯甲酰胺 (zonk2003
‑
2)的合成
[0082][0083]
将(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酸(3.71g,10mmol)、 4
‑
二甲氨基吡啶(1.22g,10mmol)、氨基甲磺酸(1.11g,10mmol)分别溶解于二 氯甲烷(30ml)中,然后加入二环己基碳二亚胺(2.27g,11mmol),室温搅拌5h。 反应液浓缩,柱层析纯化得到浅黄色固体(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼 基)甲基)
‑
n
‑
(甲磺酰基)苯甲酰胺(3.41g,76.2%)。1h nmr(dmso
‑
d6 400mhz)δ8.10 (s,1h),8.00
‑
7.43(m,9h),3.67(s,3h),3.42(s,3h).esi
‑
ms m/z:449.1[m+h]+.
[0084]
2、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑
n
‑
(乙基磺酰基)苯甲胺 (zonk2003
‑
4)的合成
[0085][0086]
将(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酸(5.0g,13.4mmol)、 乙基磺酰胺(1.46g,13.4mol)、4
‑
二甲氨基吡啶(1.63g,13.4mol)溶解于二氯甲烷 (100ml)中,冰水浴加入二环己基碳二亚胺(2.90g,14.1mol),室温反应5h。反 应液浓缩,柱层析纯化得到白色固体(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基) 甲基)
‑
n
‑
(乙磺酰)苯甲酰胺(5.27g,85.1%)。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1 h),8.01
‑
7.34(m,9h),3.66(s,3h),3.43(m,2h),1.23(m,3h).esi
‑
ms m/z:463.5[m+h]+.
[0087]
3、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑
n
‑
(丙磺酰)苯甲
酰胺(简称 zonk2003
‑
14)的合成
[0088][0089]
将(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)苯甲酸(5.0g,13.4mmol)、 丙基磺酰胺(1.65g,13.4mol)、4
‑
二甲氨基吡啶(1.63g,13.4mol)溶解于二氯甲烷 (100ml)中,冰水浴加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐(2.70g,14.1 mol),室温反应5h。反应液浓缩,柱层析纯化得到白色固体(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻 唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑
n
‑
(丙磺酰)苯甲酰胺(5.50g,86.2%)。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1h),8.01
‑
7.34(m,9h),3.66(s,3h),3.43(m,2h),1.69(m,2h),1.23(m,3 h).esi
‑
ms m/z:477.5[m+h]
+
.
[0090]
4、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基亚肼基)甲基)
‑
n
‑
(甲磺酰)苯甲酰胺的合成 (简称zonk2003
‑
15)
[0091][0092]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基 亚肼基)甲基)
‑
n
‑
(甲磺酰)苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1h),8.01
‑
7.34 (m,9h),3.34(s,3h),3.13(m,1h),1.09(d,6h).esi
‑
ms m/z:477.1[m+h]
+
.
[0093]
5、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基亚肼基)甲基)
‑4‑
氟
‑
n
‑
(甲磺酰)苯甲酰胺 的合成(简称zonk2003
‑
16)
[0094][0095]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基 亚肼基)甲基)
‑4‑
氟
‑
n
‑
(甲磺酰)苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1 h),8.01
‑
7.34(m,8h),3.34(s,3h),3.13(m,1h),1.09(d,6h).esi
‑
ms m/z:495.5[m+h]
+
.
[0096]
6、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基亚肼基)甲基)
‑
n
‑
(乙基磺酰基)
‑5‑
氟苯甲 酰胺的合成(简称zonk2003
‑
17)
[0097][0098]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
异丙基 亚肼基)甲基)
‑
n
‑
(乙基磺酰基)
‑5‑
氟苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1 h),8.01
‑
7.34(m,8h),346(m,2h),3.25(m,1h),1.,23(m,3h),1.09(d,6h).esi
‑
ms
ꢀꢀ
m/z:509.5[m+h]
+
.
[0099]
7、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑4‑
氟
‑
n
‑
(甲磺酰)苯甲酰胺的 合成(简称zonk2003
‑
18)
[0100][0101]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚 肼基)甲基)
‑4‑
氟
‑
n
‑
(甲磺酰)苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1 h),8.01
‑
7.34(m,8h),3.66(s,3h),3.42(s,3h).esi
‑
ms m/z:467.1[m+h]
+
.
[0102]
8、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚肼基)甲基)
‑
n
‑
(乙基磺酰)
‑4‑
氟苯甲酰胺 的合成(简称zonk2003
‑
19)
[0103][0104]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)
‑2‑
甲基亚 肼基)甲基)
‑
n
‑
(乙基磺酰)
‑4‑
氟苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1 h),8.01
‑
7.34(m,8h),3.66(s,3h),3.12(m,2h),1.29(m,3h).esi
‑
ms m/z:481.5[m+h]
+
.
[0105]
9、(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)亚肼基)甲基)
‑5‑
甲基
‑
n
‑
(甲磺酰)苯甲酰胺的合成 (简称zonk2003
‑
20)
[0106][0107]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(2
‑
氯苯基)噻唑
‑2‑
基)亚肼基)甲 基)
‑5‑
甲基
‑
n
‑
(甲磺酰)苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1h),8.01
‑
7.34 (m,8h),3.42(s,3h),2.54(s,3h).esi
‑
ms m/z:449.5[m+h]
+
.
[0108]
10、(e)
‑2‑
((2
‑
(4
‑
(3,5
‑
二氯苯基)噻唑
‑2‑
基)亚肼基)甲基)
‑5‑
甲基
‑
n
‑
(甲磺酰)苯甲酰胺的 合成(简称zonk2003
‑
21)
[0109][0110]
综合实施例1
‑
3的制备方法,合成得到(e)
‑2‑
((2
‑
(4
‑
(3,5
‑
二氯苯基)噻唑
‑2‑
基)亚肼基) 甲基)
‑5‑
甲基
‑
n
‑
(甲磺酰)苯甲酰胺。1h nmr(dmso
‑
d
6 400mhz)δ8.60(s,1h),8.01
‑
7.34 (m,7h),3.42(s,3h),2.54(s,3h).esi
‑
ms m/z:483.5[m+h]
+
.
[0111]
实施例11、系列化合物体外抗病毒试验
[0112]
采用mtt法测定zonk2003系列化合物(式i所示化合物)对培养病毒的mrc
‑
5、 mdck细胞的毒性作用,设计合适浓度进行抗病毒试验。采用致细胞病变法(cytopathiceffect,cpe法)进行体外抗病毒药效学试验,评价zonk2003系列化合物的对引起呼 吸道疾病的病毒的作用。
[0113]
试验结果:zonk2003系列化合物对mrc
‑
5、mdck细胞的均无明显毒性;对两株病 毒均具有不同程度的抗病毒作用,以半数有效率(ec50)评价其抗病毒作用。对冠状 病毒(hcov
‑
229e)的ec50为12.83μmol/l、15.00μmol/l;对甲型流感病毒(h1n1) 的ec50为11.75μmol/l、18.19μmol/l。
[0114]
试验结论:在10~20μmol/l浓度范围内,zonk2003系列化合物对两株病毒均具 有不同程度的抑制作用,可促进细胞在受病毒感染后的恢复。
[0115]
1.试验材料
[0116]
1.1受试物
[0117]
受试物:zonk2003
‑
4,批号:20200521,纯度98.70%;、zonk2003
‑
2,批号:20200513, 纯度99.01%,由广东中科药物研究有限公司提供。以dmem培养基配制成50.0、25.0、 12.5、6.25、3.13、1.56μmol/l,2~8℃保存备用。
[0118]
1.2阳性对照品
[0119]
磷酸奥司他韦颗粒,规格15mg
×
10袋装,宜昌东阳光长江药业股份有限公司产品, 批号:0371912115,有效期至2021.12.11,用于抗甲型流感病毒的阳性对照药;重组 人干扰素α2b凝胶,规格1.0
×
105iu/克,10g/支,兆科药业(合肥)有限公司,用 于抗冠状病毒的阳性对照药。
[0120]
1.3病毒株
[0121]
冠状病毒(hcov
‑
229e),编号:atcc
‑
vr
‑
740,购自于美国atcc;甲型流感病毒 (h1n1),编号atcc
‑
vr
‑
95,购自于美国atcc。均在ii级生物安全实验室培养并保 存。
[0122]
1.4细胞株
[0123]
人胚肺细胞(mrc
‑
5),犬肾细胞(mdck),均来源于武汉普诺赛生命科技有限公 司。
[0124]
1.5主要试剂
[0125][0126]
1.6主要仪器
[0127]
bsciib2
‑
1101型生物安全柜,上海瑞仰净化装备有限公司生产,中心编号:019, yxq
‑
50a型立式压力蒸汽灭菌器,上海博讯医疗生物仪器股份有限公司生产,中心编 号:584;3111型co2培养箱,美国thermofisher公司生产,中心编号:147。
[0128]
1.7试验设施
[0129]
长沙市病原微生物实验室,实验室等级:生物安全ii级(bsl
‑
ii),备案号:长 卫计实备字(2019)第b001号。本试验在中心生物安全ii级实验室(bsl
‑
ii
‑
1)进 行,严格按照法规及本中心sops执行。
[0130]
2.试验方法
[0131]
2.1细胞培养
[0132]
人胚肺细胞(mrc
‑
5)为贴壁生长细胞。培养基选用含10%fbs的dmem培养基, 生长状态良好时,每隔2~3d可进行传代。在净化工作台中弃去培养基,用1
×
pbs 清洗2~3次,然后加入适量的0.25%trypsin
‑
edta消化,约1~3min后,待细胞脱 落,加入适量的含10%fbs的dmem培养基以终止胰酶的消化作用,吹打成单细胞悬液, 转入ep管中,以1000rpm离心5min。弃去培养基,加入新鲜的培养基重悬,按一定 比例(细胞密度约为105/ml)接种到新的培养瓶中,放置于37℃、5%co2培养箱中培 养。
[0133]
犬肾细胞(mdck)为贴壁生长细胞。培养基选用含10%fbs的dmem培养基,生长 状态良好时,每隔2~3d可进行传代。在净化工作台中弃去培养基,用1
×
pbs清洗2~ 3次,然后加入适量的0.25%trypsin
‑
edta消化,约2~5min后,待细胞脱落,加入 适量的含10%fbs的dmem培养基以终止胰酶的消化作用,吹打成单细胞悬液,转入 ep管中,以1000rpm离心5min。弃去培养基,加入新鲜的培养基重悬,按一定比例(细 胞密度约为105/ml)接种到新的培养瓶中,放置于37℃、5%co2培养箱中培养。
[0134]
2.2病毒的扩增
[0135]
2.2.1冠状病毒(hcov
‑
229e):mrc
‑
5细胞扩增
[0136]
将mrc
‑
5细胞接种于75cm2培养瓶中,当细胞密度达到80~90%时去掉部分的培养 基,剩余的刚好覆盖好细胞,加入适量的hcov
‑
229e病毒,待病毒吸附于细胞表面后 (约3h左右,每隔30min轻轻晃动培养板,使病毒吸附均匀),更换不含fbs的新鲜 培养基,置于35℃、5%co2加湿的恒温培养箱中培养。观察细胞开始产生病变至不再 产生病变时(一般为5~7天)采取反复冻融法,于3000rpm离10min以除去细胞残渣, 收集上清液分装于冻存管中,进行标注后于
‑
80℃中短期保存或液氮中长期保存,备用。
[0137]
2.2.2甲型流感病毒(h1n1):mdck细胞扩增
[0138]
将mdck细胞接种于75cm2培养瓶中,当细胞密度达到70~80%时去掉部分的培养 基,剩余的刚好覆盖好细胞,加入适量的h1n1病毒,待病毒吸附于细胞表面后(约 3h左右,每隔30min轻轻晃动培养板,使病毒吸附均匀),更换不含fbs的新鲜培养 基,置于33℃、5%co2加湿的恒温培养箱中培养。观察细胞开始产生病变至不再产生 病变时(一般为2~3天),采取反复冻融法,于3000rpm离10min以除去细胞残渣, 收集上清液分装于冻存管中,进行标注后于
‑
80℃中短期保存或液氮中长期保存,备用。
[0139]
2.3病毒半数组织培养感染浓度(tissue culture infective dose,tcid
50
)的测定
[0140]
将2.2.1、2.2.2收集的病毒液进行tcid
50
的测定:分别在96孔细胞培养板接种 适宜密度的相应细胞悬液100μl,培养24h后吸去培养板中的培养液,加入用细胞维 持液稀释的病毒液100μl(病毒进行10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、10
‑6梯度稀释), 每个稀释度做10个复孔,33℃,5%co2培养箱吸附培养3h,吸去未吸附的病毒液, 每孔补加细胞维生长持液100μl,继续培养。逐日在倒置显微镜下观察细胞病变效应(cytopathic effect,cpe,病毒在培养细胞中所致cpe的特征:细胞变圆,折光性 较强,融合细胞突起,部分脱壁,胞浆有丝状突起或伪足状,整个形状有如不规则的 地图,形成大而圆的融合性多核巨细胞)。并记录出现cpe的孔数,以最高稀释度不 再出现病变时为终点,细胞病变程度用
“‑
~++++”示:无细胞
病变
“‑”
,≤25% 细胞病变“+”,25%~50%细胞病变“+”,50%~75%细胞病变“+++”,>75%细 胞病变“++++”。根据reed
‑
muench公式计算tcid
50
:
[0141]
tcid
50
=log(cpe低于50%的病毒稀释度)+距离比例
×
稀释度间距
[0142]
其中,距离比例=(高于50%百分数
‑
50)
÷
(高于50%的百分数
‑
低于50%的百分 数)
[0143]
2.4受试物的浓度设计
[0144]
2.4.1细胞毒性检测
[0145]
用dmem培养基配制系列浓度的zonk2003系列化合物(浓度梯度为50.0、25.0、 12.5、6.25、3.13、1.56μmol/l)和磷酸奥司他韦(浓度梯度为20.0、10.0、5.0、 2.5、1.25、0.625μg/ml)、干扰素α2b(浓度梯度为1
×
103、5
×
102、2.5
×
102、 1.25
×
102、6.25
×
101、3.1
×
101iu/ml),分别加入至培养好的mrc
‑
5、mdck细胞, 37℃、5%co2加湿的恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长 下测得各孔的od值,计算zonk2003系列化合物对各细胞的ec
50
。
[0146]
2.4.2当化合物对细胞有毒性时,采用1/2ic
50
为最高浓度,以2倍间距向下稀释设 置3个测试浓度;当化合物对细胞无毒性时,采用20μmol/l为最高浓度,以2倍间 距向下稀释设置3个测试浓度。
[0147]
2.5抗病毒作用的检测
[0148]
2.5.1细胞接种:病毒感染前24h,将生长良好的相应细胞株以适宜的密度(约105个 /孔)均匀接种于96孔板中,100μl/孔,于37℃、5%co2培养箱中培养;
[0149]
2.5.2待细胞至70%~80%左右后,吸去部分培养基,剩余刚好覆盖细胞(使得病毒与 细胞更好地吸附),接种100tcid
50
的病毒液50μl/孔,放入培养箱中培养3h后, 吸去96孔板中的培养基,加入用不含血清的细胞维持液配制的不同浓度的受试物溶液 (根据细胞毒性设置),200μl/孔,于33℃、5%co2培养箱中培养。
[0150]
2.5.3分组
[0151]
正常对照组:未用病毒感染组;
[0152]
模型对照组:病毒感染组;
[0153]
阳性对照组:市售对照药;
[0154]
受试物组:感染组+不同浓度的受试物。
[0155]
2.5.4抗病毒活性评价(cpe法)
[0156]
逐日观察细胞病变,连续观察至细胞病变不再增加,记录每个浓度细胞病变孔数 和未病变孔数。
[0157]
2.6结果评价
[0158]
以正常对照组细胞未病变率为100%,细胞病变率抑制率(%)=(1
‑
各组细胞未病 变孔/8)
×
100%。
[0159]
本试验数据有效数字修约按照四舍五入进行,统计所用软件为spss 16.0。计量 资料以均数
±
标准差表示,用leven’s test方法检验正态性和方差齐性。 如果没有统计学意义(p>0.05),用单因素方差分析(anova)进行统计分析。如果 anova有统计学意义(p≤0.05),用lsd法进行比较分析。如果方差不齐(p≤0.05), 则用kruskal
‑
wallis检验。如果kruskal
‑
wallis检验有统计学意义(p≤0.05), 则用dunnett’s test(非参数方
法)进行比较分析。统计结果以α=0.05为检验界 限,其中p≤0.05表示有统计学意义,p≤0.01表示所检验的差别有非常显著性 意义。
[0160]
3.试验结果
[0161]
3.1系列化合物的对各细胞增殖的影响
[0162]
如表1
‑
1、1
‑
2所示,两种化合物在测试浓度范围内(1.56~50.0μmol/l)对mrc
‑
5、 mdck均无明显细胞毒性,故在抗病毒研究中最高浓度设置为20.0μmol/l。如表2所 示,阳性药在测试浓度范围内干扰素α2b(6.25
×
101~1
×
103iu/ml)对mrc
‑
5细胞、 磷酸奥司他韦(0.625~20.0μmol/l)对mdck细胞均无明显细胞毒性,故在抗病毒研 究中最高浓度分别设置为1
×
103iu/ml、20.0μmol/l。
[0163]
表1
‑
1两种化合物对mrc
‑
5细胞增殖的影响
[0164][0165][0166]
表1
‑
2两种化合物对mdck细胞增殖的影响
[0167][0168]
表2阳性药对各细胞增殖的影响
[0169][0170]
3.2病毒滴度结果检测
[0171]
如表3、表4所示,冠状病毒(hcov
‑
229e)、甲型流感病毒(h1n1)的半数病毒 感染量tcid
50
分别为10
‑
3.5
/0.1ml、10
‑
3.85
/0.1ml,病毒分别做3.16
×
104倍、7.08
×
104倍稀释时取0.1ml接种细胞,可使50%细胞产生病变。取100个tcid
50
病毒量,即分 别稀释316倍、708倍倍进行体外抗病毒试验。
[0172]
表3 hcov
‑
229e对mrc
‑
5细胞的半数病毒感染量
[0173]
[0174][0175]
表4 h1n1对mdck细胞的半数病毒感染量
[0176][0177]
3.3系列浓度zonk2003系列化合物对感染病毒后的细胞活力的影响
[0178]
化合物zonk2003
‑
4、zonk2003
‑
2抗冠状病毒(hcov
‑
229e)的ec
50
分别为 12.83μmol/l、15.00μmol/l;化合物zonk2003
‑
4、zonk2003
‑
2抗甲型流感病毒(h1n1) 的ec
50
分别为11.75μmol/l、18.19μmol/l。
[0179]
干扰素α2b对冠状病毒(hcov
‑
229e)的ec
50
为2.42
×
102iu/ml;磷酸奥司他韦 对甲型流感病毒(h1n1)的ec
50
为5.06μmol/l。
[0180]
表5供试品/对照品对hcov
‑
229e感染mrc
‑
5细胞的影响
[0181]
[0182][0183]
表6两种化合物对h1n1感染mdck细胞的影响
[0184]
[0185][0186]
4.结论与评价
[0187]
在本试验条件下:
[0188]
化合物zonk2003
‑
4、zonk2003
‑
2在测试浓度范围内(1.56~50.0μmol/l)对mrc
‑
5、 mdck细胞均无明显细胞毒性。阳性对照药在测试浓度范围内(0.625~20mmol/l)对 mrc
‑
5、mdck细胞均无明显毒性。
[0189]
化合物zonk2003
‑
4、zonk2003
‑
2对试验中的两株病毒均具有不同程度的抑制作用, 对冠状病毒(hcov
‑
229e)的ec
50
分别为12.83μmol/l、15.00μmol/l;对甲型流感 病毒(h1n1)的ec
50
分别为11.75μmol/l、18.19μmol/l。
[0190]
阳性对照药对实验中的两株病毒均具有不同程度的抑制作用,对冠状病毒 (hcov
‑
229e)的ec
50
为2.42
×
102iu/ml;磷酸奥司他韦对甲型流感病毒(h1n1)的 ec
50
为5.06μmol/l。
[0191]
实施例15、化合物对甲型流感病毒a/fm/1/47(h1n1)感染小鼠的保护作用
[0192]
受试物:zonk2003
‑
0、zonk2003
‑
2、zonk2003
‑
4;由广东中科药物研究有限公司 提供。
[0193]
磷酸奥司他韦颗粒,规格15mg
×
10袋装,宜昌东阳光长江药业股份有限公司产品, 批号:0371912115,有效期至2021.12.11,用于抗甲型流感病毒的阳性对照药;
[0194]
实验材料:甲型流感病毒鼠肺适应株a/fm/1/47(h1n1),接种鸡胚,收集尿囊液 保存。icr小鼠,体重18~22g。给药期间自由进食、饮水,每天12小时光照,12小 时黑暗,温度22
±
2℃,湿度55
‑
70%。实验方法:适应性饲养3天后,开始进行实验。 除未感染对照组以外,其它各组小鼠用乙醚轻度麻醉,鼻腔内接种用生理盐水稀释的 相当于8
×
ld
50
的流感病毒a/fm/1/47(h1n1)的鸡胚尿囊液50μl/只,阳性对照奥司他 韦组和实施例化合物组小鼠于感染后2h首次灌胃给药,每种化合物以10μmol/kg、 20μmol/kg、30μmol/kg的剂量口服给药,每天给药两次,连续用药5天。观察14 天内小鼠的存活情况,并计算药物对于小鼠的死亡保护率(死亡保护率=模型组死亡率 一实验组死亡率)。
[0195]
表7、化合物对a型流感病毒(h1n1甲型流感病毒)感染小鼠的保护作用
[0196][0197]
实施例16:药物对流感病毒h1n1感染导致的小鼠肺部炎症的缓解作用
[0198]
实验方法:适应性饲养3天后,开始进行实验。除未感染对照组以外,其它各组 小鼠用乙醚轻度麻醉,鼻腔内接种用生理盐水稀释的相当于8
×
ld
50
的流感病毒 a/fm/1/47(h1n1)的鸡胚尿囊液50μl/只,阳性对照奥司他韦组小鼠和供试给药组于病 毒感染24h后以80mg/kg首次灌胃给药,以后每日1次,病毒对照组及未感染对照组 同法口服生理盐水,每日1次,给药体积为0.1ml/10g体重。共5天。第6天每组取 3只小鼠称重,摘除眼球放血致死,取出全肺,称重,计算肺指数及肺指数抑制率。
[0199]
失重百分比%=给药前体重
‑
给药后体重/给药前体重
×
100%
[0200]
肺指数=小鼠肺重/小鼠体重
×
100
[0201]
肺指数抑制率(%)=病毒对照组肺指数均数
‑
给药组肺指数均数/病毒对照组肺指 数均数
×
100%
[0202]
表8
[0203][0204][0205]
实验结果:因此实施例化合物对流感病毒引起的肺部炎症有明显的保护和抑制作 用,且效果优于奥司他韦对照组和zonk2003
‑
0组。
[0206]
实施例17:zonk2003药物大鼠药代动力学实验
[0207]
雄性大鼠分成4组,分别为zonk2003
‑
0注射和口服、zonk2003
‑
2注射和口服, 其中,zonk2003
‑
0注射和口服、zonk2003
‑
2注射组每组3只,zonk2003
‑
2口服 组每组6只,分别为每只大鼠采集10个不连续的时间点。
[0208]
建立测定icr小鼠全血中zonk2003
‑
0、zonk2003
‑
2浓度的lc
‑
ms/ms分析方 法。所得血药浓度数据同时采用药动学处理软件pharsight phoenix winnonlin 8.0非房 室模型计算相关药代动力学参数。
[0209]
大鼠灌胃zonk2003
‑
2,口服剂量25mg/kg,注射zonk2003
‑
2为1.21mg/kg;
[0210]
大鼠灌胃zonk2003
‑
0,口服剂量2.51mg/kg,注射zonk2003
‑
0为1.00mg/kg,
[0211]
检测血药浓度,计算药代动力学参数:
[0212]
溶剂:20%solutol hs
‑
15/生理盐水
[0213]
详细结果见下表。
[0214]
表9大鼠尾静脉给药1.00mg/kg的zonk2003
‑
0后,大鼠体内原型药物血药浓 度检测结果(ng/ml)
[0215][0216]
表10大鼠尾静脉给药1.00mg/kg的zonk2003
‑
0后,原型药物主要药代动力学参数
[0217][0218][0219]
表11大鼠灌胃给药2.51mg/kg的zonk2003
‑
0后,大鼠体内原型药物血药浓度检测结 果(ng/ml)
[0220][0221]
表12大鼠灌胃给药2.51mg/kg的zonk2003
‑
0后,原型药物主要药代动力学参数
[0222][0223][0224]
表13大鼠尾静脉给药1.21mg/kg的zonk2003
‑
2后,原型药物主要药代动力学参数
[0225][0226]
表14 zonk2003
‑
2灌胃给药25mg/kg组大鼠原型药物血药浓度检测结果(ng/ml)
[0227][0228]
nd:未检测到,即血药浓度达峰后测定值低于定量下限点
[0229]
表15大鼠灌胃给药25mg/kg的zonk2003
‑
2后,原型药物主要药代动力学参数
[0230][0231]
由上表可知,zonk2003
‑
0的绝对生物利用度f值为62.5%,zonk2003
‑
2组的 绝对生物利用度f值为106.0%。
[0232]
实施例18:zonk2003系列化合物的镇痛作用实验
[0233]
实施例化合物对冰醋酸致nih小鼠扭体的影响
[0234]
nih小鼠:spf级,雌雄各半,15
‑
17g,110只,由广东省医学实验动物中心 提供,zonk2003
‑
0、zonk2003
‑
2、zonk2003
‑
4、zonk2003
‑
14、zonk2003
‑
18; 由广东中科药物研究有限公司提供。
[0235]
2、实验方法和结果
[0236]
nih小鼠110只,雄性,体重15
‑
17g。检疫3天,检疫结束后按体重随机分成 组,每组10只,即:模型组、实验药物组。实验时各小鼠尾静脉给予相应的药物, 给药容积:0.1ml/10g体重,模型组给予等容积的生理盐水。给药后0.5小时按 10ml/kg体重腹腔注射0.7%(0.7g/100ml)hac致痛,然后立即观察15min内各 鼠的扭体反应,并记录扭体次数,计算抑制率。
[0237]
试验结果如表17所示,各剂量组与模型组比较均能显著抑制冰醋酸致nih小 鼠的扭体次数(p<0.05或p<0.01),作用强度优于zonk2003
‑
0组。
[0238]
表17化合物对冰醋酸致nih小鼠扭体的影响
[0239][0240][0241]
实施例19dhodh酶抑制活性测试
[0242]
zonk2003
‑
0和zonk2003
‑
2、brequinar的dhodh酶活性测试结果如下:
[0243]
表18
[0244][0245]
zonk2003
‑
2与zonk2003
‑
0不同,zonk2003
‑
2不是通过dhodh酶的抑制发 挥抗病毒作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1