维生素E微胶束参与的异恶唑啉类化合物的水相制备方法
维生素e微胶束参与的异恶唑啉类化合物的水相制备方法
技术领域
1.本发明涉及一种水溶性维生素e微胶束参与的异恶唑啉类化合物的水相合成方法。
背景技术:
2.异恶唑啉作为一种含有n、o的五元杂环化合物,已经被广泛的应用于中间体以及具有生物活性的天然产物的合成过程中。异恶唑啉同样也扮演着药物分子骨架的身份,比如在新型广谱兽药弗雷拉纳、抗炎药物伐地昔布以及抗菌药物氟氯西林等药物中,异恶唑啉均起到了分子骨架的作用。除此之外,它也被广泛应用于抗抑郁药、抗结核药等的合成中。由于其独特的杂环结构,异恶唑啉一直是研究的热门。
3.micheli等人在1986年实现了肟与烯烃在nahco3的参与下实现1,3
‑
偶极环氧化反应,同时生成了溴取代的异恶唑啉,之后在碱与甲醇的作用下实现三位甲氧基异恶唑啉的合成。2020年荣良策所在课题组实现了在cu的催化作用下,经过1,3
‑
偶极环加成等步骤合成最终产物异恶唑啉衍生物,该反应中的异恶唑啉衍生物的氮源与氧源均来自硝基化合物(式一)。2015年徐斌等人研究发现了 cu(no3)2介导的烯烃与炔烃的[2+2+1]环化反应合成异恶唑啉的反应。
[0004][0005]
式一
[0006]
为了减少对异恶唑啉合成过程中的耐受性与区域选择性的影响,韩冰等人在 2012年首次利用过量的tempo引发β,γ
‑
不饱和烯烃肟分子的自由基环化反应 (式二)。在该反应过程中,tempo作为自由基捕捉剂捕获异恶唑啉骨架中间体,从而得到目标分子异恶唑啉。2016年于伟等人提出醋酸铜也可以催化β,γ
‑ꢀ
和γ,δ
‑
不饱和酮肟与富电子的芳基胺和脂胺发生自由基反应,可以用于合成异恶唑啉及其衍生物。
[0007][0008]
式二
[0009]
但是,这些反应都存在产率低、合成步骤多、部分反应条件苛刻,使用的催化剂毒性较高,部分价格也较为昂贵等缺点。因此,我们希望建立一种简便的、 tpgs
‑
750
‑
m(水溶性维生素e)微胶束(micelle)参与的水相1,3
‑
偶极环加成反应来制备异恶唑啉的合成方法。由于2wt.%的tpgs
‑
750
‑
m水溶液容易形成微胶束,此微胶束亲水端(peg端)朝外,分散在水相当中;而亲油端(维生素e 端)向内,因此微胶束内部就会形成类似一个“亲油的环境”,可供化学反应在其中完成反应,从而实现了化学反应在水相中进行。与以前的方法相
比,本方法主要优点是水作为反应的溶剂,绿色环保,反应条件简单,收率高,纯度高。
技术实现要素:
[0010]
为解决现有技术污染大、废物多等问题,本发明提供一种式(ⅲ)所示的异恶唑啉类化合物绿色简便的合成方法,该方法在tpgs
‑
750
‑
m形成的微胶束参与下,在水相中完成了异恶唑啉类化合物的合成,该发明不仅具有反应底物适用性广的特点,而且减少了有机溶剂的使用,避免了传统方法的条件苛刻,环境危害严重等缺陷,具有反应条件温和、高效、绿色环保等特点,响应了可持续发展理念,实现了溶剂零排放。
[0011][0012]
为了实现上述目的,本发明采用如下技术方案:
[0013]
本发明提供了一种式(ⅲ)所示的异恶唑啉类化合物的水相合成方法,所述方法为:
[0014]
以式(i)所示的苯甲醛肟为底物,在质量浓度为1wt%
‑
5wt%(优选2wt%) 的表面活性剂的水溶液中,在n
‑
氯代丁二酰亚胺(ncs)、碱性物质的共同作用下,与式(ii)所示的烯类化合物在室温下反应6
‑
16h(优选8h),所得反应液经后处理,得到式(ⅲ)所示异恶唑啉类化合物;式(ii)所示的烯类化合物、式(i)所示的苯甲醛肟、n
‑
氯代丁二酰亚胺与碱性物质的物质的量之比为 1:1
‑
1.5:1
‑
1.8:0.5
‑
2(优选为1:1.5:1.8:1.3);
[0015][0016]
其中,r1、r2、r3各自独立为h、c1‑
c6烷基、苯基、或或者r3与r1连接成环并与二者之间的碳构成五元碳环,且r2为h;
[0017]
所述的碱性物质选用下列之一:氢氧化钠(naoh)、碳酸钾(k2co3)、三乙胺(et3n)、哌啶(优选为三乙胺或哌啶,最优选为三乙胺);所述表面活性剂为生育酚甲氧基聚乙二醇琥珀酸(tpgs
‑
750
‑
m)。
[0018]
反应式如下:
[0019][0020]
本发明推荐所述反应在搅拌条件下进行。
[0021]
进一步,所述表面活性剂的水溶液的体积以式(ii)所示的取代炔烃的物质的量计为5
‑
20ml/mmol(优选10ml/mmol)。
[0022]
优选地,r1为苯基、己烷基、或r2为h、甲基或苯基,r3为h或苯基。
[0023]
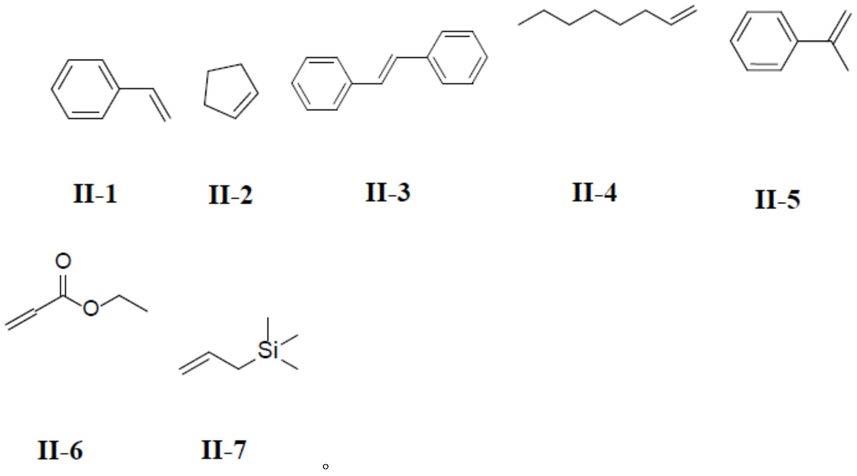
进一步优选地,所述式(ii)所示的烯类化合物为下列之一:
[0024][0025]
进一步,所述的后处理为:用乙酸乙酯萃取所述反应液,合并有机相,减压蒸去溶剂,固体残留物以体积比为1:2的石油醚:乙酸乙酯混合液进行柱层析分离,收集含目标产物的洗脱液,减压蒸去溶剂,得到式(ⅲ)所示异恶唑类化合物。
[0026]
进一步,本发明使用的表面活性剂十二烷基硫酸钠(sds)、聚乙二醇辛基苯基醚(trition x
‑
100)和十六烷基三甲基溴化铵(ctab)为市售产品,生育酚甲氧基聚乙二醇琥珀酸(tpgs
‑
750
‑
m)可采用市售产品,本发明中为自制,优选为2wt.%的tpgs
‑
750
‑
m;
[0027]
进一步优选地,所述tpgs
‑
750
‑
m按如下方法制备:
[0028]
(1)搅拌条件下,向生育酚和琥珀酸酐的甲苯溶液中加入三乙胺。随后继续搅拌。反应结束后,向反应混合物中加入水,然后用二氯甲烷萃取。合并的有机层用1mol/l的盐酸和水洗涤,用无水硫酸钠干燥,并在真空减压下除去溶剂,得到黄色液体,将其使用硅胶柱色谱法纯化。洗脱液经真空减压下除去溶剂后得到呈白色固体状的生育酚琥珀酸酯;
[0029]
(2)将含有生育酚琥珀酸酯,聚乙二醇单甲醚
‑
750和对甲苯磺酸的甲苯混合物使用迪安
‑
斯达克榻分水器回流。反应结束后,冷却至室温,将混合物倒入饱和碳酸氢钠水溶液中,并用二氯甲烷萃取。合并的有机层用饱和碳酸氢钠,饱和氯化钠洗涤,用无水硫酸钠干燥,真空减压下除去溶剂后得到目标产物。
[0030]
与现有技术相比,本发明的有益效果在于:以水作为反应溶剂,减少了有机溶剂的使用量,实现了溶剂的零排放;充分利用水的优秀理化性质,反应条件温和且高效,表面活性剂tpgs
‑
750
‑
m通过处理可以回收利用,完全符合环境友好的原则;反应底物适用性广,可以应用于醛肟和烯烃合成异恶唑啉,为合成异恶唑啉提供了一个简易环保的制备方法。
[0031]
说明书附图
[0032]
图1是水溶性维生素e(tpgs
‑
750
‑
m)的1h nmr谱;
[0033]
图2是水溶性维生素e(tpgs
‑
750
‑
m)的
13
c nmr谱。
具体实施方式
[0034]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0035]
进一步,本发明使用的表面活性剂十二烷基硫酸钠(sds)、聚乙二醇辛基苯基醚(trition x
‑
100)为市售产品,生育酚甲氧基聚乙二醇琥珀酸溶液 (tpgs
‑
750
‑
m,水溶性维生素e)可以购买获得,但本发明的tpgs
‑
750
‑
m为自制,优选为2wt.%tpgs
‑
750
‑
m。
[0036]
实施例中使用的表面活性剂tpgs
‑
750
‑
m为自制,制备方法如下:
[0037][0038]
第一步:向搅拌下的生育酚(4.3g,10mmol)和琥珀酸酐(1.5g,15mmol) 的甲苯(20ml)溶液中加入三乙胺(0.35ml,2.5mmol)。随后,在60℃下继续搅拌5h。反应结束后,向反应混合物中加入水(10ml),然后用二氯甲烷 (3
×
10ml)萃取。合并的有机层用1mol/l的盐酸(3
×
50ml)和水(2
×
30 ml)洗涤,用无水硫酸钠干燥,并真空浓缩,得到生育酚琥珀酸酯粗品,最后利用重结晶方法得到呈白色固体状的生育酚琥珀酸酯(5.25g,收率99%)。结晶条件为:结晶时间26小时,结晶温度4℃,正己烷/生育酚琥珀酸酯粗品的用量8ml/g。
[0039]
第二步:将含有生育酚琥珀酸酯(2.97g,5.6mmol),聚乙二醇单甲醚
‑
750(4 g,5.33mmol)和对甲苯磺酸(0.15g,0.79mmol)的甲苯(20ml)混合物使用迪安
‑
斯达克榻分水器回流5小时。反应结束后,冷却至室温,将混合物倒入饱和碳酸氢钠水溶液中,并用二氯甲烷(3
×
10ml)萃取。合并的有机层用饱和碳酸氢钠(3
×
50ml),饱和氯化钠(2
×
30ml)洗涤,用无水硫酸钠干燥,真空减压下除去溶剂后得到目标产物(6.6g,98%),产率80%,淡黄色蜡状固体。
[0040]1h nmr(400mhz,cdcl3)δ4.27(m,2h),3.70
‑
3.65(m,60h),3.55(m,2h),3.38 (s,3h),2.93(t,j=7.2hz,2h),2.79(t,j=7.2hz,2h),2.58(t,j=6.8hz,2h),2.08 (s,3h),2.01(s,3h),1.97(s,3h),1.81
‑
1.75(m,2h),1.52(m,3h),1.38(m,3h), 1.27
‑
1.23(m,12h),1.14(s,3h),1.07(s,3h),0.87
‑
0.84(m,12h);
13
c nmr(100 mhz,cdcl3)δ172.2,170.9,149.5,140.6,126.7,125.0,123.0,117.4,,75.1,72.0, 70.6,70.58
‑
70.33(m,多个
碳),69.1,64.0,59.0,39.4,37.55
‑
37.29(m,多个碳), 32.79
‑
32.69(m,4c),29.2,28.9,28.0,24.816,24.805,24.5,22.8,22.7,21.1,20.6, 19.77
‑
19.61(m,多个碳),1 13.0,12.1,11.8.
[0041]
实施例1:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0042][0043]
在50ml的反应瓶中加入241mg(1.8mmol)ncs、182mg(1.5mmol)苯甲醛肟(i),然后将10ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,室温下搅拌4小时后,再依次加入182μl(1.3mmol)et3n和104mg(1mmol)苯乙烯(ii
‑
1),室温下反应8h后反应结束,向反应瓶中加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,(下层水相中的tpgs
‑
750
‑
m用二氯甲烷萃取可分离回收,见实施例5),合并两次得到的有机相,减压蒸去溶剂,固体残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯(v/v,下同)=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基异恶唑啉217.7mg,白色固体,收率为97.5%。hplc检测纯度为98.6%。式(
ⅲꢀ‑
1)的结构表征如下:
[0044]1h nmr(500mhz,cdcl3)δ7.73(dd,j=6.6,2.9hz,2h),7.46
‑
7.38(m,7h), 7.37
‑
7.33(m,1h),5.76(dd,j=11.0,8.3hz,1h),3.80(dd,j=16.5,11.0hz,1h), 3.37(dd,j=16.6,8.3hz,1h);
13
c nmr(126mhz,cdcl3)δ156.08,140.93, 130.10,129.49,128.73,128.71,128.20,126.73,125.85,82.56,43.13;gc
–
ms(ei):m/z 223[m
+
].
[0045]
实施例2:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0046]
在50ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,室温下搅拌4小时后,再依次加入7μl(0.05mmol)et3n和10.4mg(0.1mmol) 苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉13.8mg,白色固体,收率为62%。hplc检测纯度为95%。
[0047]
实施例3:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0048]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,室温下搅拌4小时后,再依次加入21μl(0.15mmol)et3n和10.4mg(0.1mmol) 苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉21.0mg,白色固体,收率
为94%。hplc检测纯度为97%。
[0049]
实施例4:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0050]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入28μl(0.2mmol)et3n,10.4mg (0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml 乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml 乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑ꢀ
二氢异恶唑啉20.3mg,白色固体,收率为91%。hplc检测纯度为96.9%。
[0051]
实施例5:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0052]
在500ml的反应瓶中加入2.41g(18mmol)ncs、1.82g(15mmol)苯甲醛肟(i
‑
1),然后将100ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4.5小时。再依次加入1.82ml(13mmol)et3n,1.04g (10mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入50ml 乙酸乙酯,搅拌5min后静置分层,收取上层乙酸乙酯相后,下层水相再加入50 ml乙酸乙酯,搅拌5min后静置分层,收取上层乙酸乙酯相后,下层水相中的 tpgs
‑
750
‑
m分别用50ml二氯甲烷萃取两次,合并二氯甲烷萃取液,减压蒸去二氯甲烷,回收得1.6g tpgs
‑
750
‑
m;合并两次得到的乙酸乙酯相,减压蒸去溶剂,固体残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉。2.188g,白色固体,收率为98%。hplc检测纯度为98.9%。
[0053]
实施例6:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0054]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入6mg(0.15mmol)naoh,10.4mg (0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml 乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml 乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑ꢀ
二氢异恶唑啉3.8mg,白色固体,收率为17%。
[0055]
实施例7:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0056]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入20.7mg(0.15mmol)k2co3,10.4 mg(0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入 2ml乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,下层水相再加入2 ml乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
ꢀ‑
4,5
‑
二氢异恶唑啉2.9mg,白色固体,收率为13%。
[0057]
实施例8:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0058]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入30.7mg(0.13mmol) cs2co3,10.4mg(0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,用 tlc检测反应液,发现没有目标产物(
ⅲ‑
1)生成。
[0059]
实施例9:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0060]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入13μl(0.13mmol)哌啶,10.4mg (0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml 乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,下层水相再加入2ml 乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑ꢀ
二氢异恶唑啉17.2mg,白色固体,收率为77%。hplc检测纯度为96%。
[0061]
实施例10:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0062]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入14μl(0.1mmol)et3n,10.4mg (0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml 乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,下层水相再加入2ml 乙酸乙酯,搅拌2min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑ꢀ
二氢异恶唑啉20.8mg,白色固体,收率为93%。hplc检测纯度为97.1%。
[0063]
实施例11:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0064]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml sds(15mol%)加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n,10.4mg(0.1mmol) 苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉12.7mg,白色固体,收率为57%。
[0065]
实施例12:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0066]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml tritonx
‑
100加入瓶中,并将混合液在室温下搅拌4 小时。四小时后,再依次加入18.2μl(0.13mmol)et3n,10.4mg(0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减
压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉15.0mg,白色固体,收率为67%。
[0067]
实施例12:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0068]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml ctab加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入18.2μl(0.13mmol)et3n,10.4mg(0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉4.9mg,白色固体,收率为22%。
[0069]
实施例13:3
‑
苯基
‑
3a,5,6,6a
‑
四氢环戊异恶唑啉的合成
[0070][0071][0072]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n, 6.8mg(0.1mmol)环戊烯(ii
‑
2),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
2)所示的3
‑ꢀ
苯基
‑
3a,5,6,6a
‑
四氢环戊异恶唑啉18.35mg,白色固体,收率为98%。hplc检测纯度为99%。式(
ⅲ‑
2)的结构表征如下:
[0073]1h nmr(500mhz,cdcl3)δ7.76
‑
7.67(m,2h),7.44
‑
7.37(m,3h),5.23(dd,j =8.8,4.9hz,1h),4.14
‑
3.97(m,1h),2.23
‑
2.16(m,1h),2.01
‑
1.94(m,1h), 1.93
‑
1.86(m,1h),1.82
‑
1.72(m,2h),1.61
‑
1.50(m,1h);
13
c nmr(126mhz, cdcl3)δ158.47,129.60,129.41,128.67,126.92,87.71,52.06,35.84,31.59,23.44; gc
‑
ms(ei):m/z 187[m
+
].
[0074]
实施例14:3,4,5
‑
三苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0075][0076]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时后,再依次加入18.2μl(0.1 3mmol)et3n,18mg (0.1mmol)1,2
‑
二苯基乙烯(ii
‑
3),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相
后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
3)所示的3,4,5
‑ꢀ
三苯基
‑
4,5
‑
二氢异恶唑啉28.4mg,白色固体,收率为95%。hplc检测纯度为 98.7%。式(
ⅲ‑
3)的结构表征如下:
[0077]1h nmr(500mhz,cdcl3)δ7.65
‑
7.59(m,2h),7.43
‑
7.28(m,13h),5.55(d,j =5.5hz,1h),4.71(d,j=5.5hz,1h);
13
c nmr(126mhz,cdcl3)δ157.59, 140.87,139.19,129.88,129.46,128.89,128.59,128.27,127.88,127.57,127.36,125.33,91. 75,63.30;gc
‑
ms(ei):m/z 299[m
+
].
[0078]
实施例15:5
‑
己基3
‑
苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0079][0080]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n, 11.2mg(0.1mmol)辛
‑1‑
烯(ii
‑
4),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
4)所示的5
‑ꢀ
己基3
‑
苯基
‑
4,5
‑
二氢异恶唑啉21.8mg,白色固体,收率为94%。hplc检测纯度为98.3%。式(
ⅲ‑
4)的结构表征如下:
[0081]1h nmr(500mhz,cdcl3)δ7.72
‑
7.64(m,2h),7.47
‑
7.36(m,3h),4.81
‑
4.68 (m,1h),3.40(dd,j=16.4,10.4hz,1h),2.98(dd,j=16.4,8.2hz,1h),1.87
‑
1.76 (m,1h),1.67
‑
1.59(m,1h),1.52
‑
1.28(m,8h),0.91(t,j=6.7hz,3h);
13
c nmr (126mhz,cdcl3)δ156.36,129.98,129.84,128.64,126.57,81.51,39.94,35.35,31.72, 29.12,25.49,22.55,14.03;gc
‑
ms(ei):m/z 231[m
+
].
[0082]
实施例16:5
‑
甲基
‑
3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0083][0084]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小
时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n, 11.8mg(0.1mmol)2
‑
苯基
‑1‑
丙烯(ii
‑
5),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
5)所示的5
‑
甲基
‑
3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉22.5mg,白色固体,收率为95%。hplc 检测纯度为98.4%。式(
ⅲ‑
5)的结构表征如下:
[0085]1h nmr(500mhz,cdcl3)δ7.70
‑
7.66(m,2h),7.52(dd,j=7.9,1.6hz,2h), 7.43
‑
7.38(m,5h),7.31(d,j=7.6hz,1h),3.58
‑
3.46(m,2h),1.83(s,3h);
13
c nmr(126mhz,cdcl3)δ156.16,145.51,129.98,129.92,1 2 8.68,128.51,127.38, 126.57,124.70,88.10,48.75,28.24;gc
‑
ms(ei):m/z 237[m
+
].
[0086]
实施例17:3
‑
苯基
‑
4,5
‑
二氢异恶唑啉
‑5‑
羧酸乙酯的合成
[0087][0088]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n, 10.0mg(0.1mmol)丙烯酸乙酯(ii
‑
6),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
6)所示的3
‑
苯基
‑
4,5
‑
二氢异恶唑啉
‑5‑
羧酸乙酯20.6mg,黄色固体,收率为94%。hplc 检测纯度为98%。式(
ⅲ‑
6)的结构表征如下:
[0089]1h nmr(500mhz,cdcl3)δ7.89
‑
7.80(m,2h),7.50
‑
7.47(m,3h),5.17(s, 1h),4.29
‑
4.25(m,2h),3.65
‑
3.63(m,2h),1.34(t,j=7.1hz,3h);13c nmr(126 mhz,cdcl3)δ170.13,155.95,130.43,128.73,128.58,126.88,78.07,61.92,38.80,14.05; gc
‑
ms(ei):m/z 219[m
+
].
[0090]
实施例19:3
‑
苯基
‑5‑
(三甲基甲硅烷基)
‑
4,5
‑
二氢异恶唑啉的合成
[0091]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、18.2mg(0.15mmol) 苯甲醛肟(i),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小
时。四小时后,再依次加入18.2μl(0.13mmol)et3n, 11.4mg(0.1mmol)烯丙基三甲基硅烷(ii
‑
7),室温下反应8h。反应结束后,向反应瓶中加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入2ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
7) 所示的3
‑
苯基
‑5‑
(三甲基甲硅烷基)
‑
4,5
‑
二氢异恶唑啉20mg,白色固体,收率为 91%。hplc检测纯度为97.3%。式(
ⅲ‑
7)的结构表征如下:
[0092]1h nmr(500mhz,cdcl3)δ7.67(dd,j=6.6,3.1hz,2h),7.44
‑
7.37(m,3h), 3.40(dd,j=16.2,9.8hz,1h),2.90(dd,j=16.1,9.2hz,1h),1.34
‑
1.06(m,2h), 0.13(s,9h);
13
c nmr(126mhz,cdcl3)δ156.71,129.80,128.63,126.50,80.18, 42.15,24.29,
‑
0.99;gc
‑
ms(ei):m/z 219[m
+
].
[0093]
实施例20:5
‑
苯基
‑3‑
[(2,4
‑
二硝基)]异恶唑啉的合成
[0094][0095]
在5ml的反应瓶中加入24.1mg(0.18mmol)ncs、31.7mg(0.15mmol) 2,4
‑
二硝基苯甲醛肟(i
‑
12),然后将1ml新配制的2wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,并将混合液在室温下搅拌4小时。四小时后,再依次加入18.2μl(0.1 3mmol)et3n,10.4mg(0.1mmol)苯乙烯(ii
‑
1),室温下反应8h。反应结束后,用tlc检测反应液,发现没有目标产物(
ⅲ‑
8)生成。
[0096]
实施例21:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0097][0098]
在50ml的反应瓶中加入241mg(1.8mmol)ncs、182mg(1.5mmol)苯甲醛肟(i),然后将10ml新配制的1wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,室温下搅拌4小时后,再依次加入182μl(1.3mmol)et3n和104mg(1mmol)苯乙烯(ii
‑
1),室温下反应8h后反应结束,向反应瓶中加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,合并两次得到的有机相,减压蒸去溶剂,固体残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基异恶唑啉149.6 mg,白色固体,收率为67%。
[0099]
实施例22:3,5
‑
二苯基
‑
4,5
‑
二氢异恶唑啉的合成
[0100][0101]
在50ml的反应瓶中加入241mg(1.8mmol)ncs、182mg(1.5mmol)苯甲醛肟(i),然后将10ml新配制的5wt.%的tpgs
‑
750
‑
m水溶液加入瓶中,室温下搅拌4小时后,再依次加入182μl(1.3mmol)et3n和104mg(1mmol)苯乙烯(ii
‑
1),室温下反应8h后反应结束,向反应瓶中加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,下层水相再加入15ml乙酸乙酯,搅拌5min后静置分层,收取上层有机相后,(下层水相中的tpgs
‑
750
‑
m用二氯甲烷萃取可分离回收,见实施例5),合并两次得到的有机相,减压蒸去溶剂,固体残留物经柱层析分离,洗脱液为石油醚:乙酸乙酯=1:2,收集含目标产物的洗脱液,减压蒸去溶剂,得到如式(
ⅲ‑
1)所示的3,5
‑
二苯基异恶唑啉180.9mg,白色固体,收率为81%。hplc检测纯度为96.1%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1