非洲猪瘟病毒核酸检测的引物探针组、试剂盒及检测方法与流程
1.本发明属于动物病原分子诊断技术领域,具体涉及一种非洲猪瘟病毒核酸检测的引物探针组、试剂盒及检测方法。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引起的猪的一种急性、高度传染性、高致死率的传染病,临床上以高热、网状内皮系统出血为特征。所有年龄段的猪都易感,易感猪群的病死率甚至高达100%,对养猪业危害极大,被世界动物卫生组织(oie)列为必须通报的a类动物疫病,我国将其列为重点防控的一类动物疫病。
3.asfv除感染家猪外还能感染野猪和软蜱,可在这三者之间循环传播;加之存在隐性感染猪,以及受asfv污染的生猪产品的流通,使得该病的传播非常迅速。asfv在1921年首次在非洲肯尼亚发现后(eustace montgomery,1921),1957年传入欧洲葡萄牙,70~80年代传到欧洲和美洲(plowright,parker et al.1969),2007年先后在格鲁吉亚、亚美尼亚、俄罗斯爆发asf疫情。不到一个世纪的时间,该病从非洲起始几乎传遍全球。2018年,自我国在辽宁省首次报道asf疫情后,疫情迅速蔓延至全国,不仅给我国养猪业带来巨大的经济损失,而且作为全球最大的猪肉消费国,非洲猪瘟对我国国民生活的影响也是相当大的。
4.目前,asf尚无有效的治疗方法,短期内亦无安全高效的疫苗用于防控,其防控仍然依赖于快速、准确的诊断和扑杀。asf在临床症状上与猪瘟和高致病性猪繁殖与呼吸综合征难以区分,因此建立快速、准确的检测方法对于该病的防控至关重要。目前用于asfv的检测方法有酶联免疫吸附试验(elisa)、胶体金试纸条和核酸检测法。随着分子诊断技术的飞速发展,荧光定量pcr技术不仅有很高的敏感性和特异性,且能实现高通量检测大量样本,在分子诊断领域成为首选主流技术。目前国内已有多种荧光定量pcr试剂盒产品应用于asfv的检测,检测的靶标基本集中在asfv的主要结构蛋白编码基因vp72上。
5.影响荧光定量pcr检测效果的因素主要有三方面:一是标本因素,标本的采集部位、标本保存方法和保存时间等都会影响到检测时的靶标含量;二是人员因素,实验人员的技术水平和在实际操作过程中的操作习惯等对检测结果有直接影响;三是仪器因素,设备的稳定性、升降温速度、激发光源强度、软件算法等也会对检测结果的判定有影响。后两个因素可以人为控制,但第一个因素主要由疾病发生发展过程和宿主状态决定,很难人为控制。当国内开始出现asfv流行毒株强毒变弱的趋势时,被感染猪的病程延长,潜伏期增加,采样部位的病毒载体也大幅减少,对检测的第一个关键因素影响很大,使得asfv的检测难度更大。
6.我们可根据其基因组dna的复制这一事件将病毒增殖周期分为复制前阶段和复制后阶段。在病毒基因组进行大量复制前,机体感染细胞内的病毒相关dna的数量很少,如果感染过程延长,感染部位病毒数量少,那么即便是最主要的病毒结构编码基因,拷贝数也可能低于可检测的阈值,这也正是为什么asfv天然弱毒株检测难度更高的原因。因此,急需开
发一种提高asfv天然弱毒株检测敏感性和特异性的方法和检测试剂盒。
技术实现要素:
7.为解决目前asfv天然弱毒株检测难度高的难题,本发明筛选出asfv结构蛋白编码基因之外,病毒感染早期dna复制前转录丰度高的mrna序列作为荧光定量pcr的检测靶标,在荧光定量pcr过程中加上一步逆转录,通过一步法rt-qpcr实现asfv,尤其是asfv天然弱毒株的检测,不仅将asfv感染猪能检测到排毒的时间点尽可能的提前,最大效率的辅助猪场实施asf的“拔牙”净化策略,而且即便用于检测asfv病毒的结构蛋白编码基因,其扩增的rna模板数量也远远超过dna模板的拷贝数,大大提高asfv,尤其是asfv天然弱毒株的分子检测敏感性。
8.为实现上述目的,本发明提供一种非洲猪瘟病毒核酸检测的引物探针组,所述引物探针组包括以下两套引物探针组:
9.a引物探针组:用于检测非洲猪瘟病毒p72基因mrna和dna的引物探针组,所述p72基因的序列为seqidno:1所示的核苷酸序列;
10.b引物探针组:用于检测非洲猪瘟病毒a151r基因mrna的引物探针组,所述a151r基因的序列为seqidno:2所示的核苷酸序列。
11.优选的,所述a引物探针组包括:上游引物为seqidno:3所示的核苷酸序列,下游引物为seqidno:4所示的核苷酸序列,探针为seqidno:5所示的核苷酸序列;所述b引物探针组:上游引物为seqidno:6所示的核苷酸序列,下游引物为seqidno:7所示的核苷酸序列,探针为seqidno:8所示的核苷酸序列。
12.优选的,所述a引物探针组中的探针的5’端标记有荧光报告基团fam、3’端标记有荧光淬灭基团bhq1,所述b引物探针组中的探针的5’端标记有荧光报告基团vic、3’端标记有荧光淬灭基团bhq1。
13.本发明还提供一种非洲猪瘟病毒核酸检测试剂盒,所述试剂盒包括上述非洲猪瘟病毒核酸检测的引物探针组。
14.优选的,所述试剂盒还包括阳性对照品、阴性对照品、缓冲液、rnase抑制剂、dntp、酶混合液、无核酸酶水。
15.优选的,所述阳性对照品为含有整合p72基因序列和a151r基因序列的阳性质粒pmd-312151的te缓冲液,所述te缓冲液中的阳性质粒pmd-312151含量为1
×
105copies/μl;所述阴性对照为无菌水。
16.本发明还提供一种非诊断目的的非洲猪瘟病毒检测方法,应用上述非洲猪瘟病毒核酸检测试剂盒检测非洲猪瘟病毒,包括以下步骤:
17.a、提取待检样本模板;
18.b、配制rt-qpcr反应体系;
19.c、pcr扩增及检测;
20.d、结果判定。
21.优选的,所述rt-qpcr反应体系总体积为25μl,其中包括无核酸酶水13.55μl、10
×
缓冲液2.5μl、25mm的dntp 0.2μl、100
×
rnase抑制剂0.25μl、酶混合液1μl、20倍终浓度的a引物探针组1.25μl、20倍终浓度的b引物探针组1.25μl、扩增模板5μl。
22.优选的,所述pcr扩增及检测反应条件为:逆转录50℃15min;预变性95℃2min;循环扩增95℃10s,57℃30s,重复45个循环。
23.优选的,所述结果判定如下:
24.实验成立条件:阳性对照fam通道和vic通道出现典型的扩增曲线,fam通道ct值≤30,且vic通道ct值≤30;阴性对照无扩增曲线且无ct值;
25.在实验成立的情况下,按照如下标准判读结果:如果fam通道ct值≤40或vic通道ct值≤40,且出现典型的扩增曲线,则所述待检样本模板中存在非洲猪瘟病毒;如果fam通道和vic通道均无ct值,且无扩增曲线,则所述待检样本模板中检测不到非洲猪瘟病毒。
26.可以理解的,以seqidno:1所示的核苷酸序列和/或seqidno:2所示的核苷酸序列为asfv检测靶标为本发明的构思,本领域技术人员可知,针对本发明筛选出的上述asfv检测靶标可以设计不同的引物、探针,任何针对上述asfv检测靶标设计的引物、探针,以及任何包含针对上述asfv检测靶标设计的引物、探针的反应物、反应液、试剂盒均在本发明的保护范围之内。
27.本发明的非洲猪瘟病毒检测的引物探针组、试剂盒可用于以下样品中asfv核酸的检测,包括但不限于全血、血清、血浆、鼻拭子、唾液、淋巴结和猪肉组织。
28.本发明的有益效果是:现有asfv分子检测靶标集中在asfv主要结构蛋白编码基因,检测对象仅为dna,导致asfv天然弱毒株检测难度高、无法尽早检测出asfv感染猪,区别于以上情况,本发明筛选出asfv结构蛋白编码基因之外、病毒感染早期dna复制前转录丰度高的基因a151r,并将p72基因和a151r基因的mrna和dna一并作为荧光定量pcr的检测靶标,针对靶标设计两套特异性引物探针组,制备包含p72基因和a151r基因这两个检测靶标的特异性引物探针组的双重检测试剂盒,利用该双重检测试剂盒通过一步法rt-qpcr,不仅将asfv感染猪能检测到排毒的时间点尽可能提前,而且对asfv,尤其是asfv天然弱毒株的检出率大大提高,最大效率的辅助猪场实施asf的“拔牙”净化策略。
附图说明
29.图1为本发明的引物浓度梯度和探针浓度梯度两个变量的正交实验扩增曲线;
30.图2为本发明试剂盒评估检测敏感性实验的扩增曲线;
31.图3为本发明试剂盒评估检测特异性实验的扩增曲线;
32.图4-图8本发明试剂盒评估检测重复性实验的扩增曲线;其中,图4为第一次扩增曲线,图5为第二次扩增曲线,图6为第三次扩增曲线,图7为第四次扩增曲线,图8为第五次扩增曲线;
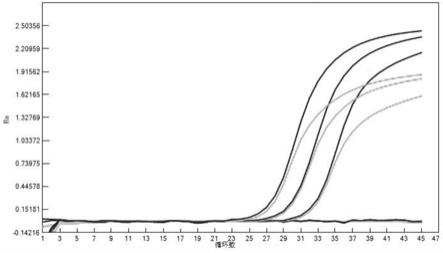
33.图9为本发明试剂盒检测asfv的扩增曲线。
具体实施方式
34.为了更清楚地表述本发明,下面结合实施例对本发明作进一步地描述。下述实施例中所使用的试验方法如无特殊说明,均为常规方法。
35.实施例1:rt-qpcr引物、探针设计
36.选择中国地区及邻国asfv分离株的p72/a151r基因序列,进行同源性分析,同时以猪的常见看家基因序列作为避免非特性结合的参考,设计出针对保守区,且不与猪的常见
看家基因序列结合的引物及taqman探针,序列如下所示:
37.一、asfv检测靶标p72基因的核苷酸序列为:
38.p72:
39.ttcttaaaccccgcaaattacttttttttaggtactgtaacgcagcacagctgaaccgttctgaagaagaagaaagttaatagcagatgccgataccacaagatcagccgtagtgatagaccccacgtaatccgtgtcccaactaatataaaattctcttgctctggatacgttaatatgaccactgggttggtattcctcccgtggcttcaaagcaaaggtaatcatcatcgcacccggatcatcgggggttttaatcgcattgcctccgtagtggaagggtatgtaagagctgcagaactttgatggaaatttatcgataagattgataccatgagcagttacggaaatgtttttaataataggtaatgtgatcggatacgtaacggggctaatatcagatatagatgaacatgcgtctggaagagctgtatctctatcctgaaagcttatctctgcgtggtgagtgggctgcataatggcgttaacaacatgtccgaacttgtgccaatctcggtgttgatgaggattttgatcggagatgttccaggtaggttttaatcctataaacatatattcaatgggccatttaagagcagacattagtttttcatcgtggtggttattgttggtgtgggtcacctgcgttttatggacacgtatcagcgaaaagcgaacgcgttttacaaaaaggttgtgtatttcaggggttacaaacaggttattgatgtaaagttcattattcgtgagcgagatttcattaatgactcctgggataaaccatggtttaaagcgtatattgcgtctac(seqidno:1)
40.针对asfv的p72基因的核苷酸序列设计的特异性引物探针组如下:
41.p72-1f:atcggatacgtaacggggct(seqidno:3)
42.p72-1r:ttatgcagcccactcaccac(seqidno:4)
43.p72-1p:5'fam-tgcgtctggaagagctgtatctctatcctgaaagc-bhq1-3'(seqidno:5)
44.二、asfv检测靶标a151r基因的核苷酸序列为:
45.a151r:
46.atgatggcgttgttacacaaagaaaagcttatagagtgcatctatcatgagctagaaaatggcgggacaatattgcttctaacaaaaaatattgttgtgtcagaaatttcatacattggcaatacttataaatattttacctttaatgacaatcatgatctgataagcaaagaagatcttaaaggagcaacatccaaaaacattgctaaaatgatttataattggattataaaaaatcctcaaaataataagatttggagtggtgagccgcgtactcaaatttattttgaaaatgatttatatcatacaaattacaatcataaatgtataaaagatttttggaatgtttcaacttcagtcggtcctcatatctttaatgatcgtagcatttggtgtactaaatgcacatccttttacccatttaccaacattatgtcgcccaatatattccaataa(seqidno:2)
47.针对asfv的a151r基因的核苷酸序列设计的特异性引物探针组如下:
48.a151r-5f:tggcgttgttacacaaagaaaag(seqidno:6)
49.a151r-5r:aatgtttttggatgttgctccttt(seqidno:7)
50.a151r-5p:5'vic-cttctttgcttatcagatcatgattgtcat-bhq1-3'(seqidno:8)
51.其中,基因探针中的fam、vic为荧光报告集团,bhq1为荧光淬灭基团。
52.上述引物、探针均由上海百力格生物技术有限公司合成。
53.实施例2:asfv rt-qpcr检测试剂盒的制备
54.1rt-qpcr反应体系及反应条件优化
55.1.1反应体系的优化:
56.根据引物的理论tm值,初步拟定反应程序为:逆转录50℃15min;预变性95℃2.5min;循环扩增95℃10sec,56℃40sec(采集荧光信号),重复45个循环
57.分别设置引物浓度梯度和探针浓度梯度两个变量的正交实验。每个反应体系(25μ
l)中,浓度为20μm的探针分别添加0.0625μl、0.125μl、0.25μl;浓度为20μm的引物分别添加0.125μl、0.25μl、0.5μl、1μl,组合形式如表1所示:
58.表1引物、探针添加量
[0059][0060]
每一组引物探针有六种浓度组合,两组引物探针各个浓度组合交叉组合数共36组。以asfv共提核酸(dna和rna)作为检测样本,将每个组合设置2个复孔进行试验,扩增结果曲线图如图1所示,实验结果显示两组引物探针的最佳配比为a引物组的p72-1f和p72-1r各0.25μl、探针p72-1p 0.125μl;b引物组的a151r-5f和a151r-5r各0.25μl、探针a151r-5 0.065μl。将两组引物探针浓度分别配制成20倍终浓度的储存液:a引物探针组,50μl无核酸水中加20μl引物p72-1f(20μm)、20μl引物p72-1r(20μm)和10μl探针p72-1p(20μm);b引物探针组,54.8μl无核酸水中加20μl引物a151r-5f(20μm)、20μl引物a151r-5r(20μm)和5.2μl探针a151r-5p(20μm)。最佳反应体系最终如表2所示:
[0061]
表2最佳反应体系(总体积25μl)
[0062]
组分体积(μl)无核酸酶水13.5510x缓冲液2.5dntp(每种25mm)0.2rnase抑制剂(100x)0.25酶混合液120倍浓度a引物探针组1.2520倍浓度b引物探针组1.25扩增模板5
[0063]
1.2反应程序的优化
[0064]
将asfv共提核酸作为扩增样本,稀释到中等浓度和低浓度(通过预实验确定扩增结果ct值在29~32之间的模板稀释度为中等浓度样本;ct值在32~40之间的模板稀释度为低浓度样本)。设定预变性时间(2min、2.5min、3min)、退火延伸温度(55℃、56℃、57℃)、退火延伸时间(30sec、35sec、40sec)这三个变量,选用1.1中优化的反应体系,分别用中等浓度和低浓度样本扩增,每种组合设置3个复孔。根据测试最佳结果,确定双重荧光pcr的最佳反应程序为:逆转录50℃15min;预变性95℃2min;循环扩增95℃10sec,57℃30sec(采集荧光信号),重复45个循环。
[0065]
表3最佳反应程序
[0066][0067][0068]
2阳性对照品的制备
[0069]
2.1重组质粒pmd-72151的获得:将asfv的p72/a151r基因序列采用dna合成技术,合成后直接连接至pmd18t载体。dan的合成和重组质粒的获得委托南京金斯瑞生物科技有限公司完成。
[0070]
2.2重组质粒pmd-72151的制备:将南京金斯瑞生物科技有限公司提供的质粒pmd-72151溶解后,取1μl转化大肠杆菌dh5α感受态细胞,涂布于含有100μg/ml羧苄青霉素的lb平板,37℃恒温箱培养16h后,挑取4个单菌落,接种lb肉汤培养基,37℃恒温摇床培养12h后,提取质粒进行酶切和测序鉴定,将确认无误的阳性克隆留存菌种,并扩大培养提取质粒。
[0071]
2.3配制阳性质粒pmd-72151的te缓冲液,te缓冲液中阳性质粒pmd-72151的含量为1
×
105copies/μl,该te缓冲液作为阳性对照品。
[0072]
3阴性对照品设置为无菌无酶水。
[0073]
实施例3、asfv rt-qpcr检测试剂盒敏感性评估
[0074]
将阳性质控质粒pmd-72151进行梯度稀释,分别稀释到含量为50、5、0.5copies/μl,作为扩增样本,每个样本浓度作10个复孔,使用上述组装的双重荧光rt-pcr检测试剂盒对其进行检测,两个靶标各自对应的不同荧光通道的ct值见表4,扩增曲线见图2:
[0075]
表4本发明试剂盒敏感性评估各样本ct值
[0076]
[0077][0078]
该试剂盒的检测敏感性在模板浓度5copies/μl时检出率100%,模板浓度0.5copies/μl时检出率约50%(5/10)。
[0079]
实施例4、asfv rt-qpcr检测试剂盒特异性验证
[0080]
将健康猪全血(n1)、健康猪肉(n2)、猪繁殖于呼吸综合征病毒细胞培养液(n3)、猪瘟病毒细胞培养液(n4)、猪圆环病毒2型细胞培养液(n5)、猪伪狂犬病毒灭活疫苗(n6)、大肠杆菌培养液(n7)、猪链球菌培养液(n8)、猪肺炎支原体细胞培养液(n9)样本提取的核酸,作为特异性评估样本,使用本发明的双重荧光rt-pcr检测试剂盒对其进行检测,每个样本作一个复管,检测设置的阳性对照样本为asfv共提核酸中等浓度(pm)和低浓度(pl)模板各两管。不同样本扩增的ct值见表5,扩增曲线见图3。结合图表可看出,asfv共提核酸样本在两个检测通道均有荧光信号,健康猪样本或其他病毒、细菌和支原体的基因组均无荧光信号,表明本发明试剂盒特异性良好。
[0081]
表5本发明试剂盒特异性评估各样本ct值
[0082][0083]
实施例5、asfv rt-qpcr检测试剂盒重复性验证
[0084]
将阳性质控质粒pmd-312151进行梯度稀释,分别稀释到含量为1
×
104、1
×
103、1
×
102、1copies/μl,作为扩增样本,使用本发明的双重荧光rt-pcr检测试剂盒对其进行检测,重复检测5次,每次扩增设置一个以猪的基因组作为扩增样本的对照管,计算两个靶标在三种模板浓度下对应的变异系数(cv,%),结果见表6。结果显示各浓度梯度的检测结果ct值的变异系数均小于2%,表明本发明试剂盒重复性良好。
[0085]
表6本发明试剂盒重复性评估各样本ct值及相应cv值(%)
[0086][0087]
重复性验证的扩增曲线见图4-图8,其中,图4为第一次扩增曲线,图5为第二次扩增曲线,图6为第三次扩增曲线,图7为第四次扩增曲线,图8为第五次扩增曲线;图4-图8表明本发明试剂盒重复性良好。
[0088]
实施例6、asfv rt-qpcr检测试剂盒的应用
[0089]
1样本前处理
[0090]
磁珠法或吸附柱法分别提取asfv阳性猪的全血样本2个(b1/b2)和鼻拭子1个(s1)的总核酸作为检测模板。提取方法具体参考使用的商品化试剂盒说明书,需注意的是每次提取需设置阴性提取对照。
[0091]
2 rt-qpcr操作步骤
[0092]
2.1配制反应液
[0093]
取出试剂盒中各组分,按照以下比例配制5管反应液(25μl/反应):
[0094]
组分体积(μl)反应预混液19酶混合液1扩增模板5
[0095]
2.2扩增
[0096]
打开pcr仪,选择fam和vic两个荧光通道,按照以下反应程序设置反应条件:逆转录50℃15min;预变性95℃2min;循环扩增95℃10sec,57℃30sec(采集荧光信号),重复45个循环。
[0097]
3结果判定
[0098]
实验成立条件:阳性对照fam通道和vic通道出现典型的扩增曲线,fam通道ct值≤30,且vic通道ct值≤30;阴性对照无扩增曲线且无ct值。不同样本扩增的ct值见表7,扩增曲线见图9。
[0099]
表7检测结果ct值
[0100][0101]
由表7和图9可知,上述检测的阳性对照和阴性对照结果表明实验成立,再按照如下标准判读样本结果:如果fam通道ct值≤40或vic通道ct值≤40,且出现典型的扩增曲线,则所述待检样本中存在asfv;如果fam通道和vic通道均无ct值,且无扩增曲线,则所述待检样本中检测不到asfv。因此,可判定样本b1和s1中含有asfv,样本b2中未检测到asfv。
[0102]
以上公开的仅为本发明的几个具体实施例,但是本发明并非局限于此,任何本领域的技术人员能思之的变化都应落入本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1