检测CarT细胞中是否存在RCL污染的引物、探针及试剂盒的制作方法
检测cart细胞中是否存在rcl污染的引物、探针及试剂盒
技术领域
1.本发明涉及一种临床检验用途的检测cart细胞中复制型慢病毒(rcl)的试剂盒,采用探针taqman实时荧光定量pcr技术,针对vsv
‑
g包膜基因片段特异性扩增,非常适合在car
‑
t细胞临床试验的早期来检测rcl/rcr,更好地控制rcr/rcl风险。
背景技术:
2.随着肿瘤免疫学理论和临床技术的发展,嵌合抗原受体t细胞疗法(car
‑
t)成为目前最有发展前景的肿瘤免疫疗法之一。car
‑
t细胞疗法通过外源基因转染技术,把识别肿瘤相关抗原的单链抗体(scfv)和t细胞活化序列的融合蛋白表达到t细胞表面,使可以特异识别肿瘤相关抗原的scfv通过跨膜区与t细胞胞内的活化增殖信号域偶联。同时,经过car改造后的t细胞能够以hla非依赖的方式识别肿瘤抗原的能力,不受mhc限制,具有活化和增殖的能力,因此具有高效的杀伤肿瘤细胞的能力。表达car的t细胞以抗原依赖、但非mhc限制的方式结合肿瘤抗原,启动并活化特异性杀伤肿瘤反应。
3.car
‑
t细胞疗法在血液肿瘤中的治疗效果得到了越来越多的认可,因此成为肿瘤免疫治疗领域中的热点。在car
‑
t细胞的生产中,主要是依靠逆转录病毒载体或慢病毒载体将car基因导入到t细胞中,在此过程中也可能使得car
‑
t产品受到复制型逆转录病毒(rcr)或复制型慢病毒(rcl)的污染。有rcr/rcl污染的产品如果被回输到患者体内可能有造成二次肿瘤的风险,所以在car
‑
t细胞产品的生产各个环节中都会涉及到rcr/rcl的检测,以确保无rcr/rcl污染,目前建立的rcl检测方法并不多,虽然rcr/rcl细胞感染试验有较高的灵敏度,但是该方法耗时长,本发明所建立的检测方法以针对vsv
‑
g包膜基因片段的荧光定量pcr为基础,在确保高灵敏度的同时,可以快速检测,且假阳性低。可以有效地作为car
‑
t细胞生产环节中的质控手段。
技术实现要素:
4.本发明设计了针对vsv
‑
g包膜基因片段的引物和探针序列,用于检测cart细胞中的复制型慢病毒污染,采用荧光定量pcr技术,利用标准曲线的方法,构建了vsv
‑
g的定量标准曲线,可以实现对vsv
‑
g片段的定量检测,从而间接定量rcl。
5.一种检测cart细胞中是否存在rcl污染的引物和探针,其特征在于,所述引物和探针针对vsv
‑
g包膜基因进行定量检测,所述引物和探针的碱基序列如下:
6.vg
‑
f:agggaactgtgggatgactg
7.vg
‑
r:gaacacctgagcctttgagc
8.vg
‑
probe:fam
‑
tatgaagacgtggaaattggaccca
–
mgb。
9.本发明还提供了一种检测cart细胞中是否存在rcl污染的试剂盒,其特征在于,所述试剂盒包括:dna提取试剂、检测体系pcr反应液、阳性对照品和阴性对照品;其中检测体系pcr反应液包括扩增vsv
‑
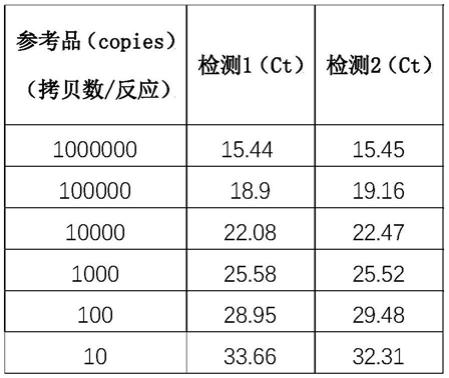
g包膜基因片段的引物和探针,所述引物和探针的碱基序列如下:
10.vg
‑
f:agggaactgtgggatgactg
11.vg
‑
r:gaacacctgagcctttgagc
12.vg
‑
probe:fam
‑
tatgaagacgtggaaattggaccca
–
mgb。
13.本发明试剂盒使扩增效率和速率均达到最佳,最低检测限可以下探到10拷贝。
14.进一步地,所述阳性对照品为含有vsv
‑
g片段的质粒dna稀释液;所述阴性对照品为未经过转染的人正常细胞提取dna。
15.本发明的有益效果:本发明将实时荧光pcr技术结合采用taqman探针,利用标准曲线的方法,构建了vsv
‑
g的定量标准曲线,检测car
‑
t细胞产品中是否存在rcl污染,可用于car
‑
t细胞产品生产各个环节的质量控制。经过优化后的引物、探针和合理的体系、检测条件可以使整个试剂盒对vsv
‑
g片段的检测下限下探到10拷贝数(检出率100%)。该试剂盒经测试特异性好,灵敏度高,操作简便,所建立的检测方法以针对vsv
‑
g包膜基因片段的荧光定量pcr为基础,在确保高灵敏度的同时,可以快速检测,且假阳性低,可以有效地作为car
‑
t细胞生产环节中的质控手段。
具体实施方式
16.下面结合具体实施例和附图,进一步阐述本发明。应当注意的是,实施例中未说明的常规条件和方法,通常按照所属领域实验人员常规采用方法:譬如,奥斯柏和金斯顿主编的《精编分子生物学实验指南》第四版,或者按照制造厂商所建议的步骤和条件。
17.实施例1
18.定量检测检测cart细胞中复制型慢病毒(rcl)的检验试剂盒包括:
19.血液/组织dna抽提试剂(天根生物);
20.检测体系pcr反应液:thnderbird probe qpcr mix(2
×
)、vg上、下游引物各0.8um、vg探针0.4um;
21.其中:
22.vg
‑
f:agggaactgtgggatgactg
23.vg
‑
r:gaacacctgagcctttgagc
24.vg
‑
probe:fam
‑
tatgaagacgtggaaattggaccca
–
mgb。
25.阳性对照品为cart细胞产品中提取的dna;所述阴性对照品为未经过转染的人正常细胞提取dna。
26.实施例2
27.本方法的操作流程:
28.血液/细胞/组织基因组dna抽提试剂盒(天根生物)的操作流程:
29.(1)抽提血液中的组织dna:
30.1)抽取300μl血液加入900μl红细胞裂解液,颠倒混匀,室温放置5分钟,期间再颠倒混匀几次。12,000rpm离心1min,吸去上清,留下白细胞沉淀,加200μl缓冲液ga,振荡至彻底混匀。
31.2)加入20μl蛋白酶k溶液,混匀。
32.3)加入200μl缓冲液gb,充分颠倒混匀,70℃放置10分钟,溶液应变清亮,简短离心以去除管盖内壁的水珠。
33.4)加入200μl无水乙醇,充分振荡混匀15秒,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
34.5)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放回收集管中。
35.6)向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。
36.7)向吸附柱cb3中加入700μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。
37.8)向吸附柱cb3中加入500μl漂洗液pw,12,000rpm离心30秒,倒掉废液。
38.9)将吸附柱cb3放回收集管中,12,000rpm离心2分钟,倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
39.10)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加100μl洗脱缓冲液te,室温放置2
‑
5分钟,12,000rpm离心2分钟,将溶液收集到离心管中。
40.(2)试剂配置:按检测人份数配置检测体系pcr反应液各x ul,每人份23ul分装:
41.x=23ul反应液
×
(6份目的基因(标准曲线)+n份标本+1份阳性对照+1份阴性对照+1份空白对照);
42.(4)加样:加入检测体系pcr反应液中2ulcdna;阳性对照和阴性对照直接加2ul阳性对照品和阴性对照品;空白对照加2ul生理盐水或不加任何物质。
43.(5)检测:检测在实时荧光pcr仪上进行,可用仪器包括abi7300,7500(美国applied biosystems公司)等。反应条件:95℃预变性1min;95℃15s,58℃35sec40个循环,荧光信号于58℃35sec时采集。
44.(6)结果判断:将阈值线调整至背景信号及阴性扩增线以上,系统根据标准曲线和ct值自动计算出拷贝数。
45.1)内参阳性时,检测结果才认为有效;
46.2)阳性判断标准:,ct<36,为阳性;35≤ct≤38,为疑似阳性,需要再次验证;ct>38,为阴性。
47.实施例3
48.采用本发明核酸检测试剂盒检测阳性样本1,按实施例2所述方法提取基因组dna、配制试剂并检测。
49.每份标本加入检测体系pcr反应液中2ul。检测时间仅为100分钟。
50.阴、阳性样品的检测结果图如图1所示。
51.实施例4线性区间检测
52.取阳性参考品梯度稀释,按实施例2所述方法配制试剂并检测。
53.每份样品加入检测体系pcr反应液中2ul。用荧光pcr仪检测,时间为100分钟。6个浓度梯度样本中所有样本均起线且重复性良好,进一步的,对实验数据进行线性分析,发现线性关系很好,r2大于0.99。实验结果如下表1所示,线性分析结果如图2所示:
54.表1 6个浓度梯度样本vsv
‑
g检测结果
[0055][0056]
本发明将实时荧光pcr技术结合采用taqman探针,利用标准曲线的方法,构建了vsv
‑
g的定量标准曲线,检测car
‑
t细胞产品中是否存在rcl污染,可用于car
‑
t细胞产品生产各个环节的质量控制。经过优化后的引物、探针和合理的体系、检测条件可以使整个试剂盒对vsv
‑
g片段的检测下限下探到10拷贝数(检出率100%)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1