用L-2-氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法与流程
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法
技术领域
1.本发明涉及药物合成技术领域,具体为用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法。
背景技术:
2.癫痫是一种由多种病因引起的慢性反复发作性短暂脑功能失调综合症,由于该疾病的长期反复发作严重影响了患者的生活质量和社会工作能力,对个人及社会均造成很大危害。
3.左乙拉西坦,化学名(s)
‑
α
‑
乙基
‑2‑
氧代
‑1‑
吡咯烷乙酰胺,是比利时ucb公司开发研制的一种新型抗癫痫药,与同类药物相比,左乙拉西坦具有治疗指数高、安全指数高、可用于单独治疗、不与其它抗癫痫药物发生相互作用、副作用轻微、耐受性好、药代动力学各项指数优良等特点,是目前报道的唯一具有预防癫痫发生的独特性能的抗癫痫药物。左乙拉西坦的化学结构式如下:
[0004][0005]
现有技术关于左乙拉西坦的合成报道,主要有以下几种工艺路线:
[0006]
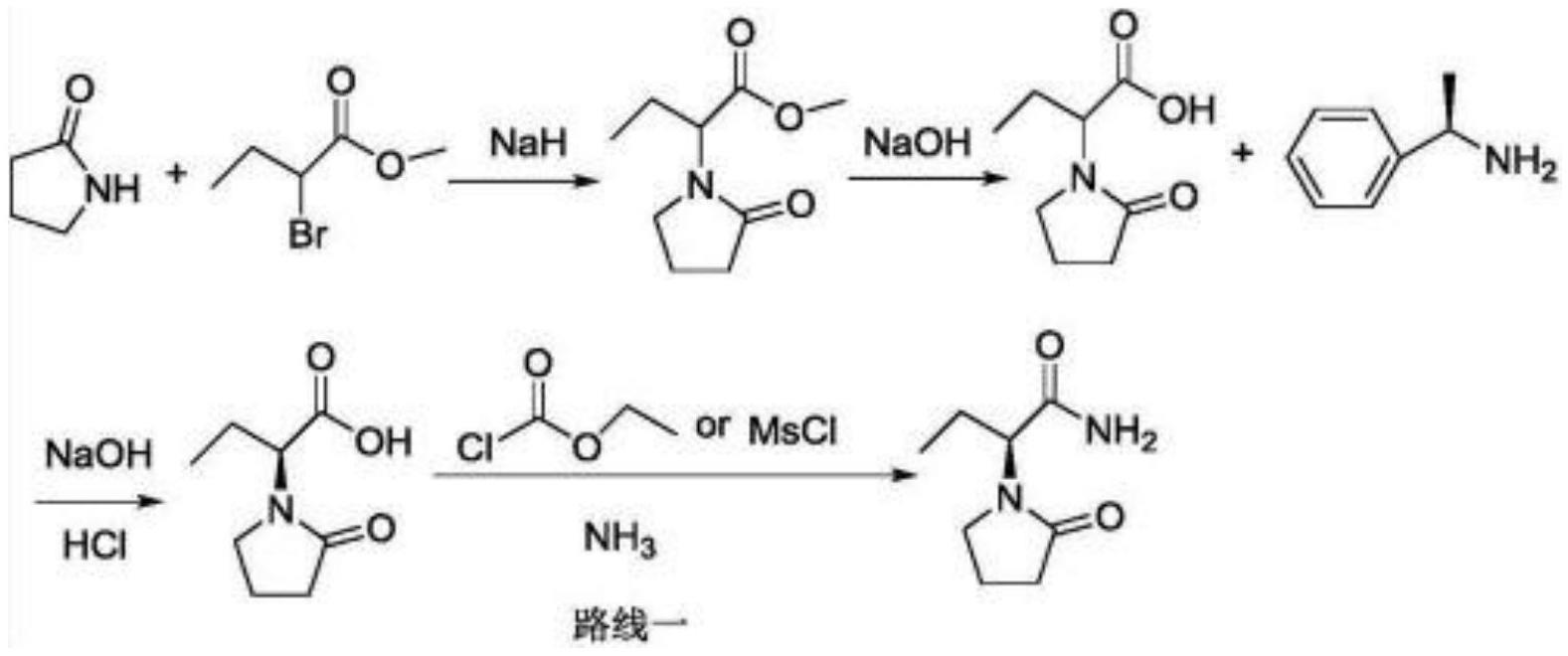
路线一:us 4696943公开了一种以2
‑
吡咯烷酮为起始原料的合成方法,其首先合成左乙拉西坦酸,然后拆分,再转化成混酐活化羧基,最后得到左乙拉西坦。该路线是早期得到左乙拉西坦的合成方法,反应步骤长,反应条件较苛刻,拆分损失大,不适合工业化生产。
[0007][0008]
路线二:ep 1806339a公开了一种以手性2
‑
溴丁酰氨为原料的合成方法,以避免后面的拆分,但是在反应中要用到强碱甲醇钠,因此亲核取代反应过程难免发生消旋,导致产品纯度不够,还需进一步纯化处理,且收率仅有40%,成本增大,因而不适合工业化生产。
[0009][0010]
路线三:wo 0164637a1公开了一种以2
‑
氧代丁酸甲酯为原料的合成方法,其中首先使2
‑
氧代丁酸甲酯与2
‑
吡咯烷酮反应生成2
‑
(2
‑
氧代
‑
吡咯烷)
‑2‑
丁烯酸甲酯,再氨化得到2
‑
(2
‑
氧代
‑
吡咯烷)
‑2‑
丁烯酰胺,最后在手性膦为配体的铑或钌络合物的催化下,氢化还原得到左乙拉西坦。但是该路线用到价格昂贵的手性金属催化剂铑或钌,成本高,并且还用到高压釜,反应安全要求高,不适合工业化生产。
[0011][0012]
路线四:cn 102558012a公开了一种以(s)
‑2‑
氨基丁酸为原料的合成方法,其首先使用(s)
‑2‑
氨基丁酸与4
‑
氯丁酰氯进行烃化反应得到酰化产物,然后经酰化反应得到混酸酐,再进行氨解得到氯代丁酰胺,最后关环生成目标产物左乙拉西坦。该路线在氨解过程中会产生部分消旋,并且最后关环需要使用强碱,也会导致消旋,从而使得目标产物纯度较低,反应步骤较长,不适合工业化生产。
[0013][0014]
路线五:cn101550100a公开了一种以l
‑
苏氨酸为原料的合成方法,其经过酯化、卤代、催化还原、氨解和环合等过程制备得到左乙拉西坦。其中,酯化和卤代过程中都使用了卤化亚砜,催化还原过程中使用雷尼镍、钯碳、铑碳或负载型氧化铂等。该方法由于氯化亚砜具有较高的腐蚀性和催泪性,对操作人员危害较大,是公安部门管制的化学试剂,且其遇水很容易水解生成二氧化硫和氯化氢,对环境影响很大。国际上对使用氯化亚砜的规定也较严格,如美国acgih(美国政府工业卫生学家会议)规定车间内的氯化亚砜的顺时阈值不能超过4.9mg/m3。因此,该方法不适合工业化生产。
[0015][0016]
而在合成抗癫痫药物左乙拉西坦过程中,l
‑2‑
氨基丁酰胺盐酸盐是重要的中间体,目前主要是采用传统的手性成盐游离的方法制备,制备过程中会产生大量d构型的副产物,导致成本将大幅度上升,且不环保,而l
‑2‑
氨基丁酰胺盐酸盐还可以通过不对称合成的方法来制备,主要有以下合成路线:
[0017]
(1)2
‑
溴丁酸/2
‑
溴丁酸甲酯路线
[0018]
cn102020584a报道以2
‑
溴丁酸为起始原料,先与氯化亚砜生成2
‑
溴丁酰氯,与氨水反应得混旋的2
‑
氨基丁酰胺,经l
‑
酒石酸拆分,后成盐得到。
[0019]
cn102898324a报道以2
‑
溴丁酸甲酯为起始原料,与氨水反应一步得到混旋的2
‑
氨基丁酰胺,经l
‑
酒石酸拆分,后成盐得到。
[0020]
上述专利报道合成收率较高,反应步骤短,操作简单,但是2
‑
溴丁酸/2
‑
溴丁酸甲酯价格贵,原料成本高,产品价格无优势,并且生产过程产生大量废水,不利于环境保护。
[0021]
(2)海因路线
[0022]
以正丙醛为原料与碳酸氢铵和氰化钠反应生成海因,在加压碱性条件下水解,得到2
‑
氨基丁酸钠,用盐酸调节ph到等当点即得到2
‑
氨基丁酸。将2
‑
氨基丁酸用l
‑
酒石酸拆分得到l
‑2‑
氨基丁酸,再将l
‑2‑
氨基丁酸酰化得l
‑2‑
氨基丁酰化合物,后在氨水条件下得到l
‑2‑
氨基丁酰胺。该反应放出大量氨气,同时除盐成本较高,且理论收率只有50%。
[0023]
(3)正丙醛路线
[0024]
cn101928229a公开了以正丙醛为原料,与氨、氯化铵、氰化钠的水溶液进行斯特雷反应,得到2
‑
氨基丁腈,在碱性条件下常压水解得到2
‑
氨基丁酰胺,最后拆分成盐得l
‑2‑
氨基丁酰胺盐酸盐。该方法操作简单,无高温高压反应,产品收率较高,质量较好。但用到剧毒物质氰化钠,氰化钠在加料秤量阶段操作不当会致人中毒甚至死亡,对操作人员健康危害大。此外,反应产生大量含氯化铵和过量氰化钠的废水,处理成本高,这些安全隐患限制了这些工艺的工业推广。
技术实现要素:
[0025]
本发明的目的在于提供用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,以解决上述背景技术中提出的问题。
[0026]
为实现上述目的,本发明提供如下技术方案:
[0027]
一种用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,所述治疗癫痫病药物为左乙拉西坦;
[0028]
所述方法是在氮气保护下,取l
‑2‑
氨基丁酰胺盐酸盐与4
‑
氯丁酸酯加至异丙醇
中,在碱性物质和催化剂作用下,加热回流进行亲核取代反应和闭环反应,即得所述治疗癫痫病药物,具体化学反应式如下:
[0029][0030]
其中,r为甲基或乙基。
[0031]
进一步的,所述l
‑2‑
氨基丁酰胺盐酸盐是取2
‑
氨基丁酰胺加至溶剂中,加入诱导剂甘油醛和拆分剂l
‑
酒石酸,加热进行不对称拆分,过滤,所得复盐加至浓盐酸中进行分离,滴加乙醇析出制得,具体化学反应式如下:
[0032]
进一步的,所述2
‑
氨基丁酰胺、甘油醛和l
‑
酒石酸三者之间的摩尔比为1:0.3~0.8:1~1.2;
[0033]
所述2
‑
氨基丁酰胺与溶剂的重量体积比为1g:5~10ml;
[0034]
所述2
‑
氨基丁酰胺与浓盐酸的摩尔比为1:1.1~1.3;
[0035]
所述浓盐酸的浓度为30~36wt%。
[0036]
进一步的,所述不对称拆分的温度为60~80℃、时间为5~8h;
[0037]
所述分离的温度为室温、时间为1~2h。
[0038]
进一步的,所述溶剂为乙醇、正丙醇或异丙醇。
[0039]
进一步的,所述4
‑
氯丁酸酯与l
‑2‑
氨基丁酰胺盐酸盐的摩尔比为1.0~2.0:1。
[0040]
进一步的,所述碱性物质与l
‑2‑
氨基丁酰胺盐酸盐的摩尔比为2~4:1。
[0041]
进一步的,所述催化剂与l
‑2‑
氨基丁酰胺盐酸盐的摩尔比为0.1~0.3:1。
[0042]
进一步的,所述催化剂为碘化钠或碘化钾。
[0043]
进一步的,所述碱性物质为碳酸氢钠、碳酸钾、碳酸钠或三乙胺。
[0044]
与现有技术相比,本发明的有益效果是:
[0045]
本发明采用比较温和的碱性物质,采用一锅法合成左乙拉西坦,操作简单,中间无需后处理即可制得左乙拉西坦,本发明所得左乙拉西坦杂质含量低、化学纯度高,收率可达83.43%以上,纯度达99.6%;
[0046]
本发明采用不对称拆分的方法制得l
‑2‑
氨基丁酰胺盐酸盐,采用甘油醛作为诱导剂、l
‑
酒石酸作为拆分剂,能够将现有技术中需剔除掉的d型氨基丁酰胺转化为l型氨基丁酰胺,拆分率可达95.53%以上,相对现有技术理论转化率50%,提高了一倍,且所得l
‑2‑
氨基丁酰胺盐酸盐杂质含量低、化学纯度高,原料成本相对现有技术大大降低、反应过程温和、环境友好,避免了生产过程中的危险。
具体实施方式
[0047]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0048]
实施例一:
[0049]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0050]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0051]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入100ml三口瓶中,加入60ml乙醇,搅拌分散,加入4.5g(0.05mol)诱导剂甘油醛和15.0g(0.1mol)拆分剂l
‑
酒石酸,加热至70℃,维持70℃进行不对称拆分,搅拌反应6h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0052]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至11.6ml浓度为30wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.1)中,室温下搅拌进行分离反应1.5h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至0℃析晶4h,过滤,真空干燥,即得13.33g的l
‑2‑
氨基丁酰胺盐酸盐,收率96.18%,纯度99.6%,ee值为99.76%,具体化学反应式如下:
[0053][0054]
二)左乙拉西坦的制备
[0055]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、12g(0.0879mol)的4
‑
氯丁酸甲酯、36g(0.260mol)碳酸钾、1.2g(0.007mol)碘化钾加至100ml异丙醇,加热至回流反应24h,反应完成后,趁热过滤,滤液减压蒸干,所得残留物中再加入60ml丙酮、1g活性炭,再次加热回流2h,趁热过滤除去活性碳,缓慢降温至0℃,维持0℃析晶4h,过滤,得10.11g左乙拉西坦,收率84.87%,hplc测纯度为99.8%,ee值为99.92%,具体化学反应式如下:
[0056][0057]
实施例二:
[0058]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0059]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0060]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入100ml三口瓶中,加入51ml正丙醇,搅拌分散,加入2.7g(0.03mol)诱导剂甘油醛和16.5g(0.11mol)拆分剂l
‑
酒石酸,加热至80℃,维
持80℃进行不对称拆分,搅拌反应5h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0061]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至11.8ml浓度为32wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.2)中,室温下搅拌进行分离反应1.5h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至4℃析晶6h,过滤,真空干燥,即得13.31g的l
‑2‑
氨基丁酰胺盐酸盐,收率96.03%,纯度99.5%,ee值为99.64%。
[0062]
二)左乙拉西坦的制备
[0063]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、21.09g(0.14mol)的4
‑
氯丁酸乙酯、23.52g(0.28mol)碳酸氢钠、3.15g(0.021mol)碘化钠加至120ml异丙醇,加热至回流反应22h,反应完成后,过滤,滤液减压蒸干,所得残留物中再加入60ml丙酮、1g活性炭,再次加热回流2h,趁热过滤除去活性碳,缓慢降温至5℃,维持5℃析晶6h,过滤,得10.28g左乙拉西坦,收率86.28%,hplc测纯度为99.7%,ee值为99.89%。
[0064]
实施例三:
[0065]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0066]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0067]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入250ml三口瓶中,加入80ml异丙醇,搅拌分散,加入3.6g(0.04mol)诱导剂甘油醛和18.0g(0.12mol)拆分剂l
‑
酒石酸,加热至65℃,维持65℃进行不对称拆分,搅拌反应8h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0068]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至11.9ml浓度为33wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.25)中,室温下搅拌进行分离反应2h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至1℃析晶5h,过滤,真空干燥,即得13.29g的l
‑2‑
氨基丁酰胺盐酸盐,收率95.89%,纯度99.7%,ee值为99.73%。
[0069]
二)左乙拉西坦的制备
[0070]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、9.56g(0.07mol)的4
‑
氯丁酸甲酯、14.84g(0.14mol)碳酸钠、1.16g(0.007mol)碘化钾加至80ml异丙醇,加热至回流反应26h,反应完成后,过滤,滤液减压蒸干,所得残留物中再加入50ml丙酮、1g活性炭,再次加热回流3h,趁热过滤除去活性碳,缓慢降温至2℃,维持2℃析晶5h,过滤,得9.94g左乙拉西坦,收率83.43%,hplc测纯度为99.7%,ee值为99.89%。
[0071]
实施例四:
[0072]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0073]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0074]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入250ml三口瓶中,加入90ml乙醇,搅拌分散,加入4.5g(0.05mol)诱导剂甘油醛和15.0g(0.1mol)拆分剂l
‑
酒石酸,加热至75℃,维持75℃进行不对称拆分,搅拌反应7h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0075]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至11.6ml浓度为30wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.1)中,室温下搅拌进行分离反应1h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至3℃析晶5.5h,过滤,真空干燥,即得
13.24g的l
‑2‑
氨基丁酰胺盐酸盐,收率95.53%,纯度99.5%,ee值为99.81%。
[0076]
二)左乙拉西坦的制备
[0077]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、15.06g(0.1mol)的4
‑
氯丁酸乙酯、23.52g(0.2mol)三乙胺、2.25g(0.015mol)碘化钠加至100ml异丙醇,加热至回流反应20h,反应完成后,过滤,滤液减压蒸干,所得残留物中再加入60ml丙酮、0.8g活性炭,再次加热回流2h,趁热过滤除去活性碳,缓慢降温至3℃,维持3℃析晶4h,过滤,得10.13g左乙拉西坦,收率85.02%,hplc测纯度为99.8%,ee值为99.93%。
[0078]
实施例五:
[0079]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0080]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0081]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入250ml三口瓶中,加入102ml乙醇,搅拌分散,加入3.2g(0.36mol)诱导剂甘油醛和17.3g(0.115mol)拆分剂l
‑
酒石酸,加热至70℃,维持70℃进行不对称拆分,搅拌反应7.5h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0082]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至11.2ml浓度为36wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.3)中,室温下搅拌进行分离反应1.8h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至3℃析晶4.5h,过滤,真空干燥,即得13.26g的l
‑2‑
氨基丁酰胺盐酸盐,收率95.67%,纯度99.6%,ee值为99.69%。
[0083]
二)左乙拉西坦的制备
[0084]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、12.29g(0.09mol)的4
‑
氯丁酸甲酯、24.88g(0.18mol)碳酸钾、3.32g(0.02mol)碘化钠加至100ml异丙醇,加热至回流反应23h,反应完成后,过滤,滤液减压蒸干,所得残留物中再加入55ml丙酮、1.2g活性炭,再次加热回流2.5h,趁热过滤除去活性碳,缓慢降温至0℃,维持0℃析晶4h,过滤,得10.08g左乙拉西坦,收率84.60%,hplc测纯度为99.8%,ee值为99.92%。
[0085]
实施例六:
[0086]
用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,其合成步骤如下:
[0087]
一)l
‑2‑
氨基丁酰胺盐酸盐的拆分
[0088]
取10.2g(0.1mol)的2
‑
氨基丁酰胺投入100ml三口瓶中,加入65ml乙醇,搅拌分散,加入4.1g(0.046mol)诱导剂甘油醛和15.8g(0.105mol)拆分剂l
‑
酒石酸,加热至60℃,维持60℃进行不对称拆分,搅拌反应6.5h,过滤,少量乙醇洗涤,即得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐(无需烘干直接进行下一步反应)。
[0089]
取所得l
‑2‑
氨基丁酰胺l
‑
酒石酸复盐加至10.6ml浓度为34wt%的浓盐酸(2
‑
氨基丁酰胺与盐酸摩尔比1:1.15)中,室温下搅拌进行分离反应1.3h至溶液完全澄清,然后缓慢滴加乙醇进行析晶,滴加至有少量晶体析出后,降温至0℃析晶5h,过滤,真空干燥,即得13.30g的l
‑2‑
氨基丁酰胺盐酸盐,收率95.96%,纯度99.6%,ee值为99.72%。
[0090]
二)左乙拉西坦的制备
[0091]
在氮气保护下,取9.7g(0.07mol)的l
‑2‑
氨基丁酰胺盐酸盐、15.02g(0.11mol)的4
‑
氯丁酸甲酯、22.26g(0.21mol)碳酸钠、2.99g(0.018mol)碘化钾加至100ml异丙醇,加热至回流反应24h,反应完成后,过滤,滤液减压蒸干,所得残留物中再加入50ml丙酮、0.8g活
性炭,再次加热回流2h,趁热过滤除去活性碳,缓慢降温至4℃,维持4℃析晶5h,过滤,得10.01g左乙拉西坦,收率84.01%,hplc测纯度为99.6%,ee值为99.90%。
[0092]
对比例一:
[0093]
购买市场上常见的成品l
‑2‑
氨基丁酰胺盐酸盐,得知其产品拆分率为35.4%,纯度为98.2%。
[0094]
将实施例一至实施例六的l
‑2‑
氨基丁酰胺盐酸盐的拆分率和纯度与对比例的产品收率和纯度进行比对,其比对结果如表1所示:
[0095]
通过表1可以得知,采用不对称拆分的方法,所得的l
‑2‑
氨基丁酰胺盐酸盐的拆分率和纯度高于市面上售卖的产品拆分率和纯度。
[0096]
表1
[0097]
项目拆分率(%)纯度(%)实施例一96.1899.6实施例二96.0399.5实施例三95.8999.7实施例四95.5399.5实施例五95.6799.6实施例六95.9699.6对比例一35.498.2
[0098]
对比例二:
[0099]
购买市场上常见的成品左乙拉西坦,得知其收率为35.4%,纯度为98.2%。
[0100]
将实施例一至实施例六的左乙拉西坦的收率和纯度与对比例的产品收率和纯度进行比对,其比对结果如表1所示:
[0101]
通过表2可以得知,采用本发明的用l
‑2‑
氨基丁酰胺盐酸盐合成治疗癫痫病药物的方法,生产出的左乙拉西坦其产品的收率和纯度高于市面上售卖的产品收率和纯度。
[0102]
表2
[0103]
项目收率(%)纯度(%)实施例一84.8799.8实施例二86.2899.7实施例三83.4399.7实施例四85.0299.8实施例五84.6099.8实施例六84.0199.6对比例60.898.2
[0104]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1