一种肝卵圆细胞永生化培养基及其制备方法和应用与流程
1.本发明涉及癌细胞培养技术领域,具体涉及一种肝卵圆细胞永生化培养基及其制备方法和应用。
背景技术:
2.正常组织来源的细胞在体外培养条件下可分裂生长,但经过有限次数的传代后,就会停止增殖,发生衰老和死亡。有的细胞自发或受外界因素的影响,可以从增殖衰老危机中逃离,从而拥有无限增殖的能力,该过程称之为细胞永生化。永生化细胞能够提供稳定均一、性状一致的细胞来源,并且可以降低材料成本。永生化细胞是体外研究细胞增殖、分化、凋亡、衰老等的理想模型。现阶段,已经有大量的商业化的永生化细胞,即标准细胞系,这些商业化的细胞系为生命科学研究和药物研发创造了理想的体外和体内实验的条件。
3.目前,肝卵原细胞的商业化的永生化标准细胞系较少,仅限于一些大鼠来源的肝卵原细胞标准细胞系,例如wb
‑
f344。如果想研究小鼠肝卵圆细胞,则没有商业化的标准细胞系供使用,想要获得小鼠肝卵圆细胞进行相关实验,则需要“现取现用”。即,从小鼠肝脏中分离得到原代肝卵圆细胞,需要在较短的时间内进行后续实验,否则,原代肝卵圆细胞经过在非常有限次数的传代后,会大量发生分化,并且丧失持续增殖的能力。这样就会对实验研究造成不便,并且细胞性质稳定性有限,也一定程度上影响了实验研究的准确性。亟需研发一种能够促进小鼠肝卵圆细胞永生化的方法,使其具有可以多次传代的特性,从而为研究人员提供更多的细胞资源。
技术实现要素:
4.本发明意在提供一种肝卵圆细胞永生化培养基,以解决难以永生化培养小鼠离体肝卵圆细胞的技术问题。
5.为达到上述目的,本发明采用如下技术方案:
6.一种肝卵圆细胞永生化培养基,包括基础成分和添加因子;所述添加因子包括肝细胞生长因子、表皮生长因子和白血病抑制因子。
7.本方案还提供了一种肝卵圆细胞永生化培养基在保持肝卵圆细胞增殖活性上的应用。
8.本方案还提供了一种肝卵圆细胞永生化培养基在抑制肝卵圆细胞分化的应用。
9.采用上述技术方案的原理以及有益效果:在本技术方案中,在基础培养基中添加肝细胞生长因子(hgf)、表皮生长因子(egf)和白血病抑制因子(lif),可有效促进小鼠肝卵圆细胞(hoc)的永生化进程,hoc在离体条件下至少可以保持8周以上的细胞增殖活性,且未见细胞分化,细胞呈圆形或卵圆形。本方案的培养基的研发成功,可实现小鼠hoc的永生化,可将小鼠hoc制备成为标准细胞株系以供使用,克服了小鼠hoc必须“现取现用”的技术问题。采用本方案,使小鼠hoc具有可以多次传代的特性,可为研究人员提供更多的细胞资源。在本技术方案中,三种因子连用可以促进细胞维持其分裂增殖的能力,还可以抑制细胞分
化,因此肝卵圆细胞永生化培养基可以应用于保持hoc增殖活性和抑制hoc分化的实践操作中。
10.本技术方案使用到的三种因子,lif可应用于维持胚胎干细胞的未分化状态,hgf是一种可调节多种细胞生长、运动和形态发生的多功能因子,egf可促进靶细胞的dna合成及有丝分裂。将这三种因子应用于同一培养基中,并对hoc进行永生化培养,上述应用尚属首次。单用其中任一物质,均会一定程度上造成hoc的分化。但是,三者连用却能够保证细胞在培养到8周以上后未出现任何分化的情况。这说明,三种物质联合使用产生了协同作用,克服了hoc容易发生分化的技术问题,获得了预料不到的技术效果。
11.进一步,肝细胞生长因子、表皮生长因子和白血病抑制因子在肝卵圆细胞永生化培养基中的含量分别为10μg/l、20μg/l和10μg/l。
12.上述浓度的肝细胞生长因子、表皮生长因子和白血病抑制因子,具有较为显著地促进hoc永生化的作用。三种因子的浓度过低,促永生化的效果被削弱;肝细胞生长因子、表皮生长因子的浓度过高,对促永生化的效果不再显著提高;白血病抑制因子的浓度过高,甚至会引起hoc的生长抑制,无法实现其永生化。
13.进一步,所述基础成分为dmem/f12培养基。
14.进一步,在所述dmem/f12培养基中,dmem和f12的体积比为1:1。
15.dmem是一种含各种氨基酸和葡萄糖的培养基,是在mem培养基的基础上研制的。f12培养基是动物细胞培养基,其成分复杂,含有多种微量元素。f12常和dmem以1:1的比例配制,称为dmem/f12培养基,以利用f12含有较丰富的成分和dmem含有较高浓度的营养成分的优点。
16.进一步,所述添加因子还包括双抗,所述双抗在肝卵圆细胞永生化培养基中的含量为100u/ml。双抗为青链霉素,是为了避免培养体系受到污染而加入。
17.进一步,所述添加因子还包括l
‑
谷氨酰胺,所述l
‑
谷氨酰胺在肝卵圆细胞永生化培养基中的含量为2mmol/l。l
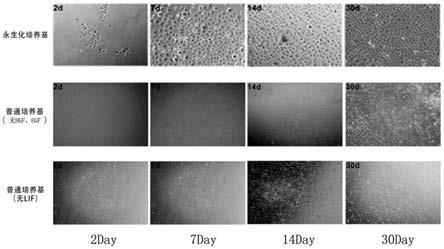
‑
谷氨酰胺可作为培养细胞的能量来源、参与蛋白质的合成和核酸代谢。在本方案中,l
‑
谷氨酰胺除了能够实现上述常规的功能之外,其对hoc细胞的永生化性能的维持起到了显著的促进作用。如果培养基中不含有l
‑
谷氨酰胺,hoc虽然能保持8周以上的细胞增殖活性,但是增殖速度较慢,传代的频率为7天一次。并且在培养基缺失l
‑
谷氨酰胺的情况下,会出现少量hoc细胞发生分化的现象。
18.进一步,所述添加因子还包括胎牛血清,所述胎牛血清在肝卵圆细胞永生化培养基中的体积百分数为10%。胎牛血清可提供对维持细胞指数生长的激素以及营养物质;胎牛血清是细胞贴壁、铺展在塑料培养基质上所需因子来源;还可以起到起酸碱度缓冲液作用;胎牛血清可提供蛋白酶抑制剂,使在细胞传代时使剩余胰蛋白酶失活,保护细胞不受伤害。
19.进一步,所述肝卵圆细胞的增殖活性维持时间在8周以上。使用本方案的培养基对原代hoc进行培养,原代hoc细胞经过8周的培养以及传代后,依然能够保持较为旺盛的增殖活性,传代频率可以达到2
‑
3天传代一次。并且,经过8周培养之后,hoc仍然处于未分化状态,形态呈圆形或卵圆形,且表达afp和ck19。
附图说明
20.图1为本发明实施例1的肝脏卵圆细胞体外分离及培养结果。
21.图2为本发明实施例2的ddc小鼠模型构建后肝脏病理组织切片。
22.图3为本发明实施例2的肝脏成熟细胞与肝脏卵圆细胞相关标志物western blot检测结果。
23.图4为本发明实施例2的成熟肝细胞与卵圆细胞相关标志物免疫荧光检测结果。
具体实施方式
24.下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例所用的技术手段为本领域技术人员所熟知的常规手段;所用的实验方法均为常规方法;所用的材料、试剂等,均可从商业途径得到。
25.实施例1:永生化培养基以及细胞培养
26.在本方案中,永生化培养基的基础成分为dmem/f12(1:1)培养基和胎牛血清,其中,dmem/f12(1:1)培养基是由dmem培养基和f12培养基组成,dmem培养基和f12培养基的体积比为1:1。在基础成分中添加多种添加因子,包括肝细胞生长因子、表皮生长因子、白血病抑制因子、双抗、l
‑
谷氨酰胺和胎牛血清。肝细胞生长因子、表皮生长因子、白血病抑制因子、双抗、l
‑
谷氨酰胺和胎牛血清在永生化培养基中的含量分别为10μg/l、20μg/l、10μg/l、100u/ml、2mmol/l和10%(体积百分数)。其中,双抗为青链霉素,双抗和胎牛血清均为细胞培养过程中用于避免培养体系污染和增加被培养细胞营养所经常采用的物质。白血病抑制因子(lif),是一种具有多种功能的细胞因子,但其最重要的应用是维持胚胎干细胞的未分化状态。肝细胞生长因子(hgf)是一种可调节多种细胞生长、运动和形态发生的多功能因子。表皮生长因子(egf)是一种由53个氨基酸残基组成的耐热单链低分子多肽,egf与靶细胞上的egf受体特异性识别结合后,发生一系列生化反应,最终可促进靶细胞的dna合成及有丝分裂。hoc永生化(自制)培养基的组成以及货号信息具体如下:dmem/f12基础培养基(gibco,11320033)+胎牛血清(gibco,10091148)+100u/ml双抗(gibco,15140163)+2mmol/l l
‑
谷氨酰胺(35050061)+10μg/l小鼠肝细胞生长因子(abcam,ab123229)+20μg/l小鼠表皮生长因子(abcam,ab206643)+10μg/l白血病抑制因子(abcam,ab209118)。
27.使用上述培养基进行小鼠肝卵圆细胞(hoc)的体外培养,具体过程如下:将hoc以每孔104数量接种于六孔板中,加入2ml永生化培养基,在37℃,5%co2条件下培养。培养过程中对细胞进行常规传代以及更换培养基,传代和更换培养基均为本领域的常规手段,在此不做赘述。使用本方案的永生化培养基的培养结果参见图1的第一排。本方案的永生化培养基通过合理配比可实现分离得到的原代hoc的快速增殖和长期培养,hoc在离体条件下至少可以保持8周以上的细胞增殖活性。刚分离纯化出的原代hoc呈游离状态(原代hoc的分离参见后文),漂浮于培养液中,24h后大部分贴壁生长。贴壁细胞呈圆形或卵圆形,呈铺路石样排列。参见图1的第一排,培养的卵圆细胞约在第七天逐渐聚集呈集落状,第十四天呈克隆样增殖,第二十天开始大量增殖。
28.发明人对培养基中各成分的配比进行了大量的研究和筛选,培养基使用情况和实验结果参见表1。对比培养基1
‑
10的成分组成为:在含有10%胎牛血清的dmem/f12(1:1)培养基上添加如表1所示的成分。对比培养基1中没有加入任何的细胞因子(不含egf和hgf),
对比培养基2中不含有lif,细胞培养情况分别参见图1的第二排和第三排。使用永生化培养基的卵圆细胞始终保持正常的形态,而缺乏全部细胞因子或lif的细胞在第二周会出现分化从而无法长期培养。
29.表1:培养基及其效果研究
[0030][0031][0032]
注*:判定细胞是否分化的标准为:镜下观察细胞形态,如果视野下贴壁细胞均呈圆形或卵圆形,则判定为细胞未分化,如果细胞呈现出其他形态(例如成纤维细胞),则判定细胞出现分化。
[0033]
细胞增殖活性是指细胞分裂形成新细胞的进行细胞数目扩增的速度,具体体现在细胞接种后铺满细胞培养容器的速度。一般细胞在培养容器中的融合度达到80%需要进行传代,以保证细胞适合的生长条件,可以以传代的频次来反应细胞增殖的活性。
[0034]
由表1的数据可知,使用本方案的永生培养基对原代hoc进行培养,hoc保持8周以上的细胞增殖活性且不出现细胞分化;在培养至8周左右的时候,细胞增殖迅速,可以实现2
‑
3天进行一次传代;8周后对细胞表面标志物进行检测(wb和/免疫荧光),可检测到afp以及ck19。
[0035]
对比培养基1没有加入hgf和egf,仅加入了lif(图1第二排),使用对比培养基1对原代hoc进行培养时,hoc细胞增殖速度慢,具体表现在,将原代hoc接种7天后,细胞融合度仍然不能达到80%以上;除此之外,在培养8天之后,hoc细胞全部分化为成纤维细胞,并同时对细胞进行表面标志物检测,不能检测到afp以及ck19。
[0036]
对比培养基2中没有加入lif,但加入了hgf和egf(图1最后一排),使用对比培养基2对原代hoc进行培养时,hoc能保持8周以上的细胞增殖活性,在培养至8周左右的时候,可以实现2
‑
3天进行一次传代;但在第二周30%的细胞出现分化,第4周90%以上的细胞出现分化;对4周时的hoc进行表面标志物检测,其不表达hoc相关标志物afp以及ck19。
[0037]
将对比培养基1(含lif)和对比培养基2(含hgf和egf)的培养结果与永生化培养基(含lif、hgf和egf)的培养结果相比较,使用对比培养基1和2时,hoc均在不同培养时间发生
分化,但是永生化培养基将lif、hgf和egf联合使用,hoc细胞在培养第8周的时候仍然未发生分化,这说明,三种物质联合使用产生了协同作用,克服了hoc容易发生分化的技术问题,获得了预料不到的技术效果。
[0038]
对比培养基3中没有加入hgf、egf和lif,hoc无法有效增殖,大量细胞逐渐死亡,8天后只剩下少量细胞。
[0039]
对比培养基4中,hgf和egf的用量减半。使用对比培养基4对原代hoc进行培养时,细胞在8周以上能够保持一定的增殖活性,在第8周的时候的传代频率为4
‑
5天进行一次传代;但是,在第8周的时候,40%左右的细胞发生了分化。
[0040]
对比培养基5中,lif的用量减半。使用对比培养基5对原代hoc进行培养时,hoc能保持8周以上的细胞增殖活性,在第8周的时候的传代频率为4
‑
5天进行一次传代;较多细胞出现分化,在第四周的时候70%以上的细胞发生分化。
[0041]
对比培养基4和对比培养基5的实验结果说明,lif、hgf和egf的用量需要维持在一定水平之上,才能实现对细胞增殖的促进和对细胞分化的抑制,进而实现hoc的永生化。
[0042]
对比培养基6中,没有使用hgf。使用对比培养基6进行细胞培养的时候,细胞增殖速度较慢,在第7天的时候,才能对细胞进行第一次传代,并同时可观测到20%左右的细胞已经发生了分化;细胞在4周后停止生长。
[0043]
对比培养基7中,没有使用egf。使用对比培养基7进行细胞培养的时候,细胞增殖速度较慢,在第7天的时候,才能对细胞进行第一次传代;细胞在5
‑
6周后停止生长。
[0044]
分析对比培养基6和对比培养基7的实验结果,并与对比培养基2的实验结果进行比较,相对于hgf和egf的单独使用,hgf和egf的联合使用对细胞增殖能力具有更强的促进作用。
[0045]
对比培养基8中,hgf和egf的用量增加。使用对比培养基8进行细胞培养的时候,hoc保持8周以上的细胞增殖活性且不出现细胞分化;在培养至8周左右的时候,细胞增殖迅速,可以实现2
‑
3天进行一次传代;8周后对细胞表面标志物进行检测(wb和/免疫荧光),可检测到afp以及ck19。对比培养基8效果和本方案的永生培养基相当,说明hgf和egf的用量维持在一定的水平之上,并配合一定量的lif,可实现对hoc增殖的促进和对hoc分化的抑制,从而实现hoc的永生化。
[0046]
对比培养基9中,lif的用量增加。使用对比培养基9对原代hoc进行培养时,hoc细胞无法增殖,生长受到抑制,无法进行传代。细胞大量死亡,在第八天的时候,只剩下了少量的细胞。这说明,lif的用量过高,会引起生长抑制,将其浓度维持在一定水平,并配合适当浓度的hgf和egf,才能有效促进hoc的永生化。
[0047]
对比培养基10中,没有使用l
‑
谷氨酰胺。使用对比培养基10对原代hoc进行培养时,hoc能保持8周以上的细胞增殖活性,但是增殖速度较慢,在第8周的时候,传代的频率为7天一次;在第8周的时候,约20%左右的细胞出现了分化现象。这说明lif、hgf和egf,需要配合l
‑
谷氨酰胺使用,才能获得较为理想的维持hoc永生化的效果。
[0048]
实施例2:原代hoc的分离和获取
[0049]
原代hoc由如下的方法制备获得:采用8周雄性c57bl/6小鼠,在饮水中加入0.1%ddc(3,5
‑
diethoxycarbonyl
‑
1,4
‑
dihydro
‑
collidine),持续喂饲2周,构建ddc小鼠模型,于第14天剖杀小鼠,进行检测。图2展示了ddc小鼠模型构建后肝脏病理情况,ddc小鼠诱导2
周后出现明显胆汁淤积性胆管炎,通过免疫组化染色显示,肝脏汇管区门静脉周围出现卵圆细胞聚集增生并表达ck19和alb,说明模型构建成功。
[0050]
将ddc模型小鼠进行异氟烷麻醉,开腹并暴露肝门静脉,置入肝素化静脉留置针后固定;使用100ml 37℃预热的磷酸盐缓冲液(pbs)冲洗肝内血液,再用20ml 0.01%iv型胶原酶以2ml/min速度灌注10min;取下肝组织置入含0.01%胶原酶iv的dmem/f12培养基中,剪碎后吹打分散细胞,并过100目筛网;使用离心法分离肝脏非实质细胞,加入含0.01%pronasee和0.005%dnasei的消化液并在37℃下消化30min;通过percoll梯度离心提取hoc。对获得的hoc进行western blot检测,并与肝脏成熟细胞进行对比,实验结果参见图3,可见卵圆细胞同时表达alb、afp以及ck19而成熟肝细胞只表达alb而不表达afp和ck19。对本方案获得的hoc进行免疫荧光检测,并与肝脏成熟细胞进行对比,实验结果参见图4,可见肝卵圆细胞同时表达alb、afp以及ck19而成熟肝细胞只表达alb而不表达afp和ck19。
[0051]
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1