一种鸡传染性喉气管炎重组病毒株及其应用的制作方法
1.本发明属于兽用生物制品领域,具体涉及一种鸡传染性喉气管炎重组病毒株及其应用。
技术背景
2.鸡传染性喉气管炎(infectious laryngotracheitis,ilt)是由传染性喉气管炎病毒(iltv)引起的一种急性呼吸道传染病。该病具有高度接触性,传染性的特点,其特征为呼吸困难、咳嗽,咳出含有血液的渗出物,喉部和气管粘膜肿胀、出血并形成糜烂。由于感染鸡的死亡和产蛋下降等,给养禽业造成严重的经济损失。ilt于1925年首次被may和tittsler报道于美国,随后在世界各地均有报道发生,我国在1950年后发生本病。
3.传染性喉气管炎病毒iltv的宿主范围较窄,主要感染宿主是鸡。虽然该病毒可以感染所有年龄的鸡,但以成年鸡最易感。接触性感染是该病主要的传播方式,但病毒液可以通过口咽途径或呼吸道、眼睛进入鸡体。本病一年四季均可发生,主要表现为夏季发病少,冬春季节发病较多,饲养环境拥挤、饲养管理条件差均可促进本病的发生。
4.iltv能在某些原代细胞上繁殖,如鸡胚肝细胞(cel),鸡胚肾细胞(cek)、鸡肾细胞(ck)和鸡胚肺细胞等。研究证明,鸡肝癌细胞(lmh)能使iltv得到适应,并能良好繁殖生长。lmh细胞是患肝细胞癌的鸡的肝细胞经二乙基亚硝胺致突变而筛选得到的,已经成功的用于iltv重组病毒的构建。与原代细胞相比,lmh细胞生长速度快,易于培养和传代,并且可以液氮保存,lmh细胞系不会有其它不适于iltv增殖的细胞的污染。但是iltv在鸡胚上增殖的效率最高,因此,目前常用的iltv培养方法仍然是鸡胚,通过尿囊腔或绒毛尿囊膜(cam)接种iltv,在接种后48h即可观察到许多个中央凹陷、边缘不透明的痘斑,一般在72h
‑
120h鸡胚死亡。
5.自然感染或接种疫苗后,易感鸡对iltv的抵抗力就发生了改变。iltv感染后7天,在血清中就能检测到中和抗体,21天左右抗体水平达到高峰。虽然体液免疫与感染有关,但对于iltv的感染,它并不是主要的保护机制,而是以细胞介导的免疫为主。喉气管炎母源抗体虽能经卵传给子代,但不能提供保护作用,也不干扰鸡的免疫接种。因此对于本病的预防,使用疫苗是最行之有效的方法。
6.灭活疫苗制作简单,易随时制备,安全且不受母源抗体的干扰。但灭活疫苗主要诱导体液免疫,诱发细胞免疫的作用不强,免疫保护效果有限,现在大规模防治iltv时几乎不使用灭活疫苗。使用最多的是鸡胚源或组织源的弱毒疫苗。
7.常规弱毒活疫苗一般通过体外传代而减毒制得,但是在实际使用中,这些弱毒株的减毒程度难以控制,存在毒力不稳定的问题,有时弱毒疫苗株能够返祖成为强毒株,成为新的传染源。这也是iltv一直无法根治的重要原因。
技术实现要素:
8.本发明的目的是提供一种鸡传染性喉气管炎重组病毒株及其应用,所提供的鸡传
染性喉气管炎重组病毒株作为弱毒株用于制备疫苗。
9.本发明首先提供一株鸡传染性喉气管炎病毒弱毒株,是将鸡传染性喉气管炎强毒株的orfc基因进行缺失,通过同源重组拯救后筛选获得的;
10.所述orfc基因的核苷酸序列如seq id no:1所示,orfc基因缺失后的核苷酸序列如seq id no:2所示。
11.本发明还提供了上述鸡传染性喉气管炎基因缺失株的构建方法,包括以下步骤:
12.1)分别将鸡传染性喉气管炎强毒株的icp4蛋白基因和ul48蛋白基因连接到载体构建辅助质粒;
13.所述的载体,一种实施例的具体记载为pci
‑
neo载体;
14.2)构建含有acgfp表达盒的重组转移载体:通过pcr扩增分别获得传染性喉气管炎病毒orfc基因两侧的左同源臂orfc
‑
l和右同源臂orfc
‑
r,pcr扩增获得acgfp表达盒片段;将3个片段按顺序插入载体pbluescript ii ks(+/
‑
),获得转移载体l
‑
acgfp
‑
r
‑
pbluescript,载体中acgfp表达盒上下游分别连有左同源臂orfc
‑
l与右同源臂orfc
‑
r;
15.所述的左同源臂orfc
‑
l的核苷酸序列如seq id no:3所示,右同源臂orfc
‑
r的核苷酸序列如seq id no:4所示,acgfp表达盒的核苷酸序列如seq id no:5所示;
16.3)获取传染性喉气管炎病毒强毒株的完整基因组dna;
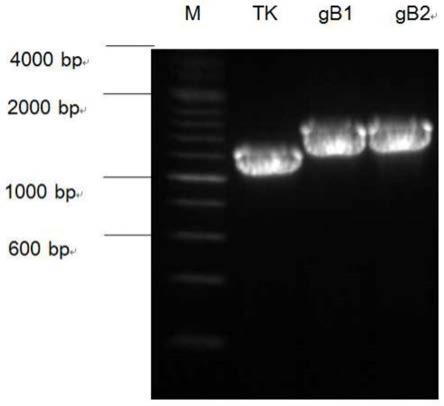
17.4)分别将获取的传染性喉气管炎病毒强毒株的基因组dna与1)中构建的辅助质粒和2)中构建的转移载体共转染宿主细胞,通过极限稀释法获得表达acgfp荧光基因的传染性喉气管炎重组病毒。
18.所述的宿主细胞,作为实施例的一种具体记载,为lmh细胞。
19.5)lmh细胞转染表达cre重组酶的质粒pbs513ef1alpha
‑
cre,24h后接种表达acgfp荧光基因的传染性喉气管炎重组病毒;培养96h后用极限稀释法筛选获得不含荧光基因的传染性喉气管炎重组病毒。
20.其中一种传染性喉气管炎重组病毒,为鸡传染性喉气管炎病毒riltv/l株,于2021年8月4日保藏在位于武汉、武汉大学的中国典型培养物保藏中心,保藏编号为cctcc no:v202158;
21.本发明提供的传染性喉气管炎重组病毒用于制备疫苗;
22.本发明再提供一种iltv orfc基因缺失株弱毒疫苗,所用的抗原为上述的传染性喉气管炎重组病毒弱毒株。
23.本发明所提供的iltv基因缺失弱毒株,致病力显著弱于亲本株,免疫后所引起的副反应显著小于现有的疫苗株k317株,并可以对当前流行的iltv提供良好的保护作用。
附图说明
24.图1:iltv分离株的pcr鉴定图,
25.图2:转移载体的构建图,
26.图3:辅助质粒的构建图,
27.图4:重组病毒的荧光筛选图,
28.图5:重组病毒与亲本病毒的生长曲线图。
具体实施方式
29.本发明公开了一种orfc基因缺失的鸡传染性喉气管炎病毒重组疫苗株及其构建方法和应用,是对iltv强毒株进行基因缺失,运用同源重组技术删除其orfc基因并通过极限稀释的方法,筛选获得遗传稳定的弱毒株。
30.本发明构建获得的iltv重组弱毒株克服了iltv传统疫苗株免疫后副反应大、并有效的降低了疫苗株毒力返强的风险,免疫原性没有受到影响,与传统疫苗株相当。
31.下面结合实施例对本发明进行详细的描述。
32.实施例1鸡传染性喉气管炎强毒株的分离及鉴定
33.2019年10月份从山东潍坊某养殖场(未免疫过iltv疫苗)获取发病鸡的气管、喉头等组织,加入ph7.2的pbs溶液(penicilin 10000iu/ml,streptomycin 10mg/ml,geamicin 250μg/ml,kanamycin 250μg/ml)进行研磨。8000r/min离心10min,取上清0.2ml接种于10日龄spf鸡胚,尿囊膜接种。将接种后48h内死亡的鸡胚弃掉,而48h后死亡的鸡胚放于4℃冰箱暂时保存。收取120h后未死亡鸡胚也放于4℃冰箱4h,收取所有48h后死亡和120h后未死亡鸡胚的尿囊膜和尿囊液,并观察尿囊膜病变情况。
34.收取长有痘斑并增厚的绒毛尿囊膜,研磨并用收取的尿囊液稀释,磨成组织液后离心,7000rpm/min离心10min,取上清液。病毒上清液倍比稀释后接种lmh细胞,用噬斑筛选的方法纯化病毒,在细胞上纯化3代。继续接种鸡胚尿囊膜传代,取尿囊膜传代的第5代毒进行进一步分析检测。
35.根据genbank公布的iltv全基因组序列(mf417808.1),设计引物,扩增tk基因和gb1基因及gb2基因(gb基因分为2段进行扩增),引物序列信息如下:
36.tk
‑
f:5
′‑
agccacgctctctcgagtaagaatgagtac
‑3′
、
37.tk
‑
r:5
′‑
tcctccagtgatctgacgagagctcggt
‑3′
、
38.gb
‑
1f:5
′‑
gatgcttctatgccaaaacgactgaaagat
‑3′
、
39.gb
‑
1r:5
′‑
gaagaggcacaaagacaaaatcatctcccg
‑3′
、
40.gb
‑
2f:5
′‑
cagttggcggttctgaagctcacaccacgc
‑3′
、
41.gb
‑
2r:5
′‑
gcgtcgatgaccgcgggaaactgggtccag
‑3′
。
42.取200μl病毒液,按omega公司dna提取试剂盒说明书提取dna,以提取的病毒dna为扩增模板,pcr反应体系:2
×
gflex pcr buffer,25μl;tk
‑
f,1μl;tk
‑
r,1μl;模板,2μl;tks gflex dna polymerase,1μl;灭菌水,up to 50μl。
43.pcr反应条件:94℃预变性1min;98℃10sec;55℃15sec;68℃1min,pcr 30个循环;68℃10min。pcr产物电泳后,回收阳性条带,送生工生物工程有限公司进行测序。,测序结果在ncbi网站进行比对分析。
44.结果显示,成功扩增出tk基因和gb1及gb2基因条带(图1),条带大小分别为1.2kb、1.5kb、1.5kb。测序结果在ncbi网站进行比对后确认所分离毒株为iltv病毒,命名为iltv/q。
45.实施例2iltv/q株的动物回归试验
46.30只35日龄spf鸡随机分成3组,每组10只,其中2组为病毒接种组,1组为pbs接种毒,滴鼻、点眼,每只鸡0.1ml,接种剂量和分组情况等见表1所示。3组动物在相同的条件下隔离饲养,接种后连续观察14天,每天观察并记录鸡的发病状态,包括死亡、流泪、咳嗽、流
涕、甩头等症状。
47.表1:iltv/q株动物回归试验表
[0048][0049]
结果表明iltv/q株为强毒株。
[0050]
实施例3构建orfc基因缺失的iltv重组毒株
[0051]
运用同源重组技术,构建转移载体,将转移载体和转录激活蛋白icp4、ul48质粒与iltv基因组共转染lmh细胞,极限稀释法筛选获得orfc基因缺失的含荧光标记的重组病毒。由于在构建转移载体时引入了loxp位点,因此可以利用cre重组酶消除loxp位点之间的序列,达到删除荧光基因的目的,获得不含荧光标记的orfc基因缺失重组病毒。
[0052]
下面就具体的步骤进行描述。
[0053]
(1)转移载体的构建
[0054]
根据genbank公布的iltv全基因组序列(mf417808.1),设计引物,扩增orfc基因及其两翼基因,引物序列如下:
[0055]
orfc
‑
f1:5
′‑
atacaggtgatggagggagtaaccgacac
‑3′
、
[0056]
orfc
‑
r1:5
′‑
atcggttcaagcgttcgaaccacctcg
‑3′
、
[0057]
orfc
‑
f2:5
′‑
agctgataagtcagcgcgcggttattctg
‑3′
、
[0058]
orfc
‑
r2:5
′‑
tgtctgcagacaagtggaaagatggagtcg
‑3′
。
[0059]
根据测序结果,获得orfc基因及其两侧基因的准确序列,设计同源臂引物。根据质粒pacgfp1
‑
n1的基因序列,设计acgfp表达盒引物。引物序列信息如下:
[0060]
l
‑
f:5
′‑
accgcggtggcggccgctctagaactagtggatccgccgttgtggtaacgcgtggggcaattacagac
‑3′
、
[0061]
l
‑
r:5
′‑
tatctgcagtaaagaccaataaataaattattgacagta
‑3′
、
[0062]
m
‑
f:f:
[0063]
m
‑
r:r:
[0064]
r
‑
f:5
′‑
tatgaattcgctgaggttccgatcgagagaag
‑3′
、
[0065]
r
‑
r:5
′‑
tgggtaccgggccccccctcgaggtcgacggtatcgataagcttgaagaaactcccatgtgcggcaagtttctgtgcgcagc
‑3′
。
[0066]
引物设计遵循高保真dna组装预混液说明书的要求,即各片段之间有30bp左右的同源臂序列。其中,小写字母序列与载体pbluescript ii ks(+/
‑
)中的两翼
序列同源,粗体字母为loxp基因序列。
[0067]
将载体pbluescript ii ks(+/
‑
)用bamh i和hind iii双酶切后,与pcr扩增的上述3个片段一起进行电泳,切胶回收阳性条带(图2)。将pcr扩增回收的3个片段与酶切后的载体共连接,构建转移载体,连接体系如下:回收的3个片段,各取2.5ul;nebuilder hifi dna assembly master mix 10ul。50℃作用1h后直接转化大肠杆菌感受态细胞,阳性菌落测序鉴定后,完成转移载体的构建,命名为l
‑
acgfp
‑
r
‑
pbluescript。
[0068]
(2)辅助质粒的构建
[0069]
设计引物,扩增icp4基因和ul48基因,扩增产物电泳并分别回收后(图3),分别与经过nhe i/xba i酶切的pci
‑
neo载体连接,连接体系:pcr回收产物6.6ul,酶切产物3.4ul;nebuilder hifi dna assembly master mix 10ul。反应条件同上。构建的辅助质粒分别命名为pci
‑
icp4和pci
‑
ul48。引物序列如下:
[0070]
icp4
‑
f:f:
[0071]
icp4
‑
r:5
′‑
ctaaagggaagcggccgcccgggtcgactctagattaccaccaagggtcagtgacagtg
‑3′
、
[0072]
ul48
‑
f:f:
[0073]
ul48
‑
r:5
′‑
tcactaaagggaagcggccgcccgggtcgactctagattagggcataggtgtatcaagg
‑3′
。
[0074]
其中,小写字母序列与载体pci
‑
neo中的两翼序列同源,粗体字母代表cozak序列。
[0075]
(3)iltv/q基因组dna的提取
[0076]
将iltv/q接种到长至80%的单层lmh细胞,待细胞病变达80%以上时弃去培养基,每个t75细胞瓶加入裂解液10ml(100mmol/l nacl,10mmol/l tris
‑
hcl,ph8.0 1mmol/l edta,0.5%sds,200mg/l蛋白酶k),室温作用5~10min,将裂解液吸入50ml离心管,37℃水浴2h;分别加入等体积的酚:氯仿和氯仿:异戊醇各抽提一次,每次4000r/min离心10min;吸取上清液,加入2倍体积预冷的无水乙醇,
‑
20℃作用10min沉淀基因组dna;70%乙醇洗涤沉淀,干燥后溶解于500μl的te溶液中,取少量dna用分光光度计测定核酸浓度,等量分装,4℃保存备用。
[0077]
(4)含荧光标记基因的重组病毒的转染及筛选
[0078]
lmh细胞接种于6孔细胞培养板中,待细胞生长至60%
‑
80%时进行转染。分别取1.5ug基因组dna、转移载体l
‑
acgfp
‑
r
‑
pbluescript 1μg、辅助质粒pci
‑
icp4和pci
‑
ul48各0.5ug混合后进行共转染,按照lipofectamine 3000脂质体转染试剂盒说明书进行操作。转染后的细胞置于37℃,5%co2恒温培养箱中继续培养。72h
‑
96h后在荧光显微镜下观察荧光及cpe产生情况(图4),待cpe达到80%左右时收获病毒,冻融3次后保存于
‑
70℃冰箱中备用。
[0079]
将收获的重组病毒液用无血清dmem做10
‑1‑
10
‑6倍稀释,接种于生长至90%左右的lmh细胞。37℃,5%co2恒温培养箱中培养96h,荧光显微镜观察荧光,选取含有荧光标记病毒的最大稀释孔,以同样的方法继续筛选,直至筛选到能使细胞产生的cpe全部带有荧光的
孔。取100μl的病毒液,提取病毒dna,用荧光定量的方法检测重组病毒的orfc基因,检测是否获得纯化的重组毒株。直至所检测的含病毒细胞孔检测不到orfc基因。筛选的重组毒命名为riltv
‑
gfp。荧光定量检测引物的序列信息如下所示:
[0080]
orfc
‑
df1:5
′‑
gctgtcgtatagagtttc
‑3′
、
[0081]
orfc
‑
dr1:5
′‑
ccatcattaccttcagttaa
‑3′
、
[0082]
orfc
‑
dp1:5
′‑
hex
‑
tcgttccttgtctaccatactgtcg
‑
bhq1
‑3′
。
[0083]
(5)荧光标记基因的消除
[0084]
lmh细胞接种于6孔细胞培养板中,待细胞生长至60%
‑
80%时进行转染。按照lipofectamine 3000脂质体转染试剂盒说明书,取2.5μg表达cre重组酶的质粒pbs513ef1alpha
‑
cre进行转染。转染后24h,转染的细胞孔按2%的比例接种riltv
‑
gfp重组病毒。接种病毒后72h在荧光显微镜下观察荧光及cpe产生情况,待cpe达到80%左右时收获病毒,冻融3次后保存于
‑
70℃冰箱中备用。
[0085]
用极限稀释法筛选不含荧光基因的重组病毒,方法同步骤(4)。筛选获得的重组病毒命名为riltv/l。
[0086]
重组病毒riltv/l株尿囊膜接种10日龄spf鸡胚并连续传代20代,每隔5代对收取的尿囊膜病毒样品进行pcr检测及测序鉴定,基因缺失的位置没有发生任何插入及基因突变等。表明获得的重组毒株可以稳定遗传。
[0087]
将筛选的riltv/l株进行保藏,保藏编号为cctcc no:v202158。
[0088]
实施例4重组riltv/l株在lmh细胞上的生长曲线
[0089]
将lmh细胞传代并铺于24孔细胞培养板中,细胞计数仪对细胞进行计数。分别将重组病毒riltv/l株和亲本毒株iltv/q株以0.01moi接种于生长良好的lmh细胞单层,37℃孵育2h,弃掉病毒液,换成含2%胎牛血清的dmem细胞维持液,置于37℃5%co2恒温培养箱培养。分别于接种后0h(接种细胞前的病毒稀释液)、12h、24h、36h、48h、72h和96h收获病毒,每个时间点做3个平行重复,
‑
70℃反复冻融三次,
‑
70℃贮存备用。所有样品同一时间测定病毒滴度(tcid
50
),比较2株病毒增殖情况。结果显示(图5),2株病毒在接毒后12h的病毒滴度呈下降趋势,之后开始上升,至96h达到最大值,2株病毒的生长趋势相似,表明iltv重组病毒在基因缺失后,没有影响病毒的增殖能力。
[0090]
实施例5重组riltv/l株在spf鸡毒力返强试验验证
[0091]
(1)iltv在spf鸡的连续传代
[0092]
20只35日龄spf鸡随机分为2组,每组10只,一组为重组病毒riltv/l株接种组,一组为市售疫苗k317株接种组。初代接种时,每组试验鸡的接种病毒剂量均为10
3.8
eid
50
/只,滴鼻、点眼接种。接种后第4天,每组试验鸡分别剖杀,收取气管组织。其中riltv/l株接种组的10只鸡气管组织放在一起研磨,用10ml pbs重悬;k317株接种组的10只鸡气管组织放在一起研磨,用10ml pbs重悬。冻融3次后分别离心,取上清液作为第2代传代接种spf鸡的病毒来源,每只鸡滴鼻、点眼接种0.2ml。按照上述方法,在spf鸡连续传代5代。
[0093]
取在spf鸡上连续传代至第5代的2组病毒液,分别尿囊膜接种10枚spf鸡胚。120h后收取鸡胚尿囊膜组织和尿囊液,组织研磨仪研磨后用滤网过滤。对收取的riltv/l株病毒液和k317株病毒液,分别测定效价(eid
50
),用于致病力的检测。
[0094]
(2)毒力返强试验验证
[0095]
20只35日龄spf鸡随机分成2组,每组10只,分别接种上述测定效价后的riltv/l株病毒液和k317株病毒液,滴鼻、点眼,接种剂量为10
3.8
eid
50
/只。在相同的条件下隔离饲养,接种后连续观察14天,每天观察并记录鸡的发病状态,包括死亡、流泪、咳嗽、流涕、甩头等症状。结果见下表所示。
[0096]
表2:iltv毒力返强试验数据表
[0097][0098]
注:副反应表示动物在接种后3
‑
5日有轻度眼炎或轻微咳嗽,但在2
‑
3日后恢复正常;健康动物数量为除去死亡数量或发病数量、副反应数量之后剩余的动物数。
[0099]
结果显示,重组病毒riltv/l株在spf鸡连续传代5代后,没有出现毒力返强的现象。而k317疫苗株出现毒力返强的现象,出现5只发病,表现为严重的眼炎、流泪、咳嗽、呼吸困难等症状。表明重组病毒riltv/l株的稳定性更好,毒力返强的几率很小。
[0100]
实施例6重组iltv活疫苗的制备
[0101]
重组病毒riltv/l株接种鸡胚后,120h后收取鸡胚尿囊膜组织和尿囊液,组织研磨仪研磨后用滤网过滤用于制备疫苗。用5%蔗糖脱脂乳1:1加入至稀释的病毒液中,定量稀释后的病毒含量为10
3.8
eid
50
/0.1ml,充分混匀后冻干制备活疫苗。制备的活疫苗按2010年版《中国兽药典》附录进行无菌检验,结果符合标准,无细菌污染。
[0102]
实施例7重组iltv活疫苗的安全性试验
[0103]
分别用7日龄、21日龄和53日龄的spf鸡进行安全性试验,另外选取k317疫苗株和/或分离的亲本毒株iltv/q株作为对照。在相同的条件下隔离饲养,接种方式为点眼或滴鼻,接种后连续观察14天,每天观察并记录鸡的发病状态,包括死亡、流泪、咳嗽、流涕、甩头等症状。spf鸡分组情况及结果见下表3所示。
[0104]
表3:iltv活疫苗的安全性试验表
[0105][0106]
注:
“‑”
代表未进行相关试验;副反应表示动物在接种后3
‑
5日有轻度眼炎或轻微咳嗽,但在2
‑
3日后恢复正常;健康动物数量为除去死亡数量或发病数量、副反应数量之后剩余的动物数。
[0107]
上述结果表明,riltv/l接种动物后,仅对53日龄的个别鸡引起副反应,安全性明显优于亲本株和当前的疫苗株k317株。orfc基因缺失后,iltv的毒力明显降低,构建的riltv/l株为弱毒株。
[0108]
实施例8重组iltv活疫苗的免疫效果评价
[0109]
35日龄spf鸡30只,随机分为3组,每组10只。免疫组分为riltv/l株免疫组和k317免疫组,滴鼻或点眼,10
2.8
eid
50
/只,每只0.1ml;对照组10只鸡免疫相同剂量的pbs。隔离饲养,免疫后21天进行攻毒,每只鸡气管注射iltv强毒株(王岗株)0.2ml(含10
4.0
eid
50
),观察14天。结果见下表4所示。
[0110]
表4:iltv活疫苗的攻毒保护性试验表
[0111][0112]
结果表明,riltv/l株免疫动物后,可以提供对强毒攻击100%的保护,保护效果同
k317疫苗株。
[0113]
综上所述,本发明构建的iltv orfc基因缺失株,免疫动物后,对鸡的副反应明显优于现有疫苗株k317株,免疫保护效果与疫苗株相当,均可实现100%的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1