一种茶树源侧枝分化调控相关基因及其编码产物与应用
1.本发明属于生物技术领域,具体涉及一种茶树源侧枝分化调控相关基因及其编码产物与应用。
背景技术:
2.侧枝分化是植物地上部分形态建成的一个主要的决定性因素,是影响作物产量和品质的重要农艺性状之一。茶树(camellia sinensis l.)是我国重要的叶用经济作物,其腋芽萌发及侧枝生长与茶叶的产量和品质密切相关。茶树的顶端优势极为明显并且侧枝的分化节位较高,生产上需要通过人为调控其侧枝的生长促进茶树形成大量的新梢。因此,发掘茶树分枝发育调控相关基因,培育具有分枝节位较低和合理分枝数量的茶树品种是茶树生产的迫切需求。另一方面,茶树基因组测序的完成以及遗传学、功能基因组学等相关技术的日益完善,特别是植物生长发育调控研究领域取得的突破性进展,为加速茶树品种的培育提供了有力的理论与技术支持。
3.生长素是调控植物生长发育的关键激素,生长素浓度对腋芽发育的关键作用已被明确,必须严格控制植物体内生长素的平衡。植物体内的生长素主要以游离态和结合态两种形态存在,其中游离态iaa是植物体内有活性的生长素的主要形态,而结合态生长素是吲哚乙酸与其它物质结合成共轭物而暂时失去了生理活性。
4.在生长素稳态的调节机制里,研究最为广泛的是生长素早期响应基因(primary
‑
response genes)。iaa酰胺合成酶(iaa
‑
amido synthetase,gretchen hagen 3,gh3)家族蛋白是一类在植物中广泛存在的生长素早期响应蛋白,能够通过催化过量iaa与氨基酸发生螯合反应从而维持植物体内的生长素稳态。到目前为止,至少已在拟南芥、水稻、大豆、番茄、苹果、棉花、猕猴桃等19种植物中报道了gh3基因家族的全基因组鉴定和功能研究。拟南芥基因组存在20个gh3基因,根据gh3蛋白的结构和功能,将其分为3个亚家族(亚家族ⅰ、ii和ⅲ),其中亚家族ii具有iaa氨基酸结合酶活性。植物gh3基因广泛参与调控植物多种生长发育过程目前已得到证实并受到广泛关注。例如,gh3基因的过量表达引起内源游离态iaa水平降低,从而产生独特的低生长素植株表型,包括植株矮化、分蘖提早和分蘖数增加等。
技术实现要素:
5.针对现有技术存在的不同,本发明的目的在于涉及提供一种茶树源侧枝分化调控相关基因及其编码产物与应用的技术方案。
6.本发明具体通过以下技术方案实现:
7.本发明一方面提供一种茶树源侧枝分化调控相关基因csgh3.1,该基因的dna序列如seq id no.1所示。
8.本发明另一方面提供一种茶树源侧枝分化调控相关基因csgh3.1的编码蛋白,包括以下任一蛋白:
9.1)如seq id no.2所示的氨基酸序列的蛋白质;
10.2)将seq id no.2所示的氨基酸序列经过一个或多个氨基酸残基的取代、缺失;
11.3)添加且具有与seq id no.2所示的氨基酸残基序列相同活性的seq id no.2所示的氨基酸的衍生蛋白质。
12.进一步,本发明提供一种茶树源侧枝分化调控相关基因csgh3.1在培育转基因植物中的应用。
13.进一步,本发明提供一种茶树源侧枝分化调控相关基因csgh3.1在作物育种中的应用。
14.进一步,本发明提供一种茶树源侧枝分化调控相关基因csgh3.1在调控植物内源生长素稳态中的应用。
15.进一步,本发明提供一种茶树源侧枝分化调控相关基因csgh3.1在调控植物侧枝分化中的应用。
16.进一步,本发明提供一种茶树源侧枝分化调控相关基因csgh3.1在增加植物的二级分枝数量和降低分蘖节位中的应用。
17.本发明的有益效果是,利用rt
‑
pcr技术,克隆得到了csgh3.1基因;利用荧光定量pcr(qpcr)明确了csgh3.1基因在修剪诱导的茶树腋芽生长发育过程中的表达情况及其与生长素(包括结合态生长素和游离态生长素iaa)含量的相关性;通过农杆菌转化法获得了csgh3.1基因过量表达的转基因拟南芥植株,并进一步揭示了csgh3.1基因在拟南芥侧枝分化调控中的重要作用。该基因的分离克隆,对于具有理想分枝表型茶树品种的培育,具有十分重要的促进作用。
附图说明
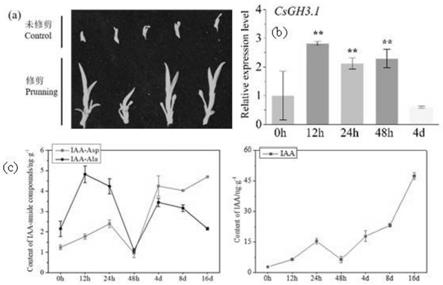
18.图1是修剪16天后的茶树腋芽表型(a),csgh3.1在修剪诱导的茶树腋芽发育过程中的表达图谱(b)以及生长素(包括结合态生长素和游离态生长素iaa)含量变化(c)。
19.图2是csgh3.1基因的orf全长扩增产物电泳图。1
‑
2泳道为1799bp的csgh3.1基因片段。
20.图3是csgh3.1基因的过量表达转化pcambia2301载体示意图。注:下划线处为内切酶位点。
21.图4是csgh3.1过表达拟南芥株系纯合鉴定。(a)过表达株系的pcr鉴定;(b)过表达株系的gus活性鉴定。
22.图5是拟南芥野生型与过表达株系的表型比较。(a)4周龄野生型(wt)拟南芥和csgh3.1过表达株系表型;(b)10周龄csgh3.1过表达拟南芥与野生型表型;(c)野生型拟南芥和csgh3.1过表达株系的花和顶端果荚长势。
23.图6是野生型(wt)拟南芥和csgh3.1过表达株系侧枝发育的表型统计。注:pb(primary branches)代表一级侧枝;sb(secondary branches)代表二级侧枝;t(tillers)代表分蘖。
24.图7是茶树csgh3.1基因在拟南芥过表达植株中的组织差异表达图谱(a);8个拟南芥atgh3亚家族ii基因在拟南芥叶片中的表达图谱(b)。
具体实施方式
25.本发明利用rt
‑
pcr技术,获得了csgh3.1基因的orf全长序列;利用荧光定量pcr(qpcr)技术,证实了csgh3.1基因可能参与调控内源生长素稳态从而调控茶树分枝发育;通过农杆菌转化法获得了csgh3.1过量表达的拟南芥转基因植株;统计结果表明csgh3.1过表达能够增加拟南芥的二级分枝数量、降低分蘖节位并且减小二级分枝长度。综上所述,csgh3.1基因的分离克隆及生物学功能分析,对于选育具有理想株型的作物品种,特别是选育具有理想株型的茶树品种将具有重要的促进作用。
26.实现本发明的具体技术步骤如下:
27.1)csgh3.1基因的表达特征分析。分别取夏季修剪后0小时至16天7个时间点剪口下方第一节位的腋芽,以及对照茶树(不修剪)相应节位的腋芽。分别进行总rna提取,反转录得到cdna;利用qpcr技术,以茶树csgapdh为内参基因,测定csgh3.1基因的诱导表达情况。
28.2)csgh3.1调控夏季修剪诱导的茶树腋芽生长发育的功能研究。内源生长素含量测定:选择修剪后0h、12h、24h、48h、4d、8d、16d的腋芽样品,测定其内源游离态生长素iaa和酰胺结合态生长素(iaa
‑
amido,包括iaa
‑
asp和iaa
‑
ala)的含量。
29.3)csgh3.1基因的分离及克隆以及csgh3.1过表达拟南芥转基因株系的获得。
①
利用rt
‑
pcr技术,获得了csgh3.1基因的orf全长序列;
②
将csgh3.1的全长orf插入到pcambia2301的35s启动子后,通过农杆菌转化法获得了csgh3.1过表达的拟南芥转基因株系,并进一步结合gus染色和pcr鉴定,最终筛选得到了2个t3代纯合品系csgh3.1
‑
ox
‑
line1和csgh3.1
‑
ox
‑
line4。
30.4)csgh3.1调控csgh3.1过表达拟南芥株系分枝表型的功能研究。
①
分别统计拟南芥野生型和csgh3.1过表达株系一级分枝和二级分枝的数量、长度和分蘖节位;
②
分别测定拟南芥野生型和csgh3.1过表达株系不同组织内(包括根、茎、叶、花和角果)内茶树csgh3.1基因的表达;分别测定拟南芥野生型和csgh3.1过表达株系叶片内8个拟南芥atgh3亚家族ii成员(包括atgh3.1)的表达。
31.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明范围。
32.实施例1:csgh3.1在夏季修剪诱导的茶树腋芽生长发育过程中的调控作用研究1)夏季修剪处理
33.修剪是茶树生产过程中重要的栽培措施。目前,只采春茶不采夏秋茶的立体树冠培养茶园,一般采取二次修剪培养树冠。第一次是春茶结束后进行重修剪;第二次是7月20日左右在原修剪高度基础上提高20cm再进行一次修剪,然后任其生长。采集2019年夏季修剪后剪口下方第一节位的腋芽,按不同时间点0h、12h、24h、48h、4d、8d、16d取样,立即浸入液氮,
‑
80℃保存备用;在茶园中提前留有未休剪的茶树作为对照组,与实验组样品进行同样的取样操作。
34.2)修剪诱导的茶树腋芽表型变化以及csgh3.1的表达特征分析
35.①
表型分析
36.表型分析结果表明,与对照组相比,修剪16天后剪口下方第一节位腋芽的表型发生了显著变化。修剪诱导的叶芽体积远大于对照组,叶芽增长明显且更加肥壮,说明修剪显
著诱导了茶树叶芽的发育(图1a)。
37.②
qpcr分析
38.rna提取和cdna合成方法同前。qpcr使用ssofast
tm probes supermix试剂盒(bio
‑
rad),以茶树csgapdh基因作为内参基因,通过cfx96
tm real
‑
time system(bio
‑
rad)荧光定量pcr仪进行检测;反应体系及程序参照产品说明书。引物及信息如下:
39.gh3.1
‑
f1:5
’‑
atgtgattgtaacgggtgc
‑3’
(如seq id no.3所示)
40.gh3.1
‑
r1:5
’‑
gagttgggttcgtgaggga
‑3’
(如seq id no.4所示)
41.gapdh
‑
f:5
’‑
ttggcatcgttgagggtct
‑3’
(如seq id no.5所示)
42.gapdh
‑
r:5
’‑
cagtgggaacacggaaagc
‑3’
(如seq id no.6所示)。
43.如图1b所示,腋芽内csgh3.1基因在修剪后12~48h内表达量显著上调,并且在修剪后4d恢复至0h水平。
44.3)修剪诱导的茶树腋芽内生长素含量的变化
45.为进一步研究在修剪诱导的茶树腋芽生长发育过程中csgh3.1的调控机制,检测了内源生长素(游离态iaa和iaa的酰胺结合态化合物)含量的变化,并且分析了csgh3.1表达与内源生长素含量的相关性。本试验总共检测了8种iaa amido化合物,但是仅检测到2种,即iaa
‑
asp与iaa
‑
ala。结果表明,各酰胺化合物的含量分别随游离态iaa含量动态变化,与iaa含量的变化具有高度同步性。如,在修剪后0~24h及48h~4d内,iaa
‑
asp和游离态iaa含量均增加;在24~48h及4~8d内,游离态iaa含量减少或增长缓慢,此时两种结合态iaa的含量整体随之降低。两种酰胺化合物含量的总体变化趋势也具有相似性(图1c),12h和24h与0h相比均显著升高,48h时下降到0h的水平,然后急剧升高。iaa
‑
ala与iaa
‑
asp含量的变化既有同步性又有交替性,能在短时间内迅速积累,iaa
‑
ala含量在12h已达峰值。此外,结合态化合物的含量主要在4d内具有较大波动,游离态iaa含量则在修剪8d后持续增加。
46.实施例2:csgh3.1基因的克隆和序列分析
47.1)茶树叶片总rna的提取及cdna合成
48.称取100mg研磨后的茶树叶片,利用sv total rna isolation system(promega)提取总rna并进行浓度及纯度检测;1μg总rna用于cdna合成(primescript
tm
rt
‑
pcr kit,takara),具体操作参照产品说明书。
49.2)csgh3.1基因克隆
50.以上述cdna为模板,扩增csgh3.1基因的orf序列,反应体系及程序参照hs dna polymerase(takara)说明书。扩增产物经电泳检测后(图2),利用axyprep
tm
dna gel extraction kit(axygen)进行回收纯化;由于primestar hs高保真dna聚合酶的扩增产物大部分为平滑末端,因此纯化后的片段连入平末端克隆载体blunt zero并转入大肠杆菌tg1细胞;挑选阳性克隆保存、测序。引物序列如下:
51.gh3.1
‑
f2:5'
‑
ggatcttccagagatatggcggttgattctgttttg
‑
3'(如seq id no.7所示)
52.gh3.1
‑
r2:5'
‑
ctgccgttcgacgattcaccgacggcgttcagg
‑
3'(如seq id no.8所示)。
53.3)oshr1基因序列分析
54.测序结果见seq id no.1。根据该序列的开放阅读框(orf),推算出该基因编码蛋白的氨基酸序列,见seq id no.2。
55.实施例3:csgh3.1基因过表达拟南芥品系的获得
56.1)csgh3.1过表达载体的构建
57.设计引物gh3.1
‑
f2和gh3.1
‑
r2扩增csgh3.1的orf片段,产物经kpni和xbai双酶切,插入表达载体pcambia2301的camv35s启动子后(图3),并转入农杆菌菌株中保存、测序。引物信息如下:
58.gh3.1
‑
f3:5
’‑
ggggtaccatggcggttgattctgttttg
‑3’
(如seq id no.9所示)
59.gh3.1
‑
r3:5
’‑
gctctagatcaccgacggcgttcaggag
‑3’
(如seq id no.10所示)。
60.2)浸花法转化拟南芥
61.选取刚开始开花的拟南芥(或在抽苔至4
‑
5cm时去除顶端花芽,促进其侧芽生长,然后当侧芽长出至刚刚开花时),备用;挑取农杆菌至加入相应抗生素的lb培养基中,摇菌,离心富集菌体,弃上清;将农杆菌重新悬浮于渗透溶液中;将渗透溶液倒入合适的三角瓶中,将拟南芥倒置扣于三角瓶上,保证莲座叶以上部分浸没于液体中,轻轻抖动,放置约10s;取出植株,抖动3s,用于去掉多余的液体,然后横放在黑色塑料袋中保持湿度,避免高光、高温,放置24h,然后继续正常培养;待种子成熟后,收取t0代种子。
62.3)过表达拟南芥纯合子株系的筛选与鉴定
63.将t0代转基因种子播种于含卡那霉素的1/2ms培养基进行抗性筛选,标记存活植株并进一步移栽培养,收集种子标记为t1代。将t1代种子继续抗性筛选,收集种子标记为t2代;将t2代种子继续抗性筛选,统计种子萌发率。未发生性状分离的t2代的母本即为纯合子。对纯合子植株进行株系标记并移栽培养。收集种子标记为t3代,此代种子为纯合子;将t3代种子继续播种于含卡那霉素的1/2ms培养基,进行纯化鉴定。取幼苗提取rna用于pcr鉴定并且进行gus染色(图4)。
64.利用pcr特异性扩增进一步鉴定过表达株系。结果显示,过表达株系中均能鉴定到csgh3.1的特异性条带,而野生型中无相应特征条带,表明csgh3.1已成功转化拟南芥,且在转录水平上成功表达(图4a)。为进一步鉴定csgh3.1是否在蛋白水平成功表达,对拟南芥幼苗进行gus染色。以野生型脱色至无色为对照,可以看出过过表达株系整体均有明显gus活性,表明csgh3.1蛋白已成功在拟南芥中表达(图4b)。以上结果说明,本试验已成功获得csgh3.1过表达株系,可用于后续实验。经纯合鉴定后,将剩余幼苗移栽培养至成熟。
65.实施例4:csgh3.1转基因拟南芥株系调控拟南芥侧枝分化功能研究
66.1)过表达csgh3.1拟南芥植株表型分析
67.在长日照条件下培养4周后,csgh3.1过表达拟南芥与野生型的生长开始出现差异,从拟南芥过表达株系中选择了两株典型的植株csgh3.1
‑
ox
‑
line1、csgh3.1
‑
ox
‑
line4与野生型进行比较(图5a)。培养至10周时,过表达与野生型植株的表型呈现显著差异(图5b)。与野生型相比,两过表达株系明显矮化,同时伴随二级分枝数量明显增加,一级分枝位点降低至茎基部。
68.为进一步分析过表达与野生型植株在侧枝表型上的具体差异,分别统计了过表达植株与野生型一级分枝和二级分枝的相关数据。由图6可见,过表达植株的二级分枝数量增加、长度缩短,并伴随分蘖位点降低,而一级分枝数量及长度与野生型差异不显著。上述数据说明,csgh3.1过表达对拟南芥侧枝生长的影响主要体现在二级分枝的发育。
69.2)组织特异性表达分析
70.为观察csgh3.1过表达载体在拟南芥组织中的表达活性,测定了csgh3.1在过表达植株不同组织中的相对基因表达量。csgh3.1在过表达植株的叶、花、果荚中均具有显著的表达,且在叶片中表达量最高,其次为果荚(图7a)。
71.考虑到csgh3.1是亚家族ii基因,主要催化游离态iaa与氨基酸结合形成iaa酰胺结合物以维持生长素稳态,目前在其他物种中已有多个亚家族ii基因被证实具有酰胺催化酶活性。本研究测定了8个atgh3亚家族ii基因的表达量,以野生型为对照。结果显示,atgh3.1、atgh3.4、atgh3.6、atgh3.9和atgh3.17均受到了csgh3.1过表达的显著诱导,尤其是atgh3.4 的表达量是野生型中的约58倍(图7b)。以上结果说明,诱导拟南芥atgh3亚家族ii成员的表达可能是csgh3.1过表达拟南芥植株调控內源生长素稳态的机制之一。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1