培美曲塞二酸新晶型及其制备方法与流程
1.本发明属于药物化学技术领域,具体涉及培美曲塞二酸的新晶型,以及新晶型的制备方法及用途。
背景技术:
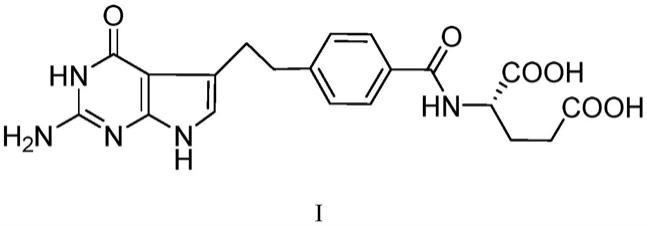
2.培美曲塞二酸(pemetrexed),化学名称为:n-[4-[2-(2-氨基-4,7-二氢-4-氧代-1h-吡咯[2,3-d]嘧啶-5-基)乙基]苯甲酰]-l-谷氨酸,具有如式i所示的化学结构。该化合物是美国礼来公司研发的治疗肿瘤药物培美曲塞二钠的前体,也是新剂型培美曲塞注射液的活性成分。
[0003][0004]
现有技术文献中已公开培美曲塞二酸的多种晶型。例如:美国专利us20080045711中公开了培美曲塞二酸晶型a、晶型b、晶型c、晶型d、晶型e、晶型f、晶型g,其中:晶型a和晶型b是水合物,晶型c是二甲亚砜溶剂合物,晶型d和晶型e是n,n-二甲基甲酰胺溶剂合物,晶型f和晶型g是无水物;国际专利申请wo2010031357中公开了培美曲塞二酸晶型h、晶型i和晶型j,这三种晶型均为水合物;国际专利申请wo2014185797中还公开了培美曲塞二酸晶型1和晶型2,所述晶型1和晶型2均是二甲亚砜溶剂合物;研究表明:晶型a制备收率低(约40%),过滤困难,制备成本太高,晶型b制备时间较长,仅析晶就需耗时约18小时,不利于放大生产;晶型c、晶型d及晶型e均为高沸点溶剂化物,在进一步制备制剂成品过程中,高沸点溶剂可能会引入成品中,造成成品溶剂残留超标,从而造成溶剂毒性;晶型f和晶型g是经高温干燥而得,稳定性较差,在干燥温度下,产品会发生一定的降解,不利于产品纯度的保持;晶型h、晶型i和晶型j的含水量太高(高达80%),不利于样品的储存和运输;由于晶型1和晶型2均是从二甲亚砜中制备得到,而二甲亚砜是高沸点溶剂,因此产品中包含较多的二甲亚砜溶剂,具有溶剂毒性;关键是,现有的培美曲塞二酸晶型均存在流动性差,可压性不好,不能实现压制制备成口服制剂,以致目前只能以注射剂上市使用,存在生产成本较高,使用不便等缺陷问题。因此,目前急需寻找一种稳定性好、无溶剂毒性,易于实现规模化生产,且可实现压制开发成口服制剂的培美曲塞二酸新晶型,以满足培美曲塞二酸新剂型的开发要求。
[0005]
因此,为了克服培美曲塞二酸现有晶型的缺陷,我们对培美曲塞二酸的晶型进行了更深入广泛的研究。在此过程中我们获得了培美曲塞二酸的新晶型,这些新晶型稳定性好,不含不易除去的溶剂,制备方法适宜规模化生产,生产周期短,实用性强,解决了现有技术存在的不足。
技术实现要素:
[0006]
本发明的目的在于提供化学稳定性好、制备工艺简便、实用性强的培美曲塞二酸新晶型,以及制备这些新晶形的方法。
[0007]
本发明第一方面提供的培美曲塞二酸的新晶型,使用cu-kα辐射,以2θ角度表示的x-射线粉末衍射在5.4
°±
0.2
°
、6.6
°±
0.2
°
、10.1
°±
0.2
°
、10.8
°±
0.2
°
、12.4
°±
0.2
°
、16.3
°±
0.2
°
、20.1
±
0.2
°
、22.7
±
0.2
°
处有特征衍射峰,其在本发明中被定义为晶型n。
[0008]
具体地,本发明所述晶型n,使用cu-kα辐射,以2θ角度表示的x-射线粉末衍射在5.4
°±
0.2
°
、6.6
°±
0.2
°
、8.1
°±
0.2
°
、10.1
°±
0.2
°
、10.8
°±
0.2
°
、12.4
°±
0.2
°
、13.3
±
0.2
°
、16.3
°±
0.2
°
、17.4
°±
0.2
°
、18.3
°±
0.2
°
、19.1
°±
0.2
°
、19.3
±
0.2
°
、20.1
°±
0.2
°
、22.7
°±
0.2
°
处具有特征衍射峰;
[0009]
更具体地,本发明所述晶型n,使用cu-kα辐射,以2θ角度表示的x-射线粉末衍射在5.4
°±
0.2
°
、6.6
°±
0.2
°
、8.1
°±
0.2
°
、10.1
°±
0.2
°
、10.8
°±
0.2
°
、12.4
°±
0.2
°
、13.3
±
0.2
°
、16.3
°±
0.2
°
、17.4
°±
0.2
°
、18.3
°±
0.2
°
、19.1
°±
0.2
°
、19.3
±
0.2
°
、20.1
°±
0.2
°
、22.7
°±
0.2
°
、24.6
±
0.2
°
、25.1
±
0.2
°
、25.4
±
0.2
°
、26.0
±
0.2
°
处具有特征衍射峰。
[0010]
在本发明的一个优选方案中,所述培美曲塞二酸晶型n具有如图1所示的x-射线粉末衍射图谱。
[0011]
经测定,本发明所述晶型n的dsc图谱分别在46.1~102.4℃、102.4~141.9℃、240.4~281.7℃范围具有吸热峰;具体地,所述吸热峰的峰值分别出现在80.3
±
2℃、132.1
±
0.1℃、262.1
±
2℃;更具体地,在本发明的一个方案中,所述培美曲塞二酸晶型n具有如图2所示的dsc图谱。
[0012]
经测定,本发明提供的培美曲塞二酸的晶型n,其tga图谱在37~142℃范围内失水重量为8%~12%;具体地,其tga图谱在37~102℃范围内失水5.3%~6.3%,在102~142℃范围内失水3.8%~4.8%。在本发明的一个技术方案中,所述曲塞二酸晶型n具有如图2所示的tga图谱。
[0013]
本发明第二方面提供一种制备培美曲塞二酸晶型n的方法,该方法包括以下步骤:
[0014]
将培美曲塞二钠加入水与乙醇的混合溶剂中,用盐酸调节ph值至1~3,升温溶解至剩余少许固体,降温至0~30℃析晶,再次升温溶解至剩余少许固体,降温至0~30℃析晶,过滤,室温晾干,得到培美曲塞二酸晶体n。
[0015]
其中,水与乙醇的体积比为1:0.5~2.0,优选1:0.8~1.5,更优选1:1;培美曲塞二钠与混合溶剂的质量体积比:为1:20~70,优选1:40~60,更优选1:50,单位:mg/ml,升温溶解温度为55~60℃.
[0016]
本发明第三方面提供另一种制备培美曲塞二酸晶型n的方法,该方法包括以下步骤:
[0017]
将培美曲塞二钠加入水与混溶于水的溶剂组成的混合溶剂中,用盐酸调节ph至1~3,加热溶清,加入晶型n的晶种,降温析晶,过滤,室温晾干,得到培美曲塞二酸晶体n。其中,所述混溶于水的溶剂选自甲醇、乙醇、异丙醇、丙酮、乙腈之一或其任意混合溶剂。
[0018]
其中,水与混溶于水的溶剂的体积比为1:0.20~5.0,优选1:0.25~4;培美曲塞二钠与混合溶剂的体积比为1:40~100,优选1:60~80,更优选1:75;回流溶解,析晶温度为:0~30℃,晶种的加入量为培美曲塞二钠投料量的0.5~1%。
[0019]
本发明第四方面提供另一种制备培美曲塞二酸晶型n的方法,该方法包括以下步骤:
[0020]
将培美曲塞二酸加入水与混溶于水的溶剂组成的混合溶剂中,加热溶清,加入晶型n的晶种,降温析晶,过滤,得到培美曲塞二酸晶体,其中,所述混溶于水的溶剂选自甲醇、乙醇、异丙醇、丙酮、乙腈之一或其任意混合溶剂。
[0021]
其中,水与混溶于水的溶剂的体积比为1:0.20~5.0,优选1:0.25~4.0;培美曲塞二钠与混合溶剂的重量体积投料比:1:40~100,优选1:60~80,更优选1:75;单位:g/ml;加热溶清温度:回流溶解,降温析晶温度0~30℃,晶种的量:0.5~1%。
[0022]
本发第五方面提供培美曲塞二酸的另一新晶型,使用cu-kα辐射,以2θ角度表示的x-射线粉末衍射在5.7
°±
0.2
°
、7.0
°±
0.2
°
、10.6
°±
0.2
°
、12.1
°±
0.2
°
、18.4
°±
0.2
°
、20.6
°±
0.2
°
、22.8
°±
0.2
°
、26.7
°±
0.2
°
、31.7
°±
0.2
°
处有衍射峰。该晶型在本发明被定义为晶型p。
[0023]
具体地,本发明所述晶型p,使用cu-kα辐射,以2θ角度表示的x-射线粉末衍射在5.7
°±
0.2
°
、7.0
°±
0.2
°
、10.6
°±
0.2
°
、11.4
°±
0.2
°
、12.1
°±
0.2
°
、13.6
°±
0.2
°
、15.8
°±
0.2
°
、17.8
°±
0.2
°
、18.4
°±
0.2
°
、20.6
°±
0.2
°
、21.5
°±
0.2
°
、22.2
°±
0.2
°
、22.8
°±
0.2
°
、25.8
°±
0.2
°
、26.7
°±
0.2
°
、28.1
°±
0.2
°
、31.7
°±
0.2
°
处有衍射峰。
[0024]
在本发明的一个优选实施方案中,所述培美曲塞二酸晶型p具有如图3所示的x-射线粉末衍射图谱。
[0025]
本发明所述培美曲塞二酸晶型p的dsc图谱在37.1~132.3℃、140.9~162.3℃、162.1~192.8℃、197.0~220.5℃、251.3~274.0℃范围具有明显的吸热峰;具体地,所述吸热峰的峰值分别出现在49.8
±
2℃、154.7
±
2℃、180.0
±
2℃、213.6
±
2℃、265.5
±
2℃处。在本发明的一个技术方案中,所述培美曲塞二酸晶型p具有如图3所示的dsc图谱。
[0026]
本发明所述培美曲塞二酸晶型p的tga图谱显示,其在37.6~131.6范围内具有明显的失水,失重比例为3~6%。具体地,本发明所述培美曲塞二酸的晶型p具有如图4中所示的tga图谱。
[0027]
本发明第六方面提供一种制备培美曲塞二酸晶型p的方法,该方法包括以下步骤:
[0028]
将培美曲塞二钠溶于水与乙醇的混合溶剂中,加热至35~45℃,超声震荡下,用盐酸调节ph至1~2,降温至0~30℃析晶,过滤,室温晾干,得到培美曲塞二酸晶体p。
[0029]
其中,培美曲塞二钠与混合溶剂的重量体积投料比为1:40~120,优选1:60~100,更优选1:80;水与乙醇的体积比为1:0.5~1.5,优选1:0.8~1.2,更优选1:1.0.
[0030]
本发明提供的培美曲塞二酸的晶型n、晶型p,具有更为优异的化学稳定性和晶型稳定,同时通过现有的试验数据证实,本发明提供的晶型n和晶型p,在颗粒的流动性、吸湿性、溶解速度中的一方面或几方面相对于现有晶型均表现出明显的改善和提升,克服了现有技术存在的缺陷,且易于工业化制备、操作简单,具有良好的可控性。
附图说明
[0031]
图1实施例1所得培美曲塞二酸晶型n的x-rpd图谱;
[0032]
图2实施例1所得培美曲塞二酸晶型n的dsc-tga图谱;
[0033]
图3实施例8所得培美曲塞二酸晶型p的x-rpd图谱;
[0034]
图4实施例8所得培美曲塞二酸晶型p的dsc-tga图谱;
[0035]
图5实施例2所得晶型n的扫描电镜镜像;
[0036]
图6实施例8所得晶型p的扫描电镜镜像;
[0037]
图7对比实施例1所得晶型a的扫描电镜镜像。
具体实施方式
[0038]
以下通过具体的实施方式,对本发明的上述内容做进一步的详细说明,但不应将此理解为对本发明保护主题的任何限制。凡基于本发明上述内容所实现的技术方案均属于本发明的范围。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述;除特殊说明外,本发明所述“室温”具有本领域的公知含义,具体是指15~35℃,优选20~30℃,更优选20~25℃。
[0039]
本发明所用仪器和方法:
[0040]
(1)x-射线粉末衍射仪
[0041]
仪器型号:panalytical x射线粉末衍射仪
[0042]
测试方法:将研细后的样品(100mg)填在玻璃板凹槽里,用载玻片将其平面与玻璃面挂齐平后,将样品置于panalytical x射线粉末衍射仪中,使用40kv、40ma的铜x-射线源,扫描范围为3~45
°
(2θ),扫描速度8
°
/分钟。扫描误差通常为
±
0.2度(2θ)。
[0043]
(2)tga/dsc1同步热分析仪
[0044]
仪器型号:mettler tga/dsc1。
[0045]
测试方法:将重10mg的样品置于具有小针孔的密闭铝盘中,在30℃下保持平衡,然后以10℃/min的扫描速率加热至250℃。干燥氮气被用作吹扫气体。
[0046]
(3)电镜扫描
[0047]
仪器型号:zeiss sigma 300扫描电镜
[0048]
测试方法:取适量供试品,均匀铺布于导电胶带上,喷金,于电镜视野下观察。
[0049]
实施例1培美曲塞二酸晶型n的制备
[0050]
将培美曲塞二钠4.0g溶于100ml水与100ml乙醇的混合溶剂中,用盐酸调节ph至1~3,升温至55~60℃,至剩余少许固体,降温至20~30℃析晶,再次升温至55~60℃,至剩余少许固体,降温至20~30℃析晶,过滤,室温晾干,得到3.4g培美曲塞二酸晶体n,hplc纯度99.92%,水分含量为10.1%。
[0051]
经测定,其x-rpd图谱如图1所示,其dsc-tga图谱如图2所示。
[0052]
实施例2培美曲塞二酸晶型n的制备
[0053]
将培美曲塞二钠4.0kg溶于100l水与200l乙醇的混合溶剂中,用盐酸调节ph至1~3,加热回流溶清,降温至55~60℃,然后加入晶型n的晶种20g,降温至0~10℃析晶,过滤,室温鼓风干燥,得到3.6kg培美曲塞二酸晶体n,hplc纯度99.94%,水分含量为10.7%。
[0054]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0055]
实施例3培美曲塞二酸晶型n的制备
[0056]
将培美曲塞二钠4.0g溶于240ml水与60ml甲醇的混合溶剂中,用盐酸调节ph至1~3,加热回流溶清,降温至55~60℃,,然后加入晶型n的晶种40mg,降温至20-30℃析晶,过滤,室温晾干,得到3.8g培美曲塞二酸晶体n,hplc纯度99.93%,水分含量为10.9%。
[0057]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0058]
实施例4培美曲塞二酸晶型n的制备
[0059]
将培美曲塞二钠4.0g溶于60ml水与240ml异丙醇的混合溶剂中,用盐酸调节ph至1~3,加热回流溶清,降温至55~60℃,加入晶型n的晶种40mg,降温至10~20℃析晶,过滤,室温晾干,得到3.4g培美曲塞二酸晶体n,hplc纯度99.92%,水分含量为10.9%。
[0060]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0061]
实施例5培美曲塞二酸晶型n的制备
[0062]
将培美曲塞二钠4.0g溶于80ml水与160ml乙腈的混合溶剂中,用盐酸调节ph至1~3,加热回流溶清,降温至55~60℃,然后加入晶型n的晶种40mg,降温至0~10℃析晶,过滤,室温晾干,得到3.6g培美曲塞二酸晶体n,hplc纯度99.92%,水分含量为10.1%。
[0063]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0064]
实施例6培美曲塞二酸晶型n的制备
[0065]
将培美曲塞二酸4.0g悬浮于80ml水与160ml丙酮的混合溶剂中,加热回流溶清,降温至50~55℃,加入晶型n的晶种40mg,降温至10~20℃析晶,过滤,室温晾干,得到3.7g培美曲塞二酸晶体n,hplc纯度99.92%,水分含量为9.7%。
[0066]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0067]
实施例7培美曲塞二酸晶型n的制备
[0068]
将培美曲塞二酸4.0g悬浮于160ml水与160ml丙酮的混合溶剂中,加热回流溶清,降温至50~55℃,加入晶型n的晶种40mg,降温至10-20℃析晶,过滤,室温晾干,得到3.2g培美曲塞二酸晶体n。
[0069]
经测定,其x-rpd图谱与图1基本一致,其dsc-tga图谱与图2基本一致。
[0070]
实施例8培美曲塞二酸晶型p的制备
[0071]
将培美曲塞二钠5.0g溶于200ml水与200ml乙醇的混合溶剂中,加热至35~45℃,超声震荡下,用盐酸调节ph至1~2,降温至室温析晶,过滤,室温晾干,得到4.3g培美曲塞二酸晶体p,hplc纯度99.92%,水分含量为5.3%。
[0072]
经测定,其x-rpd图谱如图3所示,其dsc-tga图谱如图4所示。
[0073]
对比实施例1:培美曲塞二酸晶型a的制备
[0074]
参考文献wo2008021405实施例1的方法,将培美曲塞二钠5.0g溶于100ml水中,用盐酸调节ph至4.5,升温至65℃搅拌25分钟,缓慢降温,5小时降至24℃,保温搅拌10小时,过滤,10ml
×
2的水洗涤滤饼,真空干燥16.5小时,得到1.4g培美曲塞二酸晶体a;经测定,其x-rpd图谱与wo2008021405图1所述图谱基本一致。hplc纯度99.90%。
[0075]
稳定性试验
[0076]
取实施例2制备得到的培美曲塞二酸晶型n、实施例8制备得到的培美曲塞二酸晶型p、对比实施例1制备得到的培美曲塞二酸晶型a样品放置在影响因素条件下,考察在放置5天、10天的稳定性,试验结果见表1。
[0077]
具体的稳定性考察的方法可以参照《中国药典》2015年版四部通则0512高效液相色谱法测定。
[0078]
表1美曲塞二酸晶型n、晶型p、晶型a的稳定性试验结果对比
[0079][0080]
由上述实验可以看出,经过10天的影响因素试验,本发明制备得到的美曲塞二酸晶型n、晶型p纯度未发生显著变化,与晶型a相比更稳定;高温40℃条件下晶型n、p颜色无明显变化,晶型a颜色变为浅绿色,其他条件趋势一致,晶型n、p均相对稳定,晶型a相对不稳定。说明本发明提供的美曲塞二酸晶型n、晶型p具有良好的化学稳定性。
[0081]
晶体微观形态及其流动性
[0082]
取实施例2所得晶型n、实施例8所得晶型p、对比实施例1所得晶型a对其微观形态进行扫描电镜测定,测定结果见表2。
[0083]
表2培美曲塞二酸晶型n、晶型p、晶型a的晶体微观形态比较
[0084][0085]
上述数据表明,晶型n、p粒径较细,无需粉碎,且流动性好;而晶型a易粘结成大块,粉碎后有较强的静电,流动性差;说明晶型n、p更适合口服制剂的开发。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1