一种地奈德晶型B及制备方法和应用与流程
一种地奈德晶型b及制备方法和应用
技术领域
1.本发明涉及医药技术领域,尤其涉及一种地奈德晶型b及制备方法和应用。
背景技术:
2.皮肤病是我们日常生活中常见的疾病,目前皮肤病发病率高,种类繁多,因其多发于体表,不仅给患者带来身体的伤害;还影响了患者外观和容貌,给患者带来精神上的伤害。
3.近年来随着人民生活水平不断提高,对皮肤病的要求和对皮肤病的药物需求也日趋增强。目前治疗皮肤病的药物种类繁多,多为各种软膏、乳膏剂。地奈德乳膏是目前常用的制剂,适用于对皮质类固醇治疗有效的各种皮肤病,如接触下皮炎、神经性皮炎、脂溢性皮炎、湿疹、银屑病、扁平苔藓、单纯性苔藓、汗疱症等引起的皮肤炎症和皮肤瘙痒的治疗。地奈德乳膏为糖皮质激素类药物,具有抗炎、抗过敏、止痒及减少渗出作用;可以减轻和防止组织对炎症的反应,能消除局部非感染性炎症引起的发热、发红和肿胀,从而减轻炎症的表现;具有防止或抑制细胞免疫反应、抑制初次免疫应答的免疫抑制作用。
4.然而,现有可市售的地奈德晶型a的流动性、水溶性、在光照条件下的稳定性均不满足工业生产推广,极大影响该品种在药剂上的应用。
5.因此,亟需提高地奈德的流动性、水溶性、在光照条件下的稳定性,开发具有优越的物理化学特性的地奈德新晶型,从而使其可有利的在药物加工和药物组合物中使用。
技术实现要素:
6.基于现有技术中,地奈德晶型a存在的流动性、水溶性、稳定性差的问题,本发明提供一种地奈德晶型b。该晶型流动性好,光稳定性好,便于产品的质量控制;在水中的溶解度有显著提高,有利于药效的发挥;同时该晶型的制备工艺简单,有利于工业化生产中的产品成本控制。
7.第一方面,本发明提供一种地奈德晶型b,所述地奈德晶型b使用cu
‑
kα辐射,以2θ角度表示的x射线衍射峰图谱在9.93
°±
0.2
°
、14.39
°±
0.2
°
、15.90
°±
0.2
°
、17.25
°±
0.2
°
、17.50
°±
0.2
°
、17.96
°±
0.2
°
、19.94
°±
0.2
°
处有特征吸收峰。
8.第二方面,本发明提供了一种上述第一方面所述的地奈德晶型b的制备方法,该方法包括:
9.将地奈德粗品与乙腈的混合溶液在第一预设温度下进行第一次保温搅拌后,降温至第二预设温度;
10.在第二预设温度下进行第二次保温搅拌,过滤,干燥得到地奈德晶型b。
11.优选地,所述地奈德粗品与乙腈的重量体积比比为1g:5ml~1g:30ml。
12.优选地,所述地奈德粗品与乙腈的重量体积比比为1g:10ml。
13.优选地,所述第一预设温度为70~82℃,所述保温打浆搅拌的时间为20min~1h。
14.优选地,所述第二预设温度为15~35℃,所述保温搅拌的时间为1h~5h。
15.优选地,所述地奈德粗品是地奈德晶型a,所述地奈德晶型a使用cu
‑
kα辐射,以2θ角度表示的x射线衍射峰图谱在13.93
°±
0.2
°
、14.17
°±
0.2
°
、15.51
°±
0.2
°
、16.94
°±
0.2
°
处有特征吸收峰。
16.第三方面,本发明提供了一种上述第一方面所述的地奈德晶型b的应用,具体为:将地奈德晶型b用于制备药物组合物,所述药物组合物包含地奈德晶型b以及药学上可以接受的辅料。
17.优选地,所述药物组合物的剂型为吸入气雾剂、乳膏或洗液。
18.优选地,所述地奈德晶型b以及制备得到的所述药物组合物用于治疗皮肤病。与现有技术相比,本发明包括以下优点:
19.本发明提供了一种地奈德晶型b及制备方法和应用,该地奈德晶型b具有光稳定性好的优势,便于产品生产使用过程中的质量控制;且晶体在水中的溶解度高达50mg/100ml,相较于现有的地奈德晶型a(5mg/100ml)有显著提高,更有利于药效的发挥;此外,本发明提供的地奈德晶型b的制备工艺简单、有利于工业化生产中的成本控制,具有较高的经济价值。
附图说明
20.图1示出了现有技术中地奈德晶型a的x衍射图谱;
21.图2示出了本发明实施例中的地奈德晶型b的x衍射图谱。
具体实施方式
22.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
23.实施例中未注明具体实验步骤或者条件,按照本领域内的现有技术所描述的常规实验步骤的操作或条件即可进行。所用试剂以及其他仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
24.首先,公开号cn103936813b(公开日:2014年7月23日)的中国发明专利申请说明书中披露了有关地奈德的制备方法。因此,发明人参照cn103936813b制备方法制备了地奈德,并对制备得到的地奈德进行晶型分析,发现该地奈德为a晶型,与外购标准品(来源:中检院)的晶型一致。此外,发明人在进一步研究中发现,地奈德晶型a在光照条件下并不稳定,极大影响该品种在药剂上的应用。
25.因此,发明人想到,不同晶型的同一种药物,其溶解度、生物利用度会存在很大差异,其稳定性、流动性、可压缩性也会不同,这些理化性质对药物的应用产生一定的影响,从而影响药物的疗效。基于上述思考,发明人得出本发明的技术构思,具体为:通过晶型转化溶剂对现有地奈德晶型a进行作用,改变现有地奈德(a晶型)的晶型,使其转变为地奈德晶型b,从而具备优秀的光稳定性、流动性、水溶性,更有利的在药物加工和药物组合物中使用。基于上述技术构思,发明人提供了一种地奈德晶型b及制备方法和应用,具体实施内容如下:
26.第一方面,本发明提供一种地奈德晶型b,该地奈德晶型b使用cu
‑
kα辐射,以2θ角度表示的x射线衍射峰图谱在9.93
°±
0.2
°
、14.39
°±
0.2
°
、15.90
°±
0.2
°
、17.25
°±
0.2
°
、17.50
°±
0.2
°
、17.96
°±
0.2
°
、19.94
°±
0.2
°
处有特征吸收峰。
27.具体实施时,本发明提供的地奈德晶型b在使用cu
‑
kα辐射,以2θ角度表示的x射线衍射图谱在9.68
°±
0.2
°
、9.93
°±
0.2
°
、12.46
°±
0.2
°
、14.39
°±
0.2
°
、14.93
°±
0.2
°
、15.90
°±
0.2
°
、17.25
°±
0.2
°
、17.50
°±
0.2
°
、17.96
°±
0.2
°
、19.94
°±
0.2
°
、24.65
°±
0.2
°
、25.60
°±
0.2
°
、26.46
°±
0.2
°
、28.39
°±
0.2
°
、30.11
°±
0.2
°
、31.05
°±
0.2
°
处有特征吸收峰。
28.第二方面,本发明提供了一种上述第一方面所述的地奈德晶型b的制备方法,该方法包括:
29.将地奈德粗品与乙腈的混合溶液在第一预设温度下进行第一次保温搅拌后,降温至第二预设温度;
30.在第二预设温度下进行第二次保温搅拌,过滤,干燥得到地奈德晶型b。
31.具体实施时,地奈德粗品(地奈德晶型a)在晶型转化溶剂乙腈的作用下,经精确的温控控制,由地奈德晶型a转化为地奈德晶型b,该地奈德晶型b在水中的溶解度、光稳定性均较地奈德晶型a有大幅提升,更有助于地奈德产品生产使用过程中的质量控制和药效的发挥。
32.具体实施时,地奈德粗品与乙腈的重量体积比比为1g:5ml~1g:30ml。
33.具体实施时,地奈德粗品与乙腈的重量体积比比为1g:10ml。
34.具体实施时,本发明优选地奈德粗品与乙腈的重量体积比比为1g:10ml。
35.具体实施时,第一预设温度为70~82℃,第一次保温搅拌的时间为20min~1h。
36.具体实施时,本发明将地奈德粗品与乙腈混合后,升温至第一预设温度(70~82℃),进行保温搅拌,使地奈德晶型a在乙腈溶液环境中充分转晶。本发明具体实施时,优选第一预设温度为75~82℃,第一次保温搅拌的时间为20min~40min。
37.具体实施时,第二预设温度为15~35℃,保温搅拌的时间为1h~5h。
38.具体实施时,地奈德粗品(a晶型)经控温搅拌(70~82℃)转晶后,降温析出,在第二预设温度(15~35℃)条件下,由温差变化而析出地奈德晶型b晶体,辅以搅拌使地奈德晶型b完全析出,从而保证收率。本发明具体实施时,优选第二预设温度为20~25℃,第二次保温搅拌的时间为1~3h。
39.具体实施时,地奈德粗品是地奈德晶型a,地奈德晶型a使用cu
‑
kα辐射,以2θ角度表示的x射线衍射峰图谱在13.93
°±
0.2
°
、14.17
°±
0.2
°
、15.51
°±
0.2
°
、16.94
°±
0.2
°
处有特征吸收峰。
40.第三方面,本发明提供了一种上述第一方面所述的地奈德晶型b的应用,具体为:将地奈德晶型b用于制备药物组合物,药物组合物包含地奈德晶型b以及药学上可以接受的辅料。
41.具体实施时,药物组合物的剂型为吸入气雾剂、乳膏或洗液。
42.具体实施时,地奈德晶型b以及制备得到的药物组合物用于治疗皮肤病。
43.下面是本发明在具体实施时的详细介绍:
44.其中,部分试剂、原料、仪器购买情况如下:
45.11β
‑
羟基
‑
16α,17
‑
[(1
‑
甲基亚乙基)
‑
二氧]孕甾
‑
1,4
‑
二烯
‑
3,20
‑
二酮
‑
21
‑
醋酸酯,cas25092
‑
25
‑
5,纯度99%,采购自湖南玉新药业有限公司。
[0046]
核磁共振仪:bruker avance iii hd 500;
[0047]
质谱ltq orbitrap elite;
[0048]
液相色谱(agilent 1260)。
[0049]
在下述实施例及对比例中,hplc检测均按照如下方法进行:
[0050]
色谱柱:phenomenex kinetex c8,2.6μm,150
×
4.6mm;
[0051]
柱温:20℃;
[0052]
样品盘温度:20℃;
[0053]
流速:1.0ml/min;
[0054]
检测波长:254nm;
[0055]
进样量:5μl;
[0056]
流动相a:0.1%磷酸水溶液;
[0057]
流动相b:乙腈。
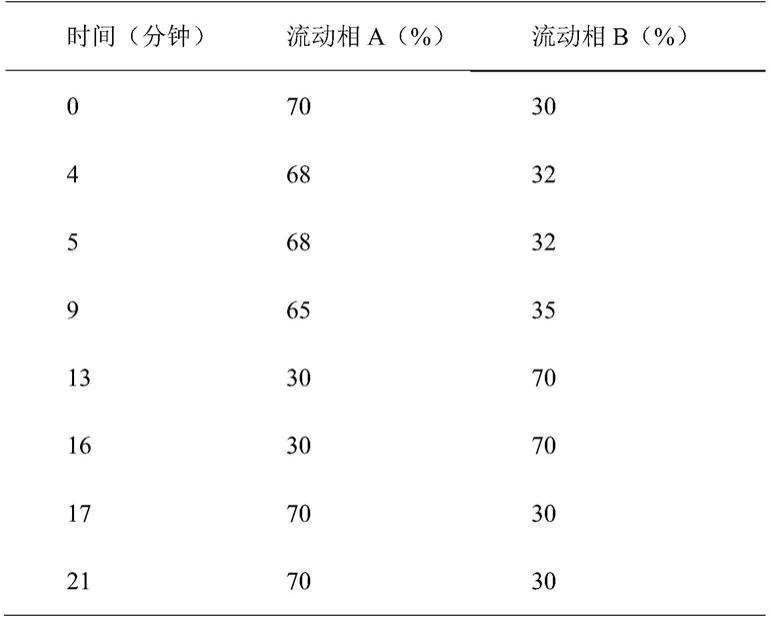
[0058]
梯度:具体见表1
[0059]
表1:hplc检测参数梯度
[0060][0061]
在下述实施例和对比例中,x射线衍射的检测条件为:
[0062]
仪器型号:bruker d8 advance
[0063]
测试条件:x
‑
射线源:
[0064]
工作电流:40ma
[0065]
工作电压:40kv
[0066]
检测器:psd
[0067]
初始角度:4
°
(2
‑
theta)
[0068]
结束角度:40
°
(2
‑
theta)
[0069]
增量:0.05
°
/step
[0070]
扫描速度:1sec/step
[0071]
实施例1:地奈德晶型a的制备
[0072][0073]
该制备工艺同cn103936813b中的实施例2。
[0074]
氮气保护下,将300g(0.65mol)11β
‑
羟基
‑
16α,17
‑
[(1
‑
甲基亚乙基)
‑
二氧]孕甾
‑
1,4
‑
二烯
‑
3,20
‑
二酮
‑
21
‑
醋酸酯和10kg甲醇加入至反应瓶中,搅拌,控温25~30℃,加入200g氢氧化钠水溶液(3wt%,0.15mol),25~30℃保温反应40分钟,tlc显示原料反应完全,滴入10.21g(0.17mol)冰醋酸,测ph≈6,滴入10kg水,滴完后搅拌1小时,过滤,滤饼60℃真空干燥得215g白色固体。收率78.90%,纯度99.10%(hplc)。1hnmr(dmso
‑
d6):δppm0.79(s,3h),0.97
‑
1.00(m,1h),1.06(s,3h),1.34(s,3h),1.39(s,3h),1.49
‑
1.59(m,3h),1.68
‑
1.78(m,2h),1.98
‑
2.09(m,2h),2.28
‑
2.32(m,1h),2.51
‑
2.57(m,2h),4.04
‑
4.08(d,1h),4.30(s,1h),4.50
‑
4.55(m,1h),4.74
‑
4.75(d,1h),4.88
‑
4.89(s,1h),5.10(s,1h),5.92(s,1h),6.15
‑
6.18(d,1h),7.30
‑
7.33(d,1h),ms(esi)417m/z(m+h)
+
。
[0075]
图1示出了现有技术中地奈德晶型a的x衍射图谱,具体x衍射数据见表2。
[0076]
表2:地奈德晶型a的x射线粉末衍射数据
[0077]
序号角度强度(%)16.958.1212.956.5313.93100414.1711.8515.5113.5616.9443.1719.485.8820.977.1922.198.21023.595.91124.725.2
[0078]
按照《中国药典》(2020版)二部附录xix j药物引湿性试验指导原则进行试验,测定本实施例制备得到的地奈德晶型a的引湿性,结果引湿性增重0.05%。室温下测定地奈德晶型a在水中的溶解度为5mg/100ml。
[0079]
实施例2:地奈德晶型b的制备
[0080]
将5g实施例1得到的地奈德晶型a和50ml乙腈加入至反应瓶中,搅拌,升温至回流
(约82℃),回流打浆半小时,降温至20~25℃保温搅拌2小时,过滤,滤饼50℃真空干燥得4.75g白色固体,收率:95%,纯度:99.8%。
[0081]
图2示出了本发明实施例中的地奈德晶型b的x衍射图谱,具体x衍射数据见表3。
[0082]
表3:地奈德晶型b的x射线粉末衍射数据
[0083]
序号角度强度(%)19.6814.429.93100312.4610.6414.3920.7514.9312.2615.9018.9717.2516.7817.5038.3917.96161019.9449.31124.6591225.6010.31326.464.91428.397.61530.118.41631.058.9
[0084]
按照《中国药典》(2020版)二部附录xix j药物引湿性试验指导原则进行试验,测定本实施例制备得到的地奈德晶型b的引湿性,结果引湿性增重0.02%。室温下测定地奈德晶型b在水中的溶解度为50mg/100ml。
[0085]
实施例3:地奈德晶型b的制备
[0086]
将5g实施例1得到的地奈德晶型a和25ml乙腈加入至反应瓶中,搅拌,升温至70℃,保温搅拌1小时,降温至35℃,35℃保温搅拌1小时,过滤,滤饼50℃真空干燥得4.0g白色固体,收率:80%,纯度99.8%。
[0087]
采用bruker d8 advance x射线衍射仪,本实施例的产物得到与图2、表3基本一致的x射线衍射图谱(图谱略)。
[0088]
按照《中国药典》(2020版)二部附录xix j药物引湿性试验指导原则进行试验,测定本实施例制备得到的地奈德晶型b的引湿性,结果引湿性增重0.02%。室温下测定地奈德晶型b在水中的溶解度为50mg/100ml。
[0089]
实施例4:地奈德晶型b的制备
[0090]
将5g实施例1得到的地奈德晶型a和150ml乙腈加入至反应瓶中,搅拌,升温至回流(约82℃),回流打浆20min,降温至15℃,15℃保温搅拌5小时,过滤,滤饼50℃真空干燥得4.1g白色固体,收率:82%,纯度99.3%。
[0091]
采用bruker d8 advance x射线衍射仪,本实施例的产物得到与图2、表3基本一致的x射线衍射图谱(图谱略)
[0092]
按照《中国药典》(2020版)二部附录xix j药物引湿性试验指导原则进行试验,测定本实施例制备得到的地奈德晶型b的引湿性,结果引湿性增重0.02%。室温下测定地奈德晶型b在水中的溶解度为50mg/100ml。
[0093]
实施例5:地奈德晶型b的制备
[0094]
将5g实施例1得到的地奈德晶型a和100ml乙腈加入至反应瓶中,搅拌,升温至回流(约82℃),回流打浆半小时,降温至20~25℃保温搅拌2小时,过滤,滤饼50℃真空干燥得4.5g白色固体,收率:90%,纯度:99.5%。
[0095]
采用bruker d8 advance x射线衍射仪,本实施例的产物得到与图2、表3基本一致的x射线衍射图谱(图谱略)
[0096]
按照《中国药典》(2020版)二部附录xix j药物引湿性试验指导原则进行试验,测定本实施例制备得到的地奈德晶型b的引湿性,结果引湿性增重0.02%。室温下测定地奈德晶型b在水中的溶解度为50mg/100ml。
[0097]
实施例6:晶型稳定性考察
[0098]
参照中国药典2020年版四部通则9001原料药物与制剂稳定性试验指导原则进行,具体对地奈德晶型a和地奈德晶型b分别进行在高湿(r.h.92.5%)、高温(60℃)和光照(4500
±
500lx)条件下的稳定性影响因素试验,分别于5天、10天和30取样进行pxrd(多晶x射线衍射)检测,同时进行hplc纯度测定,并与0天的结果进行对照。
[0099]
表4:晶型a和晶型b稳定性影响因素试验
[0100][0101]
从表4的数据得知,a晶型和b晶型在高温和高湿条件下,30天均比较稳定,纯度和0天相比无明显变化;但是光照30天时,b晶型明显比a晶型稳定。综上,b晶型的光稳定性较好,且b晶型在高温、高湿、光照三种条件下均比较稳定。
[0102]
以上对本发明所提供的一种地奈德晶型b及制备方法和应用进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1