一种FAPα酶激活式鬼臼毒素衍生物及其制备方法与应用与流程
一种fap
α
酶激活式鬼臼毒素衍生物及其制备方法与应用
技术领域
1.本发明涉及化学技术领域,尤其是一种fapα酶激活式鬼臼毒素衍生物及其在治疗/预防恶性肿瘤和白血病相关药物的应用。
背景技术:
2.恶性肿瘤是严重威胁人类健康的一类常见疾病,其发病率及死亡率呈逐年递增的态势。据统计,2012年全球新增的恶性肿瘤患者为1400余万,到2018年已经超过了1810万,预计2030年全球恶性肿瘤病例将由2012年的1400万上升到2200万。鬼臼毒素(podophyllotoxin)是一种具有显著抗肿瘤活性的化合物。其抗肿瘤作用机制主要有:抑制微管蛋白、拓扑异构酶ii、自由基作用、抑制血管增生等。但其水溶性较差、毒副作用较强且易产生耐药性的缺陷严重制约了它的临床应用。虽然许多药学工作者对鬼臼毒素进行了大量的结构改造,相继也发现了诸如依托泊苷、替尼泊苷等药物。然而,它们在临床应用时依然存在水溶性差、易产生多药耐药、严重的胃肠道功能紊乱等缺陷。因此,寻找更高效低毒、选择性更好的鬼臼毒素类衍生物显得尤为重要。
3.成纤维细胞激活蛋白α(fibroblast activation protein,fapα)是由肿瘤基质成纤维细胞表达的一种膜结合蛋白,它在超过90%的上皮癌(包括肺癌、结肠癌、乳腺癌、膀胱癌、胰腺癌等)的基质活化成纤维细胞中表达,在正常组织仅短暂表达于愈合伤口中。因此,fapα作为一种极具潜力的抗肿瘤靶标分子正受到越来越多的关注。多项研究表明,fapα酶特异性底物(n
‑
苄氧羰基甘氨酰
‑
l
‑
脯氨酸,z
‑
gly
‑
pro
‑
oh)能激活fapα酶,并特异性水解gly
‑
pro序列后的脯氨酸和其他小分子形成的肽键,从而导致肿瘤细胞的行为发生改变,在肿瘤
‑
宿主界面基质的降解以及重建中发挥着重要作用。由此可见,选择fapα高表达的肿瘤基质作为肿瘤治疗靶标,比传统的细胞毒药物更有优势。
4.大量鬼臼毒素结构修饰研究表明,用非糖结构取替依托泊苷的c
‑
4位糖基能够显著地克服依托泊苷所导致的抗药性。借助计算机辅助药物设计技术,筛选鬼臼毒素4
‑
oh与fapα酶特异性底物(n
‑
苄氧羰基甘氨酰
‑
l
‑
脯氨酸,z
‑
gly
‑
pro
‑
oh)之间的连接臂,发现采用氨基酸作为连接臂时,形成的虚拟分子与fapα具有更多的结合位点。为进一步研究氨基酸作为连接臂在fapα酶激活式鬼臼毒素抗肿瘤前体药物研发中的价值,采用不同的氨基酸将鬼臼毒素与fapα酶的特异性底物(z
‑
gly
‑
pro
‑
oh)进行拼接,得到一系列的fapα酶激活式鬼臼毒素衍生物,通过测试发现它们具有良好的抗肿瘤活性,可以被进一步开发研究,同时也可以为生物活性筛选提供化合物源,对药物的筛选和制药行业具有重要的应用价值。
技术实现要素:
5.本发明的目的是:提供一种fapα酶激活式鬼臼毒素衍生物及其制备方法与应用,它是一类重要的药物分子类似物和医药中间体类似物,同时为生物活性筛选提供化合物源,对药物的筛选和制药行业具有重要的应用价值,其合成方法非常经济简便,且收率较高。
6.本发明还发现该类化合物在制备防治肿瘤疾病药物中的应用。
7.本发明是这样实现的:fapα酶激活式鬼臼毒素衍生物,该类化合物具有如通式(ⅰ)所示的结构:
[0008][0009]
式中,r为色氨酸、正缬氨酸、丙氨酸、亮氨酸、缬氨酸、苯丙氨酸、丝氨酸、赖氨酸、苏氨酸、甲硫氨酸、酪氨酸、异亮氨酸、半胱氨酸、胱氨酸、组氨酸、精氨酸、谷氨酸、生物素、乙二胺、硫脲、乙二醇、2,2'
‑
二氯二乙醚、1,2
‑
二(2
‑
氯乙氧基)乙烷、氯乙酰氯、1,4
‑
二(2
‑
氯乙基)哌嗪、甲基、乙基、丙基、丁基、戊基、己基、丁二酰基、戊二酰基或丁烯二酰基;r1为n
‑
苄氧羰基甘氨酰
‑
l
‑
脯氨酸、色氨酸、正缬氨酸、丙氨酸、亮氨酸、缬氨酸、苯丙氨酸、丝氨酸、赖氨酸、苏氨酸、甲硫氨酸、酪氨酸、异亮氨酸、半胱氨酸、胱氨酸、组氨酸、精氨酸、谷氨酸、生物素、乙二胺、硫脲、乙二醇、2,2'
‑
二氯二乙醚、1,2
‑
二(2
‑
氯乙氧基)乙烷、氯乙酰氯、1,4
‑
二(2
‑
氯乙基)哌嗪、乙酰基、甲基、乙基、丙基、丁基、戊基、己基、丁二酰基、戊二酰基或丁烯二酰基。
[0010]
fapα酶激活式鬼臼毒素衍生物及其制备方法:
[0011]
将鬼臼毒素(podophyllotoxin)、各种n
‑
cbz
‑
氨基酸或烷烃链按摩尔比为1:1.0~1:5.0的比例溶解在有机溶剂之中,在催化剂和缚酸剂作用下,反应生成中间体i,然后在催化剂条件下脱掉cbz保护基得到中间体ii,最后在催化剂和缚酸剂条件下得到fapα酶激活式鬼臼毒素衍生物。
[0012]
合成路线举例如下:
[0013][0014]
式中,r为氨基酸;r1为n
‑
苄氧羰基甘氨酰
‑
l
‑
脯氨酸、色氨酸、正缬氨酸、丙氨酸、亮氨酸、缬氨酸、苯丙氨酸、丝氨酸或异亮氨酸。
[0015]
所述的有机小分子碱性催化剂为4
‑
二甲氨基吡啶或其它有机生物碱等,有机小分子碱性催化剂举例如下(但需强调的是本发明的有机小分子碱性催化剂不限于如下表示的
内容):
[0016][0017]
缚酸剂为三乙胺或其它有机生物碱等,缚酸剂举例如下(但需强调的是本发明的缚酸剂不限于如下表示的内容):
[0018][0019]
缩合剂为n,n'
‑
二环己基碳二亚胺或其它有机生物碱等,缩合剂举例如下(但需强调的是本发明的缩合剂不限于如下表示的内容):
[0020][0021]
所述的有机溶剂为二氯甲烷、氯仿、甲苯、n,n'
‑
二甲基甲酰胺、三氟乙酸、四氢呋喃等。
[0022]
所述的反应温度为
‑
20℃~80℃,反应时间为1.0~24.0小时。
[0023]
fapα酶激活式鬼臼毒素衍生物在治疗/预防恶性肿瘤相关疾病药物的应用。
[0024]
通过采用上述技术方案,鬼臼毒素(podophyllotoxin)、各种n
‑
cbz
‑
氨基酸或烷烃链按摩尔比为1:1.0~1:5.0的比例溶解在有机溶剂之中,在催化剂和缚酸剂作用下,反应生成中间体i,然后在催化剂条件下脱掉cbz保护基得到中间体ii,最后在催化剂和缚酸剂条件下得到fapα酶激活式鬼臼毒素衍生物。该类化合物同时包含鬼臼毒素和fapα酶的特异性底物(n
‑
苄氧羰基甘氨酰
‑
l
‑
脯氨酸,z
‑
gly
‑
pro
‑
oh)结构,具有潜在的生物活性,同时为生物活性筛选提供化合物源,对药物的筛选和制药行业具有重要的应用价值,且通过体外抗肿瘤活性筛选发现,该类化合物对人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7具有很好的抑制作用,且优于阳性对照药依托泊苷,部分fapα酶激活式鬼臼毒素衍生物对上述细胞的抑制作用可达依托泊苷的100倍以上。很有可能进一步开发成为新的防治肿瘤的药物。本发明操作方法非常经济简便,产物收率较高,溶解性较好,原料便宜易得,可进一步研究发掘其抗肿瘤活性。
附图说明
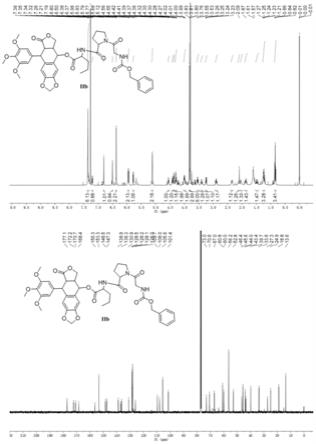
[0025]
附图1实施实例化合物iib核磁谱图数据。
[0026]
附图2实施实例化合物iv核磁谱图数据。
[0027]
附图3实施实例iiia与fapα蛋白的三维模拟结合图。
[0028]
附图4实施实例iiia与fapα酶的分子对接图示。
[0029]
附图5fapα酶激活式鬼臼毒素衍生物的设计图示。
具体实施方式
[0030]
本发明的实施例:在50ml的反应管中,依次加入鬼臼毒素(0.207g,0.5mmol)、n
‑
cbz
‑
氨基酸(0.75mmol,1.5eq.)、dmap(0.183g,1.50mmol,3.0eq)、无水二氯甲烷(10ml),搅拌使其溶解,0℃冷却搅拌30min后,再加入dcc(0.155g,0.75mmol,1.5eq),自然升温到室温反应,薄层色谱(tlc)监测,约2~3小时反应完全,加入乙酸乙酯(50ml
×
2)萃取,依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得无色油状物(化合物i),产物不经纯化直接用于下一部反应。
[0031]
取上一步浓缩至干的油状化合物ia(0.20g,0.287mmol)于100ml的茄形瓶,依次加入无水二氯甲烷(10ml)、pdcl2(5.0mg,0.29mmol,0.1eq.)、三乙胺(0.12ml,0.86mmol,3.0eq.),搅拌使其溶解,室温下缓慢滴加三乙基硅烷(0.14ml,0.86mmol,3.0eq.)的二氯甲烷溶液(1ml),薄层色谱(tlc)监测,约20~40min反应完全,缓慢滴加三氟乙酸(0.5ml)终止反应,继续搅拌30min,加入1mol/l的氢氧化钠水溶液调节ph至8,硅藻土过滤,滤液用乙酸乙酯萃取(50ml
×
2),依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得浅黄色油状物或浅黄色固体(化合物ii),产物未经纯化直接用于下一部反应。
[0032]
在50ml的反应管中,依次加入中间体iia(0.207g,0.5mmol)、z
‑
gly
‑
pro
‑
oh(0.75mmol,1.5eq.)、dmap(0.183g,1.50mmol,3.0eq)、无水二氯甲烷(10ml),搅拌使其溶解,0℃冷却搅拌30min后,再加入dcc(0.155g,0.75mmol,1.5eq),自然升温到室温反应,薄层色谱(tlc)监测,约3~4小时反应完全,加入乙酸乙酯(50ml
×
2)萃取,依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得粗产品,采用硅胶柱分离纯化(洗脱剂:乙酸乙酯:石油醚=2:1),即得化合物iiia。白色固体,三步总收率39.3%;核磁共振和高分辨质谱测试结果如下:1h nmr(400mhz,cdcl3)δ:7.38
‑
7.30(7h,m,ar
‑
h
×
5,nh
×
2),6.84(1h,s,ar
‑
h),6.52(1h,s,ar
‑
h),6.38(2h,s,
‑
och2o
‑
),5.96(2h,d,j=6.9hz),5.72(1h,s),5.12(2h,s,ar
‑
ch2),4.62~4.54(2h,m),4.51~4.42(1h,m),4.36(1h,dd,j=9.0,7.1hz),4.24~4.14(1h,m),4.00(2h,d,j=14.7hz),3.81(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.66~3.51(2h,m),3.42(1h,dd,j=16.7,8.9hz),2.86~2.76(1h,m),2.42~2.32(1h,m),2.18~2.11(1h,m),2.06~1.98(1h,m),1.96~1.86(1h,m),1.42(3h,d,j=7.2hz,ch3);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),173.3(c=o),170.8(c=o),168.5(c=o),156.3(c=o),152.6(c
×
2),148.2,147.6,137.0,136.2,134.8,132.1,128.5(c
×
2),128.2,128.1(c
×
2),127.8,109.6,108.1,108.0,107.2,101.6(
‑
och2o
‑
),74.4,71.1,67.0,60.7(
‑
och3),59.9,56.2(
‑
och3),56.1(
‑
och3),48.7,46.5,45.4,43.6,43.4,38.5,29.7,24.9,17.5(ch3);esi ms(m/z):796.2[m+na]
+
。
[0033]
化合物iiib至iiih的制备方法同化合物iiia,投料比与化合物iiia相同,可得到
化合物iiib至iiih,详见表1,但需强调的是本发明的化合物不限于表1所表示的内容。
[0034]
表1为一种fapα酶激活式鬼臼毒素衍生物的化学结构
[0035][0036]
化合物iiib:白色固体,总收率46.5%;1h nmr(400mhz,cdcl3)δ:7.39~7.29(7h,m,ar
‑
h
×
5,nh
×
2),6.87(1h,s,ar
‑
h),6.53(1h,s,ar
‑
h),6.38(2h,s,
‑
och2o
‑
),5.97(2h,d,j=6.6hz),5.69(1h,s),5.12(2h,s,ar
‑
ch2),4.61(1h,d,j=4.4hz),4.44(1h,dd,j=13.7,6.5hz),4.36(1h,dd,j=9.2,7.1hz),4.24~4.12(2h,m),4.05~3.96(2h,m),3.81(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.60~3.53(1h,m),3.42(1h,dd,j=16.7,9.2hz),2.93(1h,dd,j=14.5,4.5hz),2.85~2.74(1h,m),2.45~2.36(1h,m),2.19~2.10(1h,m),2.05(1h,dd,j=10.0,6.7hz),1.92~1.84(1h,m),1.82~1.74(1h,m),1.40~1.31(3h,m),0.91(3h,t,j=7.3hz,ch3);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),173.0(c=o),170.8(c=o),168.5(c=o),156.3(c=o),152.7(c
×
2),148.3,147.7,137.2,136.3,134.9,132.2,128.6(c
×
2),128.2,128.1(c
×
2),127.9,109.6,108.1(c
×
2),107.3,101.6,74.4,71.3,67.1,60.8(
‑
och3),60.0 56.2(
‑
och3×
2),52.9,46.5,45.5,43.7,43.5,38.6,33.9,27.2,24.9,18.9(ch2),13.7(ch3);esi ms(m/z):824.3[m+na]
+
。
[0037]
化合物iiic:白色固体,总收率51.7%;1h nmr(400mhz,cdcl3)δ:7.44(1h,d,j=7.1hz,nh),7.38~7.32(5h,m,ar
‑
h),7.31(1h,d,j=4.7hz,nh),6.89(1h,s,ar
‑
h),6.52(1h,s,ar
‑
h),6.38(2h,s,
‑
och2o
‑
),5.97(2h,d,j=9.5hz,ar
‑
h),5.92(1h,d,j=9.3hz),5.12(2h,s,ar
‑
ch2),4.62(2h,d,j=7.8hz),4.49~4.44(1h,m),4.35(1h,dd,j=13.9,6.4hz),4.21(1h,t,j=9.9hz),4.03(2h,s),3.81(3h,s,
‑
och3),3.77(1h,s),3.74(6h,s,
‑
och3×
2),3.56(1h,t,j=7.7hz),3.42(1h,dd,j=16.6,9.1hz),2.92(1h,dt,j=13.2,6.6hz),2.84~2.74(1h,m),2.46~2.37(1h,m),2.33~1.99(2h,m),1.93~1.82(1h,m),1.76~1.53(2h,m),0.90(6h,m,ch3×
2);
13
c nmr(151mhz,cdcl3)δ:173.5(c=o),172.2(c=o),170.8(c=o),168.6(c=o),156.3(c=o),152.7(c
×
2),148.3,147.7,137.2,136.3,134.9,132.2,128.6(c
×
2),128.2,128.1(c
×
2),127.9,109.6,108.1(c
×
2),107.4,101.6(
‑
och2o
‑
),74.5,71.4,67.1,60.8(
‑
och3),60.0,57.3,56.1(
‑
och3×
2),46.5,45.6,43.7,43.5,38.7,37.3,27.0,25.6,25.0,15.6(ch3),11.6(ch3);esi ms(m/z):838.1[m+na]
+
。
[0038]
化合物iiid:白色固体,总收率40.5%;1h nmr(400mhz,cdcl3)δ:7.46(1h,d,j=
7.3hz,nh),7.38~7.30(5h,m,ar
‑
h),6.88(1h,s,ar
‑
h),6.52(1h,s,ar
‑
h),6.38(2h,s,
‑
och2o
‑
),5.97(2h,d,j=8.8hz,ar
‑
h),5.92(1h,d,j=9.2hz),5.11(2h,d,j=8.6hz,ar
‑
ch2),4.65~4.58(2h,m),4.43~4.31(2h,m),4.20(1h,dd,j=16.7,7.0hz),4.09~3.98(2h,m),3.81(3h,s,
‑
och3),3.74(6h,s,
‑
och3×
2),3.62~3.51(1h,m),3.42(1h,dd,j=16.8,9.3hz),2.92(1h,dt,j=14.1,7.1hz),2.86~2.73(1h,m),2.48~2.39(1h,m),2.22~2.01(3h,m),1.94~1.82(1h,m),0.94(3h,d,j=4.6hz,ch3),0.92(3h,d,j=4.5hz,ch3);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),172.4(c=o),171.0(c=o),168.7(c=o),156.4(c=o),152.8(c
×
2),148.4,147.8,137.3,136.4,134.9,132.3,128.7(c
×
2),128.4,128.2(c
×
2),127.9,109.7,108.2(c
×
2),107.5,101.8(
‑
och2o
‑
),74.6,71.5,67.2,60.9(
‑
och3),60.1,58.2,56.3(
‑
och3×
2),46.6,45.7,43.8,43.6,38.8,30.8,27.1,25.1,19.2(ch3),18.3(ch3);esi ms(m/z):824.2[m+na]
+
。
[0039]
化合物iiie:白色固体,总收率31.9%;1h nmr(400mhz,cdcl3)δ:7.43 1h,(d,j=7.7hz,nh),7.36~7.29(6h,m,ar
‑
h,nh),6.89(1h,s,ar
‑
h),6.51(1h,s,ar
‑
h),6.38(2h,s,
‑
och2o
‑
),5.96(2h,d,j=7.2hz),5.92(1h,d,j=5.0hz),5.11(2h,s,ar
‑
ch2),4.73(1h,t,j=3.9hz),4.61(1h,d,j=4.5hz),4.39(1h,dd,j=9.2,7.1hz),4.24~4.14(2h,m),3.82~3.78(2h,m),3.79(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.64~3.52(3h,m),3.46~3.37(1h,m),2.97~2.88(1h,m),2.85~2.72(1h,m),2.44~2.24(1h,m),2.03(1h,m),1.98~1.88(2h,m),1.08(s,9h,ch3);
13
c nmr(151mhz,cdcl3)δ:173.7(c=o),171.0(c=o),170.8(c=o),168.0(c=o),156.2(c=o),152.6(c
×
2),148.2,147.6,137.1,136.2,134.9,132.1,128.5(c
×
2),128.2,128.0(c
×
2),127.7,109.6,108.0(c
×
2),107.3,101.6(
‑
och2o
‑
),74.6,73.7,71.3,67.0,62.2,60.7(
‑
och3),60.0,56.1(
‑
och3×
2),49.8,46.3,45.4,43.6,43.4,38.8,28.1,27.2(ch3×
3),24.8;esi ms(m/z):868.3[m+na]
+
。
[0040]
化合物iiif:白色固体,总收率39.8%;1h nmr(400mhz,cdcl3)δ:7.63(1h,d,j=6.1hz,nh),7.43(1h,d,j=7.5hz,nh),7.40~7.30(5h,m),6.90(1h,s,ar
‑
h),6.53(1h,s,ar
‑
h),6.39(2h,s,
‑
och2o
‑
),5.97(2h,d,j=5.0hz,ar
‑
h),5.93(1h,d,j=9.3hz),5.12(2h,s,ar
‑
ch2),4.66(1h,dd,j=7.9,5.2hz),4.44(1h,d,j=6.6hz),4.39~4.32(1h,m),4.23~4.12(2h,m),4.10~3.92(2h,m),3.81(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.68~3.36(3h,m),2.97~2.76(1h,m),2.44~2.23(1h,m),2.15~1.81(5h,m),1.42~1.25(1h,m),1.00~0.85(6h,m,ch3×
2);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),171.0(c=o),168.5(c=o),167.3(c=o),156.1(c=o),152.6(c
×
2),148.2,147.7,137.1,136.3,134.9,132.1,128.5(c
×
2),128.2,128.1(c
×
2),127.9,109.5,108.0(c
×
2),107.3,101.6,74.3,71.2,67.0,60.7(
‑
och3),59.2,56.1(
‑
och3×
2),51.7,46.8,45.5,43.7,43.4,40.6,33.9,27.2,25.3,24.9,22.6,21.9;esi ms(m/z):838.3[m+na]
+
。
[0041]
化合物iiig:白色固体,总收率43.1%;1h nmr(400mhz,cdcl3)δ:7.54(1h,d,j=7.0hz,nh),7.43(1h,d,j=8.6hz,nh)),7.41~7.31(5h,m,ar
‑
h),7.24~7.17(3h,m,ar
‑
h),7.11(1h,s),7.09(1h,s),6.54(1h,s,ar
‑
h),6.49(1h,s,ar
‑
h),6.36(2h,s,
‑
och2o
‑
),5.94(1h,s),5.89(1h,s),5.81(1h,d,j=9.4hz),5.14(2h,d,j=4.0hz,ar
‑
ch2),4.58(1h,d,j=4.5hz),4.55(1h,d,j=7.2hz),4.16~4.07(2h,m),3.99(1h,d,j=4.8hz),3.86(1h,d,j=3.9hz),3.81(3h,s,
‑
och3),3.74(6h,s,
‑
och3×
2),3.58(1h,dd,j=8.3,5.8hz),3.53
~3.39(3h,m),3.20~3.15(1h,m),2.89(1h,dd,j=14.5,4.6hz),2.71~2.61(1h,m),2.47~2.33(1h,m),2.07~1.89(3h,m);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),171.9(c=o),170.4(c=o),168.4(c=o),156.2(c=o),152.6(c
×
2),148.2,147.5,136.2,135.5,134.9,132.1,129.1(c
×
2),128.7,128.6(c
×
2),128.5(c
×
2),128.4,128.2,128.1,127.5(c
×
2),109.5,108.0(c
×
2),107.3,101.6(
‑
och2o
‑
),74.8,71.3,67.1,60.7(
‑
och3),59.8,56.2(
‑
och3×
2),53.8,46.3,45.5,43.6,43.4,38.4,33.9,28.1,24.9;esi ms(m/z):872.1[m+na]
+
。
[0042]
化合物iiih:白色固体,总收率47.7%;1h nmr(400mhz,cdcl3)δ:7.52(1h,t,j=6.1hz,nh),7.47(1h,d,j=5.7hz,nh),7.45
‑
7.41(1h,m),7.40~7.31(9h,m,ar
‑
h),7.11(1h,t,j=7.6hz),6.93(1h,t,j=7.5hz),6.55(1h,s),6.49(1h,s),6.38(2h,s,
‑
och2o
‑
),5.78(1h,d,j=9.4hz),5.14(1h,d,j=7.2hz,ar
‑
ch),5.11(1h,d,j=4.8hz,ar
‑
ch),4.64~4.49(2h,m),4.43~4.28(1h,m),4.22~4.15(1h,m),4.02(2h,t,j=7.9hz),3.89(1h,d,j=7.5hz),3.81(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.60~3.53(1h,m),3.51~3.39(1h,m),3.37~3.32(1h,m),3.25(2h,dd,j=14.4,6.5hz),2.94~2.81(1h,m),2.31~2.24(1h,m),2.18~1.87(3h,m);
13
c nmr(151mhz,cdcl3)δ:173.7(c=o),172.4(c=o),170.9(c=o),168.4(c=o),156.8(c=o),152.6(c
×
2),148.3,147.5,136.3,136.2,135.0,134.8,132.1,128.7(c
×
2),128.5,128.1,128.0(c
×
2),127.9,123.2,122.4,119.5,118.2,111.5,109.5,109.1,108.2,108.0,107.3,101.6(
‑
och2o
‑
),74.6,71.2,67.6,60.8(
‑
och3),59.9,56.3(
‑
och3×
2),53.5,46.2,45.5,43.6,43.4,38.4,30.7,29.7,24.8;esi ms(m/z):889.4[m+h]
+
。
[0043]
化合物iv:白色固体,总收率36.8%;1h nmr(400mhz,cdcl3)δ:7.41~7.29(5h,m,ar
‑
h),6.97(1h,s,ar
‑
h),6.52(1h,s,ar
‑
h),6.39(2h,s,
‑
och2o
‑
),5.98(1h,s,ar
‑
h),5.97(1h,d,j=1.0hz,ar
‑
h),5.11(2h,s,ar
‑
ch2),4.60(1h,d,j=4.3hz),4.54(1h,dd,j=8.3,5.0hz),4.34(1h,t,j=8.0hz),4.17(1h,dd,j=12.8,6.7hz),4.13~4.05(1h,m),3.97(2h,dd,j=17.1,4.2hz),3.80(3h,s,
‑
och3),3.75(6h,s,
‑
och3×
2),3.65~3.50(3h,m),2.96~2.74(1h,m),2.71~2.62(1h,m),2.54~2.44(1h,m),2.33~2.21(1h,m),2.18~1.91(1h,m);
13
c nmr(151mhz,cdcl3)δ:173.6(c=o),172.6(c=o),167.2(c=o),156.3(c=o),152.6(c
×
2),148.2,147.8,137.3,136.3,134.9,132.1,128.5(c
×
2),128.1(c
×
3),128.0,109.6,108.3(c
×
2),107.2,101.6(
‑
och2o
‑
),74.4,71.1,67.0,60.8(
‑
och3),59.2,56.3(
‑
och3×
2),46.1,45.4,43.7,43.4,38.5,29.2,25.0;esi ms(m/z):702.3[m]
+
。
[0044]
本发明的式(i)化合物具有重要的生物活性,通过mtt法体外对人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7的细胞毒性试验表明:此类式(i)所示的结构的fapα酶激活式鬼臼毒素衍生物对肿瘤细胞生长具有很好的抑制作用,且优于阳性对照药依托泊苷,很有可能进一步开发成为新的防治肿瘤的药物。但需强调的是本发明的化合物不限于人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7表示的细胞毒性。
[0045]
药理实施例:化合物iiia~iiih、iv对人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7的体外抗肿瘤活性测试,采用mtt法,以hepg2为例。
[0046]
将hepg2细胞从液氮中取出,快速放入37℃水浴锅中,轻摇冻存管使冻存液溶解;溶解后把细胞转移到含有5ml培养基的离心管中,离心收集细胞,室温1000rpm离心5min,弃上清;用含10%胎牛血清的完全培养基悬浮细胞,接种到培养皿中,轻轻吹打混匀,37℃、5%co2饱和湿度条件下培养;当细胞的密度达到80%时,对细胞进行传代;弃去培养基,用pbs洗一遍;加1
‑
2ml0.25%胰蛋白酶消化细胞,显微镜下观察,消化1
‑
2min,可看到细胞相互分离变圆,即消化完成;快速弃去胰酶,加入完全培养基,吹打细胞,制成单细胞悬液,按1:3的比例传代,37℃、5%co2饱和湿度条件下扩大培养;取处于对数生长期,生长状态良好的hepg2细胞,以4
×
103个/孔,接入96孔板,同时设空白组,37℃培养过夜;分别将新配的化合物iiia~iiih、iv的二甲基亚砜溶液以浓度梯度加入到各孔中,使孔中化合物最终浓度分别为3.125、6.25、12.5、25、50、100μmol/l,设阳性对照组依托泊苷终浓度为3.125、6.25、12.5、25、50、100μmol/l,同时设空白组;细胞培养72h后,每孔加入10μl mtt,37℃培养2
‑
4h;小心吸出培养基上清,加入150μl dmso震荡10min,以溶解还原的mtt晶体甲臜(formazan),酶标仪568nm测定各孔吸光值od。细胞增殖抑制率=1
‑
(实验组od
‑
空白组od值)/(对照组od值
‑
空白组od值),hepg2细胞半抑制浓度ic
50
由spss软件分析得到。
[0047]
化合物iiia对hepg2、thp
‑
1、hela、mcf
‑
7肿瘤细胞的ic
50
依次为0.0618μmol/l、0.105μmol/l、0.570μmol/l、1.419μmol/l;阳性对照依托泊苷对hepg2、thp
‑
1、hela、mcf
‑
7肿瘤细胞的ic
50
依次为17.750μmol/l、16.760μmol/l、117.800μmol/l、32.880μmol/l;化合物iiia的起始原料鬼臼毒素对hepg2、thp
‑
1、hela、mcf
‑
7肿瘤细胞的ic
50
依次为0.786μmol/l、0.952μmol/l、65.380μmol/l、6.263μmol/l。化合物iiia对hepg2、thp
‑
1、hela、mcf
‑
7肿瘤细胞的抑制作用分别是阳性对照依托泊苷的288、160、206、23倍,活性为全面提升。化合物iiib~iiih、iv对hepg2、thp
‑
1、hela、mcf
‑
7肿瘤细胞的ic
50
详见表2。
[0048]
表2化合物iiia~iiih、iv对四种肿瘤细胞的抑制作用
[0049]
[0050]
采用分子对接模拟分析化合物iiia与fapα酶的结合作用(详见附图3),发现化合物iiia与fapα酶的tyr458(a)、ala459(a)、arg402(a)、thr297(a)、leu296(a)、trp298(a)残基能形成氢键,其氢键长度分别为长度分别为化合物iiia与fapα酶的与asp457(a)、pro216(a)、trp214(a)、trp213(a)、phe357(a)、pro355(a)、val403(a)、val356(a)、val299(a)具有疏水作用。
[0051]
研究结论:人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7是测试化合物体外对肿瘤细胞的细胞毒性的有效工具和评价指标。本实验表明此类式(i)所示的fapα酶激活式鬼臼毒素衍生物对人肝癌细胞hepg2、人髓系白血病单核细胞thp
‑
1、人宫颈癌细胞hela、人乳腺癌细胞mcf
‑
7具有较强的细胞毒性,部分药物明显优于临床肿瘤用药依托泊苷,部分fapα酶激活式鬼臼毒素衍生物对上述细胞的抑制作用可达依托泊苷的100倍以上。经过后期抗肿瘤机制等一系列实验研究,该类化合物有可能进一步被开发称为临床使用的抗肿瘤药物。由此可见以上化合物具有开发成为抗肿瘤药物的潜力,且具有一定的经济和临床价值,值得我们继续深入研究下去。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1