一种表达载体、重组腺相关病毒及其在制备2019新型冠状病毒疫苗中的应用的制作方法
1.本发明属于生物工程技术领域,更具体地,涉及一种表达载体、重组腺相关病毒及其在制备2019新型冠状病毒疫苗中的应用。
背景技术:
2.冠状病毒(coronavirus)是一类有包膜的单股正链rna病毒,是目前已知rna病毒中基因组最大的病毒。目前共发现7种可以感染人的冠状病毒,分别是人冠状病毒229e (hcov-229e)、人冠状病毒oc43(hcov-oc43)、人冠状病毒nl63(hcov-nl63)、香港i型人冠状病毒(hcov-hku1)、严重急性呼吸道综合征冠状病毒(sars-cov)、中东呼吸综合征冠状病毒(mers-cov)及2019新型冠状病毒(sars-cov-2)。其中,sars-cov、 mers-cov和sars-cov-2是目前发现的人高致病性冠状病毒,给人类健康带来了极大危害。
3.2019新型冠状病毒(sars-cov-2)具有高传染性和高隐蔽性,感染病毒的人会出现不同程度的症状,包括轻症样的发烧或轻微咳嗽,或是重症样的肺炎,而更为严重的甚至造成患者死亡。目前全世界对于新冠疫情的防控主要在于通过隔离消毒等措施,控制向未感染人群的传播,同时接种新型冠状病毒预防性疫苗。目前全球获批紧急使用的新型冠状病毒预防性疫苗包括:(1)新型冠状病毒灭活疫苗(vero细胞)(厂家:国药北京生物、国药武汉生物、北京科兴生物、康泰生物);(2)腺病毒载体新冠疫苗(厂家:康希诺ad5、强生 ad26、阿斯利康ad26、gamaleya ad5+ad26);(3)mrna新冠疫苗(厂家:辉瑞、moderna); (4)重组蛋白新冠疫苗(厂家:智飞龙科马、novavax)。
4.目前获批紧急使用的新型冠状病毒疫苗各有其优劣。
5.灭活疫苗是使用直接灭活的新型冠状病毒作为抗原对人体进行免疫,从而产生抗体,是我国使用最广泛的疫苗,科兴、国药疫苗均为灭活疫苗。这类疫苗技术十分成熟,发展较早,其优势在于:极高的安全性,很低的不良反应几率,方便的储存条件;劣势为:有效率较低,生产周期长,有时会引起抗体依赖性增强效应(antibody dependent enhancement,ade),加重病毒感染。
6.腺病毒载体疫苗:目前有阿斯利康疫苗、俄罗斯疫苗、强生疫苗、康希诺疫苗为腺病毒载体疫苗。该疫苗优势在于:生产速度快,适用于突发重大流行病,有效率高;劣势在于:安全性差,不良反应率极高。这种不良反应主要是源自人体对腺病毒的强烈免疫反应,目前已出现几例由该不良反应引发的死亡案例。
7.mrna疫苗:辉瑞、moderna疫苗均为mrna疫苗,也是目前美国所采用的主流疫苗。其机理为通过修饰抗原决定簇的编码mrna使其不具备较强的炎症激活能力,在被细胞吸收后,在宿主细胞内表达抗原决定簇,使得免疫系统识别该宿主细胞表达的抗原后产生细胞免疫抗体,从而杀灭病毒。但rna疫苗载体本身具有一定的免疫原性,外源性核酸感染细胞时会引起后者炎症活化,从而使得大量rna被降解。该疫苗优势为:有效率高,免疫持续时间长,生产速度快;缺点为:储存条件严苛,技术门槛高,多数国家无法大规模生产,安全性低
于灭活疫苗。
8.重组蛋白新冠疫苗:智飞龙科马和novavax疫苗为此类型疫苗。重组蛋白疫苗需要辅助使用佐剂激活人体的免疫应答,而佐剂的选择对疫苗副作用的产生具有较大影响,同时由于蛋白质稳定性的问题,生物体无法长期持续性产生抗体。优势为:安全性仅次于灭活疫苗,生产速度较快,有效率高;缺点为:需要多次免疫,如智飞龙科马的重组疫苗需要免疫三针。
9.腺相关病毒(adeno-associated virus,aav)是一类小的、复制缺陷的、无包膜的病毒,属于细小病毒科,由于aav存在安全性好(迄今从未发现野生型aav对人体致病)、免疫原性低、能感染分裂细胞和非分裂细胞、重组aav不整合到宿主细胞基因组等优点,近年来,用aav作基因治疗载体已成为基因治疗研究的热点。目前美国以及欧洲均已批准腺相关病毒的临床药物上市,有大量临床案例辅助证实了其安全性。
10.目前基于重组aav的新冠疫苗相较于其他种类疫苗研究较少,缺乏aav新冠疫苗的长效性研究,迫切需要开发一种针对预防新型冠状病毒sars-cov-2具有长效性、稳定性强的aav载体疫苗。
技术实现要素:
11.针对现有技术的缺陷,本发明的目的在于提供一种表达载体、重组腺相关病毒及其在制备2019新型冠状病毒疫苗中的应用,通过在双链aav的表达载体中插入tpa分泌信号肽编码序列连接的rbd基因,以实现新型冠状病毒rbd蛋白在动物机体内的高效、稳定地、长期地的分泌表达。
12.为实现上述目的,本发明提供了一种表达冠状病毒刺突蛋白受体结合结构域的表达载体,其包括目的基因表达盒和位于所述编码区两端的aav反向末端重复序列,所述目的基因表达盒包含从5’至3’的、可操作连接的启动子、编码tpa分泌信号肽的核苷酸序列及编码冠状病毒rbd的核苷酸序列,所述表达载体用于制备重组双链腺相关病毒。
13.优选地,所述启动子为cbh启动子、cmv启动子、cag启动子或cba启动子。
14.优选地,所述启动子为cbh启动子。
15.优选地,所述编码冠状病毒rbd的核苷酸序列经过人源密码子优化。
16.优选地,所述冠状病毒为2019新型冠状病毒,所述编码冠状病毒rbd的核苷酸序列如 seq id no.2所示。
17.优选地,所述编码冠状病毒rbd的核苷酸序列的3’端可操作连接有编码靶向肽的核苷酸序列,所述靶向肽为mhc2受体结合结构域。
18.按照本发明的另一方面,提供了一种表达冠状病毒刺突蛋白受体结合结构域的重组腺相关病毒,其由上述表达载体参与转染宿主细胞而制得。
19.优选地,所述重组腺相关病毒为双链aav。
20.优选地,所述重组腺相关病毒的衣壳蛋白为aav2、aav5、aav6、aav7、aav8或 aav9血清型衣壳蛋白。
21.优选地,所述重组腺相关病毒的衣壳蛋白为aav6或aav9血清型衣壳蛋白。
22.按照本发明的另一方面,提供了一种重组腺相关病毒的制备方法,其包括如下步骤:将上述表达载体、辅助质粒phelper和血清型质粒prepcap共孵育,在转染试剂聚乙烯亚
胺存在的条件下转染宿主细胞,培育细胞后,离心收集细胞,经过裂解和纯化,得到含有重组腺相关病毒的纯化液。
23.优选地,所述血清型质粒prepcap中rep基因来源于aav血清2型,cap基因来源于 aav血清6型。
24.按照本发明的另一方面,提供了上述重组腺相关病毒在制备预防冠状病毒的疫苗中的应用。
25.优选地,所述冠状病毒为2019新型冠状病毒原始株或其变异株。
26.优选地,所述冠状病毒为2019新型冠状病毒delta变异株或2019新型冠状病毒d614g 变异株。
27.优选地,所述疫苗制成注射剂,用于肌肉注射或鼻腔滴注。
28.优选地,所述疫苗还包含药学上可接受的稀释剂和/或赋形剂。
29.总体而言,通过本发明所构思的以上技术方案与现有技术相比,具有以下有益效果:
30.(1)本发明通过表达冠状病毒rbd抗原分子诱导产生抗体,相比全长s蛋白,抗体效价更高;在rbd分子上通过添加分泌信号肽tpa,提高抗原片段的胞外表达;同时,选择双链aav(scaav),极大地提高了抗原分子的表达效率。
31.(2)相较于cmv启动子,本发明表达载体采用cbh启动子,长期表达效果更好,稳定性更强;在同样的表达强度下,选择cbh启动子可大大降低aav疫苗的注射计量,以减小高剂量aav注射后引起的机体不良反应,同时这样也降低了成本。
32.(3)本发明为了提高抗原分子的靶向性,在抗原分子表达载体上设计了三种不同靶向肽,经过实验筛选出了靶向免疫细胞的mhc2受体结合结构域,利用该表达载体生产的raav 能够实现一针免疫,且在机体中稳定保持较高的中和抗体和总抗体水平,相较于现有的已上市的疫苗,其持续性、稳定性更好。
33.(4)目前已报道的aav疫苗大多选择靶向肌肉较好的aav血清9型,但有文献报告 aav9除了在靶组织肌肉中高表达抗原分子以外,还会感染肝脏、神经系统等全身其他组织器官,这可能会引起潜在的疫苗安全性问题;而aav6公认靶向的组织会更少,且肌肉嗜性较好。本发明设计一种表达冠状病毒rbd抗原分子的aav6,选择较优的cbh启动子能够实现aav6抗原分子的表达水平与aav9相当。
34.(5)本发明raav疫苗不仅免疫性高效,且在一针剂量的免疫后,较高的中和抗体水平能够维持一年以上,尤其针对传染性更强、病毒载量更高的新冠delta变异毒株,具有更强的保护效力和稳定性,免疫效果明显优于现有疫苗。
附图说明
35.图1为本发明实施例1中单链aav(ssaav)和双链aav(scaav)载体感染细胞48h 和72h后的荧光电镜图。
36.图2为本发明实施例1中感染细胞72h后不同载体表达mcherry的表达量检测图。
37.图3为本发明实施例2中载体gt-0172的构建示意图。
38.图4为本发明实施例4中载体0168制备的raav和载体0173制备的raav分别感染小鼠诱导产生的总抗体检测图。
39.图5为本发明实施例4中载体0168制备的raav和载体0173制备的raav分别感染小鼠诱导产生的中和抗体检测图。
40.图6为本发明实施例5中载体0172制备的raav和载体0173制备的raav以不同剂量分别感染小鼠诱导产生的总抗体检测图(a)和中和抗体检测图(b)。
41.图7为本发明实施例5中载体0172制备的血清6型raav、血清9型raav和载体0173 制备的血清6型raav、血清9型raav分别感染小鼠诱导产生的总抗体检测图(a)和中和抗体检测图(b)。
42.图8为本发明实施例6中载体0173、0174、0175、0176制备的raav分别感染小鼠诱导产生的总抗体检测图(a)和中和抗体检测图(b)。
43.图9为本发明实施例7中载体0173、0176制备的raav分别感染小鼠90天诱导产生的中和抗体对新冠病毒原始株、delta变异株、d614g变异株的保护效力检测图。
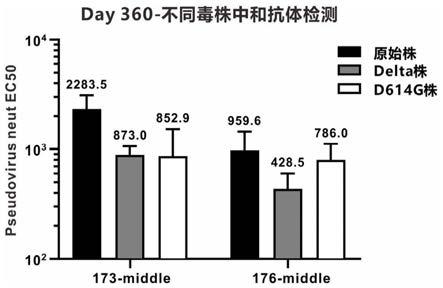
44.图10为本发明实施例7中载体0173、0176制备的raav分别感染小鼠360天诱导产生的中和抗体对新冠病毒原始株、delta变异株、d614g变异株的保护效力检测图。
具体实施方式
45.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
46.术语解释
47.正如本文所用的,术语“可操作连接”是指多核苷酸(或多肽)序列以功能性关系的连接。当两段核苷酸序列置于功能性关系时,这两段核苷酸序列是“可操作连接”的。例如,转录调控序列(例如启动子)如果影响某基因编码序列的转录,则其与该基因编码序列可操作连接。
48.术语“表达盒”是指包含引入宿主细胞时可操作连接的编码序列和调控序列的核酸构建体,分别导致rna或多肽的转录和/或翻译。表达盒应理解为包括允许转录开始的启动子、目的基因开放阅读框和转录终止子。通常,启动子序列置于目的基因上游,与目的基因的距离与表达控制相容。启动子是rna聚合酶识别、结合和开始转录的一段dna序列,它含有rna聚合酶特异性结合和转录起始所需的保守序列,多数位于结构基因转录起始点的上游,启动子本身不被转录。
49.术语“载体”是指设计用于转运、转移和/或存储遗传物质,以及表达遗传物质和/或将遗传物质整合到宿主细胞染色体dna中的核酸分子,例如质粒载体、粘粒载体、人工染色体、噬菌体载体和其他病毒载体。载体通常由至少三个基本单元组成,即复制源、选择标记和多克隆位点。
50.术语“重组腺相关病毒载体”是指重组非复制型的腺相关病毒,重组腺相关病毒(raav) 载体包括血清型蛋白衣壳,并包裹着重组的基因组,基因组包括功能性的5’和3’反向末端重复序列(inverted terminal repeats,itr),两端itr之间连接外源基因表达盒替代野生型aav 的rep基因表达盒和/或cap基因表达盒。itr序列提供对raav功能性拯救、复制、包装。如果突变去除aav两端itr中的任一d序列,导致无法正确地剪切ssdna,就会使得基因组二聚体显著增加,在复制时形成双链反向重复序列,最终包装进入aav衣壳形成双链
aav (scaav)。一些实施例中,itr序列来自aav2。外源基因表达盒通常由一系列表达调控元件和编码区组成。
51.aav血清型质粒prepcap包括aav的rep基因表达盒和cap基因表达盒,分别用于表达aav的rep复制蛋白和vp衣壳蛋白。本领域技术人员已知的,vp蛋白包括vp1、vp2、 vp3三种亚基,不同血清型的aav具有不同的衣壳蛋白编码序列。不同的aav血清型在感染效率和组织特异性方面存在一定的差异。一些实施例中,rep基因来源于aav血清2 型。
52.aav辅助质粒phelper通常包括腺病毒va、e4、e2a等编码区域提供aav复制必须的功能,以辅助生产出具有感染性的aav病毒颗粒。
53.冠状病毒根据种类的不同,其基因组编码的结构蛋白有4-5种,分别为刺突蛋白(spikeprotein,s蛋白),核衣壳蛋白(nucleocapsidprotein,n蛋白),膜蛋白(membrane protein, m蛋白)和包膜蛋白(envelope protein,e蛋白),少数种类还有血凝素糖蛋白 (haemaglutinin-esterase,he蛋白)。其中,s蛋白有两个亚基:s1和s2,受体结合结构域(rbd)位于s1亚基上。s蛋白以三聚体的形式组成病毒粒子外膜表面的刺突,其主要功能是识别宿主细胞表面受体,并介导病毒包膜与宿主细胞的细胞膜融合。目前有研究表明, sars-cov病毒与2019新型冠状病毒均通过其刺突蛋白上的受体结合结构域(rbd)与人体细胞血管紧张素转化酶2(ace2)受体结合,从而引发病毒对人体细胞的入侵。
54.2019新型冠状病毒目前突变迅速,发现的主要变异株包括alpha变异株、beta变异株、 gamma变异株、delta变异株和lambda变异株。alpha变异株的突变让它与靶细胞表面受体更容易结合,从而传染性大大增强;beta和gamma株的突出特点是具有免疫逃逸的本领; delta和lambda株则同时具有了高传染性和免疫逃逸的能力,并且潜伏期短、病毒载量高,说明其复制速度大大增加。其中,delta变异毒株是目前全球和国内最重要的流行株,其相较于原始毒株一共有15处突变,有6处发生在刺突蛋白上,其中又有3处突变比较关键: l452r和e484q突变发生在刺突蛋白与人体细胞血管紧张素转化酶2(ace2)受体结合的区域,即rbd区,l452r提高了病毒侵入细胞的能力,e484q有助于增强病毒的免疫逃逸;第三处突变p681r也能使病毒更有效地进入细胞。这些突变的综合效应使delta变异毒株能部分避开一些中和抗体,传染性增强。
55.本发明提供的一种表达冠状病毒刺突蛋白受体结合结构域的表达载体,其包括目的基因表达盒和位于所述目的基因表达盒两端的腺相关病毒反向末端重复序列,所述目的基因表达盒包含从5’至3’的、可操作连接的启动子、编码tpa分泌信号肽的核苷酸序列及编码冠状病毒rbd的核苷酸序列,所述表达载体用于制备重组双链腺相关病毒。
56.组织纤溶酶原激活剂(tissue-type plamnipen activator,tpa)又称组织型纤维蛋白溶酶原激活剂。tpa信号肽可有效促进外源蛋白的分泌,提高其诱导抗体产生的能力。一些实施例中,编码tpa分泌信号肽的核苷酸序列如seq id no.4所示。
57.一些实施例中,启动rbd抗原分子表达的启动子可采用在aav表达载体中能够正常启动表达的各种启动子,包括但不限于cbh启动子、cag启动子、cmv启动子、cba启动子等,优选为cbh启动子,cbh启动子的核苷酸序列如seq id no.6所示。相较于cag启动子(1721bp),cbh启动子(794bp)的片段更小,相较于cmv启动子,cbh启动子的长期表达效果更好,稳定性更高;采用cbh启动子可以大大降低aav-rbd疫苗的注射剂量,从而减小了高剂量aav注射后引起的机体不良反应,同时还降低了成本。
58.一些实施例中,所述编码冠状病毒rbd的核苷酸序列经过人源密码子优化,使得rbd 编码序列与人体细胞的密码子使用频率相匹配,从而提高蛋白表达水平。优选地,针对2019 新型冠状病毒设计人源密码子优化的rbd编码序列,其核苷酸序列如seq id no.2所示。
59.一些实施例中,可以对rbd抗原多肽的氨基酸序列c端进行延伸,使得抗原分子更富含有原序列自有的半胱氨酸,有利于免疫抗原蛋白的聚体化,提高稳定性,降低其降解速度,从而能长期稳定地诱导生物体产生足够的免疫应答,具体延伸序列可参见中国专利文献 cn111518175a和cn111996216a。
60.一些实施例中,所述编码冠状病毒rbd的核苷酸序列的3’端可操作连接有编码靶向肽的核苷酸序列,所述靶向肽为mhc2受体结合结构域,以提高抗原分子靶向免疫细胞的靶向性,同时表达有靶向肽的疫苗分子在机体中能稳定保持较高的中和抗体和总抗体水平。编码mhc2受体结合结构域的核苷酸序列如seq id no.5所示。
61.本发明还提供一种表达冠状病毒刺突蛋白受体结合结构域的重组腺相关病毒,其由以上表达载体参与转染宿主细胞而制得。
62.一些实施例中,该重组腺相关病毒可以为各种血清型,对应具有不同的衣壳蛋白,本发明的重组腺相关病毒包括但不限于aav血清6型或9型。
63.本发明还提供一种重组腺相关病毒的制备方法,包括如下步骤:将上述表达载体、辅助质粒phelper和血清型质粒prepcap共孵育,在转染试剂聚乙烯亚胺存在的条件下转染宿主细胞,培育细胞后,离心收集细胞,经过裂解和纯化,得到含有重组腺相关病毒的纯化液。
64.一些实施例中,所述血清型质粒prepcap为prep2cap6,其中cap基因的核苷酸序列如 seq id no.7所示。
65.重组腺相关病毒的制备可采用本领域技术人员已知的工艺方法。本发明实施例中采用的是基于hek293t的aav无辅助病毒系统(aavhelper-freesystem)进行生产,即三质粒共转染法,aav无辅助病毒系统中含有包含aavitrs的表达载体、包含rep/cap基因的质粒 prepcap和辅助质粒phelper这三种质粒,辅助质粒phelper提供生产具感染性aav病毒颗粒所需的腺病毒基因产物(如e2a、e4和varna基因),其余的腺病毒基因产物由稳定表达腺病毒e1基因的aav-293t宿主细胞提供。在辅助质粒的帮助下,仅需两端的itr就能将携带的目的基因片段包装进入腺相关病毒颗粒。病毒载体、prepcap质粒和辅助质粒之间不具有同源性序列,因此重组aav在理论上不具有复制能力。腺相关病毒的itrs序列和 rep/cap基因分别由独立的质粒表达,具有高度安全性。
66.本领域技术人员还可以基于sf9细胞系的昆虫系统构建表达质粒和血清型质粒生产,例如中国专利申请cn108699567a;或者利用能够更稳定传代表达的重组杆粒,该重组杆粒包含aav的rep基因、cap基因和带有外源目的基因的核心表达元件itr-goi,例如中国专利申请cn112553257a。此外,还有基于疱疹病毒辅助或者腺病毒辅助的病毒包装系统等。
67.本发明制备的重组腺相关病毒可用于制备预防冠状病毒的疫苗,该疫苗包含所述重组腺相关病毒,疫苗注射360天后血清中仍能保持较高的总抗体和中和抗体水平。
68.一些实施例中,所述重组aav适用于sars-cov、mers-cov或sars-cov-2等各种冠状病毒的疫苗制备。优选地,该冠状病毒为2019新型冠状病毒原始株或其变异株,本发明疫苗
诱导产生的抗体对2019新型冠状病毒原始株和变异株均有优异的免疫效果,尤其针对传染性更强的delta变异株,效果明显优于其它现有疫苗。
69.一些实施例中,所述疫苗制成注射剂,用于肌肉注射或鼻腔滴注。
70.一些实施例中,所述疫苗还包含药学上可接受的稀释剂和/或赋形剂。
71.以下结合具体实施例,对上述技术方案详细说明。
72.以下实施例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆实验指南 (sambrook等,new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商提供的说明书条件。
73.以下实施例中所采用的材料如无特殊说明,均可从商业途径得到。
74.实施例1
75.现有技术中使用的均是单链aav表达新冠疫苗分子,本实施例对单、双链病毒在细胞中表达水平的差异进行了验证。
76.1、质粒构建
77.构建2种raav质粒,raav-cmv-mcherry-bghpa(编号:pb2-0948)和 pfd-scaav-cmv-mcherry-bghpa(编号:gt-0118),分别用于制备单链aav和双链 aav。
78.2、病毒包装和滴度检测
79.hek293t细胞在转染前24h以每培养皿1.5
×
106个细胞的密度在100mm培养皿中接种,加入核心质粒paav-goi(pb2-0948或gt-0118):血清型质粒prepcap:辅助质粒 phelper=5μg:10μg:7.5μg和45μl转染试剂聚乙烯亚胺溶液(pei,1mg/ml)孵育转染,转染72h后,离心收集细胞,经过裂解和纯化,收获病毒上清。用sybrgreen q-pcr检测2种病毒上清的物理滴度。
80.3、感染hepg2细胞并拍照
81.以moi=1e+05感染hepg2细胞,感染48h和72h后在荧光显微镜下进行红色荧光拍照。
82.由图1看出,感染48h和72h后,双链aav的表达强度明显高于单链aav。
83.4、rt-pcr。
84.感染72h后收获细胞,用rna提取试剂盒分别提取rna,进行rt-pcr检测mcherry 的表达量,并用graphpad prism软件进行作图。
85.由图2看出,两者间目的基因的表达量存在着显著性的差异,说明双链aav表达目的基因的水平远高于单链aav。因此,本发明在后续实验中选择双链aav进行新冠疫苗分子的表达。
86.实施例2不同抗原分子载体的制备
87.本实施例中使用的sars-cov-2(2019-ncov-wiv04)全长s蛋白编码序列是委托金斯瑞公司合成的如seq id no.1所示的核苷酸序列,该核苷酸序列经过人源密码子优化,命名为 2019-hncov-s。选取s蛋白的主要抗原识别表位rbd区域,如seq id no.2所示,命名为 rbd;该序列对应的氨基酸序列如seq id no.3所示。在该序列的基础上,设计以下信号肽 tpa和3种靶向肽序列,如表1所示。
88.表1信号肽和靶向肽序列信息
[0089][0090]
其中tpa为分泌信号肽,载体构建时加在rbd序列的n端,靶向肽分别加在rbd序列的c端,本发明采用的靶向肽分别为狂犬病毒的g蛋白受体结合结构域rvg片段、糖基化位点2nnplpqr肽段和靶向免疫细胞的mhc2受体结合结构域,其中编码tpa分泌信号肽和mhc2受体结合结构域的核苷酸序列分别如seq id no.4和seq id no.5所示,构建如表2所示的不同质粒载体。
[0091]
表2不同质粒载体组成信息
[0092][0093][0094]
其中gt-0173~gt-0176和gt-0168均采用cbh启动子,其核苷酸序列如seq id no.6 所示;gt-0172采用cmv启动子。gt-0168是单链aav包装,而其他的分子均是双链aav 包装。如图3所示,以gt-0172为例,载体的具体构建过程如下:
[0095]
(1)使用限制性内切酶agei和saci双酶切pb2-894载体 pfd-scaav-itr-cmv+intron-egfp-bghpa,得到大小分别为6779bp和758bp的酶切片段,回收大小6779bp片段,命名984-as。
[0096]
(2)以金斯瑞_mc_0101081_7695(人源优化)2019-hncov-s为模板,设计引物 0172-rbd-f和0172-rbd-r,克隆目的片段0172-rbd,大小为737bp。合成tpa片段,并与0172-rbd进行酶连,得到0172-tpa-rbd片段,大小为791bp。
[0097]
(3)0172-tpa-rbd片段同源重组,转化,用引物0172-tpa-f和0172-rbd-r进行菌落pcr鉴定,片段大小791bp。
[0098]
(4)使用引物cx-bhgpa-r进行测序验证。本实施例所用引物信息见表3。
[0099]
表3引物信息
[0100]
引物名称引物序列0172-rbd-fgctgtgtgctgctgctgtgtggagcagtcttcgtttcgcccagggtgcagccaaccgagt0172-tpa-ftgcctttctctccacagaccggtgccaccatggatgcaatgaagagagggctctgctgtgtgctgctgctgtgt0172-rbd-ragtcgaggctgatcagcgagctctagtcgacttagaagttcacgcacttgttcttccx-bghpa-rggcaaacaacagatggctgg
[0101]
其他载体的构建参照以上构建过程。
[0102]
实施例3病毒的包装和生产
法测定假病毒的感染滴度。检测时,将待测血样56℃灭活30min。取已灭活的小鼠免疫血清梯度稀释,假病毒稀释至200tcid50/孔,与待测血样在37℃5%co2培养箱中共孵育1h。随后在孔中加入培养中的293t-ace2-egfp细胞。阳性对照孔不加待测血样。回滴板中,按照1000tcid50、100tcid50、10tcid50、1tcid50、0.1tcid50每个稀释度病毒加8个复孔进行检测,校准所用的假病毒滴度。0.1tcid50的病毒加入的细胞为阴性质控孔。在感染后第3天记录感染病毒的红色荧光细胞数量。第三天阳性质控孔出现病变,阴性质控孔无病变,该实验的适用性条件成立。观察计算各实验组红色荧光细胞数,通过reed-muench 法计算ec50值作为血清的中和效价。
[0112]
结果以假病毒中和抗体效价值ec50为纵坐标、不同时间点为横坐标作折线图,实线代表gt-0173即全长s蛋白,虚线代表gt-0168即rbd蛋白,如图5所示。从30天到240 天,全长s蛋白的中和抗体效价均低于rbd蛋白,在2.81-7.99倍间。进一步说明rbd抗原要比全长s抗原的分子构建更优。
[0113]
实施例5不同启动子、不同血清型aav-rbd病毒免疫balb/c小鼠
[0114]
以上筛选出的rbd分子进一步评估不同启动子cmv和cbh的表达强度和持续性,以及不同血清型aav6和aav9感染肌肉细胞的效率。
[0115]
1、病毒注射。每组随机选取8只6-8周龄balb/c小鼠进行肌肉注射gt-0172或gt-0173,不同血清型(aav6、aav9)和不同剂量病毒,病毒稀释至50μl进行注射。病毒注射分组信息见表4。其中5e+10vg/只为低剂量组,1e+11vg/只为中剂量组,2e+11vg/只为高剂量组。另外选取8只6-8周龄balb/c小鼠进行肌肉注射pbs(50μl)作为阴性对照。注射病毒day14,day30,day60,day90,day120,day150,day210,day240,day300,day360后进行眼眶采血,阴性对照pbs组也需要采血。将收集的血清转移到干净的ep管中,保存在-80℃冰箱。
[0116]
表4实施例5中病毒注射分组信息
[0117][0118][0119]
2、总抗体和中和抗体检测。样品为day14,day30,day60,day90,day120,day150, day210,day240,day300,day360采的眼眶后静脉丛血清,检测方法参考实施例4的检测操作步骤。
[0120]
启动子比较结果见图6,圆实线和虚线分别代表gt-0173的低剂量和中剂量,三角形实线和虚线分别代表gt-0172的高剂量和中剂量。结合图6和表5可以明显看出,gt-0173分子的低剂量组不同时间点的总抗体效价基本上均比gt-0172分子高剂量组高1.22-1.93
倍,中和抗体效价基本上高1.18-7.59倍。由此可见,cbh启动子在抗原分子的持续强启动表达上要远远优于cmv启动子,其低剂量组的表达强度比cmv的高剂量组还高,选择cbh启动子可以大大降低aav-rbd疫苗的注射剂量,降低成本以及高剂量aav注射后引起的机体不良反应。
[0121]
表5不同启动子cmv和cbh不同剂量抗体效价比值
[0122][0123]
2种不同血清型比较结果见图7,实心圆形和空心圆形分别代表gt-0173分子的aav6 型和aav9型;实心三角形和空心三角形分别代表gt-0172分子的aav6型和aav9型。从图中可以明显看出aav9-gt-0172分子的抗体效价要明显高于aav6,但是在gt-0173分子上,aav9总抗体水平只是略高于aav6,中和抗体水平aav6在120天后反而会略高于aav9。同时,aav6-gt-0173的抗体效价要高于aav9-gt-0172,进一步说明选择好的启动子,可以弥补和跨越aav血清型感染带来的表达差异。
[0124]
实施例6不同改造aav-rbd病毒免疫balb/c小鼠
[0125]
在以上筛选出的cbh启动子的基础上进一步改造rbd分子,即以gt-0173分子为基础进行改造。包括添加靶向免疫细胞的mhc2受体结合结构域的核苷酸编码序列、狂犬病毒的g蛋白受体结合结构域rvg片段的核苷酸编码序列以及糖基化位点2nnplpqr肽段的核苷酸编码序列。
[0126]
1、病毒注射。每组随机选取8只6-8周龄balb/c小鼠进行肌肉注射gt-0173~gt-0176,血清型为aav6,注射剂量1e+11vg/只,病毒稀释至50μl进行注射。病毒注射分组信息见表6。另外选取8只6-8周龄balb/c小鼠进行肌肉注射pbs(50μl)作为阴性对照。注射病毒day14,day30,day60,day90,day120,day150,day210,day240,day300,day360进行眼眶采血,阴性对照pbs组也需要采血。将收集的血清转移到干净的ep管中,保存在-80℃冰箱。
[0127]
表6实施例6中病毒注射分组信息
[0128]
编号抗原名称剂量(vg)数量(n)gt-0173tpa-rbd1e+118gt-0174tpa-rbd-rvg1e+118gt-0175tpa-rbd-2nnplpqr1e+118gt-0176tpa-rbd-mhc21e+118
[0129]
2、总抗体和中和抗体检测。样品为day14,day30,day60,day90,day120,day150,
day210,day240,day300,day360采的眼眶后静脉丛血清,检测方法参考实施例4的检测操作步骤。
[0130]
图8中圆实线代表gt-0176,三角形实线代表对照分子gt-0173,正方形实线代表 gt-0174,正方形虚线代表gt-0175,从总抗体和中和抗体的检测结果看,添加rvg片段和糖基化位点2nnplpqr肽段都使得rbd抗原分子的总抗体和中和抗体效价下降严重,而添加靶向免疫细胞的mhc2受体结合结构域在第30天至210天均提高了rbd抗原分子的总抗体水平,且在第150天时总抗体效价达到751209.7,而不改造的rbd分子最高只能达到 375604.9。从中和抗体的检测结果看,在rbd上添加mhc2片段所激起的机体中和抗体水平和不改造的rbd相差不大,分析原因,mhc2片段是靶向免疫细胞的一个结构域,添加这个片段会增加rbd分子对免疫细胞的嗜性,从而更快的进入免疫细胞诱导b细胞的成熟,释放抗体。而中和抗体则不受这个过程的影响。因此,我们得出结论,scaav6-tpa-rbd和 scaav6-tpa-rbd-mhc2疫苗分子能够实现一针免疫,且在机体中稳定保持较高的中和抗体和总抗体水平,相较于现有的已上市的疫苗,其持续性、稳定性更好。
[0131]
实施例7aav-rbd疫苗对新冠delta毒株和b1株(d614g)的保护效力
[0132]
将实施例6中gt-0173疫苗和gt-0176疫苗免疫的balb/c小鼠血样:90天和360天,进行新冠delta毒株和b1株(d614g)的中和抗体检测试验,评估这2种疫苗对新冠变异株的保护力。检测方法参见实施例4中的中和抗体检测方法。vsv
‑△
g-mcherry-sars-cov-2-s假病毒中的s膜蛋白由原始株(野生株)的换成新冠delta毒株和b1株(d614g),该病毒由枢密自行生产。评估aav-rbd疫苗对新冠delta毒株和b1 株(d614g)的保护效力,结果如图9。
[0133]
从图9可以看出,疫苗血清样本对delta毒株和b1株(d614g)的保护效力都略有下降,下降的倍数见表7。
[0134]
表7本发明疫苗免疫后不同时间点对delta毒株保护效力下降倍数
[0135][0136]
从表7可以看出,相较于原始株和b1株(d614g),免疫后90天和360天的血样,对 delta毒株的保护效力基本上都下降了2倍左右,疫苗的稳定保护性较好。这比文献公开报道的其他上市疫苗对于delta株的中和检测数据要更优,保护效力更强,稳定性更好。
[0137]
表8其他上市疫苗对于delta株的中和检测数据
[0138][0139]
备注:
[0140]
[1]tadatakuya,zhouhao,samanovicmarieietal.comparisonofneutralizingantibodytiterselicitedbymrnaandadenoviralvectorvaccineagainstsars-cov-2variants.[j].biorxiv,2021,doi:10.1101/2021.07.19.452771.
[0141]
[2]wallemmac,wumary,harveyruthetal.neutralisingantibodyactivityagainstsars-cov-2vocsb.1.617.2andb.1.351bybnt162b2vaccination.[j].lancet,2021,397:2331-2333.
[0142]
[3]wallemmac,wumary,harveyruthetal.azd1222-inducedneutralisingantibodyactivityagainstsars-cov-2deltavoc.[j].lancet,2021,398:207-209.
[0143]
[4]sapkalgn,yadavpd,sahayrr,etal.neutralizationofdeltavariantwithseraofcovishieldvaccineesandcovid-19-recoveredvaccinatedindividuals[j].journaloftravelmedicine,2021.
[0144]
从表8可以看出,已上市的疫苗对目前传染性更强、毒性更猛的delta毒株的保护力在第28天-90天时较b1株下降了2.5倍-7.4倍,而本发明的疫苗在90天时只下降了1.68倍-2.09倍,由此可见,本发明的新冠疫苗虽然针对的是原始株,但是对变异株的保护效力更强,稳定更好,比现有的疫苗更优。
[0145]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1