携带猪肺炎支原体P216基因的重组5型腺相关病毒载体及其构建方法与应用与流程
携带猪肺炎支原体p216基因的重组5型腺相关病毒载体及其构建方法与应用
技术领域
1.本发明涉及生物技术领域中的重组病毒载体及应用,特别是涉及一种携带猪肺炎支原体p216基因的重组5型腺相关病毒载体及其构建方法,与其在制备抗猪肺炎支原体感染及预防相关疾病的疫苗或药物中的应用。
背景技术:
2.猪气喘病或猪喘气病,又称猪支原体肺炎,是由支原体科猪肺炎支原体引起的一种接触性、慢性、消耗性呼吸道传染疾病。患有该病的病猪多表现为食欲不振,致使饲料整体利用率降低,减缓猪的生长速度,不仅延长了育肥饲养期,还增加了饲养成本,对养殖场来说利益受到了严重损害。但猪气喘病的潜伏期较长,大多数猪在感染该病后不会表现出特别明显的症状,很难被及时发现,因此整个猪群受到感染的容易度较高。
3.猪支原体肺炎具有发病率高、致死率低的特点,属于慢性疾病的范畴,虽然危害性大,但对于猪个体成活率的直接影响较小,加上目前养殖过程中需要的烈性疾病的免疫种类已经很多了,很多猪场管理者很难再预留出时间来接种用于预防该疾病的传统疫苗,因此存在忽视该疾病的情况。因此,寻求一种使用方便且有明显预防或治疗效果的抗猪肺炎支原体感染的药物十分紧迫。
4.腺相关病毒(adeno
‑
associatedvirus,aav)属于微小病毒科,依赖病毒属,是一种非致病性的缺陷型病毒,在复制时需要其他病毒(如腺病毒)的基因产物参与辅助,进而表现出感染性。aav的颗粒直径在20~26nm之间,含有4.7kb大小的线状单链dna基因组,基因组的两端为反向末端重复序列(inverted terminal repeats,itr),包含了复制、包装、拯救及整合的信号,中间为病毒的结构基因,包括与病毒复制有关的rep基因和病毒包膜cap基因。通过将外源基因导入aav以及适当删除部分结构基因以增大外源性基因的容量,可形成具有感染性的重组腺相关病毒(recombinant adeno
‑
associated virus,raav),其能介导外源基因长期稳定表达,具有生物安全性好、无致病性、免疫原性低、物理性质稳定、宿主细胞范围广的优点,被视为最有前途的基因治疗载体之一,成为目前基因治疗载体研究的热点。
5.但在本行业内,目前暂未将重组5型腺相关病毒载体技术用于预防或治疗猪肺炎支原体性疾病。
技术实现要素:
6.本发明的目的在于提供一种实用性好的携带猪肺炎支原体p216基因的重组5型腺相关病毒载体,通过将目的基因猪肺炎支原体p216基因插入5型腺相关病毒载体中,获得携带p216基因的重组5型腺相关病毒载体raav5
‑
p216,所述p216基因的序列如seq id no:1所示。
7.优选地,所述raav5
‑
p216采用三质粒共转染法制备得到,所用的三质粒包括基因
携带载体质粒、包装质粒和辅助质粒,所述基因携带载体质粒是将外源基因的表达单位(通常由转录启动子、目的基因和多聚腺苷酸序列组成)插入骨架质粒中,所述骨架质粒携带aav的itr序列,所述包装质粒携带5型aav的cap基因和2型aav的rep基因,所述辅助质粒携带腺病毒的e2a、e4orf6和va rna基因。
8.通常来说,根据包装质粒cap蛋白的不同,可以将重组腺相关病毒分为10个以上的基因型,不同基因型对不同组织器官细胞的亲和性存在差别,如:aav1对肌肉、心脏、骨骼肌等神经组织等的亲和力强;aav2对中枢神经、肌肉、肝脏、脑组织和眼等亲和力强;aav3对肌肉、肝脏、肺和眼等亲和力强;aav4对中枢神经、肌肉、眼和脑等亲和力强;aav5对肺、眼、中枢神经、关节滑膜和胰腺等亲和力强;aav6对肺和心脏等亲和力强;aav7则对肌肉和肝脏等亲和力强等等。
9.因为猪肺炎支原体主要感染部位是动物的肺部,因此,本发明中针对性地选择了5型cap蛋白和2型rep蛋白的腺相关病毒包装质粒,构建了猪肺炎支原体p216基因的重组raav5
‑
p216病毒。
10.优选地,所述骨架质粒为paav
‑
mcs、paav
‑
ires
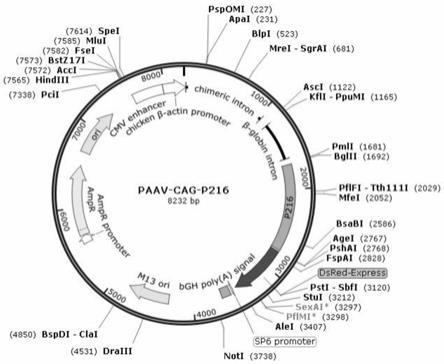
‑
hrgfp或paav
‑
cag
‑
rfp;所述包装质粒为paav
‑
rc5,所述辅助质粒为phelper。
11.本发明的另一目的在于提供一种关于上述携带猪肺炎支原体p216基因的重组5型腺相关病毒载体的构建方法,所述方法包括以下步骤:
12.步骤1、将猪肺炎支原体p216基因插入骨架质粒中,形成携带p216基因的重组腺相关病毒dna载体质粒;
13.步骤2、将重组腺相关病毒dna载体质粒、包装质粒和辅助质粒共转染宿主细胞,在宿主细胞中,包装质粒提供aav的rep蛋白和cap蛋白,rep蛋白配合辅助质粒将含有外源基因表达单位的raav基因组从dna载体质粒上表达出来,并加以复制,cap蛋白将单链的raavdna包装成感染性的复制缺陷型病毒颗粒。
14.优选地,所述宿主细胞为hek293细胞、hela细胞或pam细胞。更优选地,所述宿主细胞为hek293细胞,因为hek293细胞在用磷酸钙转染时的效率最高,磷酸钙转染相对于脂质体转染的原料来说,价格更低廉,适合工业化生产。
15.优选地,所述步骤1的过程为:对从猪体内提取出的dna进行pcr扩增,筛选出含有目的基因的片段并与骨架质粒进行双酶切反应,连接后转化到感受态细胞中,测序正确的pcr阳性克隆即为重组腺相关病毒dna载体质粒。
16.优选地,pcr扩增时所用的引物针对p216基因进行设计,其中,正向引物为5
’‑
cgt aga tct cca cca tgg tct caa ctt ttg gtt caa taa tc
‑3’
,反向引物为5
’‑
cgc acc ggt cta aaa agt tt cgg gct taa ta
‑3’
。
17.本发明还提供了一种抗猪肺炎支原体感染以及由肺炎支原体感染导致的疾病的疫苗或药物,所述疫苗或药物中的活性成分包括上述携带猪肺炎支原体p216基因的重组5型腺相关病毒载体。
18.优选地,所述疫苗或药物的剂型可采用粉剂、片剂或针剂。
19.本发明提供的技术方案至少具有如下有益效果:
20.本发明的重组腺相关病毒载体可将其携带的猪肺炎支原体的p216基因准确输送到动物的肺部表达目的蛋白,刺激集体产生免疫反应,具有靶向性、特异性、应激反应小或
者无应激反应等优点。实验证明,本发明提供的重组腺相关病毒载体对猪肺泡巨噬细胞具有极高的感染效率;同时,小鼠实验结果表明,只需要一次raav5
‑
p216注射就能达到p216重组蛋白疫苗两次注射所产生的细胞免疫应答和体液免疫应答反应,在使用上更加方便。重组五型腺相关病毒载体raav5
‑
p216可以大规模地快速制备,而且不需要重组蛋白疫苗乳化所需要的弗氏完全或者不完全佐剂,价格相对更低廉。因此,本发明的raav载体或与raav载体相关的产品可被用于制备抗猪肺炎支原体感染以及由肺炎支原体感染导致的疾病的药物,抗感染效果好,应用前景广阔,可给养殖业带来巨大的收益。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1是本发明实施例1步骤1.1中腺相关病毒包装系统的骨架质粒paav
‑
cag
‑
rfp的载体图谱;
23.图2是本发明实施例1步骤1.1中腺相关病毒包装系统的包装质粒paav
‑
rc5的载体图谱;
24.图3是本发明实施例1步骤1.1中腺相关病毒包装系统的辅助质粒phelper的载体图谱;
25.图4是本发明实施例1步骤2.1中构建的paav
‑
cag
‑
p216的酶切分析结果图,其中,标号1为paav
‑
cag
‑
p216,m1为marker,条带位置分别为100bp、250bp、500bp、750bp、1000bp和2000bp;
26.图5是本发明实施例1步骤2.2中提取得到的各质粒的凝胶电泳图,其中,标号1为paav
‑
cag
‑
p216,标号1为paav
‑
rc5,标号1为phelper,m为marker,条带位置分别为250bp、1000bp、2500bp、5000bp、7500bp、10000bp和15000bp;
27.图6是本发明实施例1步骤2.3中对纯化后的重组腺相关病毒raav5
‑
p216的电镜图;
28.图7是本发明实施例1步骤2.5中被重组腺相关病毒raav5
‑
p216感染的pam细胞在普通光源下的显微镜观察图;
29.图8是本发明实施例1步骤2.5中被重组腺相关病毒raav5
‑
p216感染的pam细胞在红色荧光下的显微镜观察图;
30.图9是本发明实施例1中制备得到的paav
‑
cag
‑
p216的载体图谱。
31.图10是本发明实施例1中制备得到的paav
‑
cag
‑
p216
‑
rfp的载体图谱。
具体实施方式
32.为了便于理解本发明,下面将结合说明书附图和较佳的实施例对本发明中的技术方案作更全面、细致地描述,但本发明的保护范围并不限于以下具体的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,均属于本发明保护的范围。
33.需要特别说明的是,当某一元件被描述为与另一元件存在“固定、固接、连接或连通”关系时,它可以是直接固定、固接、连接或连通在另一元件上,也可以是通过其他中间件间接固定、固接、连接或连通在另一元件上。
34.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解的含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
35.实施例1重组腺相关病毒raav5
‑
p216的制备
36.1材料
37.1.1基因、载体和细胞
38.腺相关病毒包装系统包括:骨架质粒paav
‑
cag
‑
rfp(图谱参见图1)、包装质粒paav
‑
rc5(图谱参见图2)和辅助质粒phelper(图谱参见图3)。
39.hek293细胞由实验室保存。细胞培养用dmem、胎牛血清、双抗、胰蛋白酶等购自gibco公司,细胞培养皿、细胞培养板购自corning公司。
40.1.2工具酶及试剂
41.bgl ii限制性内切酶、age i限制性内切酶,购自neb公司,t4 dna连接酶、taq dna聚合酶、dnamarker、蛋白质分子量标准和q
‑
pcrpremix等购自takara公司。转染试剂氯化钙、2
×
hbs购自sigma公司。
42.细胞培养基1640培养基、胎牛血清、胰蛋白酶为gibco公司产品。
43.质粒dna提取试剂盒、pcr纯化试剂盒和胶回收试剂盒购自美国omega公司。细胞总rna抽提试剂盒和cdna第一链合成试剂盒为invitrogen公司产品。rt
‑
pcr试剂盒购自美国promega公司。
44.其余试剂均为进口或者国产分析纯。
45.1.3主要仪器
46.mco
‑
18ac型二氧化碳培养箱,日本三洋公司;
47.vs
‑
840k
‑
u型洁净工作台,苏净集团苏州安康空气技术有限公司;
48.hh
·
s11
‑2‑
s型电热恒温水浴锅,上海跃进医疗器械厂;
49.z323k型低温冷冻高速离心机,hermle labortechnik gmbh;
50.ldzx
‑
30fb型高压灭菌器,上海申安医疗器械厂;
51.dhg
‑
9240a型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;
52.df
‑
102
‑
1型远红外干燥箱,北京兴争仪器设备厂;
53.倒置相差显微镜,日本olympus;
54.显微照相系统,nikon e200;
55.yos
‑
35
‑
80型液氮罐,四川乐山市东亚机电工贸有限公司;
56.mdf
‑
u2086s/216l超低温冰箱,日本三洋公司;
57.easy
‑
10超纯水仪,上海力康生物医疗科技控股有限公司;
58.60mm
×
15mm细胞培养皿,corning;
59.pm
‑
996parafilm封口膜,美国parafilm;
60.0.22um的细菌滤器,biomiga;
61.无菌塑料冷冻保存管,nalgene公司;
62.jem
‑
1230(hc)透射电子显微镜,日本电子。
63.2方法
64.2.1携带p216基因的重组腺相关病毒dna载体质粒的构建
65.根据p216基因的核苷酸序列设计基因扩增引物,其中,正向引物为5
’‑
cgt aga tct cca cca tgg tca caa ctt ttg gtt caa taa tc
‑3’
,反向引物为5
’‑
cgc acc ggt cta aaa agt tt cgg gct taa ta
‑3’
,该反向引物带有终止密码子,其与正向引物扩增的基因序列如seq id no:1所示,命名为猪肺炎支原体p216基因。此外,还设计有另一反向引物5
’‑
cgc acc ggt aaa agt ttc ggg ctt aata
‑3’
,该反向引物不带终止密码子并可与骨架质粒上的红色荧光蛋白基因rfp融合表达,其与正向引物扩增的基因序列如seq id no:2所示,命名为p216
‑
rfp基因。上述引物均由南京金斯瑞基因科技有限公司合成。
66.由正向引物+不带终止密码子的反向引物扩增得到的pcr产物p216会和载体上的红色荧光蛋白基因rfp融合表达,这样转染细胞后能在荧光显微镜下看到红色荧光,便于直观看到转染效率。但融合蛋白p216
‑
rfp和p216蛋白功能是一样的,只是在试验过程中,可用p216
‑
rfp来示踪转染效率。
67.从猪的肝脏中提取基因组dna,用p216基因的引物对dna进行扩增,具体pcr反应体系如下:10
×
pcrbuffer,5μl;primer f,1μl;primer r,1μl;dntps(10mm),1μl;dna2μl;taq dnapolymerase,0.5μl;ddh2o,39.5μl。
68.反应过程如下:
①
95℃,5min;
②
95℃,30s;56℃,30s;72℃,1min;本步骤循环30次;
③
72℃,10min。
69.反应结束后进行1.2%的琼脂糖凝胶电泳,然后对目的片段进行回收。
70.对回收后的片段以及准备好的paav
‑
cag
‑
rfp载体分别进行bgl ii和age i双酶切反应,其中,目的基因的双酶切体系如下:p216(或p216
‑
rfp),38μl;bgl ii,1μl;age i,1μl;10
×
buffer h,5μl;ddh2o,5μl;总共50ul体系。paav
‑
cag
‑
rfp载体的双酶切体系如下:paav
‑
cag
‑
rfp,6μl;bgl ii,1μl;age i,1μl;10
×
buffer h,2μl;ddh2o,10μl;总共20ul体系。
71.将以上酶切体系置于37℃水浴条件下反应4h后,进行1.5%的琼脂糖凝胶电泳鉴定,电泳结果参见图4,然后回收目的片段并进行连接反应,连接反应的体系如下:p216双酶切回收产物,3.0μl;paav
‑
cag
‑
rfp双酶切回收产物,1.0μl;10
×
t4 ligase buffer,2.0μl;t4 ligase,1.0μl;ddh2o,13.0μl。
72.上述体系保持22℃反应过夜,之后转化到dh5a感受态细胞中。挑取阳性克隆进行质粒提取和pcr鉴定,对pcr鉴定呈阳性的克隆进行测序反应,并将正确的克隆命名为paav
‑
cag
‑
p216,图谱参见图9(或paav
‑
cag
‑
p216
‑
rfp,图谱参见图10)。
73.2.2重组腺相关病毒包装系统中各质粒的中量提取
74.采用手提的方法对各质粒进行提取(即碱裂解法),提取的方法步骤基本相同,仅有提取对象发生变化,具体提取步骤如下:
75.(1)从冰箱取出含对应质粒(paav
‑
cag
‑
p216或paav
‑
cag
‑
p216
‑
rfp或paav
‑
cag
‑
rfp或paav
‑
rc5或phelper)的菌种,接种50μl到5ml含100μg/ml氨苄的2
×
yt培养基中;
76.(2)在37℃、220
‑
250rpm条件下摇床,培养菌液直至对数生长期;
77.(3)在含200ml优化培养基及100μg/ml氨苄西林钠的500ml烧瓶中接种2ml对数生
长晚期的菌液,将此培养液置于37℃、220rpm条件下培养20h左右;
78.(4)继续在4℃、5000rpm条件下离心10min,收集菌体,计算菌重,存于
‑
20℃环境中;
79.(5)将菌体在37℃条件下水浴解冻,然后用菌重的4.5倍数量体积(
×
4.5ml)的碱裂解液i重悬;
80.(6)按1mg/ml加入溶菌酶;
81.(7)加
×
10ml新配制的碱裂解液ii,封口,轻轻颠倒数次使其彻底混匀,室温下放置5
‑
10min;
82.(8)加
×
7.5ml用冰水预冷的碱裂解液iii,封口,轻轻但完全地振荡混匀数次(表现为不再有两个分离的液相),在冰水浴中放置10
‑
15min;
83.(9)继续在4℃、5000rpm条件下离心10min,将上清用4层纱布过滤后移入量筒中;
84.(10)累计总液体积,加入0.6倍体积的异丙醇,充分混匀,室温下放置10min;
85.(11)继续在室温、5000rpm条件下离心10min;
86.(12)除去上清,将离心管倒置在纸巾上控干,用70%的乙醇涮洗管底及管壁,倒掉乙醇后,将离心管(底部白色沉淀为质粒dna+rna+蛋白)倒置于纸巾上控干(可置于
‑
20℃环境中冻存);
87.(13)加入苯酚和氯仿(体积比为1:1)并混匀,在12000rpm条件下离心10min;
88.(14)取上清,再加入等体积的氯仿,在12000rpm条件下离心10min;
89.(15)取离心后的上清冰浴后加入等体积冰浴预冷的5m的licl,混匀后在4℃、12000rpm条件下离心10min,以沉淀大分子rna;
90.(16)取离心后的上清并加入0.1倍体积的3m的naac,二者混匀后再加入0.6倍总体积的异丙醇,室温放置10min,在室温、12000rpm条件下离心7min,除去上清,用70%的乙醇涮洗管底及管壁,倒掉乙醇后倒置于纸巾上控干;
91.(17)加1
×
pbs溶解,加入灭活dnase的rnase用于消化小分子rna,室温下放置30min;
92.(18)加入0.1倍体积的triton x
‑
114,37℃条件下放置30min;
93.(19)加入苯酚和氯仿(体积比为1:1)并混匀,在12000rpm条件下离心10min;
94.(20)取上清,再加入等体积的氯仿,在12000rpm条件下离心10min;
95.(21)加入0.5倍体积的peg8000
‑
mgcl2溶液,室温放置10min以上,然后在4℃、12000rpm条件下离心20min,回收包括质粒dna的沉淀;
96.(22)对沉淀用70%的乙醇重悬,以去除微量peg8000;
97.(23)在12000rpm条件下离心5min,去除上清,
98.(24)再次用70%的乙醇重悬,并于超净工作台倒掉大部分乙醇,放置10
‑
20min使剩余的乙醇挥发后,沉淀用适量1
×
te溶解,即为质粒dna;
99.(25)用te将质粒dna稀释40倍,测od
260
:od
280
,计算dna浓度;
100.(26)对步骤(24)中获得的质粒dna进行琼脂糖凝胶电泳,观察是否存在基因组污染和蛋白污染情况,电泳结果参见图5,说明质粒的抽提结果良好,可以进行重组腺相关病毒的包装。
101.2.3重组腺相关病毒的包装、纯化和鉴定
102.腺相关病毒包装的具体过程如下:细胞培养
→
磷酸钙转染
→
病毒收获
→
病毒纯化和浓缩
→
病毒电镜观察。具体如下:
103.2.3.1腺相关病毒的包装
104.①
当hek 293细胞生长至铺满10cm2培养皿的90%以后,按照1:3的比例进行传代;
105.②
传代后24h,hek 293细胞生长至约70
‑
80%,换9ml无血清的dmem培养液;
106.③
磷酸钙转染:按照每个培养皿28μg质粒(10μgpaav
‑
rc5、10μg paav
‑
helper和8μg paav
‑
cag
‑
p216或paav
‑
cag
‑
p216
‑
rfp或paav
‑
cag
‑
rfp)的量,取出质粒dna并稀释于500μl 250mm cacl2中,混匀;把500μl dna/cacl2混合物滴加到500μl 2xhbs中,轻柔摇匀;静置1min,立即把质粒dna/cacl2/hbs混合物均匀逐滴加到hek 293细胞中,轻柔摇匀;放入培养箱中4
‑
6h后换新鲜的dmem完全培养液,继续培养66
‑
72h。
107.④
细胞收获:当转染后48小时,在荧光显微镜下观察细胞,如果质粒转染成功,细胞会表达红色荧光,当红色荧光强度不再增强,细胞变圆,有部分细胞开始要脱落的时候用枪头吹下hek 293细胞,连同培养上清一起收集,再用50ml离心管,1000g离心5min,弃上清;沉淀的细胞按照每10个皿1ml的量重悬于pbs中,
‑
80℃/37℃反复冻融4次后按照下面的步骤进行病毒的纯化和浓缩。
108.2.3.2腺相关病毒的纯化和浓缩
109.①
加入0.1倍体积的氯仿,置于37℃摇床中剧烈振摇1h;
110.②
加入固体氯化钠至终浓度达到1mol/l,振摇溶解;
111.③
在4℃、12000rpm的条件下离心15min,回收上层水相,弃去氯仿和沉淀;
112.④
加peg8000至终浓度达到10%(w/v),振摇溶解后,冰浴放置1h;
113.⑤
在12000rpm条件下离心15min,弃去上清;
114.⑥
用0.01倍体积的pbs缓冲液将各离心管管底和管壁上的沉淀吹打洗脱下来合并,再分装至1.5ml塑料离心管中(0.6ml/管);
115.⑦
加入dnase和rnase溶液至终浓度均为1μg/ml,室温下消化30min,以讲解掉dna和rna;
116.⑧
加等体积的氯仿抽提,在4℃、12000rpm的条件下离心10min;
117.⑨
在无菌操作下小心吸出上层水相,该液体即为浓缩和纯化后的raav5
‑
p216(或raav5
‑
p216
‑
rfp)病毒液,用透视电镜对纯化后的重组腺相关病毒进行观察,结果如图6所示,呈腺相关病毒的正20面体形状,说明成功包装出了重组腺相关病毒。
118.浓缩后的病毒液大约为原体积的1%。
119.此外,还需去内毒素,加入1%的triton x
‑
114后冰浴5
‑
10min,再在37℃条件下水浴30min,最后在12000rpm条件下离心10min,小心收集上清,测内毒素,若合格则为最终产物。
120.2.4重组腺相关病毒滴度测定
121.采用荧光定量pcr测定重组腺相关病毒的物理滴度,正向引物序列为5
’‑
ggcggagttgttacgacat
‑3’
,反向引物序列为5
’‑
gggactttccctacttggca
‑3’
,产物长度为201bp。
122.具体测定步骤如下:
123.(1)质粒标准品制备:paav
‑
cag
‑
rfp质粒用te稀释到浓度为1ng/μl,取5.5μl溶于
95μl te中,得到的即为1
×
107copies的质粒标准品,按照10倍梯度浓度逐一稀释,分别得到1
×
106copies的质粒标准品、1
×
105copies的质粒标准品、1
×
104copies的质粒标准品、1
×
103copies的质粒标准品、1
×
102copies的质粒标准品和1
×
10copies的质粒标准品,各取2μl做为pcr模板(templates);
124.(2)病毒液的dnase处理:各取50μl病毒液,加入10μl 10
×
dnase i buffer、35μl水和5μl dnase i,在37℃条件下孵育1h,以去除病毒颗粒外的dna,继续在70℃条件下孵育10min灭活dnase i;
125.(3)将10μl经dnase处理过的病毒液稀释于40μl te中,取2μl做为pcr模板(templates);
126.(4)荧光定量pcr反应体系如下:sybr premix ex taq
tm
(2
×
),10ul;正向引物10μmol/l,1ul;反向引物10μmol/l,1ul;templates(步骤(1)和(3)),2ul;dh2o,6ul;total 20.0ul。
127.反应过程如下:
①
预变性,95℃,2min;
②
pcr反应,95℃,5s;60℃,34s;本步骤循环40次;
③
溶解曲线,95℃,15min;60℃,1min;95℃,15min。
128.(5)通过以下公式计算滴度:
129.每毫升病毒颗粒数=荧光定量pcr拷贝数
×2×5×
1000/2
130.2.5重组腺相关病毒raav5
‑
p216感染pam细胞实验
131.2.5.1仔猪肺泡巨噬细胞(pam细胞)的制备
132.①
从5公斤重的仔猪体内完整收取肺脏,用消毒的止血钳完全夹持住气管(密闭以避免病原进入),放血完全且用酒精擦拭干净后进入细胞房;
133.②
用止血钳夹住肺气管侧壁,剪刀剪开一个端口,同时用止血钳夹住端口稍下2cm位置处,用50ml注射器向肺脏灌1640培养基100ml,轻轻揉捏5min,使肺泡充分打开;
134.③
将灌洗液倾入瓶口覆有无菌双层纱布的三角瓶中,注意事先用一块纱布包住血管口,严防血液灌入三角瓶;
135.④
重复若干次步骤
③
,尽量使肺泡中的巨噬细胞冲出;
136.⑤
将灌洗液分装到50ml离心管中,在4℃、1500rpm条件下离心10分钟;
137.⑥
弃去上清,用90毫升1640培养基重悬所有离心管中的细胞,并分装到两个50ml离心管中,在4℃、1500rpm条件下离心10分钟;
138.⑦
弃去上清,每管加入45毫升1640培养基重悬细胞,对细胞进行细胞计数;
139.⑧
调整细胞浓度到2
×
106个/ml,然后加入10%的胎牛血清和10%的dmso进行细胞冻存。
140.2.5.2 pam细胞感染及荧光观察
141.①
复苏一支pam细胞,用含10%胎牛血清和双抗的1640培养基重悬pam细胞;
142.②
将该pam细胞分装到一块六孔细胞培养板中进行过夜培养;次日,在细胞培养板的每个孔中接种2
×
108个含p216基因的重组腺相关病毒raav5
‑
p216
‑
rfp;
143.③
48小时后,用荧光显微镜观察红色荧光在细胞中的分布情况,结果如图8所示,对比图7中普通光源下的观察结果,可以明显看出,显微镜红色荧光下能够看到很强的荧光,且荧光的位置和普通光下看到的细胞位置一致,说明本实施例制备得到的携带猪肺炎支原体p216基因的重组腺相关病毒载体对于猪肺泡巨噬细胞具有很高的感染效率。
144.实施例2重组raav5
‑
p216疫苗的免疫剂量及血清igg测定
145.在小鼠模型上,研究重组raav5
‑
p216疫苗的免疫剂量,测定血清中igg测定。
146.spf级别的昆明小鼠(4
‑
6周龄),购自湖南景达实验动物有限公司。注射体积为50μl,免疫后每周采血,制备血清冻存于
‑
70℃冰箱备用。小鼠分组、免疫剂量及免疫部位如表1所示:
147.表1免疫分组及情况
[0148][0149]
其中,raav
‑
rfp*,为没有插入基因的空载体包装的重组病毒;p216蛋白1#和2#:由本实验室原核表达制备的复性p216蛋白,p216蛋白1#是用弗氏完全佐剂乳化的疫苗免疫,p216蛋白2#第一次用弗氏不完全佐剂乳化,第二次用弗氏完全佐剂乳化蛋白,在首次免疫后2周后进行第2次免疫。
[0150]
用间接elisa检测分离的血清样本中总igg。
[0151]
包被抗原(bl21大肠杆菌表达的复性p216蛋白,实验室制备),以1μg/ml浓度,每孔100μl包被96孔酶标板,37℃包被2h,然后用pbst(pbs+吐温)洗涤。每孔加100μl5%脱脂乳的pbst封闭液,37℃封闭1h,洗涤;每孔加入pbs稀释(1:100)的待检免疫血清,37℃孵育1h,洗涤;每孔加入pbs稀释(1:2000)的hrp(辣根过氧化物酶)标记的羊抗小鼠igg作为二抗,37℃孵育1h,洗涤;每孔加入100μltmb显色液(3,3',5,5'
‑
四甲基联苯胺),室温显色10min后每孔加入50μl 2m的硫酸终止反应,酶标仪测od
450
吸光值,分析结果。当样品的od
450
≥(阴性血清的od
450
+3倍标准方差)时即为阳性。
[0152]
免疫4周后的血清p216 igg抗体检测结果如表2所示:
[0153]
表2免疫4周后小鼠血清中p216 igg抗体水平
[0154][0155]
由表2可以看出,raav
‑
rfp*组没有产生特异的p216 igg抗体;而低中高三个raav5
‑
p216组,都能产生较高的p216 igg抗体,其中,中、高浓度组产生的抗体显著高于低浓度组,高浓度组约高于中浓度组,但差异不显著;p216蛋白组1#组产生的p216 igg抗体水平约高于raav5
‑
p216低浓度组,但显著低于raav5
‑
p216中浓度组和raav5
‑
p216高浓度组;raav5
‑
p216中浓度组和raav5
‑
p216高浓度组产生的抗体大于或者接近p216蛋白2#组产生
的抗体,说明raav5
‑
p216一次免疫能达到p216蛋白二次免疫的效果。
[0156]
实施实例3重组raav5
‑
p216疫苗诱发小鼠免疫反应评价
[0157]
1小鼠免疫方法和血清中igg1、igg2a、igg2b和igg3抗体检测
[0158]
spf级别的昆明小鼠(4
‑
6周龄),购自湖南景达实验动物有限公司。注射体积为50μl,免疫后每周采血,制备血清冻存于
‑
70℃冰箱备用。小鼠分组、免疫剂量及免疫部位如表3所示:
[0159]
表3免疫分组及情况
[0160][0161]
其中,raav
‑
rfp*,为没有插入基因的空载体包装的重组病毒;p216蛋白免疫:第一次用弗氏不完全佐剂乳化,第二次用弗氏完全佐剂乳化蛋白,在首次免疫后2周后进行第2次免疫。
[0162]
血清中igg1、igg2a、igg2b和igg3抗体(试剂盒购自武汉伊莱瑞特生物科技有限公司)的elisa测定结果如表4所示:
[0163]
表4血清中igg1、igg2a、igg2b和igg3抗体的检测结果
[0164][0165][0166]
igg1水平升高,表明保护性免疫中免疫应答向th2(体液免疫应答)方向发展;igg2a水平升高,提示保护性免疫中免疫应答向th1(细胞免疫应答)方向发展。由表4可以看出,和raav
‑
rfp组相比,raav5
‑
p216
‑
rfp组、raav5
‑
p216组和p216蛋白组的igg1、igg2a、igg2b和igg3抗体都升高了;raav5
‑
p216
‑
rfp组、raav5
‑
p216组和p216蛋白组相比,组间差异不明显;raav5
‑
p216
‑
rfp组和raav5
‑
p216组相比,组间差异不明显。这些结果说明,raav5
‑
p216组细胞免疫应答和体液免疫应答都增强了。
[0167]
2小鼠脾淋巴细胞分离
[0168]
(1)免疫4周后,引颈处死小鼠,小鼠用75%酒精浸泡5min,放于超净工作台中的无菌平皿中,剖开皮毛层,用酒精棉球轻拭剖开部位,换新的剪刀,剪开胸腔,镊子尽量不要直接夹取脾脏,可以牵扯脂肪性的系膜,暴露连接部,逐步剪开,最后镊子夹脾底系膜连结处的一条小棱将脾脏完整取出。脾脏转移至盛放有少量pbs的培养皿中。
[0169]
(2)将1ml注射器针头压弯成l型,平行于脾脏表面扎入脾脏,l型针头在脾脏表面来回推动,促进脾细胞刮出,用吸管或移液器反复吹打;均匀冲洗下来的脾细胞,使其成为单层的细胞悬液,过200目筛网后,轻轻吸入10ml离心管中。
[0170]
(3)1000rpm离心10min,弃上清,加入3ml 0.83%的nh4cl(破红细胞)重悬脾细胞,静置5min,然后加pbs到10ml。
[0171]
(4)1000rpm再次离心10min,弃上清,加10mlpbs重悬沉淀,细胞计数板进行计数,一般小鼠每只可取到脾细胞1
×
108个左右。
[0172]
(5)1000rpm离心10min,沉淀用含有10%fbs的rpmi
‑
1640调整细胞密度为4
×
106个/ml。
[0173]
3脾细胞培养上清中细胞因子检测和脾细胞流式细胞术检测
[0174]
(1)将上步分离的浓度为4
×
106个/ml的脾细胞悬液接种到12孔板,每个孔1毫升,每只小鼠加3个复孔。
[0175]
(2)然后将100ng/ml p216蛋白作为刺激因素加入到12孔板中,于37℃、5%co2环境中共育1天。
[0176]
(3)离心,吸取上清于
‑
80℃冰箱保存,用来做elisa测定(试剂盒购自武汉伊莱瑞特生物科技有限公司),il
‑
2、il
‑
4、il
‑
10和ifn
‑
γ的表达水平结果如表5所示:
[0177]
表5脾细胞培养上清中il
‑
2、il
‑
4、il
‑
10和ifn
‑
γ的检测结果
[0178][0179]
th1细胞因子(如il2、ifn
‑
g等)反映的是细胞免疫的应答水平;th2细胞因子(如il
‑
4、il
‑
10等)反映的是体液免疫的应答水平。由表5可以看出,和raav
‑
rfp组相比,raav5
‑
p216组和p216蛋白组的il
‑
2、il
‑
4、il
‑
10和ifn
‑
γ均得到了升高;而且raav5
‑
p216组il2和ifn
‑
g的表达略高于p216蛋白组,il
‑
4和il
‑
10略低于p216蛋白组。这些结果说明,raav5
‑
p216组和p216蛋白组细胞免疫应答和体液免疫应答都增强了。
[0180]
综上所述,和重组蛋白疫苗相比,本发明提供的重组raav5
‑
p216疫苗只要一次注射就可以获得很好的抗体水平,以及获得很好的特异性细胞免疫应答和体液免疫应答,使得免疫工作量减小了一半。携带p216基因的重组5型腺相关病毒载体raav5
‑
p216作为一种重组腺相关病毒疫苗或药物,可被广泛应用于抗肺炎支原体感染。
[0181]
以上所述仅为本发明的优选实施例,并非因此限制本发明的专利保护范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。在本发明的精神和原则之内,凡是利用本发明说明书及附图内容所作的任何改进或等同替换,直接或间接运用在其它相关的技术领域,均应包括在本发明的专利保护范围内。
[0182]
[0183]
[0184]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1