一种同时降解呕吐毒素和玉米赤霉烯酮的贝莱斯芽孢杆菌及应用
1.本发明涉及微生物学和植物病害生防技术领域,尤其涉及一种同时降解呕吐毒素和玉米赤霉烯酮的贝莱斯芽孢杆菌及应用。
背景技术:
2.呕吐毒素又称脱氧雪腐镰刀菌烯醇毒素(don),是一种b型单端孢霉烯族毒素,主要由禾谷镰刀菌(fusarium graminearum)和黄色镰刀菌(fusarium culmorum)等产生的次级代谢物,广泛存在于污染的谷物、饲料及食品中。由于呕吐毒素具有较高的细胞毒性和免疫抑制性质,进入人和动物体内影响消化系统造成呕吐等症状,降低机体免疫力,对人和动物的健康造成严重危害。
3.目前国内外主要采用物理法、化学法和生物法进行呕吐毒素去除。物理和化学法存在脱毒效果不理想和引入其他有害物质等缺点。与传统的物理、化学法相比,生物法能将呕吐毒素转化为无毒或低毒物质,且不会造成农产品营养损失,因此是一种绿色安全的去毒方法,被认为去除呕吐毒素的最佳方法。
4.玉米赤霉烯酮(zen)是由玉米赤霉菌、禾谷镰刀菌等真菌产生的具有雌激素毒性作用的一种甾体霉菌毒素,广泛存在于谷物当中,对人和动物构成巨大威胁,人或动物食用被玉米赤霉烯酮污染的食物后会出现细胞毒性、生殖毒性、免疫毒性和生殖毒性,对人和动物造成巨大威胁。
5.玉米赤霉烯酮同样可以用物理、化学和生物的方法脱毒,由于物理和化学方法在生活中难以使用,生物降解对生态环境、产品质量的影响最小,且减少或消除食品和饲料中玉米赤霉烯酮温和而有效,故使用生物降解逐渐成为主流。
技术实现要素:
6.本发明的目的在于克服现有技术中的不足,提供一种同时降解呕吐毒素和玉米赤霉烯酮及应用。
7.本发明是通过以下技术方案实现的:一种贝莱斯芽孢杆菌 vel-hngd-f2菌株,保藏于中国普通微生物菌种保藏管理中心,其保藏编号为cgmccno:23365。
8.优选的,该菌株能同时降解有镰刀菌属真菌毒素产生的呕吐毒素和玉米赤霉烯酮。
9.优选的,该贝莱斯芽孢杆菌vel-hngd-f2菌株发酵液对呕吐毒素降解,当菌体浓度10
8-109cfu/ml时,降解率为70%-80%。
10.优选的,该贝莱斯芽孢杆菌vel-hngd-f2菌株对玉米赤霉烯酮有降解效果,对玉米赤霉烯酮降解率为70%-80%。
11.优选的,该贝莱斯芽孢杆菌vel-hngd-f2对呕吐毒素和玉米赤霉烯酮具有降解有显著降解的效果成为为胞外酶。
12.优选的,该贝莱斯芽孢杆菌vel-hngd-f2菌株应用于食品或饲料加工过程中降解有镰刀菌属真菌产生的具有生物毒性的次级代谢物呕吐毒素和玉米赤霉烯酮。
13.优选的,该贝莱斯芽孢杆菌vel-hngd-f2具有耐高温的特性,能够在85℃20min的情况下存活菌体数高达10
8-109cfu/ml。
14.贝莱斯芽孢杆菌vel-hngd-f2全培养液培养物的制备方法为:
15.取冻存在-80℃贝莱斯芽孢杆菌vel-hngd-f2菌株划线到发酵培养基上,培养48h,挑取单菌落接种到装有50ml的发酵液体培养基锥形瓶中,在37℃震荡培养48h。
16.在上述方案的基础上,贝莱斯芽孢杆菌vel-hngd-f2菌悬液的制备方法为:
17.取20ml的贝莱斯芽孢杆菌vel-hngd-f2全培养液培养物,经 10000r/min离心10min后,分离得到菌体和上清液,制备的菌体经磷酸盐缓冲液洗涤后离心,加入磷酸盐缓冲液补齐至20ml,悬浮菌体获得vel-hngd-f2菌株菌悬液。
18.在上述方案的基础上,贝莱斯芽孢杆菌vel-hngd-f2胞外代谢物的制备方法为:
19.取20ml的贝莱斯芽孢杆菌vel-hngd-f2全培养液培养物,经 10000r/min离心10min后,分离得到菌体和上清液,上清液即为贝莱斯芽孢杆菌vel-hngd-f2胞外代谢物。
20.在上述方案的基础上,贝莱斯芽孢杆菌vel-hngd-f2粗提物的制备方法为:
21.贝莱斯芽孢杆菌vel-hngd-f2菌悬液经低温超声破碎后, 10000r/min离心10min得到的液体经0.22μm滤膜过滤制备 vel-hngd-f2菌株的粗提物。
22.本发明提供的菌株能够有效的对呕吐毒素和玉米赤霉烯酮进行有效的降解,且降解的效果达到了70%-80%,且该菌株具有很好的耐高温的效果,能够很好的应用在食品或饲料的加工中。
附图说明
23.图1为vel-hngd-f2菌株降解呕吐毒素前和降解后高效液相色谱图;
24.图2为vel-hngd-f2菌株形态图;
25.图3为vel-hngd-f2菌株降解玉米赤霉烯酮前和降解后高效液相色谱图。
具体实施方式
26.在本发明的描述中,还需要说明的是,除非另有明确的规定和限定,术语“设置”、“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
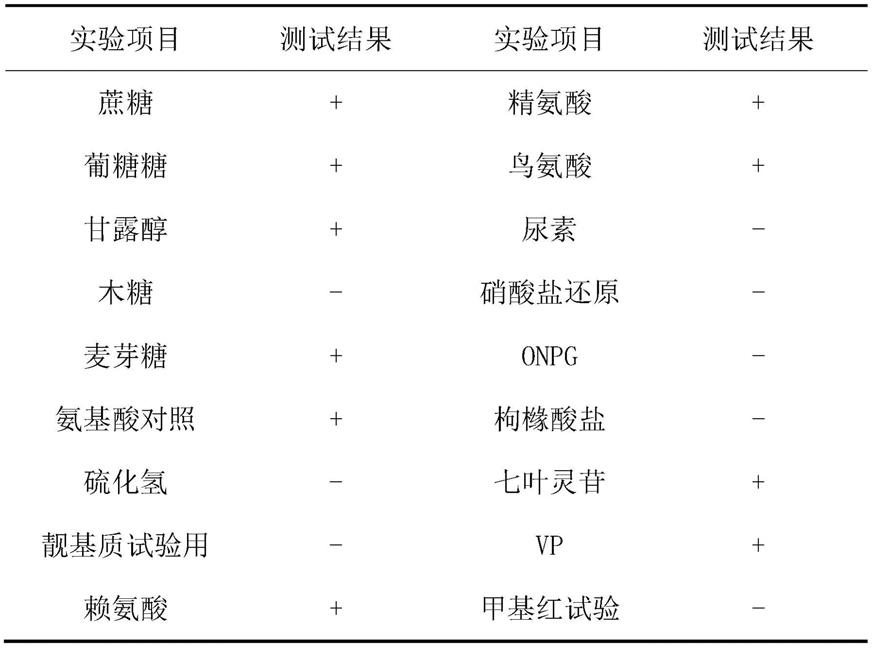
27.下面将结合发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
28.实施例1贝莱斯芽孢杆菌vel-hngd-f2的筛选及鉴定
29.1.从猪肠道微生物中取得样品,称取10g样品加到90ml生理盐水中,150r/min恒温震荡2h,吸取0.2ml悬浮液于灭菌过的发酵培养基中,摇床中150r/min,37℃48h。将培养48h
的发酵培养基等梯度稀释,稀释到10-1
、10-2
、10-3
、10-4
、10-5
、10-6
,然后分别吸取不同稀释度稀释发酵培养液200μl涂布于含有20μg/ml don初筛培养基中,37℃培养箱中倒置培养48h。观察菌株生长情况,挑取较大单菌落于初筛培养基中划线纯化,纯化3代后得到单一菌落,挑取菌落于液体发酵培养基中放入37℃摇床150rpm 48h,吸取500μl菌液于 1.5ml离心管中,加入甘油(50%)将纯化后的菌液保藏于-80℃冰箱中。编号为vel-hngd-f2。
30.2.使用ezup柱式细菌基因组dna抽提试剂盒提取细菌中的dna 使用引物7f(5
’‑
cagagtttgatcctggct-3’)和1540r (5
’‑
aggaggtgatccagccgca-3’)以基因组dna为模板扩增16s rdna。反应体系为;10
×
buffer(with mg2+)2.5μl,f(10um)0.5μl, r(10um)0.5μl,dd h2o 25μl,template(基因组dna 20-50ng/μl) 0.5μl,dntp(各2.5mm)1μl,酶0.2μl。扩增程序为;(1)94℃预变性4min;(2)94℃变性45s;(3)55℃退火45s;(4)72℃延伸1min;(6)步骤(2)到(4)循环30次;(6)72℃修复延伸10 min。使用1%琼脂糖电泳,将pcr产物和dna maker各取5μl到点样孔,150v、100ma 20min进行电泳,电泳结束后在紫外灯下观察条带,判断pcr扩增是否成功。扩增产物由上海生工生物股份有限公司进行纯化测序,测序结果在ncbi数据库比对。
31.3.对其形态特征和生理生化特征鉴定,其结果为:
32.形态特征:菌株在固体发酵培养基上单菌落凸起,浅黄色,不透明,表面圆形,表面干燥,边缘不整齐。
33.生理生化特征见表1(+为阳性,-为阴性)。
34.表1.生理生化实验结果表
[0035][0036]
综合形态特征,生理生化特征和16s rdna测序和同源性分析的结果为贝莱斯芽孢杆菌,命名为vel-hngd-f2保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日
期为2021年9月6日,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101;保藏单位河南工业大学,保藏编号为cgmcc no:23365。
[0037]
实施例2贝莱斯芽孢杆菌对呕吐毒素的降解
[0038]
1.降解呕吐毒素的贝莱斯芽孢杆菌vel-hngd-f2的培养
[0039]
降解呕吐毒素的贝莱斯芽孢杆菌的培养基为发酵培养基:牛肉膏 3g,蛋白胨10g,葡糖糖6g,nacl 5g,加蒸馏水到1000ml,ph为 7.2-7.4。
[0040]
从-80℃冰箱将冻存的贝莱斯芽孢杆菌取出,冷却,挑取菌液划线至固体发酵培养基上,在37℃恒温培养箱培养48h,挑取培养较大的单菌落至液体发酵培养基中,放入37℃摇床150rpm 48h。
[0041]
2.贝莱斯芽孢杆菌vel-hngd-f2对呕吐毒素的降解
[0042]
取950μl的贝莱斯芽孢杆菌菌液置于1.5ml离心管中,加入50μl 100ppm呕吐毒素标准品(终浓度为5ppm),对照组用无菌发酵培养基代替菌液,放入37℃摇床150rpm 48h,使用呕吐毒素用免疫亲和柱,将上清液以1~2秒每滴通过免疫亲和柱,用10ml蒸馏水清洗免疫亲和柱,将3ml甲醇以1~2秒每滴通过免疫亲和柱,收集甲醇溶液,并使用氮吹仪吹干收集得甲醇溶液,再使用流动相进行复溶,收集实验组溶液以及空白组溶液。
[0043]
3.贝莱斯芽孢杆菌vel-hngd-f2对呕吐毒素降解能力分析
[0044]
将收集好的实验组溶液及空白组溶液经过经0.22μm滤器过滤后,使用hplc进行检测培养基中剩余的呕吐毒素含量。hplc检测呕吐毒素条件如下,色谱柱:c18柱(250mm
×
4.6mm,5μm);流动相:甲醇-水(30:70,v/v);检测波长218nm;柱温:35℃;流速:1.0ml/min;进样量:20μl。
[0045]
呕吐毒素降解率=(a
0-a1)
÷
a0×
100%
[0046]
式中:a0对照组呕吐毒素含量;a1为实验组呕吐毒素含量。
[0047]
结果如图1所示,结果表明27℃下贝莱斯芽孢杆菌vel-hngd-f2 对呕吐毒素的降解效果较好,降解率为76.7%。
[0048]
实施例3贝莱斯芽孢杆菌vel-hngd-f2对玉米赤霉烯酮的降解
[0049]
取950μl的贝莱斯芽孢杆菌菌液置于1.5ml离心管中,加入50μl 100ppm玉米赤霉烯酮标准品(终浓度为5ppm),对照组用无菌发酵培养基代替菌液,37℃孵育48h,使用二氯甲烷萃取,收集有机相提取其中的毒素,使用氮吹仪吹干有机相,使用流动相复溶,经0.22μm 滤器过滤后,用hplc检测。
[0050]
hplc检测玉米赤霉烯酮检测条件为:色谱柱:c18柱 (250mm
×
4.6mm,4μm);流动相:甲醇-水(80:20,v/v);检测波长 236nm;柱温:30℃;流速:1.0ml/min;进样量:20μl。
[0051]
玉米赤霉烯酮降解率=(b
0-b1)
÷
b0×
100%
[0052]
式中:b0对照组玉米赤霉烯酮含量;b1为实验组玉米赤霉烯酮含量。
[0053]
结果如图3所示,结果表明37℃下贝莱斯芽孢杆菌vel-hngd-f2 对玉米赤霉烯酮的降解效果较好,降解率为70.2%。
[0054]
实施例4贝莱斯芽孢杆菌vel-hngd-f2耐高温检测
[0055]
1.采用普通平板计数法,将贝莱斯芽孢杆菌vel-hngd-f2菌液稀释1
×
106、1
×
107、1
×
108倍,经85℃20min后涂布于固体发酵培养基上,记录加热后的菌落总数,经计算活菌数为10
8-109cfu/ml。结果见表2。
[0056]
n=∑c/(m1+0.1
×
m2)5d。式中:n为发酵液中活菌总数,∑c为平板(含适宜范围菌落数)菌落数之和,m1为第一稀释度(低稀释倍数)平板个数,m2为第二稀释度(高稀释倍数)平板个数,d为稀释倍数(第一稀释度)。
[0057]
表2.不同批次加热后活菌计数结果
[0058][0059][0060]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1