一种痕量核酸文库构建方法与流程
1.本发明属于分子生物学技术领域,具体涉及一种痕量单链核酸文库构建方法。
背景技术:
2.核酸是脱氧核糖核酸(dna)和核糖核酸(rna)的总称,是由许多核苷酸单体聚合成的生物大分子化合物,为生命的最基本物质之一。在天然存在的核酸中核糖核酸(rna)多以单链形式和发夹形式存在,也发现少量以环状形式存在。脱氧核糖核酸(dna)则以双螺旋的双链形式存在为主,也有部分以单链形式存在。在生物技术诸如核酸检测、体外诊断、基因测序等领域中,对核酸的各种处理过程中也会产生单链形式的核酸。比如,自然界中存在以单链dna或单链rna为遗传物质的生物如人类输血传染病毒(ttv)和微小病毒等等。对这些生物的遗传物质的测序研究使用传统的ngs文库构建方法不容易实现。在法医领域,从腐烂的各种人源材料如骨骼、指甲、毛发等中提取出的dna或rna往往已经高度降解成了单链碎片化核酸,并且已经是痕量(如pg或者fg级别)。对这些痕量的碎片化核酸目前还没有一个高效的文库制备手段。此外,在进行dna甲基化检测中也会涉及到将dna进行重盐转换的步骤,重盐转换后的dna绝大部分变成了比较短的碎片化单链dna。对这些单链核酸的处理目前也缺少一个特别高效的技术。
技术实现要素:
3.本发明的目的是提供一种可以对痕量核酸(dna或rna)进行文库制备的方法。该方法不依赖于dna的双链结构。该方法文库制备效率高,广泛适用于各种长度的痕量单链或双链dna及rna。
4.本发明的目的是通过以下方式实现的。
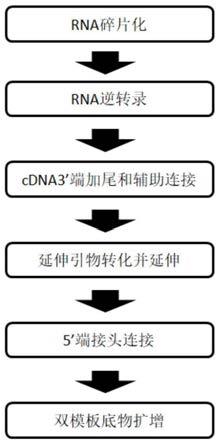
5.一种痕量单链核酸文库构建方法,包括以下步骤:
6.(1)获取碎片化的,且经过5’端磷酸化和3’端羟基化处理的dna单链或者cdna;
7.(2)步骤(1)得到的dna片段进行3’端辅助连接,延伸成dna双链;
8.(3)步骤(2)得到的dna双链的5’端连接上接头,然后进行双模板底物扩增获得文库。
9.步骤(1)中得到的dna片段长度10bp-1000bp;优选50bp-800bp,进一步优选100bp-300bp。
10.步骤(2)的过程采用以下任一种方式:
11.1)a、dna片段进行3’端辅助连接使用两种人工合成的核苷酸片段:辅助子和连接子连接:连接子与dna的3’端加尾序列连接,辅助子的3’端序列与dna的3’端的加尾序列互补,辅助子5’端和连接子互补;辅助子和连接子的3’端需要进行封闭,以防止体系中的加尾酶对辅助子或连接子进行3’端加尾;连接子连接上去后体系中加入延伸引物,延伸引物通过退火与辅助子进行位置竞争;成功竞争到位置的延伸引物在聚合酶作用下进行dna双链的延伸;
12.b、在方式a基础上,使用辅助子5’端比长连接子3’端短至少5个碱基的短辅助子进行辅助连接,然后使用与连接子3’方向互补的延伸引物进行dna片段的互补链聚合;聚合酶需要具有链置换活性或者5’到3’方向外切活性去除连接的辅助子;短的辅助子为延伸引物在连接子3’端上的结合让开了位置空间,与a方案相比不存在辅助子与延伸引物竞争的问题。
13.c、在方式a基础上,辅助子中含有至少1个特殊修饰碱基或碱基类似物,包括:rna碱基、脱氧次黄嘌呤或无碱基位点;连接子连接反应完成后使用rnaseh、或endonuclease iv修复dna损伤的无碱基位点酶进行酶切,使辅助子断裂并暴露出聚合酶延伸聚合的羟基;再由聚合酶进行解封闭并聚合形成dna片段互补链;
14.d、在方式a基础上,使用rna辅助子替代dna辅助子,rna辅助子在高温或者核糖核酸酶a(rnasea)中降解掉,降解后不会与延伸引物进行位置竞争;rna辅助子不需要3’端封闭;配合能够对dna和rna杂合链进行dna链连接的连接酶,优选:splintr连接酶,然后使用延伸引物进行dna片段的互补链聚合。
15.2)dna片段进行3’端辅助连接使用一种人工合成的核苷酸片段辅助子,以及dntp,且dntp是普通的dntp和热启动dntp的混合物,普通dntp选用四种dntp中的任一种、两种或者三种,热启动的dntp为选用的普通dntp对应剩余的三种、两种或者一种;在较低温度条件下利用所述的普通dntp进行dna片段的加尾反应;然后给体系一个较高的温度,使热启动的dntp进入到激活工作的状态;再给一个相对较低的温度,使辅助子与dna片段3’端加尾序列互补结合,最后由dna聚合酶分别以辅助子和dna片段为模板向前延伸,直至以辅助子为模板延伸出辅助子的互补链,并且以dna片段为模板延伸出dna片段的互补链,辅助子3’端含有与dna片段加尾互补的序列,且3’末端需要进行封闭,以防止体系中的加尾酶对辅助子进行3’加尾;
16.辅助子3’端使用磷酸基团修饰或c3spacer修饰封闭,那么辅助子3’端设计的碱基不应与dna链互补,通过在体系中添加高保真聚合酶或其它3’外切活性的酶进行切除不互补碱基来进行解封闭;
17.或者,辅助子3’端使用磷酸基团或c3spacer封闭,辅助子3’端最后一个碱基不要求为不互补碱基,辅助子中含有至少1个特殊修饰碱基或碱基类似物,包括:rna碱基、脱氧次黄嘌呤或无碱基位点;连接子连接反应完成后使用rnaseh、或endonuclease iv修复dna损伤的无碱基位点酶进行酶切,使辅助子断裂并暴露出聚合酶可以延伸聚合的羟基;再由聚合酶进行解封闭并聚合形成dna片段互补链。
18.所述的第1)种方式中:
19.dna片段3’端辅助连接和延伸成dna双链的过程包括:在同一反应体系中进行,或者在两个反应体系中进行;
20.如若在同一反应体系中进行,则体系中还需要添加普通的dntp和热启动dntp的混合物,普通dntp选用四种dntp中的任一种、两种或者三种,热启动的dntp为选用的普通dntp对应剩余的三种、两种或者一种;在较低温度条件下利用所述的普通dntp进行dna片段的加尾反应;然后在辅助子的帮助下连接子连接上dna片段,再给体系一个较高的温度,使热启动的dntp进入到激活工作的状态;最后给一个相对较低的温度,使用辅助子,或者引物,以dna片段为模板向前延伸,获得dna片段的互补链;
21.如果dna片段3’端辅助连接和延伸成dna双链的过程不在同一反应体系中进行,无需使用热启动的dntp,而采用普通的dntp,则没有给体系一个较高的温度,使热启动的dntp进入到激活工作的状态的过程;采用四种普通的dntp中的一种、两种或者三种加尾,采用四种普通的dntp进行延伸。
22.上述的普通dntp选用四种dntp中的任一种、两种或者三种,热启动的dntp为选用的普通dntp对应剩余的三种、两种或者一种;例如:可以理解为:普通dntp选用一种,热启动dntp则选用另外的三种;普通dntp选用两种,热启动dntp则选用另外的两种;普通dntp选用三种,热启动dntp则选用另外的一种。
23.所述的第1)种方式中:
24.封闭方式为使dna3’端不能够进行延伸的修饰,包括:磷酸基团修饰、c3spacer修饰或rna碱基修饰中的任一种。
25.进一步地,
26.辅助子3’端使用磷酸基团修饰或c3spacer修饰封闭,那么辅助子3’端设计的碱基不应与dna链互补,通过在体系中添加高保真聚合酶或其它3’外切活性的酶进行切除不互补碱基来进行解封闭;
27.或者,辅助子3’端使用磷酸基团或c3spacer封闭,辅助子3’端最后一个碱基为不互补碱基,辅助子中含有至少1个特殊修饰碱基或碱基类似物,包括:rna碱基、脱氧次黄嘌呤或无碱基位点;连接子连接反应完成后使用rnaseh、或endonuclease iv修复dna损伤的无碱基位点酶进行酶切,使辅助子断裂并暴露出聚合酶可以延伸聚合的羟基;再由聚合酶进行解封闭并聚合形成dna片段互补链;
28.rna碱基修饰的方式为辅助子3’端至少第1个碱基采用rna碱基进行封闭;所述的rna碱基为ra、rg、rc或ru,通过高温处理解除封闭。
29.具体的是在高温条件下(如95℃)使不互补的封闭碱基掉下来,使辅助子露出3’端羟基,以供体系中聚合酶聚合,生成模板互补链。
30.所述的第1)种方式中:dna片段进行3’端辅助连接使用两种人工合成的核苷酸片段,辅助子和连接子与dna作用在连接发生以前将产生三种中间产物:产物1:dna的3’端尾与连接子在辅助子的帮助下刚好完全互补,dna的3’端尾与连接子之间没有碱基缺口或冗余区,这时此产物由dna连接酶通过形成磷酸二酯键进行连接;产物2:dna的3’端尾与连接子的5’端之间有碱基缺口,需要由dna聚合酶聚合补上缺口后再由dna连接酶进行连接;产物3:dna的3’端尾与连接子的5’端之间有碱基冗余,需要由核酸内切酶或外切酶切掉冗余碱基后再由dna连接酶进行连接。
31.进一步地,
32.dna3’端辅助连接通过限制辅助子与dna3’端尾互补的碱基数目为10个以下来减少或消除产物3的产生。
33.进一步地,
34.所述的连接子的长度范围5-80nt,优选10-60nt,进一步优选20-50nt,辅助子长度范围5-80nt,优选10-60nt,进一步优选20-50nt;加尾长度范围1-30nt,优选2-25nt,进一步优选3-20nt;延伸引物长度范围5-75nt,优选8-70nt,进一步优选10-60nt。
35.进一步地,
36.如果dna片段3’端辅助连接和延伸成dna双链的过程在同一反应体系中进行,在25℃-42℃条件下反应1分钟-60分钟,利用所述的普通dntp进行dna片段的加尾;然后连接子和辅助子都连接上dna片段,再在90℃-100℃条件下反应5秒-60分钟,使热启动的dntp进入到激活工作的状态;最后在42℃-75℃条件下反应5秒-60分钟,获得dna片段的互补链。
37.如果dna片段3’端辅助连接和延伸成dna双链的过程不在同一反应体系中进行,3’端辅助连接反应程序:25℃-42℃1分钟-60分钟;55℃-75℃5秒-60分钟;延伸成dna双链反应程序:55℃-75℃5秒-60分钟。
38.在25℃-42℃条件下反应1分钟-60分钟,在此温度范围内主要是末端转移酶加尾、dna连接酶连接起作用,此时加尾只能加入普通的dntp种类;在90℃-100℃条件下反应5秒-60分钟,在上一温度范围内起作用的末端转移酶加尾、dna连接酶已经失活掉,热启动的dntp进入到激活工作的状态,辅助子从dna链上变性离开,rna封闭在此温度时可以进行解封闭,或者全rna辅助子在此温度时降解掉;在42℃-75℃条件下反应5秒-60分钟,如果体系中有dna辅助子,此温度范围内辅助子可以重新退火结合到dna原有位置,含有3’端错配碱基的辅助子可以在此时被高保真聚合酶切掉以实现解封闭,此温度范围内用于聚合延伸或切除辅助子的酶开始起作用。
39.总之,本发明使用的每一种酶都只在特定步骤程序和特定温度下起作用。如果体系中采用到引物,且加尾、辅助连接、延伸在一个总的反应体系,则引物的5’端采用包括rna碱基在内的方式封闭,如果延伸不与加尾、辅助连接在同一个反应体系,则引物不需要进行封闭。
40.进一步地,
41.反应总体系中辅助子浓度为10nm-20um,优选50nm-10um之间,进一步优选100nm-5um。
42.反应总体系中连接子与辅助子浓度为:1:1-1:10,优选1:3-1:5,进一步优选1:5;
43.反应总体系中dna片段总量范围1fmol-1nmol/50ul;
44.反应总体系中延伸引物浓度范围10nm-10um,优选20nm-1um,进一步优选50nm-200nm;
45.反应总体系中rna辅助子浓度范围10nm-50um;优选50nm-5um,进一步优选150nm-500nm;
46.反应总体系中普通dntp的浓度为2um-2mm;优选10um-1mm;进一步优选30um-0.5mm;反应总体系中普通dntp浓度是每一种热启动dntp的1倍-3倍。
47.进一步地,
48.用于连接的dna连接酶包括:t4dna连接酶、t3dna连接酶、t7dna连接酶、taq dna连接酶、e.coli dna连接酶、9
°
n dna连接酶、splintr连接酶中的一种或多种;反应体系中连接酶的浓度为0.02u/ul-2u/ul;
49.用于聚合的聚合酶包括t4dna聚合酶、e.colidna聚合酶i,klenow大片段、dna聚合酶i(e.coli)、t7dna聚合酶、bsu dna聚合酶大片段中的一种或几种;反应体系中聚合酶的浓度为0.01u/ul-2u/ul;
50.用于切除dna3’端尾与连接子的5’端之间冗余碱基的酶包括t4dna聚合酶、dna聚合酶i klenow大片段、dna聚合酶i、核酸内切酶fen1中的一种或几种;反应体系中浓度
0.01u/ul-2u/ul,优选0.1u/ul-1u/ul,进一步优选0.2u/ul-0.8u/ul;
51.反应体系中末端转移酶的浓度范围0.15u/ul-15u/ul,优选0.3u/ul-3u/ul,进一步优选0.5u/ul-2u/ul;
52.具有链置换活性或者5’到3’方向外切活性聚合酶包括:ventdna聚合酶、deep ventdna聚合酶、phi29dna聚合酶、bsu dna聚合酶大片段、bstdna聚合酶全长、野生型taq聚合酶中的至少一种,优选:2g robust dna聚合酶、rtaq dna聚合酶、taqb dna聚合酶中的至少一种,反应体系中浓度0.01u/ul-20u/ul,优选0.1u/ul-10u/ul,进一步优选0.5u/ul-2u/ul;
53.rnaseh、或endonuclease iv修复dna损伤的无碱基位点酶,反应体系中浓度0.01u/ul-5u/ul,优选0.1u/ul-2u/ul,进一步优选0.2u/ul-1u/ul;
54.高保真聚合酶或其它3’外切活性的酶进行切除不互补碱基来进行解封闭的酶包括:kapa hifi热启动高保真聚合酶、pfu dna聚合酶、phusion dna聚合酶中的一种或几种;反应体系中浓度0.01u/ul-20u/ul,优选0.04u/ul-5u/ul,进一步优选0.1u/ul-0.5u/ul。
55.进一步地,
56.步骤(3)5’端接头连接使用连接增强剂,所述的连接增强剂包括:3-二甲胺基-1,2-丙二醇、r-(-)-1,2-丙二醇、(s)-(-)-1,1-二苯基-1,2-丙二醇、(s)-(+)-1,2-丙二醇、甲基丙烯酸羟丙酯、三丙二醇、丙二醇丁醚、(s)-(+)-3-氯-1,2-丙二醇、(r)-(-)-3-氯-1,2-丙二醇缩丙酮、1,2-二乙酰氧基丙烷、(s)-(-)-碳酸丙烯酯、(r)-(+)-碳酸丙烯酯、3-氨基-1,2-丙二醇、丙二醇甲醚、1-硫代甘油、(r)-3-氨基-1,2-丙二醇、三(2-羧乙基)磷盐酸盐、丙二醇甲醚醋酸酯、1,2-丙二醇中的至少一种;反应体系中浓度(w/w)0.1%-50%,优选1%-10%,进一步优选2%-6%。
57.为了更好的理解本发明,以下更加详细的记载了各种实现发明目的的具体的例子。
58.核酸碎片化:本发明的起始模板可以是双链或单链dna,也可以是rna。可以是各种长度为10bp-1000bp。优选50bp-800bp,进一步优选100bp-300bp。如果是太长的dna或rna则首先需要进行碎片化处理。碎片化处理的方案可以是基因检测行业内常用的方案。例如,长双链dna可以使用超声破碎的方法,内切酶酶切的方法等。长链rna可以使用二价金属离子加95℃以上高温处理的方法等。不仅限制于以上举例的处理方法,凡是能够对核酸进行有效碎片化处理的方法均可。如果核酸本身已经是较短的片段则不需要再进行碎片化处理。
59.cdna5’端磷酸化和3’端羟基化处理:对于rna分子,可以在进行逆转录时使用5’端磷酸化的逆转录引物,这样逆转录出来的产物是满足条件的5’端磷酸化和3’端羟基化的cdna。也可以在逆转录完成或者逆转录过程中同时使用t4pnk酶等同样效果的酶进行5’端磷酸化修饰。对于dna分子,可以使用使用t4pnk酶等同样效果的酶进行5’端磷酸化修饰和3’端羟基化处理。本步骤处理方式不仅限于所描述的方案,任何能达到同样效果的处理方案在本发明中都是可以执行的。
60.核酸3’端加尾:对核酸进行3’端加尾可以有很多种方法实现。如rna末端腺苷酸转移酶,以atp或其类似物为前体,将单核苷酸加入到核酸的3’端尾巴上。如果以此方法实现核酸的3’端加尾,则本发明的步骤可以调换,例如先进行核酸的3’端加尾,再进行3’端辅助连接,再进行rna逆转录等。也可以使用末端转移酶(tdt),以a、t、g、c4种dntp中的一种或两
种或三种为材料进行核酸的3’端加尾。所加尾的数量可以是1个碱基到几十个碱基。可以通过调节各种dntp的浓度来控制所加尾的长度。
61.在某些情况下可以含有修饰的dntp中的一种或两种或三种,使其在较低温度时不能够被加尾酶或聚合酶使用,在较高温度时才可以被酶使用。该种可修饰的dntp的一个类似例子为trilink公司的热启动dntp。在某些情况下,在核酸3’端加尾反应的同一个反应体系和反应条件中可以进行下一步的反应,即dna3’端辅助连接。
62.dna3’端辅助连接:dna3’端辅助连接可以使用两个人工合成的核苷酸片段,辅助子和连接子。辅助子的3’端序列可以与核酸3’端的加尾序列互补,辅助子5’端可以部分和连接子互补。该方案中的辅助子和连接子的3’端需要进行封闭,以避免dna加尾反应把辅助子误认为是模板dna进行误加尾操作。发明人在本发明的发明过程中惊奇地发现在某些合适的反应体系下,辅助子和连接子不需要预先进行额外的退火反应。这使后续的基于加热反应来分解掉辅助子的实验成为可能。因为辅助子要想通过后续的加热反应来分解掉,则无法在连接事件前通过热变性及退火使辅助子和连接子进行退火反应。具体可行的流程是:在反应体系中,辅助子首先找到已经加尾的核酸3’端序列并与之互补结合,同时连接子也与辅助子的5’端序列结合。这里可能产生三种类型的产物(如图3):产物1:dna的3’端尾与连接子在辅助子的帮助下刚好完全互补,其之间没有碱基缺口或冗余区,这时此产物可以由dna连接酶通过形成磷酸二酯键进行连接;产物2:dna的3’端尾与连接子的5’端之间有碱基缺口,由dna聚合酶聚合补上缺口后再由dna连接酶进行连接;产物3:dna的3’端尾与连接子的5’端之间有碱基冗余,由核酸内切酶或外切酶切掉冗余碱基后再由dna连接酶进行连接。dna3’端辅助连接也可以通过限制辅助子与dna3’端尾互补的碱基数目(即辅助子3’端互补碱基数)来减少或消除产物3的产生(如图4)。比如将辅助子与dna3’端尾互补的碱基数目减少为10个或9个或8个或7个或6个或5个或4个或3个或2个或1个。由于辅助子首先与dna3’端尾靠近尾部的碱基互补,这样减少辅助子与dna3’端尾互补的碱基数目不仅能显著减少或消除图3中产物3的产生,而且还缩短了dna3’端加尾的碱基数目。在ngs测序中dna3’端加尾碱基的测序没有意义,因此这有利于减少无意义的碱基测序,有利于降低测序成本。dna3’端辅助连接也可以只使用一个人工合成的核苷酸片段,即辅助子。该方案的具体原理为(如图5):体系中的dntp是普通的dntp和热启动dntp的混合物。例如图5中给出的一个例子,dntp是普通的datp和热启动的dttp、dctp、dgtp。在较低温度条件下适合dna加尾反应,合适的加尾酶只能将普通的datp加入到dna的3’端。然后给体系一个较高的温度,使热启动的dttp、dctp、dgtp进入到激活可以工作的状态。再给一个相对较低的温度,使辅助子与dna3’端加尾序列互补结合,之后由dna聚合酶沿着dna的3’端尾向前延伸,直至以辅助子为模板延伸出辅助子的互补链。该方案中的辅助子3’端需要进行封闭,以避免dna加尾反应把辅助子误认为是模板dna进行误加尾操作。该方案的好处是不会产生图3方案中的三种中间产物,也就不需要对三种中间产物进行连接。该方案的另一个好处是dna加尾、dna3’端辅助连接可以在一个反应体系中进行。提高了效率并且减少了纯化步骤。这对痕量的dna起始原料来讲意义是重大的。dna3’端辅助连接的另一个优选方案如图6:辅助子的3’端最后的碱基不与dna3’端尾互补。在合适的温度条件下体系中相应的具有矫正活性的酶把不互补的碱基(图6中示例为g碱基)和封闭切除掉,使辅助子露出3’端羟基,以供体系中聚合酶聚合,生成模板互补链。该方案的好处是不仅不会产生图3方案中的三种中间产物,更重要的是
dna加尾、dna3’端辅助连接、模板链延伸可以在一个反应体系中进行。进一步提高了效率并且减少了操作步骤。在另一个解决方案中,可以使用长的连接子和短的辅助子进行辅助连接(如图7)。然后使用短的与连接子3’方向互补的延伸引物进行模板链的互补链聚合。在这个解决方案中聚合酶需要具有链置换活性或者5’到3’方向外切活性。该优选方案的好处是辅助子与延伸引物并无竞争关系,保证了延伸引物高效率延伸。在另一个优选解决方案中可以使用长的辅助子与长的连接子(如图8)。长的辅助子中可以含有1个或多个特殊修饰碱基或碱基类似物。如rna碱基、脱氧次黄嘌呤、无碱基位点等。连接子连接反应完成后可以使用rnaseh、或endonuclease iv等修复dna损伤的无碱基位点酶进行酶切,使长的辅助子断裂并暴露出聚合酶可以延伸聚合的羟基。再由聚合酶进行解封闭并聚合形成模板互补链。该优选方案的好处在于不需要额外添加延伸引物来与封闭的辅助子竞争,保证了高效率形成双链延伸产物。在另一个优选解决方案中可以使用rna辅助子。该方案的连接要配合特定的连接酶(如splintr连接酶,neb,#m0375)。如图9,该优选方案的好处在于首先辅助子为rna碱基的核酸片段,其3’端不需要特殊碱基封闭,节省了成本。其次,rna碱基的辅助子更容易在反应中被彻底去除(如使用rna酶等),以防止在后续的延伸反应中其与延伸引物进行竞争。
63.延伸引物转化并延伸:在上一步骤(dna3’端辅助连接)的一些方案描述中有部分方案已经把延伸引物转化并延伸反应同步进行了。在该延伸反应中,可以使用各种符合条件的dna聚合酶,如高保真dna聚合酶、各种taq dna聚合酶等。本发明中此步骤优选taq dna聚合酶,因为其延伸后的产物3’端有a碱基突出。该特性的产物在下面的连接步骤中是极为重要的。
[0064]5’
端接头连接:该反应完成将双链或部分双链dna接头连接到双链延伸产物中。连接的接头取决于双链延伸产物的特点。如果延伸使用的是高保真聚合酶(或者具有3’到5’方向外切活性的聚合酶)那么该产物为平末端,则对应使用的连接接头也应是平末端接头。如果延伸使用的是不具有3’到5’方向外切活性的聚合酶,例如taq dna聚合酶等,那么该产物为3’有a碱基的粘性末端,则对应使用的连接接头应是3’有t碱基的粘性末端接头。本发明优选使用后一种方案。因为后一方案首先可以保证双链延伸产物之间以及双链接头之间不会自我连接,即可以保证只能是双链延伸产物和双链接头进行连接。更重要的是此种连接方案使双链延伸产物的上、下两条链都连接到了接头序列。这也意味着此方案进一步充分利用了原本就不多的痕量模板dna。此外,本发明的实施人员惊奇地发现在连接体系中使用某些化学物质作为连接增强剂可以极大提高连接的效率。这在本行业中普遍30%-50%的连接效率对比下显然进一步提高了痕量核酸的文库转化效率。
[0065]
双模板底物扩增:如上一步骤所述,本发明的优选方案中由于对核酸模板本身及其延伸互补链都连接了接头序列,因此可以使用通用引物进行文库扩增,最终在pcr扩增指数期内相比于只连接一条链(核酸模板本身或其互补链)的方案可以得到多一倍的文库产量。
附图说明
[0066]
图1是本发明以rna为例的技术流程;
[0067]
图2是本发明具体技术细节;
[0068]
图3是三种待连接产物结构;
[0069]
图4是dna加尾碱基数量影响三种待连接产物的比例;
[0070]
图5是一种使用热启动dntp的方案;
[0071]
图6是一种使用热启动dntp的优选的方案;
[0072]
图7是一种避免辅助子与延伸引物竞争的方案;
[0073]
图8是一种不需要延伸引物的方案;
[0074]
图9是rna作为辅助子的连接方案;
[0075]
图10是实施例1文库胶图;
[0076]
图11是实施例2文库胶图;
[0077]
图12是实施例3文库胶图;
[0078]
图13是实施例4文库胶图;
[0079]
图14是实施例5文库胶图;
[0080]
图15是实施例6连接产物胶图。
具体实施方式
[0081]
以下结合实施例旨在进一步说明本发明,而非限制本发明。
[0082]
实施例1
[0083]
长链rna分子文库制备
[0084]
使用商业化试剂盒抽提拟南芥mrna。取500pg mrna构建文库。逆转录引物p1序列:
[0085]5’
p-nnnnnnnn-3’[0086]
1.核酸碎片化
[0087]
反应体系如下:
[0088][0089]
70℃反应1.5分钟。
[0090]
qiagen柱纯化。
[0091]
2.rna逆转录
[0092]
反应体系如下:
[0093]
碎片化mrna11ul逆转录引物p1(0.3ug/ul)1ul总体积12ul
[0094]
65℃反应5分钟,立即置于冰上。
[0095]
配如下反应试剂:
[0096]
5x first strand buffer4uldtt(100mm)2uldntp(10mm each)1ulrnase inhibitor0.5ul总体积7.5ul
[0097]
将上一步的12ul含rna的反应体系加入7.5ul试剂中。
[0098]
25℃反应2分钟后立即加入superscript iii reverse transcriptase
[0099]
1ul。混匀后进行如下反应:
[0100]
25℃10分钟,42℃50分钟,4℃保存。
[0101]
反应完成后qiagen柱纯化。
[0102]
3.cdna3’端加尾和辅助连接
[0103]
辅助子a1序列:
[0104]
gtgactggagttcagacgtgt-ap-ctcttccgatcttttt-c3(3’端c3spacer封闭)序列见seq id no.1,
[0105]
(ap为空碱基位点,可以被特定的酶酶切掉,如本实施例中用酶tth endonuclease iv)
[0106]
连接子l1序列:
[0107]
p-agatcggaagagcacacgtctgaactccagtcac-c3(3’端c3spacer封闭)序列见seq id no.2;
[0108]
反应体系如下:
[0109][0110]
先将30ul cdna在pcr仪上95℃1分钟,4℃保存。
[0111]
将上述20ul反应混合液加入上述cdna中,混匀。
[0112]
pcr仪上37℃10分钟,65℃15分钟,4℃保存。
[0113]
4.延伸引物转化并延伸
[0114]
本实施例步骤3已经通过对辅助子的酶切完成了辅助子向延伸引物的转化,因此只需要配制延伸反应液即可。
[0115]
配制如下反应液:
[0116][0117]
将20ul反应液加入到步骤3完成的反应体系中。
[0118]
pcr仪上72℃12分钟,4℃保存。
[0119]
2x ampure xp beads纯化。
[0120]
5.5’端接头连接
[0121]5’
端接头adt1制作:
[0122]
adt1-u:
[0123]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct,序列见seq id no.3;
[0124]
adt1-d:
[0125]
p-gatcggaagagcacacgtctgaactccagtcacatcacgatctcgtatgccgtcttctgcttg,序列见seq id no.4;
[0126]
adt1-u和adt1-d等物质的量混合后在pcr仪上98℃2分钟,缓慢降低到室温使其退火成双链即可。
[0127]
配制如下反应体系:
[0128][0129]
pcr仪上25℃15分钟,65℃20分钟,4℃保存。
[0130]
2x ampure xp beads纯化。
[0131]
6.双模板底物扩增
[0132]
扩增引物序列如下:
[0133]
pcr-f1:
[0134]
aatgatacggcgaccaccga,序列见seq id no.5,
[0135]
pcr-r1:
[0136]
caagcagaagacggcatacgagatcgtgatgtgactggagttcagacgt,序列见seq id no.6,
[0137]
扩增反应体系如下:
[0138]
连接产物33ul5x buffer a10ul2g robust dna聚合酶(5u/ul)1uldntp(2.5mm)4ul引物pcr-f1(10um)1ul引物pcr-r1(10um)1ul总体积50ul
[0139]
扩增程序如下:
[0140][0141]
终文库取5ul进行2%琼脂糖胶电泳。
[0142]
实施例1实验结果见图10。
[0143]
实施例2
[0144]
延伸引物与辅助子位置竞争的方法
[0145]
取一段5’端磷酸化的180bp的pcr产物。
[0146]
1.3’端辅助连接
[0147]
辅助子a2序列:
[0148]
gtgactggagttcagacgtgtgctcttccgatcttttt-c3(3’端c3spacer封闭)序列见seq id no.7,
[0149]
连接子l1序列:
[0150]
p-agatcggaagagcacacgtctgaactccagtcac-c3(3’端c3spacer封闭)延伸引物y1序列:
[0151]
gtgactggagttcagacgtgtgctcttccgatrc(3’端rna碱基rc封闭)序列见seq id no.8,
[0152]
反应体系如下:
[0153][0154][0155]
先将30ul30ng180bp的pcr产物在pcr仪上95℃1分钟,4℃保存。
[0156]
将上述20ul反应混合液加入上述dna中,混匀。
[0157]
pcr仪上37℃10分钟,95℃2分钟,72℃5分钟,4℃保存。
[0158]
使用2x ampurexp beads纯化。
[0159]
2.5’端接头连接
[0160]5’
端接头adt1制作:
[0161]
adt1-u:
[0162]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatctadt1-d:
[0163]
p-gatcggaagagcacacgtctgaactccagtcacatcacgatctcgtatgccgtcttctgcttgad
t1-u和adt1-d等物质的量混合后在pcr仪上98℃2分钟,缓慢降低到室温使其退火成双链即可制成5’端接头adt1。
[0164]
配制如下反应体系:
[0165][0166]
pcr仪上25℃15分钟,65℃20分钟,4℃保存。
[0167]
2x ampure xp beads纯化。
[0168]
3.双模板底物扩增
[0169]
扩增引物序列如下:
[0170]
pcr-f1:
[0171]
aatgatacggcgaccaccga
[0172]
pcr-r1:
[0173]
caagcagaagacggcatacgagatcgtgatgtgactggagttcagacgt
[0174]
扩增反应体系如下:
[0175]
连接产物33ul5x buffer a10ul2g robust dna聚合酶(5u/ul)1uldntp(2.5mm)4ul引物pcr-f1(10um)1ul引物pcr-r1(10um)1ul总体积50ul
[0176]
扩增程序如下:
[0177][0178]
终文库取5ul进行2%琼脂糖胶电泳。
[0179]
实施例2实验结果见图11。
[0180]
实施例3
[0181]
dna加尾、dna3’端辅助连接、模板链延伸在同一个反应体系中进行的方法
[0182]
取180bp的pcr产物。
[0183]
辅助子a3序列(采用c3spacer封闭3’端):
[0184]
ttcagacgtgtgctcttccgatcttttttttttttttg-c3序列见seq id no.9,
[0185]
1.反应体系如下:
[0186][0187]
先将30ul(10ng)180bp的pcr产物在pcr仪上95℃1分钟,4℃保存。
[0188]
将上述20ul反应混合液加入上述dna中,混匀。
[0189]
pcr仪上37℃10分钟,95℃10分钟,72℃15分钟,4℃保存。
[0190]
2x ampure xp beads纯化。
[0191]
2.5’端接头连接
[0192]5’
端接头adt1制作:
[0193]
adt1-u:
[0194]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct
[0195]
adt2-d:
[0196]
p-agatcggaagagcacacgtctgaactccagtcacatcacgatctcgtatgccgtcttctgcttg序列见seq id no.10,
[0197]
adt1-u和adt2-d等物质的量混合后在pcr仪上98℃2分钟,缓慢降低到室温使其退火成双链即可制成5’端接头adt2。
[0198]
配制如下反应体系:
[0199][0200]
pcr仪上25℃15分钟,65℃20分钟,4℃保存。
[0201]
2x ampure xp beads纯化。
[0202]
3.双模板底物扩增
[0203]
扩增引物序列如下:
[0204]
pcr-f1:
[0205]
aatgatacggcgaccaccga
[0206]
pcr-r1:
[0207]
caagcagaagacggcatacgagatcgtgatgtgactggagttcagacgt
[0208]
扩增反应体系如下:
[0209]
[0210][0211]
扩增程序如下:
[0212][0213]
终文库取5ul进行2%琼脂糖胶电泳。
[0214]
实施例3实验结果见图12。
[0215]
电泳结果图12表明,本实施例中采用3’端不完全匹配的辅助子a4配合高保真聚合酶能够有效构建文库。
[0216]
实施例4
[0217]
使用长的连接子和短的辅助子进行辅助连接的方法
[0218]
取10ng 220bp的pcr产物。
[0219]
辅助子a4序列:
[0220]
ctcttccgatcttttt-c3(采用c3spacer封闭3’端)序列见seq id no.11,
[0221]
连接子l1序列:
[0222]
p-agatcggaagagcacacgtctgaactccagtcac-c3(采用c3spacer封闭3’端)
[0223]
延伸引物y2序列:
[0224]
gtgactggagttcagacg序列见seq id no.12,
[0225][0226]
先将30ul(10ng)180bp的pcr产物在pcr仪上95℃1分钟,4℃保存。
[0227]
将上述20ul反应混合液加入上述dna中,混匀。
[0228]
pcr仪上37℃10分钟,65℃20分钟,4℃保存。
[0229]
配制如下反应体系
[0230][0231]
将50ul反应液加入到上述步骤完成的50ul反应体系中。
[0232]
pcr仪上72℃12分钟,4℃保存。
[0233]
2x ampure xp beads纯化。
[0234]
2.5’端接头连接
[0235]5’
端接头adt1制作:
[0236]
adt1-u:
[0237]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct
[0238]
adt1-d:
[0239]
p-gatcggaagagcacacgtctgaactccagtcacatcacgatctcgtatgccgtcttctgcttg
[0240]
adt1-u和adt1-d等物质的量混合后在pcr仪上98℃2分钟,缓慢降低到室温使其退火成双链即可制成5’端接头adt1。
[0241]
配制如下反应体系:
[0242][0243]
pcr仪上25℃15分钟,65℃20分钟,4℃保存。
[0244]
2x ampure xp beads纯化。
[0245]
3.双模板底物扩增
[0246]
扩增引物序列如下:
[0247]
pcr-f1:
[0248]
aatgatacggcgaccaccga
[0249]
pcr-r1:
[0250]
caagcagaagacggcatacgagatcgtgatgtgactggagttcagacgt
[0251]
扩增反应体系如下:
[0252][0253][0254]
扩增程序如下:
[0255][0256]
终文库取5ul进行2%琼脂糖胶电泳。
[0257]
实施例4实验结果见图13。
[0258]
实施例4表明,使用长的连接子和短的辅助子,再配合不与辅助子竞争的延伸引物,也可以高效的构建此文库。
[0259]
实施例5
[0260]
使用rna作为辅助子进行辅助连接的方法
[0261]
取一段5’端磷酸化的180bp的pcr产物。
[0262]
1.3’端辅助连接
[0263]
辅助子a5序列:
[0264]
rururcrargrarcrgrurgrurgrcrurcrururcrcrgrarurcrurururururu,序列见seq id no.13,
[0265]
连接子l1序列:
[0266]
p-agatcggaagagcacacgtctgaactccagtcac-c3
[0267]
延伸引物y1序列:
[0268]
gtgactggagttcagacgtgtgctcttccgatrc
[0269]
反应体系如下:
[0270][0271]
先将30ng180bp的pcr产物在pcr仪上95℃1分钟,4℃保存。
[0272]
将上述20ul反应混合液加入上述dna中,混匀。
[0273]
pcr仪上30℃10分钟,95℃2分钟,72℃5分钟,4℃保存。
[0274]
使用2x ampurexp beads纯化。
[0275]
2.5’端接头连接
[0276]5’
端接头adt1制作:
[0277]
adt1-u:
[0278]
aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct
[0279]
adt1-d:
[0280]
p-gatcggaagagcacacgtctgaactccagtcacatcacgatctcgtatgccgtcttctgcttg
[0281]
adt1-u和adt1-d等物质的量混合后在pcr仪上98℃2分钟,缓慢降低到室温使其退火成双链即可制成5’端接头adt1。
[0282]
配制如下反应体系:
[0283][0284]
pcr仪上25℃15分钟,65℃20分钟,4℃保存。
[0285]
2x ampure xp beads纯化。
[0286]
3.双模板底物扩增
[0287]
扩增引物序列如下:
[0288]
pcr-f1:
[0289]
aatgatacggcgaccaccga
[0290]
pcr-r1:
[0291]
caagcagaagacggcatacgagatcgtgatgtgactggagttcagacgt
[0292]
扩增反应体系如下:
[0293][0294][0295]
扩增程序如下:
[0296][0297]
终文库取5ul进行2%琼脂糖胶电泳。
[0298]
实施例5实验结果见图14。
[0299]
实施例6
[0300]5’
端接头连接使用连接增强剂提高连接效率
[0301]
人工合成如下寡核苷酸序列:
[0302]
olg1序列:
[0303]
acctttcttttccaatgttacttggttccatgctatacatgtctca序列见seq id no.14,olg2序列:
[0304]
gagacatgtatagcatggaaccaagtaacattggaaaagaaaggta序列见seq id no.15,adt1序列:
[0305]
agatcggaagagcact序列见seq id no.16,adt2序列:
[0306]
gtgctcttccgatct序列见seq id no.17,
[0307]
olg1序列与olg2序列退火形成两端3’端悬出a碱基的约47bp的olg双链dna,adt1序列与adt2序列退火形成一端3’端悬出t碱基的约16bp的adt双链接头。
[0308]
选择19种实验室常用试剂作为连接增强剂,从中选出对连接反应有增强效果的试剂。实验体系如下:
[0309][0310]
s0为未加t4dna连接酶的阴性对照。
[0311]
s1为未加增强剂的阳性反应对照。
[0312]
对应的增强剂及比例浓度见下表:
[0313][0314]
[0315]
连接产物跑4%琼脂糖胶。
[0316]
实施例6实验结果见图15。
[0317]
实验结果说明s4、s5、s6、s9、s13、s14、s15、s16、s19、s20在实施例中的浓度范围内对连接反应有比较明显的增强作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1