一种植物基因表达载体的构建方法和应用
1.本发明属于生物技术领域,尤其涉及一种植物基因表达载体的构建方法和应用。
背景技术:
2.目前,植物基因工程技术的迅速发展和广泛应用为植物的遗传改良开拓了广阔的前景。该技术克服了植物有性杂交的限制,可将来源于不同物种甚至人工合成的基因导入植物,从而改良植物性状,培育优质高产作物新品种。在基因克隆、基因功能分析以及基因转化等分子生物学的研究与应用过程中,载体构建是常用的技术手段,采用合适的表达载体和构建方法会使实验效果事半功倍。但是,现有的植物基因表达载体表达的基因不稳定,且构建成功率低、连接率不高,同时操作复杂成本昂贵。因此,亟需一种新的物基因表达载体的构建方法,以弥补现有技术中存在的问题及缺陷。
3.通过上述分析,现有技术存在的问题及缺陷为:现有的植物基因表达载体表达的基因不稳定,且构建成功率低、连接率不高,同时操作复杂成本昂贵。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种植物基因表达载体的构建方法和应用。
5.本发明是这样实现的,一种植物基因表达载体的构建方法,所述植物基因表达载体的构建方法包括以下步骤:
6.步骤一,从植物基因组中分离靶标基因对应的基因序列:根据靶标基因设计聚合酶链式反应引物,进行聚合酶链式反应即pcr;将dna模板、设计的引物、聚合酶、dntp、缓冲液以及mgcl2进行混合均匀,构成pcr体系;进行预变性和20~30次扩增温度循环,循环结束后,于65℃的条件下补齐并延伸处理15~30min后反应结束;反应结束后,进行靶标基因扩增处理,即可得到靶标基因对应的基因序列,备用;
7.步骤二,构建质粒载体:在质粒的启动子和终止子之间引入多克隆酶切位点;利用限制性内切酶,对质粒进行双酶切处理;将双酶切后的质粒,经1%的琼脂糖凝胶电泳分离后,切取目的条带,通过凝胶回收方法或凝胶回收试剂盒获得经过切除处理的的质粒;基于引入的酶切位点、限制性内切酶合成dna片段,将所述dna片段与已进行切除处理的质粒进行连接;连接后的重组质粒利用热激法转化到大肠杆菌的感受态细胞中;将转化后的大肠杆菌平涂于含有卡那霉素的lb固体培养基上培养,挑取单独菌落进行菌落pcr鉴定,筛选含有重组质粒的阳性菌落;将阳性菌落经卡那霉素的lb液体培养基扩繁后,利用质粒提取方法提取重组质粒dna,即可得到质粒载体,备用;
8.步骤三,将含有靶标基因对象基因序列连接到构建的质粒载体上,构建含靶标基因的植物表达载体:对步骤一构建得到的质粒载体进行双酶切处理,并将酶切产物经1.0%琼脂糖凝胶电泳后分别回收目的基因片段以及酶切载体;将回收的质粒载体与含有靶标基因对象基因序列进行连接,挑取培养平板上生长良好的单菌落,置于含有卡那霉素的lb液
体培养基中振荡培养一段时间;取培养后的菌液进行pcr扩增,将pcr检测呈阳性的菌落克隆在20~30ml含有50μg/ml卡那霉素的lb液体培养基中进行扩大培养;提取质粒,进行双酶切鉴定,利用0.8%琼脂糖凝胶电泳检测含有目的片段大小的条带,即可得到构建好的植物基因表达载体。
9.进一步,步骤一中,所述缓冲液为t4 dna连接酶缓冲液,由500mm tris-hcl,8%的1,3-丙二醇,2.0mm dtt,5~20mmatp组成,ph 8.0。
10.进一步,步骤一中,所述循环的条件为:90℃预变性8~12min,85℃变性60sec,45℃退火25sec,65℃延伸20sec,循环20~30次。
11.进一步,步骤二中,利用t4-dna连接酶或质粒连接用试剂盒将所述dna片段与已进行切除处理的质粒进行连接。
12.进一步,步骤二中,所述卡那霉素浓度为50mg/l。
13.进一步,步骤二中,所述质粒提取方法包括:
14.(1)将含有目的质粒的大肠杆菌接种培养,得到大肠杆菌培养菌液,进行离心,去除上清液,得到大肠杆菌体沉淀;将大肠杆菌体沉淀加入菌体裂解试剂进行菌体裂解,得到呈半透明状裂解液,室温静置2~3min;
15.(2)向呈半透明状裂解液中加入杂质去除试剂,充分混合后,高速离心,取上清菌液,备用;
16.(3)将上清菌液上样层析柱,进行洗脱,收集含有质粒的洗脱液,重复洗脱四次,即可得提取的质粒。
17.进一步,所述向呈半透明状裂解液中加入杂质去除试剂包括:按每1ml大肠杆菌培养菌液加入40~60μl杂质去除试剂的比例添加所述杂质去除试剂;其中,所述杂质去除试剂为乙酸﹑氯化钠的混合液。
18.进一步,所述高速离心的条件为:设置高速离心机的离心速率为3000~4500转/分钟,离心分离时间为10~15min。
19.进一步,步骤三中,所述振荡培养的方法包括:于35℃、180r/min的条件下振荡培养10~15h。
20.本发明的另一目的在于提供一种所述的植物基因表达载体的构建方法在转基因过程细胞的选拔和观察中的应用。
21.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的物基因表达载体的构建方法,能够快速的构建基因表达载体,且方法简便、成本低廉,成功率高,同时利用本发明的法构建的基因表达载体,插入的基因能够在植物体内稳定表达,可用于转基因过程细胞的选拔和观察,有效提高转基因效率。
附图说明
22.为了更清楚地说明本技术实施例的技术方案,下面将对本技术实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
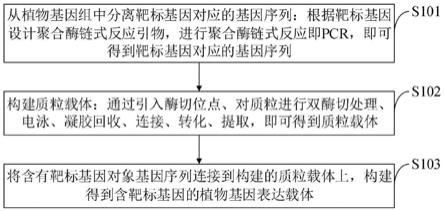
23.图1是本发明实施例提供的植物基因表达载体的构建方法流程图。
24.图2是本发明实施例提供的从植物基因组中分离靶标基因对应的基因序列的方法流程图。
25.图3是本发明实施例提供的构建质粒载体的方法流程图。
26.图4是本发明实施例提供的质粒提取的方法流程图。
27.图5是本发明实施例提供的将含有靶标基因对象基因序列连接到构建的质粒载体上,构建含靶标基因的植物表达载体的方法流程图。
具体实施方式
28.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
29.针对现有技术存在的问题,本发明提供了一种植物基因表达载体的构建方法和应用,下面结合附图对本发明作详细的描述。
30.如图1所示,本发明实施例提供的植物基因表达载体的构建方法包括以下步骤:
31.s101,从植物基因组中分离靶标基因对应的基因序列:根据靶标基因设计聚合酶链式反应引物,进行聚合酶链式反应即pcr,即可得到靶标基因对应的基因序列;
32.s102,构建质粒载体:通过引入酶切位点、对质粒进行双酶切处理、电泳、凝胶回收、连接、转化、提取,即可得到质粒载体;
33.s103,将含有靶标基因对象基因序列连接到构建的质粒载体上,构建得到含靶标基因的植物基因表达载体。
34.如图2所示,本发明实施例提供的步骤s101中,所述从植物基因组中分离靶标基因对应的基因序列,包括:
35.s201,dna模板、设计的引物、聚合酶、dntp、缓冲液以及mgcl2进行混合均匀,构成pcr体系;
36.s202,进行预变性和20~30次扩增温度循环,循环结束后,于65℃的条件下补齐并延伸处理15~30min后反应结束;
37.s203,反应结束后,进行靶标基因扩增处理,即可得到靶标基因对应的基因序列。
38.本发明实施例提供的缓冲液为t4 dna连接酶缓冲液,由500mm tris-hcl,8%的1,3-丙二醇,2.0mm dtt,5~20mmatp组成,ph 8.0。
39.本发明实施例提供的循环条件为:90℃预变性8~12min,85℃变性60sec,45℃退火25sec,65℃延伸20sec,循环20~30次。
40.如图3所示,本发明实施例提供的步骤s102中,所述构建质粒载体,包括:
41.s301,在质粒的启动子和终止子之间引入多克隆酶切位点;利用限制性内切酶,对质粒进行双酶切处理;
42.s302,将双酶切后的质粒,经1%的琼脂糖凝胶电泳分离后,切取目的条带,通过凝胶回收方法或凝胶回收试剂盒获得经过切除处理的的质粒;
43.s303,基于引入的酶切位点、限制性内切酶合成dna片段,将所述dna片段与已进行切除处理的质粒进行连接,并连接后的重组质粒利用热激法转化到大肠杆菌的感受态细胞中;
44.s304,将转化后的大肠杆菌平涂于含有卡那霉素的lb固体培养基上培养,挑取单独菌落进行菌落pcr鉴定,筛选含有重组质粒的阳性菌落;
45.s305,将阳性菌落经卡那霉素的lb液体培养基扩繁后,利用质粒提取方法提取重组质粒dna,即可构建得到质粒载体。
46.本发明实施例提供的将所述dna片段与已进行切除处理的质粒进行连接的方法为:利用t4-dna连接酶或质粒连接用试剂盒将所述dna片段与已进行切除处理的质粒进行连接。
47.本发明实施例提供的卡那霉素浓度为50mg/l。
48.如图4所示,本发明实施例提供的步骤s102中,所述质粒提取,包括:
49.s401,将含有目的质粒的大肠杆菌接种培养,得到大肠杆菌培养菌液,进行离心,去除上清液,得到大肠杆菌体沉淀;
50.s402,将大肠杆菌体沉淀加入菌体裂解试剂进行菌体裂解,得到呈半透明状裂解液,室温静置2~3min;
51.s403,向呈半透明状裂解液中加入杂质去除试剂,充分混合后,高速离心,取上清菌液,备用;
52.s404,将上清菌液上样层析柱,进行洗脱,收集含有质粒的洗脱液,重复洗脱四次,即可得提取的质粒。
53.本发明实施例提供的向呈半透明状裂解液中加入杂质去除试剂包括:按每1ml大肠杆菌培养菌液加入40~60μl杂质去除试剂的比例添加所述杂质去除试剂;其中,所述杂质去除试剂为乙酸﹑氯化钠的混合液。
54.本发明实施例提供的高速离心的条件为:设置高速离心机的离心速率为3000~4500转/分钟,离心分离时间为10~15min。
55.如图5所示,本发明实施例提供的步骤s103中,所述将含有靶标基因对象基因序列连接到构建的质粒载体上,构建含靶标基因的植物表达载体,包括:
56.s501,对构建的质粒载体进行双酶切;将酶切产物经1.0%琼脂糖凝胶电泳后分别回收目的基因片段以及酶切载体;
57.s502,将回收的质粒载体与含有靶标基因对象基因序列连接;挑取培养平板上生长良好的单菌落,在含有卡那霉素的lb液体培养基中振荡培养一段时间;
58.s503,取培养后的菌液进行pcr扩增,将pcr呈阳性的克隆在20~30ml含有50μg/ml卡那霉素的lb液体培养基中扩大培养;
59.s504,提取质粒,进行双酶切鉴定,利用0.8%琼脂糖凝胶电泳检测含有目的片段大小的条带,即为构建好的植物表达载体。
60.本发明实施例提供的振荡培养的方法包括:于35℃、180r/min的条件下振荡培养10~15h。
61.以上所述,仅为本发明较优的具体的实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1