一种病毒载体的物理滴度检测试剂盒及检测方法与流程
1.本发明涉及生物检测技术领域,尤其涉及一种病毒载体的物理滴度检测试剂盒及检测方法。
背景技术:
2.病毒的物理滴度是指病毒的颗粒数(virion particle),测定病毒载体的物理滴度可一定程度反映病毒生产的数量和质量。常用的病毒物理滴度检测方法有电镜法直接计数病毒颗粒数,elisa法检测病毒衣壳蛋白间接计算病毒颗粒数,或qpcr法绝对定量病毒基因组拷贝数并间接计算病毒颗粒数。
3.γ
‑
逆转录病毒载体是由逆转录病毒改造而来的复制缺陷型病毒,其无法通过常规的细胞病变法进行病毒滴度的测定,而通常采用病毒对细胞转导的能力作为逆转录病毒载体的滴度,即用逆转录病毒载体转导细胞(如外周血单个核细胞,pbmcs),检测转导的外源基因如外源t细胞受体(t cell receptor,tcr)的转导率,进而计算其转导滴度。由于转导滴度的检测流程较长(通常需6天以上),而逆转录病毒载体生产要求收获的病毒原液尽早冻存,不宜长时间存放于常温或4℃环境,因此目前常规法转导滴度的测定不利于逆转录病毒载体生产的快速质量放行。
4.商品化的逆转录病毒载体滴度测定试剂盒分为三个步骤:病毒基因组rna的提取、逆转录、qpcr反应,其中逆转录和qpcr反应通常使用一步法完成,即在一管体系中包含逆转录和qpcr反应的所有试剂,先后完成两步反应。但是该过程要求标准品性质为rna,而rna的保存条件较为苛刻。此外,病毒基因组rna提取的起始样品往往是病毒包装细胞的细胞上清液,在提取过程中需注意去除上清液中的病毒包装细胞基因组dna(包含有转录病毒基因组rna用的模板dna和病毒包装细胞残留dna),或在提取后通过额外步骤去除,这些dna若混杂在病毒基因组rna提取产物中会造成最终检测结果的偏差。因此,可以考虑将标准品制备为cdna形式,便于保存。
技术实现要素:
5.本发明所要解决的技术问题是目前商品化的病毒载体滴度测定试剂盒所用标准品的性质为rna,尤其是逆转录病毒载体,而rna的提取过程复杂且保存条件苛刻。
6.为了解决上述问题,本发明提出以下技术方案:
7.第一方面,本发明提供一种病毒载体的物理滴度检测试剂盒,包括引物对及探针;
8.所述引物对及探针的核苷酸序列如下所示,或与这些序列具有至少95%同一性的同功能序列;
9.primer
‑
f(seq id no 1):cgcctgcgtctgtactagttagc;
10.primer
‑
r(seq id no 2):gggattttaggactcaggtcgg;
11.probe(seq id no 3):cccggccgcaaccctgggagacg。
12.所述探针上连接有荧光基团;
13.所述病毒载体的核苷酸序列中包含有如seq id no 8所示的核苷酸序列。
14.其进一步地技术方案为,所述探针的荧光基团为fam,淬灭基团为nfq
‑
mgb。
15.其进一步地技术方案为,还包括qpcr反应缓冲液和dna提取试剂中的至少一种。
16.第二方面,本发明提供一种病毒载体的物理滴度检测方法,所述病毒载体的核苷酸序列中包含有如seq id no 8所示的核苷酸序列,所述检测方法包括以下步骤:
17.s1、将精确定量的所述病毒载体的rna标准品作逆转录,获得cdna标准品,梯度稀释后使用所述的病毒载体的物理滴度检测试剂盒进行qpcr反应,建立标准曲线;
18.s2、对初始待测样品以及初始阴性对照样品分别进行rna提取,获得rna提取产物;对rna提取产物依次进行初步dna去除反应、基因组dna去除反应及逆转录反应,得到qpcr反应用的待测样品及阴性对照样品;
19.s3、将所述待测样品及阴性对照样品的体积稀释预设倍数,使用所述的病毒载体的物理滴度检测试剂盒进行qpcr反应,得到检测值;
20.s4、根据所述检测值进行检测结果的有效性判定以及初始待测样品物理滴度的计算,最终获得初始待测样品的病毒载体的物理滴度;
21.所述初始待测样品为包含有如seq id no 8所示的核苷酸序列的病毒载体;
22.所述初始阴性对照样品为生产所述病毒载体时用的培养液;
23.其进一步地技术方案为,所述步骤s1中,将精确定量的所述病毒载体的rna标准品作逆转录,获得cdna标准品的操作具体包括:
24.s11、以所述病毒载体的质粒作为模板dna进行扩增,所述模板dna的5’端含有t7启动子以引导rna的体外转录,获得rna产物;
25.s12、对所述rna产物清除模板dna,进行纯化、精确定量其浓度,得到精确定量的rna标准品;
26.s13、将精确定量的rna标准品依次进行基因组dna去除反应及逆转录反应,获得cdna标准品;
27.扩增引物的核苷酸序列如下:
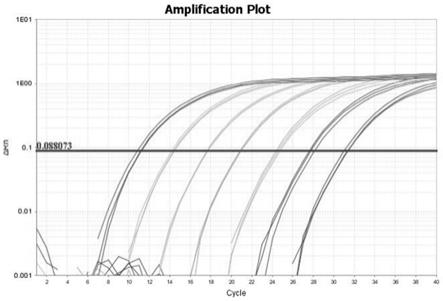
28.t7
‑
primer
‑
f(seq id no 4):
29.taatacgactcactatagggaagctggccagcggtcgt;
30.primer
‑
r(seq id no 5):cgcctagagaaggagtgagg。
31.其进一步地技术方案为,所述步骤s2、步骤s13中的逆转录反应用引物序列如下所示:
32.rt
‑
new
‑2‑
primer(seq id no 6):agagaaggagtgagggctgg。
33.其进一步地技术方案为,进行qpcr反应时,反应条件为:95℃预变性60s,然后95℃反应5s,60℃反应34s,反应40个循环。
34.与现有技术相比,本发明所能达到的技术效果包括:
35.本发明提供的病毒载体的物理滴度检测试剂盒,采用两步法qpcr反应进行绝对定量病毒基因组拷贝数并间接计算病毒颗粒数,试剂盒中的引物对含有如seq id no 8所示核苷酸序列的病毒载体具有良好的特异性,试剂盒对含有该种病毒载体的细胞制剂等产品的病毒载体的物理滴度检测具有通用性。
36.本发明提供的病毒载体的物理滴度检测方法,为两步法,标准品为cdna的形式,便
于保存,且检测过程中去除了样品包装细胞中的基因组dna,提高了检测结果的准确性。
附图说明
37.图1为本发明实施例中cdna标准品的荧光定量pcr标准曲线图;
38.图2为本发明实施例中cdna标准品的荧光扩增图。
具体实施方式
39.下面将对实施例中的技术方案进行清楚、完整地描述。显然,以下将描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.本发明提供的病毒载体的物理滴度检测试剂盒,其引物对包含有如seq id no 8所示的核苷酸序列的病毒载体具有良好的特异性。需要说明的是,本发明的引物对病毒对种类不做限定,可以是逆转录病毒,也可以是慢病毒,只要该病毒中包含有如seq id no 8所示的核苷酸序列即可被检测出。
41.msgv1质粒(msgv1
‑
1d3
‑
28z.l
‑
3mut载体质粒)中含有如seq id no 8所示的核苷酸序列,其常被用作逆转录病毒载体以生产细胞产品。因此,为便于说明,本发明以msgv1质粒的病毒载体为实施例对本发明的方案进行清楚完整的描述。
42.实施例1
43.本实施例提供的病毒载体的物理滴度检测试剂盒,包括引物对及探针。具体介绍如下:
44.1、引物对及探针
45.本发明所检测的病毒载体的基因组序列中含有如seq id no 8所示的核苷酸序列,其可来源于msgv1
‑
1d3
‑
28z.l
‑
3mut载体质粒。因此,本发明引物设计的靶序列可设置在msgv1载体的病毒元件序列上,具体地,其rna上包含两个病毒载体元件,包括嵌合mmlvψ(细分为mscv来源mesvψ及原始mmlvψ)和截短的gag片段。经过进一步的筛选,获得的对如seq id no 8所示的核苷酸序列具有良好特异性的具体的引物对及探针的核苷酸序列见表1:
46.表1:
47.48.2、标准品的制备
49.为了便于试剂盒中的标准品保存,本发明实施例所用标准品的形式为cdna。具体地,本实施例是以msgv1质粒为模板dna扩增,经rna体外转录再逆转录得到的。具体制备过程如下:
50.2.0试剂
51.msgv1
‑
1d3
‑
28z.1
‑
3mut病毒载体质粒(以下简称msgv1质粒),addgene,#107227;
52.ultrapure dnase/rnase
‑
free distilled water(以下简称ultrapure water),invitrogen;
53.2*hifitaq pcr starmix with loading dye,康润生物;
54.西班牙琼脂糖g10,by
‑
r0100;
55.50
×
tae buffer,genstar;
56.10000*gelred,us everbright;
57.dl2000 dna marker,takara;
58.e.z.n.a gel extraction kit,omega;
59.hiscribe t7 quick high yield rna synthesis kit,neb;
60.monarch rna cleanup kit,neb;
61.rl1000 rna marker,takara;
62.焦碳酸乙二酯(depc),生工生物;
63.10*mops电泳缓冲液,生工生物;
64.甲醛(37~40%)溶液,生工生物;
[0065]2×
rna甲酰胺凝胶上样缓冲液(含二甲苯青、溴酚蓝、eb、edta、sds),生工生物;
[0066]
quant
‑
it ribogreen rna reagent,invitrogen;
[0067]
primescript rt reagent with gdna eraser(perfect real time),takara;
[0068]
本发明实施例用0.1%depc水的配制:向800ml纯水中加入800μl depc,盖上瓶盖,颠倒混匀。在室温下放置2
‑
3h后在瓶盖外侧盖上锡箔纸,在放入高温灭菌器之前拧松瓶盖,121℃灭菌min。
[0069]
2.1dna模板的扩增
[0070]
以msgv1质粒为模板dna进行扩增,得到扩增产物。该模板dna的5’端含有t7启动子序列用以引导rna的体外转录,扩增用引物如下表3所示:
[0071]
表3
[0072][0073]
pcr反应体系如下表4所示(阴性对照为将质粒替换为等体积的水):
[0074]
表4
[0075][0076]
pcr反应程序如表5所示:
[0077]
表5
[0078][0079][0080]
2.2dna模板的纯化和鉴定
[0081]
将扩增后的pcr产物进行琼脂糖凝胶电泳、胶回收,经过双向测序确认胶回收后得到的dna模板序列与msgv1质粒的序列完全一致(去除引物及测序结果开头50bp左右后的序列应完全正确且测序锋图无杂峰)。正确的全长序列(seq id no 7)如下:
[0082]
taatacgactcactatagggaagctggccagcggtcgtttcgtgtctgtctctgtctttgtgcgtgtttgtgccggcatctaatgtttgcgcctgcgtctgtactagttagctaactagctctgtatctggcggacccgtggtggaactgacgagttcggaacacccggccgcaaccctgggagacgtcccagggacttcgggggccgtttttgtggcccgacctgagtcctaaaatcccgatcgtttaggactctttggtgcaccccccttagaggagggatatgtggttctggtaggagacgagaacctaaaacagttcccgcctccgtctgaatttttgctttcggtttgggaccgaagccgcgccgcgcgtcttgtctgctgcagcatcgttctgtgttgtctctgtctgactgtgtttctgtatttgtctgaaaatatgggcccgggctagcctgttaccactcccttaagtttgaccttaggtcactggaaagatgtcgagcggatcgctcacaaccagtcggtagatgtcaagaagagacgttgggttaccttctgctctgcagaatggccaacctttaacgtcggatggccgcgagacggcacctttaaccgagacctcatcacccaggttaagatcaaggtcttttcacctggcccgcatggacacccagaccaggtcccctacatcgtgacctgggaagccttggcttttgacccccctccctgggtcaagccctttgtacaccctaagcctccgcctcctcttcctccatccgccccgtctctcccccttgaacctcctcgttcgaccccgcctcgatcctccctttatccagccctcactccttctctaggcg
[0083]
其中:
[0084]
小写字母表示t7启动子,大写字母表示msgv1序列片段;
[0085]
2.3rna的体外转录
[0086]
2.3.1将得到的dna模板进行rna的体外转录,反应体系如下表6所示:
[0087]
表6
[0088][0089]
反应程序:37℃,2小时。
[0090]
2.3.2对得到的rna产物进行清除dna模板,反应体系如下表7所示:
[0091]
表7:
[0092][0093]
反应程序:37℃,15分钟。
[0094]
2.4对rna进行的纯化和鉴定,确定产物条带单一特异。
[0095]
2.5ribogreen法精确定量rna的浓度
[0096]
采用《quant
‑
it
tm picogreen
tm dsdna assay kit》试剂盒操作说明书精确测定样品基因组dna的浓度。
[0097]
2.6rna标准品的拷贝数浓度计算
[0098]
本发明实施例rna的长度为848nt,通过ribogreen精确定量可得rna的浓度c,代入下式计算拷贝数浓度:
[0099][0100]
其中:
[0101]
6.02
×
10
23
为阿伏伽德罗常数;
[0102]
340
×
109为rna单个核苷酸的平均分子质量。
[0103]
2.7逆转录
[0104]
使用《takara primescript rt reagent kit with gdna eraser(perfect real time)》试剂盒进行rna标准品的逆转录。
[0105]
2.7.1去除基因组dna反应
[0106]
按照下表8配制反应体系;
[0107]
表8:
[0108][0109]
反应条件:42℃,2分钟。
[0110]
2.7.2逆转录反应
[0111]
(1)对去除基因组dna后对产物进行逆转录反应,逆转录特异性引物序列如下表9所示。
[0112]
表9:
[0113][0114]
(2)按照下表10配制反应体系:
[0115]
表10:
[0116][0117]
反应条件:42℃,15min
→
85℃,5s
→
4℃。
[0118]
2.8cdna标准品的稀释
[0119]
由于起始的rna拷贝数为1
×
10
12
copies,cdna产物的总体积为20μl,因此cdna产物的等效rna拷贝数浓度为5
×
10
10
/μl。用ultrapure water将cdna稀释10倍,将此定义为cdna标准品(标准品stock),等效rna拷贝数浓度为5
×
109/μl。
[0120]
3、病毒载体的物理滴度检测
[0121]
3.1样品
[0122]
初始待检样品:含有如seq id no 8所示核苷酸序列的病毒载体(本实施例以基于msgv1
‑
1d3
‑
28z.1
‑
3mut病毒载体质粒经过将插入基因1d3
‑
28z.1
‑
3mut去除,并插入car基因后制备的质粒,利用pg13细胞包装成病毒载体);
[0123]
初始阴性对照样品:制备该种病毒载体时所用的d10培养液(dmem完全培养基)。
[0124]
cdna标准品(标准品stock):等效rna拷贝数浓度为5
×
109/μl。
[0125]
3.2试剂
[0126]
(1)takara minibest viral rna/dna extraction kit ver.5.0,takara;
[0127]
(2)recombinant dnase i(rnase
‑
free),takara;
[0128]
(3)recombinant rnase inhibitor(40u/μl),takara;
[0129]
(4)primescript rt reagent with gdna eraser(perfect real time),takara;
[0130]
(5)ultrapure dnase/rnase
‑
free distilled water,invitrogen(以下简称ultrapure water),invitrogen;
[0131]
(6)premix ex taq(probe qpcr),taqman探针法预混型试剂,takara;
[0132]
primer
‑
f、primer
‑
r和probe终浓度为10μm,rt
‑
new
‑2‑
primer终浓度为5μm。
[0133]
3.3检验过程
[0134]
3.3.1样品的处理
[0135]
病毒载体rna提取
[0136]
按照takara《takara minibest viral rna/dna extraction kit ver.5.0》试剂盒操作说明书开展实验。
[0137]
3.3.2dnase预处理(初步去除dna反应)
[0138]
按照takara《recombinant dnase i(rnase
‑
free)》说明书,按照表11配制以下反应体系:
[0139]
表11:dna去除反应体系
[0140][0141][0142]
反应条件:37℃,20分钟(dnase i消化)
→
75℃,10分钟(酶失活)
→
4℃。
[0143]
将初步dna去除反应产物分别命名为d
‑
dmem、d
‑
病毒载体。在本步骤中,病毒基因组rna相当于稀释2倍。
[0144]
3.3.3逆转录
[0145]
按照takara《primescript rt reagent kit with gdna eraser(perfect real time)》操作说明书进行。
[0146]
3.3.3.1基因组dna去除反应
[0147]
按照表12配制反应体系:
[0148]
表12:基因组dna去除反应体系
[0149][0150]
反应条件:42℃,2分钟。
[0151]
将基因组dna去除后反应产物分别命名为g
‑
dmem、g
‑
病毒载体。
[0152]
3.3.3.2逆转录反应
[0153]
按照表13配制反应体系。
[0154]
表13:反转录反应体系
[0155][0156]
反应条件:在pcr仪上,42℃,15min
→
85℃,5s
→
4℃。
[0157]
将逆转录反应后的cdna产物分别命名为c
‑
dmem、c
‑
病毒载体。
[0158]
本实施例中,通过逆转录(包括基因组dna去除反应和逆转录反应),dnase预处理(初步去除dna)的产物相当于稀释了5倍。
[0159]
3.4病毒载体的物理滴度检测(荧光定量pcr法)
[0160]
3.4.1qpcr反应液的配制见表14
‑
15
[0161]
表14:标准曲线或待测样品的反应体系配制
[0162][0163]
表15:质控样品反应体系配制
[0164][0165]
3.4.2样品的稀释
[0166]
分别将c
‑
dmem、c
‑
病毒载体进行10倍稀释,其中c
‑
dmem在无阳性样本操作区进行,c
‑
病毒载体可以和标准品同一个操作区进行。稀释后的产物命名为dmem稀释液、病毒载体
稀释液。
[0167]
3.4.3标准品的的稀释和标准曲线的制备
[0168]
(1)将病毒载体物理滴度检测的标准品cdna(标准品stock)从
‑
80℃冰箱取出,标准品的等效rna拷贝数浓度为5
×
109copies/μl。
[0169]
(2)按表16配制系列标准品
[0170]
表16:物理滴度检测系列标准品的配制
[0171][0172]
3.4.4质控样品用标准品的配制
[0173]
在本发明实施例的qpcr反应中,质控点中加入的标准品量为12000拷贝/反应。质控样品用标准品的制备如下:取30μl st5加入至120μl ultrapure water中,轻轻吹打混匀后,微型离心机快速离心10s,此时标准品浓度为4000copies/μl,即为质控样品用标准品。
[0174]
3.4.5上机检测
[0175]
设置反应程序,见表17:
[0176]
表17:qpcr反应程序
[0177][0178]
3.4.7结果分析
[0179]
本实施例的检测结果见图1、图2以及表18。
[0180]
表18:
[0181]
[0182][0183]
该实验结果同时满足以下条件,则实验结果有效:
[0184]
(1)标准曲线相关系数r2应≥0.99,扩增效率应介于90%~110%之间;
[0185]
(2)无模板阴性对照组(ntc)的ct值应为undetermined;
[0186]
(3)阴性对照组(ncs)的ct值应为undetermined;
[0187]
(4)同一浓度标准曲线点、质控样品和同一样品的ct值复孔之间的标准偏差应≤0.5;
[0188]
(5)质控点的回收率应介于80%~120%之间。
[0189]
3.4.8病毒载体物理滴度的计算
[0190]
上述qpcr反应中,若测定的病毒载体稀释液的物理滴度为c拷贝/反应孔,则初始待测样品的病毒物理滴度为:
[0191]
初始待测样品物理滴度
[0192]
其中:
[0193]
c:指病毒载体稀释液的检测值(拷贝/反应孔),“5”指病毒载体稀释液的上样体积是5μl/反应孔,c/5指病毒载体稀释液的拷贝数浓度(copies/μl);
[0194]“10”:指病毒载体原液稀释10倍后获得病毒载体稀释液;
[0195]“5”:指从dnase处理后的产物(8μl)到反转录产物(40μl),相当于将dnase处理后的产物稀释了5倍。
[0196]“2”:指在dnase处理过程中(12.5μl
→
25μl),将病毒rna稀释了2倍。
[0197]“200”:病毒载体原液经过核酸提取后,获得的洗脱液体积。
[0198]“2.5”:在进行病毒核酸提取时,使用的病毒载体原液体积为400μl,由于最终是测定每毫升病毒载体原液中病毒的颗粒数,因而将其转换为毫升时,需乘以2.5。
[0199]“1/2”:本实施例的病毒载体中每个病毒颗粒内含有2拷贝rna,而qpcr检测的是rna拷贝数,因而换算为病毒颗粒数时,需乘以1/2。
[0200]
将等式整理为:
[0201]
病毒载体原液物理滴度(vp/ml)=5000
×
c
[0202]
本实施例中,要求初始待测样品的病毒载体的物理滴度≥107vp/ml,则判定该批次生产的病毒载体物理滴度合格。否则,判定不合格。
[0203]
4、专属性(引物特异性)验证试验
[0204]
因本实施例中,病毒载体原液是由包装细胞phoenix
‑
eco细胞和pg13细胞培养生产而来,因此本次专属性验证的检测样本设置为:phoenix
‑
eco细胞基因组dna、pg13细胞基因组dna、dmem完全培养基。同时设置阳性对照:pmsgv质粒(基于msgv1
‑
1d3
‑
28z.1
‑
3mut病毒载体质粒,经过将插入基因1d3
‑
28z.1
‑
3mut去除,并插入car基因后制备的质粒)。将上述样品均进行荧光定量pcr检测。结果如下表19:
[0205]
表19专属性验证试验检测结果
[0206][0207][0208]
根据表19可知,除了阳性对照样本,其余样本均未检出,说明本发明提供的引物和探针不会在这些样本中发生非特异性反应。因此,本发明实施例提供的试剂盒对包含有如seq id no 8所示的核苷酸序列的病毒载体具有良好的特异性。
[0209]
5、准确度验证
[0210]
准备1批次dmem完全培养基,将dmem完全培养基的反转录产物(cdna)进行10倍稀释,得到cdna
‑
dmem稀释液,然后加标组设置如下:(1)高浓度加标样品:在cdna
‑
dmem稀释液中加入5
×
108拷贝/反应的标准品;(2)中浓度加标样品:在cdna
‑
dmem稀释液中加入5
×
105拷贝/反应的标准品;(3)低浓度加标样品:在cdna
‑
dmem稀释液中加入1
×
104拷贝/反应的标准品;每个样品需做三个复孔,进行qpcr检测,重复该实验三次,检测结果见下表20:
[0211]
表20:准确度验证实验结果
[0212]
[0213]
根据表20结果可知,在三次实验中,一批次dmem完全培养基的高中低浓度加标回收率均介于80%~120%之间,本发明的试剂盒及检测方法的准确度验证符合标准要求。
[0214]
6、精密度
[0215]
6.1批内和批间精密度
[0216]
准备3批次病毒载体,分别命名为病毒载体#1、病毒载体#2、病毒载体#3,将三批次病毒rna反转录产物及dmem培养基进行10倍稀释,每个样品需做三个复孔,进行qpcr检测,重复该实验三次,检测结果见下表21:
[0217]
表21:精密度验证结果
[0218][0219]
6.2中间精密度
[0220]
不同实验人员按照精密度验证的操作方法,重复操作该实验一次。比较不同实验人员的测定结果见下表22。
[0221]
表22:中间精密度验证结果
[0222][0223]
根据表21
‑
22的结果可知,在三次实验中,三批次样品的测定值的批内变异系数不超过20%、批间变异系数不超过20%。同一批次样品不同实验人员测定值变异系数不超过20%。因此,本发明提供的试剂盒和检测方法的精密度验证符合标准要求。
[0224]
综上,本发明提供的病毒载体的物理滴度检测试剂盒,采用两步法qpcr反应进行绝对定量病毒基因组拷贝数并间接计算病毒颗粒数,试剂盒中的引物对含有序列seq id no 8的病毒载体具有良好的特异性,该试剂盒对含有该种病毒载体的细胞制剂等产品的病毒载体的物理滴度检测具有通用性。本发明提供的病毒载体的物理滴度检测方法,为两步法,标准品为cdna的形式,便于保存,且检测过程中去除了样品包装细胞中的基因组dna,提高了检测结果的准确性。
[0225]
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详细描述
的部分,可以参见其他实施例的相关描述。
[0226]
以上所述,为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1