一种室温下利用酰胺与醇的酯化反应合成氨基甲酸酯类化合物的方法
1.本发明涉及一种合成氨基甲酸酯类化合物的方法,具体涉及一种利用酰胺与醇的酯化反应合成氨基甲酸酯类化合物的方法,属于氨基甲酸酯类化合物制备技术领域。
背景技术:
2.氨基甲酸酯类化合物作为一种重要的化合物,被广泛应用于化肥、农药、医药和精细化工产品中。传统的合成氨基甲酸酯类化合物的方法是利用异氰酸酯与醇的亲核加成反应合成。但由于异氰酸酯的剧毒性质、对环境不友好和底物受限,不符合可持续发展的需求。近年来,化学家们越来越倾向于温和条件下过渡金属催化的方法来合成氨基甲酸酯类化合物,以便增加合成产率及底物普适性。但是,这些已知反应往往底物有毒性、底物范围受限,并且需要高温及其它苛刻条件,无法广泛应用到工业生产中。室温下,直接利用没有毒性的酰胺和醇制备氨基甲酸酯类化合物的反应至今未见报道。
技术实现要素:
3.本发明提供了一种室温下利用酰胺与醇的酯化反应合成氨基甲酸酯类化合物的方法,可以高效地制备各种氨基甲酸酯类化合物。
4.本发明方法主要以各种铜盐、铜氧化物、负载纳米铜催化剂和均相/非均相钯催化剂为催化剂,空气中的氧气为氧化剂,在室温下,通过酰胺的c
‑
c键氧化断裂及醇的加成反应制备多种氨基甲酸酯衍生物,反应采用螯合辅助与c
‑
c键氧化断裂的联合策略,打破室温下酰胺不能通过c
‑
c键断裂直接和醇反应制备氨基甲酸酯类化合物的技术壁垒。
5.本发明方法所涉及的化学反应方程式如下:
[0006][0007]
利用酰胺与醇的酯化反应合成氨基甲酸酯类化合物的方法,包括如下步骤:
[0008]
(1)将酰胺、过渡金属催化剂、醇溶解于有机溶剂中得到混合液a;作为优选,所述酰胺、过渡金属催化剂、醇的摩尔比为1:0.02~0.5:1
‑
4。
[0009]
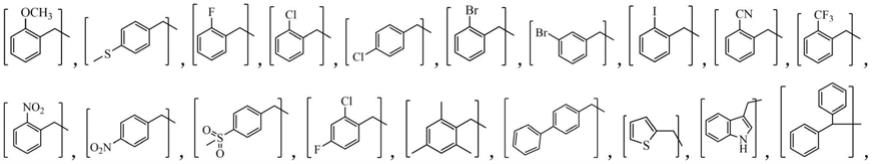
所述的酰胺为其中r为其中r为
(n=1,2,3,4,5,6);(n=1,2,3,4,5,6);(x=
‑
cn,
‑
no2,
‑
f,
‑
cl,
‑
br,
‑
i,
‑
oh,
‑
och3,
‑
oc2h5,
‑
sh,
‑
nh2,
‑
so3h,
‑
cooh,
‑
cooch3,
‑
cooc2h5,
‑
conh2,
‑
conhch3,
‑
coch3,
‑
coc2h5,
‑
cho);其中hetar为其中hetar为
[0010]
所述的过渡金属催化剂为氯化铜、硫酸铜、溴化亚铜、醋酸铜、碘化亚铜、氰化亚铜、氧化铜、氧化亚铜、负载纳米铜催化剂(cu/al2o3,cu/c,cu/mof
‑
5)或醋酸钯、三氟乙酸钯、氯化钯、四三苯基膦钯、负载纳米钯催化剂(pd/al2o3,pd/c,pd/mof
‑
5);
[0011]
所述的醇为r1oh,其中r1为(n=0,1,2,3,4,5,6),(n=0,1,2,3,4,5,6),(n=0,1,2,3,4,5,6),(n=0,1,2,3,4,5,6),(n=0,1,2,3,4,5,6),
[0012]
所述的有机溶剂为乙腈、二氯甲烷、二氯乙烷、四氢呋喃、甲苯、氯苯、三氯甲烷、n,n
‑
二甲基甲酰胺,二甲基亚砜;
[0013]
(2)将混合液a在室温下,搅拌1
‑
6小时,得到混合液b;
[0014]
步骤(2)中的反应,其反应时间并没有严格的限制,通过定时取样,用薄层色谱法(tlc)等现有手段进行跟踪分析,当其中一种原料或多种原料都反应完毕,视为反应的终点即可。
[0015]
(3)过滤混合液b,浓缩滤液,经柱层析,得到多种氨基甲酸酯类化合物。
[0016]
与现有技术相比,本发明具有如下有益效果:
[0017]
本发明方法通过酰胺与醇的酯化反应合成氨基甲酸酯类化合物,反应物均无需过量。与原有技术相比,无需异氰酸酯等剧毒或毒性物质作为反应底物,直接利用常见的、无毒性酰胺为底物。在室温下,以空气中的氧气为氧化剂,本发明方法实现了酰胺的化学专一性c
‑
c键断裂进而与醇发生酯化反应得到了多种氨基甲酸酯类化合物。反应条件温和、操作简单、时间短、产率高,适用于在工业生产中应用。
具体实施方式
[0018]
实施例1
[0019]
本实施例通过n
‑
(3
‑
甲基吡啶
‑2‑
基)
‑2‑
萘乙酰胺与乙醇的酯化反应制备乙基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯。
[0020]
将0.1mmol n
‑
(3
‑
甲基吡啶
‑2‑
基)
‑2‑
萘乙酰胺、0.01mmol氯化铜、0.2mmol乙醇溶解于1ml二氯甲烷中,将得到的反应混合液在室温下搅拌6小时;过滤所得到的混合液,浓缩滤液,经柱层析,即可得到乙基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯,产率约为73%。
[0021]
核磁监测数据如下:1hnmr(600mhz,cdcl3)δ8.27(d,j=4.2hz,1h),7.54(d,j=7.4hz,2h),7.06(dd,j=7.4,4.9hz,1h),4.22(q,j=7.1hz,2h),2.30(s,3h),1.31(t,j=7.1hz,3h);
13
cnmr(151mhz,cdcl3)δ153.9,149.6,145.8,139.9,127.1,121.0,61.5,18.0,14.5.
[0022]
实施例2
[0023]
本实施例通过n
‑
(3
‑
甲基吡啶
‑2‑
基)
‑
2,2
‑
二苯基乙酰胺与甲醇的酯化反应制备甲基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯。
[0024]
将0.5mmoln
‑
(3
‑
甲基吡啶
‑2‑
基)
‑
2,2
‑
二苯基乙酰胺、0.05mmol醋酸钯、1mmol甲醇溶解于2ml乙腈中,将得到的反应混合液搅拌6小时;过滤所得到的混合液,浓缩滤液,经柱层析,即可得到甲基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯,产率约为59%。
[0025]
核磁监测数据如下:1hnmr(600mhz,cdcl3)δ8.26(d,j=4.1hz,1h),7.54(d,j=7.5hz,1h),7.37(s,1h),7.07(dd,j=7.4,4.9hz,1h),3.78(s,3h),2.30(s,3h);
13
c nmr(151mhz,cdcl3)δ154.3,149.4,145.8,139.9,127.0,121.1,52.6,17.9.
[0026]
实施例3
[0027]
本实施例通过n
‑
(3
‑
甲基吡啶
‑2‑
基)
‑
2,2
‑
二苯基乙酰胺与肉桂醇的酯化反应制备肉桂基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯。
[0028]
将0.1mmoln
‑
(吡啶
‑2‑
基)
‑
2,2
‑
二苯基乙酰胺、0.005mmol醋酸铜、0.1mmol肉桂醇溶解于1ml二氯乙烷中,将得到的反应混合液在室温下搅拌2小时;过滤所得到的混合液,浓缩滤液,经柱层析,即可得到肉桂基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯,产率约为87%。
[0029]
核磁监测数据如下:1h nmr(600mhz,cdcl3)δ8.28(s,1h),7.53(d,j=7.5hz,2h),7.39(d,j=7.4hz,2h),7.32(t,j=7.6hz,2h),7.26(t,j=7.3hz,1h),7.06(dd,j=7.3,4.9hz,1h),6.68(d,j=15.9hz,1h),6.36
‑
6.29(m,1h),4.83(d,j=6.4hz,2h),2.30(s,3h);
13
c nmr(151mhz,cdcl3)δ153.6,149.4,145.9,139.9,136.3,134.20,128.6,128.1,127.0,126.7,123.4,121.1,66.0,18.0.
[0030]
实施例4~13
[0031]
实施例4~13中均利用实施例3的反应条件以及物料配比,仅改变酰胺以及醇的种类,各实施例中所用的原料和所得到的产物及产物收率参见表1。
[0032]
表1
[0033][0034][0035]
实施例4~13中目标产物的核磁监测数据如下:
[0036]
实施例4:正己基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0037]1h nmr(600mhz,cdcl3)δ8.27(d,j=4.2hz,1h),7.54(d,j=7.4hz,2h),7.06(dd,j=7.4,4.9hz,1h),4.16(t,j=6.8hz,2h),2.30(s,3h),1.69
‑
1.61(m,2h),1.41
‑
1.34(m,2h),1.33
‑
1.27(m,4h),0.89(t,j=6.8hz,3h);
13
c nmr(151mhz,cdcl3)δ154.0,149.6,145.8,139.8,127.1,121.0,65.7,31.5,28.9,25.5,22.6,18.0,14.0.
[0038]
实施例5:苄基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0039]1h nmr(600mhz,cdcl3)δ8.23(d,j=3.4hz,1h),7.65(s,1h),7.52(d,j=7.5hz,1h),7.41
‑
7.31(m,5h),7.03(dd,j=7.4,4.7hz,1h),5.20(s,2h),2.28(s,3h);
13
c nmr(151mhz,cdcl3)δ153.6,149.4,145.9,139.9,136.1,128.6,128.3,128.3,127.0,121.1,67.3,18.0.
[0040]
实施例6:吡啶
‑2‑
甲基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0041]1h nmr(600mhz,cdcl3)δ8.60(d,j=4.6hz,1h),8.27(d,j=4.1hz,1h),7.70(t,j=6.9hz,1h),7.54(d,j=7.4hz,1h),7.41(d,j=7.8hz,1h),7.24(dd,j=7.3,5.0hz,1h),7.06(dd,j=7.5,4.9hz,1h),5.33(s,2h),2.31(s,3h);
13
c nmr(151mhz,cdcl3)δ156.0,153.4,149.4,149.3,145.9,139.8,136.8,126.9,122.9,121.9,121.2,67.7,17.9
[0042]
实施例7:异丁基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0043]1h nmr(600mhz,cdcl3)δ8.27(d,j=4.2hz,1h),7.54(d,j=7.4hz,1h),7.36(s,1h),7.06(dd,j=7.4,4.9hz,1h),4.88
‑
4.80(m,1h),2.30(s,3h),1.70
‑
1.62(m,1h),1.61
‑
1.53(m,1h),1.27(d,j=6.3hz,3h),0.93(t,j=7.5hz,3h);
13
c nmr(151mhz,cdcl3)δ153.6,149.6,145.8,139.8,127.0,121.0,73.6,29.0,20.0,18.0,9.7.
[0044]
实施例8:环己基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0045]1h nmr(600mhz,cdcl3)δ8.27(d,j=4.2hz,1h),7.54(d,j=7.4hz,1h),7.48(s,j=65.9hz,1h),7.06(dd,j=7.5,4.9hz,1h),4.78
‑
4.69(m,1h),2.30(s,3h),1.97
‑
1.91(m,2h),1.76
‑
1.70(m,2h),1.58
‑
1.52(m,1h),1.49
‑
1.42(m,2h),1.41
‑
1.34(m,2h),1.29
‑
1.22(m,1h);
13
cnmr(151mhz,cdcl3)δ153.4,149.7,145.7,139.9,127.2,121.0,74.0,31.9,25.4,23.8,18.0.
[0046]
实施例9:二(4
‑
氯苯基)甲基(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0047]1h nmr(600mhz,cdcl3)δ8.24(d,j=3.3hz,1h),7.94(s,1h),7.55(d,j=6.9hz,1h),7.29(d,j=8.5hz,4h),7.24(d,j=8.5hz,4h),7.07(dd,j=7.3,4.9hz,1h),6.80(s,1h),2.26(s,3h);
13
c nmr(151mhz,cdcl3)δ152.6,149.2,145.8,140.0,138.3,134.0,128.8,128.7,128.5,127.9,127.3,121.4,76.7,17.9.
[0048]
实施例10:橙花醇
‑
(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0049]1h nmr(600mhz,cdcl3)δ8.26(d,j=4.1hz,1h),7.54(d,j=7.4hz,1h),7.06(dd,j=7.3,4.9hz,1h),5.41(t,j=7.1hz,1h),5.10(t,j=6.8hz,1h),4.66(d,j=7.2hz,2h),2.29(s,3h),2.17
–
2.11(m,2h),2.11
–
2.05(m,2h),1.78(s,3h),1.68(s,3h),1.60(s,3h);
13
c nmr(151mhz,cdcl3)δ153.7,149.5,145.8,142.7,139.8,132.2,126.8,123.6,121.0,119.3,62.1,32.2,26.7,25.7,23.5,18.0,17.7
[0050]
实施例11:冰片醇
‑
(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0051]1h nmr(600mhz,cdcl3)δ8.26(d,j=4.2hz,1h),7.55(d,j=7.4hz,1h),7.07(dd,j=7.4,4.9hz,1h),4.93(d,j=9.5hz,1h),2.41
‑
2.34(m,1h),2.32(s,3h),1.93
‑
1.86(m,1h),1.79
‑
1.71(m,1h),1.68(t,j=4.4hz,1h),1.33
‑
1.22(m,2h),1.11(dd,j=13.8,3.3hz,1h),0.91(s,3h),0.88(s,6h);
13
c nmr(151mhz,cdcl3)δ154.2,149.5,145.6,139.9,127.4,121.1,81.2,48.9,47.9,44.9,36.7,28.1,27.1,19.8,18.9,18.1,13.6
[0052]
实施例12:薄荷醇
‑
(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0053]1h nmr(600mhz,cdcl3)δ8.25(d,j=4.2hz,1h),7.54(d,j=7.3hz,1h),7.06(dd,j=7.4,4.9hz,1h),4.66(td,j=10.9,4.4hz,1h),2.30(s,3h),2.11(d,j=11.9hz,1h),2.02
‑
1.91(m,1h),1.74
‑
1.62(m,2h),1.55
‑
1.43(m,1h),1.42
‑
1.32(m,1h),1.12
‑
1.00(m,2h),0.95
‑
0.88(m,7h),0.80(d,j=6.9hz,3h);
13
c nmr(151mhz,cdcl3)δ153.4,149.6,145.7,139.9,127.1,121.0,75.5,47.4,41.3,34.3,31.4,26.3,23.6,22.1,20.8,18.0,16.5.
[0054]
实施例13:胆固醇
‑
(3
‑
甲基吡啶
‑2‑
基)氨基甲酸酯
[0055]1h nmr(600mhz,cdcl3)δ8.25(d,j=3.5hz,1h),7.55(d,j=7.2hz,1h),7.10
‑
7.01(m,1h),5.39(s,1h),4.65
‑
4.55(m,1h),2.48
‑
2.40(m,1h),2.39
‑
2.32(m,1h),2.31(s,3h),2.04
‑
1.92(m,3h),1.91
‑
1.79(m,2h),1.67
‑
1.41(m,8h),1.40
‑
1.30(m,3h),1.29
‑
1.22(m,2h),1.18
‑
1.05(m,7h),1.03(s,3h),1.01
‑
0.95(m,2h),0.92(d,j=6.4hz,3h),0.86(dd,j=6.5,2.4hz,6h),0.68(s,3h);
13
c nmr(151mhz,cdcl3)δ153.1,149.5,145.6,139.9,139.7,127.0,122.7,121.0,75.4,56.7,56.2,50.1,42.3,39.8,39.5,38.4,37.0,36.6,36.2,35.8,31.9,31.9,28.2,28.0,24.3,23.9,22.8,22.6,21.1,19.4,18.7,18.0,11.9.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1