抗HMMW抗体、包含该抗体的组合物、编码该抗体的核酸分子及其用途的制作方法
抗hmmw抗体、包含该抗体的组合物、编码该抗体的核酸分子及其用途
技术领域
1.本公开涉及抗hmmw抗体,包含所述抗体的组合物,编码所述抗体的核酸分子,以及所述抗体或所述组合物或所述核酸分子的用途。
背景技术:
2.这部分的陈述仅提供与本公开有关的背景信息,而不必然地构成现有技术。
3.长链非编码rna(long non-coding rna;lncrna)是一类转录本长度超过200nt的rna分子,通常认为lncrna并不编码蛋白,但能以rna的形式与蛋白、dna和rna相互作用,在表观遗传修饰(染色质重构和修饰、dna/rna甲基化)、转录水平(结合转录因子)和转录后水平(rna剪切、mrna稳定和翻译、作为cerna)等方面调控基因的表达。2011年通过对核糖体保护片段的深度测序,已经有科学家惊奇地发现lncrna可能翻译小的短肽,但受限于转录组测序技术和分析方法的的深度和准确性,国际上对非编码rna包含具有编码能力的开放阅读框争议很大。2015年德克萨斯大学西南医学中心的eric olson教授团队发现一条在骨骼肌中特异性表达的lncrna,其能编码一种包含46个氨基酸的微肽myoregulin(mln),研究发现mln在心肌细胞钙稳态的调节中发挥重要作用。2016年,eric olson实验室在science上报道了另一条由lncrna编码的微肽dworf,其在小鼠心脏中高表达,能调控肌肉的收缩。近几年,国际上陆续有科学家发现由lncrna编码的微肽,主要参与调节肌肉形成、氨基酸代谢、mrna转录后修饰、黏膜免疫等重要生理或病理过程,证实lncrna确实能编码新的功能性微肽。然而,鲜有在肿瘤中发现由lncrna编码的微肽的报道。众所周知,非编码rna占人类基因组所转录的总rna比例高达90%以上,其中85%是lncrnas。因此,结合多组学技术和体内外模型交叉验证,在肿瘤中找到由lncrna编码的微肽,揭示其在肿瘤中的具体作用和机制,并针对性地开发新的药物,对于肿瘤的治疗意义重大。
4.头颈部肿瘤是全球第七大恶性肿瘤,主要包括耳鼻喉科肿瘤(喉癌、鼻咽癌、副鼻窦癌)以及口腔颌面部肿瘤(舌癌、牙龈癌、颊癌)等。其中90%以上属于鳞状细胞癌(head and neck squamous cell carcinoma,hnscc),每年新发病例超过83万,死亡病例超过43万,中国新发病例数约占其中的1/5。目前临床头颈癌常用的治疗手段仍是手术和放化疗的合并治疗,但治疗效果不尽人意,靶向治疗药物主要是egfr(epidermal growth factor receptor,表皮生长因子受体)抑制剂,由于治疗后期易产生耐药性严重制约临床疗效,头颈癌患者的5年生存率仅为50%。因此,发现新的生物标志物和靶点进行药物开发对于提高头颈鳞癌的治疗效果具有重要意义。
5.肾细胞癌(renal cell carcinoma,rcc,简称肾癌)是起源于肾实质泌尿小管上皮的恶性肿瘤,占成人恶性肿瘤的2%-3%,最常见的为透明细胞癌,其次为乳头状肾细胞癌及嫌色细胞癌,以及集合管癌等少见类型的肾细胞癌。作为泌尿系统三大肿瘤之一,肾癌发病率仅次于前列腺癌和膀胱癌,但死亡率高居三大肿瘤之首。全球肾癌发病目前排在男性恶性肿瘤第9位(21.4万例新发患者)及女性第14位(12.4万例新患者),2018年2月国家癌症
中心发布最新癌症数据显示中国肾癌发病率为4.99/10万,其中男性肾癌发病率为6.09/10万,女性肾癌发病率为3.84/10万。由于肾脏位置隐蔽,早期临床症状不明显,且缺少公认的诊断标记物,超过30%的肾癌患者初诊时已发展到晚期,错过最佳手术根治的时机,因此寻找肾癌特异性诊断标志物,是提高临床早期诊出率进行及时治疗的必然要求。
6.前列腺癌(prostate adenocarcinoma)是指发生在前列腺的上皮性恶性肿瘤,包括腺癌、导管腺癌、尿路上皮癌、鳞状细胞癌、腺鳞癌,其中前列腺腺癌占95%以上,前列腺癌早期没有症状,出现症状往往已经有局部侵犯或远处转移,病灶波及尿道、膀胱、三角区,可引起排尿困难;远处转移时可出现腰痛、血尿、消瘦和乏力。近年来前列腺癌发病率有急剧增长趋势,2020年,前列腺癌仅次于肺癌,成为男性恶性肿瘤发病率位居第二。前列腺癌临床诊断主要依靠直肠指诊、血清psa(前列腺特异抗原)、经直肠前列腺超声和盆腔mri检查,确诊前需要通过前列腺穿刺活检进行病理检查。早期和中期患者以手术治疗和放疗为主,晚期患者以内分泌治疗为主,与西方发达国家比较,我国患者的初诊晚期前列腺癌发病率更高,晚期前列腺癌的预后较差,也是治疗的难点,在前列腺癌中发现新的诊断标志物和治疗药物对于获得良好的预后非常重要。
7.结直肠癌或大肠癌(colon and rectum carcinoma)是指发生于结肠或直肠粘膜上皮的恶性肿瘤,包括结肠癌和直肠癌,由于二者的发病机理、诊疗原则相似,医学上合并统称为结直肠癌。从目前临床治疗上的情况看,随着城市化程度提高,生活方式及饮食结构的改变,鸡鸭鱼肉等高热量、高脂肪、高蛋白食物摄入增多,以及人口老龄化进程,结直肠肿瘤高发的问题将越来越突出,城市大肠癌的发病率是第2-3位,40岁以下的年轻人患结直肠癌的比例约占结直肠癌总人数的20%,而且有进一步上升的趋势。中国已进入结直肠癌高发地区的行列,结直肠癌高发病率、高死亡率日益严重威胁着人们的身心健康,所以大肠癌的防治形势很严峻。
技术实现要素:
8.本公开提供了一种特异性地结合人hmmw微肽的抗体,其包含含有互补决定区cdrh1、cdrh2和cdrh3的重链可变区以及含有互补决定区cdrl1、cdrl2和cdrl3的轻链可变区,其中:
9.(a)cdrh1具有seq id no:1,11,21,31,41,51,61或71所示的氨基酸序列;
10.(b)cdrh2具有seq id no:2,12,22,32,42,52,62或72所示的氨基酸序列;
11.(c)cdrh3具有seq id no:3,13,23,33,43,53,63或73所示的氨基酸序列;
12.(d)cdrl1具有seq id no:4,14,24,34,44,54,64或74所示的氨基酸序列;
13.(e)cdrl2具有seq id no:5,15,25,35,45,55,65或75所示的氨基酸序列;且
14.(f)cdrl3具有seq id no:6,16,26,36,46,56,66或76所示的氨基酸序列。
15.本公开还提供了一种药物组合物,其包含如本公开所述的抗体以及药学上可接受的载体。
16.本公开还提供了一种核酸分子,其包含编码如本公开所述的抗体的核苷酸序列。
17.本公开还提供了本公开所述的抗体或药物组合物或核酸分子在制造用于治疗结直肠癌的药物中的用途。
18.本公开还提供了本公开所述的抗体或药物组合物或核酸分子在制造用于诊断头
颈鳞癌、肾癌、前列腺癌和结直肠癌的试剂盒中的用途。
附图说明
19.以下提供附图的简要说明,其用于说明本文所公开的示例性实施方式,而不是为了限制这些实施方式。
20.图1示出了hmmw微肽的sds-page电泳检测结果。
21.图2示出了hmmw微肽的hplc检测结果。
22.图3示出了抗hmmw-1抗体、抗hmmw-2抗体、抗hmmw-3抗体、抗hmmw-4抗体、抗hmmw-5抗体、抗hmmw-6抗体、抗hmmw-7抗体、抗hmmw-8抗体与固定量的hmmw微肽的western blot检测结果。
23.图4示出了抗hmmw-1抗体、抗hmmw-2抗体、抗hmmw-3抗体、抗hmmw-4抗体、抗hmmw-5抗体、抗hmmw-6抗体、抗hmmw-7抗体、抗hmmw-8抗体与头颈鳞癌cal27细胞、肾癌786-o细胞、前列腺癌du145细胞和结直肠癌hct116细胞中表达的hmmw微肽的western blot检测结果。
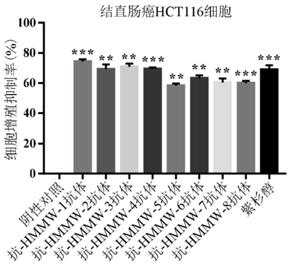
24.图5示出了抗hmmw-1抗体、抗hmmw-2抗体、抗hmmw-3抗体、抗hmmw-4抗体、抗hmmw-5抗体、抗hmmw-6抗体、抗hmmw-7抗体、抗hmmw-8抗体对结直肠癌细胞hct116的增殖抑制作用。
25.图6示出了抗hmmw-1抗体、抗hmmw-2抗体、抗hmmw-3抗体、抗hmmw-4抗体、抗hmmw-5抗体、抗hmmw-6抗体、抗hmmw-7抗体、抗hmmw-8抗体对结直肠癌细胞hct116的迁移抑制作用。
具体实施方式
26.除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。
27.在本文中使用时,表述“a和/或b”包括三种情况:(1)a;(2)b;以及(3)a和b。
28.术语“同一性”指的是一对序列(核苷酸或氨基酸)之间的相似性程度。同一性是通过将相同的残基数除以残基的总数,并且将商乘以100以获得百分比从而进行测定的。评价同一性时缺口不计算在内。因此,完全相同的序列的两个拷贝具有100%的同一性,但是具有缺失、添加或置换的序列可能具有较低程度的同一性。本领域技术人员将认识到有几种计算机程序可以用于确定序列的同一性,例如那些采用诸如blast之类的算法的程序。blast核苷酸搜索是使用nblast程序进行的,并且blast蛋白质搜索是利用blastp程序进行的,其中使用了各程序的默认参数。
29.两个不同的序列可以彼此不同,而不影响由该序列编码的蛋白质的整体功能。在这方面,本领域公知的是化学上相似的氨基酸可以相互取代,通常功能不会发生改变。相关性质可以包括酸性/碱性、极性/非极性、电荷、疏水性和化学结构。例如,碱性残基lys和arg被认为是化学上相似的,并且经常互相取代,还有的例子是酸性残基asp和glu、羟基残基ser和thr、芳香族残基tyr、phe和trp以及非极性残基ala、val、ile、leu和met。这些置换被认为是“保守的”。相似地,核苷酸密码子和可接受的变化在本领域中也是已知的。例如,密码子act、acc、aca和acg都编码氨基酸苏氨酸,即第三个核苷酸可以在不改变所得到的氨基酸的情况下进行变化。相似性是通过将相似的残基数除以残基的总数,并且将商乘以100以
获得百分比从而进行测定的。注意,相似性和同一性测量不同的性质。
30.如本文所用,术语“药物组合物”是指本公开的抗体与其它化学组分例如载体、稳定剂、稀释剂、分散剂、悬浮剂、增稠剂和/或赋形剂的混合物。药物组合物有助于将该抗体施用至生物体。本领域中存在施用抗体的多种技术,包括但不限于:静脉内、经口、气雾剂、肠胃外、眼部、肺部和局部施用。
31.术语“药学上可接受的载体”包括药学上可接受的盐、药学上可接受的材料、组合物或载体,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或封装材料,其涉及在受试者内携带或输送本公开的抗体或携带或输送本公开的抗体至受试者,使得其可以执行其预期功能。每种盐或载体在与制剂的其它成分相容的意义上必须是“可接受的”,并且不对受试者有害。可以用作药学上可接受的载体的材料的一些实例包括:糖,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;粉末黄蓍胶;麦芽;明胶;滑石;赋形剂,例如可可脂和栓剂蜡类;油,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇类,例如丙二醇;多元醇,例如甘油、山梨醇、甘露醇和聚乙二醇;酯类,例如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,例如氢氧化镁和氢氧化铝;藻酸;无热原水;等渗盐水;林格氏溶液;乙醇;磷酸盐缓冲溶液;稀释剂;造粒剂;润滑剂;粘合剂;崩解剂;润湿剂;乳化剂;着色剂;脱模剂;涂层剂;甜味剂;调味剂;加香剂;防腐剂;抗氧化剂;增塑剂;胶凝剂;增稠剂;硬化剂;定型剂;悬浮剂;表面活性剂;保湿剂;载体;稳定剂;和在药物制剂中使用的其它无毒的相容性物质,或其任何组合。
32.术语“抗体”是免疫系统用来识别靶抗原的蛋白质。抗体的基本功能单位是免疫球蛋白单体。单体由形成y形蛋白质的两个相同的重链和两个相同的轻链构成。每条轻链由一个恒定域(constant domain)和一个可变域(variable domain)组成。对于轻链,恒定域也可以被称为“恒定区(constant region)”,而可变域也可以被称为“可变区(variable region)”。每条重链由一个可变域和三个或四个恒定域组成。对于重链,恒定域一起被称为“恒定区”,而可变域也可以被称为“可变区”。y的臂被称为片段,抗原结合(fab)区,每个臂被称为fab片段。每个fab片段由来自重链的一个恒定域和一个可变域、以及来自轻链的一个恒定域和一个可变域组成。y的基部称为fc区,由来自每个重链的两个或三个恒定域组成。在fab区中的重链和轻链的可变域是抗体的结合抗原(如本公开中的hmmw)的部分。更具体地,可变域的互补决定区(cdr)结合它们的抗原(如hmmw)。在每个可变域的氨基酸序列中,有非连续的三个cdr。术语“完整”在本文中用于指包含fab区和fc区的抗体。
33.本文所用的“抗体重链”是指以其天然存在的构象存在于抗体分子中的两种类型多肽链中的较大者,并且其通常决定抗体所属的类别。
34.本文所用的“抗体轻链”是指以其天然存在的构象存在于抗体分子中的两种类型多肽链中的较小者。κ和λ轻链是指两种主要的抗体轻链同种型。
35.目前,有关微肽在头颈癌、肾癌、前列腺癌和结直肠癌中的检测和治疗方面的研究仍是空白。本发明人利用转录组测序数据分析、蛋白质组学、crispr/cas9基因编辑、体内转译等手段建立了微肽发现技术平台,发现了由lncrna编码的微肽hmmw。通过对hmmw表达差异的肿瘤谱进行筛选分析,发现hmmw在头颈鳞癌、肾癌和前列腺癌组织中的表达水平显著低于癌旁组织,而在结直肠癌组织中的表达水平显著高于癌旁组织。在此基础上,开发得到了特异性结合hmmw微肽的单克隆抗体,其能够用于头颈鳞癌、肾癌、前列腺癌和结直肠癌的
检测,并且为结直肠癌的治疗提供了新方案。本公开的抗hmmw抗体能够与不同肿瘤细胞(包括但不限于头颈鳞癌、肾癌、前列腺癌和结直肠癌细胞)中的hmmw特异性结合,灵敏地检测细胞中hmmw微肽的表达,从而有效地用于多种癌症的诊断。此外,本公开的抗hmmw抗体不仅显著抑制了结直肠癌细胞的增殖,而且显著抑制了结直肠癌细胞的迁移。
36.在一些实施方式中,本公开涉及一种特异性地结合人hmmw微肽的抗体,其包含含有互补决定区cdrh1、cdrh2和cdrh3的重链可变区以及含有互补决定区cdrl1、cdrl2和cdrl3的轻链可变区,其中:
37.(a)cdrh1具有seq id no:1,11,21,31,41,51,61或71所示的氨基酸序列;
38.(b)cdrh2具有seq id no:2,12,22,32,42,52,62或72所示的氨基酸序列;
39.(c)cdrh3具有seq id no:3,13,23,33,43,53,63或73所示的氨基酸序列;
40.(d)cdrl1具有seq id no:4,14,24,34,44,54,64或74所示的氨基酸序列;
41.(e)cdrl2具有seq id no:5,15,25,35,45,55,65或75所示的氨基酸序列;且
42.(f)cdrl3具有seq id no:6,16,26,36,46,56,66或76所示的氨基酸序列。
43.在一些实施方式中,本公开涉及一种特异性地结合人hmmw微肽的抗体,其包含含有互补决定区cdrh1、cdrh2和cdrh3的重链可变区以及含有互补决定区cdrl1、cdrl2和cdrl3的轻链可变区,其中:
44.(1)cdrh1具有seq id no:1所示的氨基酸序列,cdrh2具有seq id no:2所示的氨基酸序列,cdrh3具有seq id no:3所示的氨基酸序列,cdrl1具有seq id no:4所示的氨基酸序列,cdrl2具有seq id no:5所示的氨基酸序列,且cdrl3具有seq id no:6所示的氨基酸序列;或者
45.(2)cdrh1具有seq id no:11所示的氨基酸序列,cdrh2具有seq id no:12所示的氨基酸序列,cdrh3具有seq id no:13所示的氨基酸序列,cdrl1具有seq id no:14所示的氨基酸序列,cdrl2具有seq id no:15所示的氨基酸序列,且cdrl3具有seq id no:16所示的氨基酸序列;或者
46.(3)cdrh1具有seq id no:21所示的氨基酸序列,cdrh2具有seq id no:22所示的氨基酸序列,cdrh3具有seq id no:23所示的氨基酸序列,cdrl1具有seq id no:24所示的氨基酸序列,cdrl2具有seq id no:25所示的氨基酸序列,且cdrl3具有seq id no:26所示的氨基酸序列;或者
47.(4)cdrh1具有seq id no:31所示的氨基酸序列,cdrh2具有seq id no:32所示的氨基酸序列,cdrh3具有seq id no:33所示的氨基酸序列,cdrl1具有seq id no:34所示的氨基酸序列,cdrl2具有seq id no:35所示的氨基酸序列,且cdrl3具有seq id no:36所示的氨基酸序列;或者
48.(5)cdrh1具有seq id no:41所示的氨基酸序列,cdrh2具有seq id no:42所示的氨基酸序列,cdrh3具有seq id no:43所示的氨基酸序列,cdrl1具有seq id no:44所示的氨基酸序列,cdrl2具有seq id no:45所示的氨基酸序列,且cdrl3具有seq id no:46所示的氨基酸序列;或者
49.(6)cdrh1具有seq id no:51所示的氨基酸序列,cdrh2具有seq id no:52所示的氨基酸序列,cdrh3具有seq id no:53所示的氨基酸序列,cdrl1具有seq id no:54所示的氨基酸序列,cdrl2具有seq id no:55所示的氨基酸序列,且cdrl3具有seq id no:56所示
的氨基酸序列;或者
50.(7)cdrh1具有seq id no:61所示的氨基酸序列,cdrh2具有seq id no:62所示的氨基酸序列,cdrh3具有seq id no:63所示的氨基酸序列,cdrl1具有seq id no:64所示的氨基酸序列,cdrl2具有seq id no:65所示的氨基酸序列,且cdrl3具有seq id no:66所示的氨基酸序列;或者
51.(8)cdrh1具有seq id no:71所示的氨基酸序列,cdrh2具有seq id no:72所示的氨基酸序列,cdrh3具有seq id no:73所示的氨基酸序列,cdrl1具有seq id no:74所示的氨基酸序列,cdrl2具有seq id no:75所示的氨基酸序列,且cdrl3具有seq id no:76所示的氨基酸序列。
52.在一些实施方式中,所述抗体的重链可变区包含seq id no:7,17,27,37,47,57,67或77所示的氨基酸序列或者与seq id no:7,17,27,37,47,57,67或77所示的氨基酸序列具有至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.5%的序列同一性的氨基酸序列。在一些实施方式中,所述抗体的重链可变区的氨基酸序列如seq id no:7,17,27,37,47,57,67或77所示。
53.在一些实施方式中,所述抗体的轻链可变区包含seq id no:8,18,28,38,48,58,68或78所示的氨基酸序列或者与seq id no:8,18,28,38,48,58,68或78所示的氨基酸序列具有至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.5%的序列同一性的氨基酸序列。在一些实施方式中,所述抗体的轻链可变区的氨基酸序列如seq id no:8,18,28,38,48,58,68或78所示。
54.在一些实施方式中,所述抗体的重链可变区包含seq id no:7,17,27,37,47,57,67或77所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:8,18,28,38,48,58,68或78所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:7,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:8所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:17,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:18所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:27,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:28所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:37,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:38所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:47,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:48所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:57,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:58所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:67,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:68所示的氨基酸序列。在一些实施方式中,所述抗体的重链可变区包含seq id no:77,所示的氨基酸序列,且所述抗体的轻链可变区包含seq id no:78所示的氨基酸序列。
55.在一些实施方式中,所述抗体的轻链可变区和/或重链可变区是单链可变片段(scfv)、f(ab’)2片段、fab或fab’片段、双价抗体、三价抗体、四价抗体或单克隆抗体的部分。
56.scfv包括轻链可变区和重链可变区,通常通过连接基团接合在一起,该连接基团
通常的长度为约10至约25个氨基酸(虽然它不必一定在此范围内)。一个可变域的n-末端被连接到其它可变域的c末端。如果期望的话,所述scfv可以被peg化(用聚乙二醇),以增加其大小,像赛妥珠单抗(certolizumab pegol)那样。两个scfv可以利用另一连接基团接合在一起,以产生串联scfv。
57.如果轻链可变区和重链可变区通过短的连接基团接合在一起以形成scfv,那么这两个可变域不能折叠在一起,scfv将发生二聚化以形成二价抗体。甚至更短的连接基团可导致形成三聚体(即,三价抗体)和四聚体(即,四价抗体)。
58.完整单克隆抗体由两条重链和两条轻链形成。再次,每条轻链和每条重链均包含可变域。每条轻链与重链结合。两条重链在铰链区接合在一起。如果去除铰链区以下的重链恒定区,则产生了包含总共四个可变域的f(ab’)2片段。该f(ab’)2片段可以被分成两个fab’片段。fab’片段包含来自铰链区的巯基。当去除铰链区以上的重链恒定区时,形成fab片段,其不包含来自铰链区的巯基。然而,所有这些片段都包含轻链可变区和重链可变区。
59.在一些实施方式中,本公开的抗体是由上述具有可变区/域的轻链和重链与人恒定区组合形成的完整单克隆抗体。重链恒定区可以是任何人类同种型,包括iga1、iga2、igd、ige、igg1、igg2、igg3、igg4或igm。人轻链恒定区可以是κ或λ同种型。
60.上文针对本公开抗体所述的各种实施方式和优选项可以相互组合(只要它们彼此之间不是内在矛盾的),由此组合而形成的各种实施方式都视为本公开的一部分。
61.在一些实施方式中,本公开涉及一种药物组合物,其包含本公开所述的抗体以及药学上可接受的载体。
62.在一些实施方式中,药物组合物包括药学上可接受的载体。该载体充当用于递送抗体的媒介。药学上可接受的载体的实例包括抗体可以溶解或悬浮于其中的液体载体(如水、油和醇类)。
63.药物组合物还可以包括赋形剂。具体的赋形剂包括缓冲剂、表面活性剂、防腐剂、填充剂、聚合物和稳定剂,它们可与所述抗体一起使用。缓冲剂用于控制组合物的ph值。表面活性剂用于稳定蛋白质、抑制蛋白质聚集、抑制蛋白质吸附到表面上,并协助蛋白质重折叠。示例性的表面活性剂包括吐温80、吐温20、brij 35、triton x-10、pluronicf127和十二烷基硫酸钠。防腐剂用于抑制微生物生长。防腐剂的实例包括苯甲醇、间甲酚和苯酚。在冻干过程中使用填充剂,从而增加体积。亲水性聚合物(如葡聚糖、羟乙基淀粉、聚乙二醇、明胶)可用于稳定蛋白质。具有非极性部分的聚合物(如聚乙二醇聚合物)也可以用作表面活性剂。蛋白稳定剂可包括多元醇类、糖类、氨基酸类、胺类和盐类。合适的糖类包括蔗糖和海藻糖。氨基酸类包括组氨酸、精氨酸、甘氨酸、蛋氨酸、脯氨酸、赖氨酸、谷氨酸,以及它们的混合物。如人血清白蛋白之类的蛋白质也可以竞争性地吸附到表面上,并且降低抗体的聚集。应当注意的是,特定的分子可用于多种目的。例如,组氨酸可作为缓冲剂和抗氧化剂。甘氨酸可以用作缓冲剂和填充剂。
64.本公开的抗体或组合物可适当地开发以适合以下施用途径,包括吸入、经口、鼻部、直肠、肠胃外、舌下、经皮、经粘膜(例如,舌下、舌部、(经)颊部、(经)尿道、阴道(例如,经阴道和阴道内)、(经)鼻部和(经)直肠)、膀胱内、肺内、十二指肠内、胃内、鞘内、皮下、肌肉内、皮肤内、动脉内、静脉内、支气管内、吸入和局部施用。合适的组合物和剂型包括例如片剂、胶囊、囊剂、丸剂、软胶囊(gel cap)、含片、分散体、悬浮液、溶液、糖浆、颗粒、珠粒、经皮
贴剂、凝胶、粉末、弹丸剂、浆剂、锭剂、乳霜、糊剂、膏剂、洗剂、盘剂、栓剂、用于鼻或口服给药的液体喷雾剂、用于吸入的干粉或气雾化制剂、用于膀胱内给药的组合物和制剂等。应当理解,可用于本公开的制剂和组合物不限于本文所述的具体制剂和组合物。
65.在一些实施方式中,本公开涉及一种核酸分子,其包含编码本公开所述的抗体的核苷酸序列。
66.在一些实施方式中,本公开涉及一种核酸分子,其包含seq id no:9,19,29,39,49,59,69或79所示的重链可变区编码序列或者与seq id no:9,19,29,39,49,59,69或79所示的重链可变区编码序列具有至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.5%的序列同一性的核苷酸序列,和/或seq id no:10,20,30,40,50,60,70或80所示的轻链可变区编码序列或者与seq id no:10,20,30,40,50,60,70或80所示的轻链可变区编码序列具有至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.5%的序列同一性的核苷酸序列。
67.在一些实施方式中,本公开涉及一种核酸分子,其包含seq id no:9,19,29,39,49,59,69或79所示的重链可变区编码序列,和/或seq id no:10,20,30,40,50,60,70或80所示的轻链可变区编码序列。
68.在一些实施方式中,本公开涉及本公开所述的抗体或药物组合物或核酸分子在制造用于治疗结直肠癌的药物中的用途。
69.在一些实施方式中,本公开涉及本公开所述的抗体或药物组合物或核酸分子在制造用于诊断头颈鳞癌、肾癌、前列腺癌和结直肠癌的试剂盒中的用途。
70.上文针对本公开的抗体所述的各种实施方式和优选项同样适用于本公开的组合物、核酸分子和用途,这些实施方式和优选项亦可以相互组合(只要它们彼此之间不是内在矛盾的),由此组合而形成的各种实施方式都视为本技术公开的一部分。
71.下面将结合实施例以例证的方式更清楚、明确地阐述本公开的技术方案。应该理解的是,这些实施例仅用于例证的目的,绝不旨在限制本公开的保护范围。本公开的保护范围仅通过权利要求来限定。
72.实施例
73.实施例1:针对hmmw微肽的重组载体构建和表达
74.由安徽通用生物系统有限公司(以下简称通用生物)合成hmmw微肽(氨基酸序列如seq id no.81所示)对应的核苷酸序列(seq id no.82)。通过ecori
‑‑
bamhi双酶切(美国neb公司),将合成的核苷酸序列连接到表达载体pet28a(美国addgene),将连接产物转化大肠杆菌dh5α,涂板,挑取数个克隆,摇菌,利用北京天根生物质粒提取试剂盒提取质粒,经通用生物测序分析确定表达克隆序列正确的重组表达载体。将上述获得的表达质粒,转化大肠杆菌bl21(北京全式金生物技术有限公司),具体转化步骤为:1)加质粒1μl至感受态细胞中,混匀,冰上放置30min;2)42℃水浴90s,立即取出,冰上放置2min;3)将混合物全部接种至1ml lb培养基;4)37℃培养45min,摇床180rpm,恢复抗性;5)离心5000rpm
×
5min。弃上清,留100μl,混匀,涂布平板(lb-amp+),平板先正放,吸收20min后倒置12h,挑取单菌落接种到5ml lb(
×
2)培养基中振荡培养37℃,当菌液吸光度值od600≈0.6,加入iptg(sigma-aldrich)继续诱导培养3小时。5000rpm,5min离心收集菌体,pbs清洗菌体后离心收集菌体,4℃超声破菌。10000rpm离心,收集上清进行sds-page电泳,结果如图1所示,表明hmmw微肽
能够表达。镍离子亲和层析,咪唑梯度洗脱纯化hmmw微肽,hplc检测结果如图2所示,表明hmmw微肽纯度大于90%。
75.实施例2:抗人hmmw微肽的单克隆抗体的制备
76.购买8~12周龄balb/c小鼠(常州卡文斯实验动物有限公司),用纯化的hmmw微肽免疫balb/c小鼠,免疫原用量约50μg/只/次。首次免疫用弗氏完全佐剂(sigma-aldrich)乳化的抗原颈背部皮下多点注射,首次免疫后间隔3周,以后每隔2周左右改用由等体积的弗氏不完全佐剂(sigma-aldrich)乳化的免疫原进行第2、3次免疫,免疫剂量同首免。三次免疫之后小鼠眼静脉丛采血,检测抗血清的elisa效价(蛋白抗原包板),选择抗血清效价大于8k的小鼠进入融合阶段。
77.融合前1d,取8~12周龄balb/c小鼠1只,置于75%乙醇溶液中2min,无菌取出小鼠脾脏,置于200目的不锈钢筛网中,研磨获得单个细胞悬液,采用同样的方法获得免疫小鼠的单个细胞悬液,收集生长良好、处于对数生长期的sp2/0细胞与脾脏细胞按照1:5比例混合于50ml透明塑料离心管中,用预热rpmi 1640基础培养基(以色列biological industries生物技术公司)洗涤一遍(1400rpm,5min),弃去上清并用手指轻轻弹击管底,使两种细胞充分混匀成悬浮细胞状。将离心管置于37℃保温水浴杯中预热,吸取1ml经37℃预热的50%peg溶液,在1min内匀速加完,且边加边轻轻震荡离心管,加完后在37℃水浴中轻晃60s。沿管壁轻柔匀速滴加14ml 37℃预温的1640基础培养基终止(第1min加1ml,3min加3ml,最后缓慢加入10ml)。37℃静置5min后离心(800rpm,5min),弃去上清(将离心管倾斜,吸去上清),将沉淀细胞轻轻用37℃预热的1640选择培养基重悬(不可吹打),混匀后滴加在上述含有滋养细胞的96孔培养板中,100μl/孔,置于37℃、5%co2培养箱中培养,3d后半量换液,10d后改用ht培养基(美国thermo fisher scientific公司)培养,2周后转用含10%fbs(以色列biological industries生物技术公司)的1640培养基培养。期间每天观察96孔板中克隆生长情况,在杂交瘤细胞布满孔底1/10面积时,开始检测特异性抗体,筛选出所需要的杂交瘤细胞系。重复上述步骤直到孔中细胞株阳性率100%(识别相应的抗原),得到了8株杂交瘤细胞株。
78.实施例3:抗人hmmw抗体的轻链可变区和重链可变区的测序
79.从8株杂交瘤细胞株中提取rna(rna提取试剂盒采购自宝日医生物技术有限公司),利用5’race(宝日医生物技术有限公司)反转录cdna,利用pcr克隆该杂交瘤细胞重链可变区(vh)和轻链可变区(vl),然后进行测序。测序结果如下表1所示,其中cdr以阴影部分显示。
80.表1
81.[0082][0083]
实施例4:通过elisa方法检测抗hmmw抗体的效价
[0084]
hmmw微肽抗原包被浓度为1μg/ml,用5%牛奶pbs-t封闭。八个抗体稀释倍数均为:1:3.125k/6.25k/12.5k/25k/50k/100k,一抗37℃孵育1小时,二抗37℃孵育45分钟;加显色液37℃反应15分钟,后终止并读数。由下表2可以看出,8种抗体的效价均达到1:100k,满足后续进行抗原检测的要求。
[0085]
表2
[0086]
[0087][0088]
实施例5:提高western blot方法检测抗hmmw抗体的灵敏度
[0089]
将纯化得到的hmmw微肽利用15%sds-page凝胶电泳,总上样量为10ng,然后转移到nc膜上,5%脱脂奶粉室温封闭1小时后,用稀释的8个一抗室温孵育2小时,tbst洗4次,二抗室温孵育45min,tbst洗三次,洗膜。加ecl试剂反应1分钟,加封保鲜膜,在暗室曝光x-ray胶片显影并扫描胶片,结果见图3。从图3能够看出:八个抗hmmw抗体均能识别10ng目的hmmw微肽,灵敏度满足检测要求。
[0090]
实施例6:通过western blot方法检测抗hmmw抗体与不同肿瘤细胞中hmmw微肽的结合能力
[0091]
将头颈鳞癌cal27细胞、肾癌786-o细胞、前列腺癌du145细胞和结直肠癌hct116细胞(均来自于美国模式培养物集存库)四种细胞分别在37℃、5%co2的培养箱中培养,培养至密度为90%时用胰蛋白酶(美国biosharp公司)消化收集,离心后弃上清,pbs润洗两次,弃上清。加入ripa裂解液,冰上裂解20min。12000g离心10min收集上清。加入1
×
sds上样缓冲液,吹打混匀后煮沸变性5min。10%sds-page凝胶分离总蛋白,然后转移到pvdf膜(美国millipore公司)。5%bsa室温封闭2h,分别与8种不同的抗hmmw抗体4℃孵育过夜,tbst洗涤3次。二抗室温孵育1h,tbst洗涤3次。ecl超敏化学发光液显影,经tanon成像系统成像,比较不同抗hmmw抗体对四种肿瘤细胞中hmmw微肽表达的检测能力,结果见图4。
[0092]
从图4能够看出:8种抗hmmw抗体均能够有效检测头颈鳞癌cal27细胞、肾癌786-o细胞、前列腺癌du145细胞和结直肠癌hct116细胞中hmmw微肽的表达。
[0093]
实施例7:抗hmmw抗体对人结直肠癌细胞增殖能力的影响
[0094]
将高表达hmmw微肽的结直肠癌细胞hct116在37℃、5%co2的培养箱中培养至密度90%时用胰蛋白酶消化收集,用培养液重悬细胞并在显微镜下计数,将细胞浓度调整为3.0
×
104个/ml,将细胞悬液接种到96孔板中,每孔100μl,并于37℃,5%co2培养箱中培养过夜。待细胞完全贴壁后,以分别加入40nm的8种抗hmmw抗体之一作为给药组,加入10μg/ml的紫杉醇作为阳性对照组,不加任何药物的培养液作为阴性对照组,每孔100μl,在37℃,5%co2培养箱孵育48h。向96孔板中每孔加入20μl 5mg/ml的mtt,继续培养4h。吸去培养基,每孔加入100μl dmso溶解。用酶标仪在检测波长为570nm,参比波长为630nm处测定吸光值,并计算增殖抑制率(proliferation inhibition,pi),公式为pi(%)=1-(给药组或阳性对照组)/阴性组。试验独立重复3次,试验得到的结果以平均值
±
标准差表示,并进行统计t检验,*p<0.05为显著性差异,**p<0.01为极显著性差异,如图5所示。
[0095]
从图5能够清楚地看出:与阴性对照相比,在40nm剂量下,8种抗hmmw抗体均能够显著抑制结直肠癌细胞hct116的增殖,抑制效果与临床上广泛用于治疗癌症的抗癌药紫杉醇基本相当,从而证明其能够有效用作抗癌药物。
[0096]
实施例8:抗hmmw抗体对人结直肠癌细胞迁移能力的影响
[0097]
将高表达hmmw微肽的结直肠癌细胞hct116细胞接种到transwell小室(美国millipore公司)中,每孔100μl,同时每个小室分别加入100μl 40nm的8种抗hmmw抗体之一作为给药组,加入40nm的西妥昔单抗(cetuximab)作为阳性对照组,不加任何药物的培养液作为阴性对照组,然后在transwell下室加入0.6ml含10%fbs的完全培养基刺激细胞迁移,于5%co2,37℃培养24h。弃去孔中培液,用90%酒精常温固定30min,0.1%结晶紫常温染色10min,清水漂净,用棉签轻轻擦掉上层未迁移细胞,显微镜下观察并选择四个视野拍照计数。按照公式计算细胞的迁移抑制率(migration inhibition rate,mir):
[0098][0099]
其中n
测试
为测试组(抗体给药组或阳性对照组)的细胞迁移数,n
对照
为阴性对照组的细胞迁移数,结果如图6所示。
[0100]
从图6能够清楚地看出:与阴性对照相比,在40nm剂量下,8种抗hmmw抗体均能够显著抑制结直肠癌细胞hct116的细胞迁移,抑制效果与临床上广泛用于治疗癌症的抗癌药西妥昔单抗基本相当,从而证明其能够作为治疗药物有效抑制恶性肿瘤细胞的迁移。
[0101]
尽管具体的实施方式已被描述,然而对于申请人或其它本领技术人员而言,可能存在或目前无法预见上述实施方式的替代、修改、变化、改进和实质等效物。因此,提交的所附的权利要求以及可能被修改的权利要求旨在涵盖所有这样的替代、修改、变化、改进和实质等效物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1