一种安莎三烯类化合物及其制备方法与应用
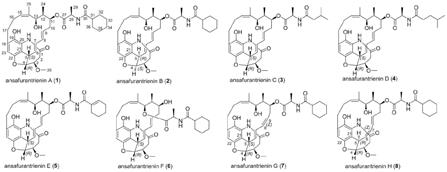
1.本发明属于医药技术领域,是从streptomyces flaveolus的发酵产物中分离得到的8个新的大环内酰胺类化合物ansafurantrienins a-h(化合物1-8)及其在制备治疗胰腺癌的药物中的应用。
背景技术:
2.安莎霉素类化合物是一类大环内酰胺类化合物,具有重要的生物活性,根据其芳香环结构的不同可分为萘安莎(naphthalene ansamycin)和苯安莎(benzene ansamycin),具有较强抗菌活性的利福霉素(rifamycin)、曲张链霉素(streptovaricins)、奈霉素(naphthomycin)等均属于萘安莎霉素;苯安莎类化合物有格尔登霉素(geldanamycin)、除莠霉素(herbimycin)、三烯霉素(trienomycins)等,具有一定的抗菌活性和潜在的抗肿瘤活性。
3.安莎三烯(ansatrienin)类化合物因大环内酰胺骨架中存在共轭三烯结构而得名,是一类结构特殊的苯安莎类化合物,芳香环取代基和脂肪侧链结构和位置的多样性使该类化合物结构变化多样。1967年coronelli等人分离得到了第一个安莎三烯类化合物mycotrieninⅱ【c.coronelli;r.c.pasqualucci,j.e.thiemann;g.tamoni.j antibiot 1967,20,329-333.】,随后mycotrieninⅱ的类似物mycotrieninⅰ【m.damberg;p.russ;a.zeeck.chemischer informationsdienst 1982,13,341】、ansatrienins a
2-a4【m.sugita;y.natori;t.sasaki;k.furihata;a.shimazu;h.seto;n.otake.j antibiot 1982,35,1460.】、mycotrienolsⅰandⅱ【m.sugita;y.natori;n.sueda;k.furihata;h.seto;n.otake.j antibiot 1982,35,1474-1479.】陆续被分离得到,这些化合物具有一定的抗真菌和抗肿瘤活性。从1985年起trienomycins a-l先后被发现【s.funayama;k.okada;k.iwasaki;k.komiyama;i.umezawa.j antibiot 1985,38,1677-1683;h.nomoto;s.katsumata;k.takahashi;s.funayama;k.komiyama;i.umezawa;s.omura.j antibiot 1989,42,479-481;w.g.kim;n.k.song;i.d.yoo.j antibiot 2002,55,204-207.】,trienomycins类化合物展示强大的抗肿瘤活性,对宫颈癌细胞、肝癌细胞、白血病细胞均有较强的细胞毒活性,其中trienomycins a、b、c对hela宫颈癌细胞,trienomycins a、c、d、e、f、j对hepg2肝癌细胞,trienomycins a、d对pc-3前列腺癌细胞的ic
50
值均为nm级,此外trienomycins a、d、j可明显抑制小胶质细胞一氧化氮(no)的生成【s.funayama;k.okada;k.iwasaki;k.komiyama;i.umezawa.j antibiot 1985,38,1677-1683;d.tang;l.l.liu;q.r.he;w.yan;d.li;j.m.gao.j nat prod 2018,81,1984-1991.】。2021年gao团队在胰腺癌细胞中发现trienomycin a可以直接与stat3结合,抑制stat3磷酸化,从而抑制胰腺癌细胞株的集落形成、增殖、迁移和侵袭【he,q.r.;tang,j.j.;liu,y.;chen,z.f.;liu,y.x.;chen,h.;li,d.;yi,z.f.;gao,j.m.br j pharmacol 2021,178,2496-2515】。thiazinotrienomycin a-g【hosokawa;naganawa;inuma;hamada;takeuchi;kanbe;hori.j antibiot 1995,48,471-478;hosokawa,n.;naganawa,h.;hamada,m.;iinuma,h.;
takeuchi,t.;tsuchiya,k.s.;hori,m.j antibiot 2000,53,886-894】以及tmc-135a、b【j.kohno,m.nishio,m.sakurai,k.kawano,s.komatsubara,tetrahedron 1999,55,7771-7786.】的发现进一步丰富了安莎三烯类化合物的结构多样性,迄今利用天然产物发现以及生物合成等手段获取的安莎三烯类化合物已达近百种。
技术实现要素:
4.本发明的目的是提供一种安莎三烯类化合物。
5.本发明的另一个目的是提供一种所述安莎三烯类化合物的制备方法。
6.本发明的再一个目的是提供一种所述安莎三烯类化合物在制备治疗胰腺癌的药物中的应用。
7.为了实现上述目的,本发明采用的技术方案如下:
8.本发明的第一方面提供了一种安莎三烯类化合物,结构为以下结构的一种:
[0009][0010]
所述安莎三烯类化合物是以streptomyces flaveolus dsm 9954菌株的发酵物作为原料,通过提取和分离得到目标化合物。
[0011]
本发明的第二方面提供了一种所述安莎三烯类化合物的制备方法,包括以下步骤:
[0012]
将streptomyces flaveolus菌株接种到种子培养基培养两天获得种子培养液,再将种子培养液接种到发酵培养基进行发酵,得到发酵产物;
[0013]
再将上述发酵产物用乙酸乙酯超声提取至提取液基本无色,减压浓缩得粗浸膏,经过分离获得所述安莎三烯类化合物。
[0014]
所述种子培养基包括:4%甘油,1%大豆蛋白胨,2.1%麦芽提取物,ph 7.0。
[0015]
所述发酵培养基包括:4%甘油,1.95%mes水合物,2%黄豆粉,ph 6.8。
[0016]
所述将种子培养液接种到发酵培养基进行发酵的条件为:28℃,220rpm培养7天。
[0017]
所述经过分离获得所述安莎三烯类化合物包括以下步骤:将上述粗浸膏用甲醇溶解,mci填料拌样,经mci柱层析,以甲醇-水梯度洗脱,meoh/h2o 30%-100%,25ml/min,按流分极性大小收集,根据hsgf254薄层色谱板检测,10%的硫酸香草醛显色,得到8个组分fr.i~fr.
ⅷ
、la、lb;la经过sephadex lh-20凝胶色谱柱,流动相为二氯甲烷:甲醇=2:1,hplc甲醇:水=62:38,流速:3ml/min分离得到ansafurantrienins c即化合物3;
[0018]
lb经过sephadex lh-20凝胶色谱柱,流动相为二氯甲烷:甲醇=2:1,得到7个组分lb.1-lb.7;lb.3经过hplc甲醇:水=76:24,流速:20ml/min得到8个组分lb.3.1-lb.3.8;
lb.3.5经过hplc乙腈:水=50:50,流速:3ml/min得到ansafurantrienins b即化合物2;
[0019]
lb.3.3经过hplc乙腈:水=48:52,流速:3ml/min得到ansafurantrienins d即化合物4和ansafurantrienins e即化合物5;
[0020]
lb.3.4过hplc乙腈:水=55:45,流速:20ml/min得到ansafurantrienins a即化合物1;
[0021]
lb.3.2过hplc乙腈:水=48:52,流速:20ml/min得到ansafurantrienins h即化合物8和ansafurantrienins g即化合物7;
[0022]
lb.3.6过hplc乙腈:水=53:47,流速:20ml/min得到ansafurantrienins f即化合物6。
[0023]
本发明制备的ansafurantrienins a-h即化合物1-8的结构经多种现代光谱分析,特别是综合应用多种二维核磁共振波谱的解析,确定了ansafurantrienins a-h即化合物1-8的化学结构。
[0024]
本发明的第三方面提供了一种所述安莎三烯类化合物在制备治疗胰腺癌的药物中的应用。
[0025]
所述胰腺癌是指胰腺癌细胞panc-1、cfpac-1、sw1990。
[0026]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0027]
本发明提供的安莎三烯类化合物能够抑制人胰腺癌细胞panc-1、cfpac-1、sw1990的生长,因此,可以作为治疗胰腺癌的药物使用。
具体实施方式
[0028]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0029]
下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。本发明实施例所用试剂除另有注明,均可以从销售公司获得。
[0030]
本发明所用的streptomyces flaveolus菌株的保藏单位为德国微生物菌种保藏中心,保藏号:dsm 9954。
[0031]
实施例1
[0032]
安莎三烯类化合物ansafurantrienins a-h(化合物1-8)的制备方法包括以下步骤:
[0033]
发酵:将streptomyces flaveolus dsm 9954菌株接种到种子培养基(4%甘油,1%大豆蛋白胨,2.1%麦芽提取物,ph 7.0)培养两天获得种子培养液,再将种子培养液接种到发酵培养基(4%甘油,1.95%mes水合物,2%黄豆粉,ph 6.8)进行发酵,28℃,220rpm培养7天得到发酵产物。
[0034]
提取:再将上述发酵产物用等体积的乙酸乙酯超声提取至提取液基本无色,减压浓缩得粗浸膏120g。
[0035]
分离:将上述粗浸膏用甲醇溶解,120g mci填料拌样,经mci柱层析(柱内径3.8cm,柱高46cm),以甲醇-水梯度洗脱(meoh/h2o 30%-100%,25ml/min),按流分极性大小收集,根据hsgf254薄层色谱板检测,10%的硫酸香草醛显色,得到8个组分(fr.i~fr.
ⅷ
,la,
lb)。la经过sephadex lh-20凝胶色谱柱(柱内径约2cm,柱高约143cm),流动相为二氯甲烷:甲醇(二氯甲烷:甲醇=2:1),hplc(甲醇:水=62:38,流速:3ml/min)分离得到ansafurantrienins c即化合物3(3.4mg,39min)。lb经过sephadex lh-20凝胶色谱柱(柱内径约2cm,柱高约143cm),流动相为二氯甲烷:甲醇(二氯甲烷:甲醇=2:1),由自动接收器收集,薄层板检测,得到7个组分(lb.1-lb.7)。lb.3经过hplc(甲醇:水=76:24,流速:20ml/min)得到8个组分(lb.3.1-lb.3.8)。lb.3.5经过hplc(乙腈:水=50:50,流速:3ml/min)得到ansafurantrienins b即化合物2(2.6mg,29min);lb.3.3经过hplc(乙腈:水=48:52,流速:3ml/min)得到ansafurantrienins d即化合物4(3.1mg,tr=35min)和ansafurantrienins e即化合物5(3.0mg,tr=40min);lb.3.4过hplc(乙腈:水=55:45,流速:20ml/min)得到ansafurantrienins a即化合物1(157.8mg,tr=23min);lb.3.2过hplc(乙腈:水=48:52,流速:20ml/min)得到ansafurantrienins h即化合物8(9.6mg,tr=30.5min)和ansafurantrienins g即化合物7(6.8mg,tr=34min);lb.3.6过hplc(乙腈:水=53:47,流速:20ml/min)得到ansafurantrienins f即化合物6(6mg,tr=33min)。
[0036]
本发明从streptomyces flaveolus dsm 9954次级代谢产物中分离得到的8个化合物,命名为ansafurantrienins a-h(即化合物1-8),8个化合物的理化数据、1h和
13
c nmr数据如表1~4所示:ansafurantrienins a即化合物1,结构如下:
[0037][0038]
淡黄色粉末;rf值0.5(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+46(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)215(4.89),226(4.82),256(5.00),271(4.81),295(3.90),315(3.92)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)219(1.08),207(-4.95),234(-11.4),270(11.8),314(-4.95)nm;红外吸收数据ir(film)
max
=3324,2930,1733,1648,1529,1478,1450,1106,987cm-1
;1h和
13
c nmr数据见表1;高分辨质谱hresims m/z:659.3359[m+na]
+
(calcd for c
36h48
n2o8na,659.3308)。
[0039]
ansafurantrienins b即化合物2,结构如下:
[0040][0041]
淡黄色粉末;rf值0.69(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+97(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)213(4.16),221(4.17),263(3.65),295(3.11),316(3.28)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)215(-12.5),235(32.4),272(-15.8),313(7.38)nm;红外吸收数据ir(film)
max
=3428,2930,1732,1705,1646,1472,1164,991cm-1
;1h和
13
c nmr数据见表1;高分辨质谱hresims m/z:659.3312[m+na]
+
(calcd for c
36h48
n2o8na,659.3308)。
[0042]
ansafurantrienins c即化合物3,结构如下:
[0043][0044]
淡黄色粉末;rf值0.5(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+84(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)316(3.47),292(3.39),272(3.93),222(4.40),213(4.40)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)316(-11.1),270(23.5),233(-23.6),220(0.95),208(-8.15)nm;红外吸收数据ir(film)
max
=3346,2928,1734,1714,1652,1507,1166,988cm-1
;1h和
13
c nmr数据见表2、3;高分辨质谱hresims m/z:633.3159[m+na]
+
(calcd for c
34h46
n2o8na,633.3152)。
[0045]
ansafurantrienins d即化合物4,结构如下:
[0046][0047]
淡黄色粉末;rf值0.61(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+66(c 0.5,meoh);紫外
吸收数据uv(mecn)λ
max
(logε)316(3.31),294(3.10),271(3.71),219(4.28),213(4.29)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)317(-7.60),270(15.6),234(-16.3),219(1.29),208(-6.17)nm;红外吸收数据ir(film)
max
=3358,2931,1732,1714,1652,1507,1167,987cm-1
;1h和
13
c nmr数据见表2、3;高分辨质谱hresims m/z:647.3319[m+na]
+
(calcd for c
35h48
n2o8na,647.3308)。
[0048]
ansafurantrienins e即化合物5,结构如下:
[0049][0050]
淡黄色粉末;rf值0.61(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+54(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)317(3.43),295(3.27),276(3.81),221(4.44),216(4.44)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)315(-9.91),270(21.5),234(-20.8),220(3.11),209(-7.02)nm;红外吸收数据ir(film)
max
=3433,2930,1731,1710,1658,1525,1167,987cm-1
;1h和
13
c nmr数据见表2、3;高分辨质谱hresims m/z:657.3180[m+na]
+
(calcd for c
36h46
n2o8na,657.3152)。
[0051]
ansafurantrienins f即化合物6,结构如下:
[0052][0053]
淡黄色粉末;rf值0.71(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+36(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)214(4.26),221(4.26),272(3.77),290(3.34),312(3.32)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)211(-7.72),220(-3.51),232(-13.0),267(10.85),314(-6.03)nm;红外吸收数据ir(film)
max
=3390,2929,1704,1646,1540,1456,1182,991cm-1
;1h和
13
c nmr数据见表2、4;高分辨质谱hresims m/z:659.3315[m+na]
+
(calcd for c
36h48
n2o8na,659.3308)。
[0054]
ansafurantrienins g即化合物7,结构如下:
[0055][0056]
淡黄色粉末;rf值0.61(ch2cl2/meoh 15:1);旋光度[α]
29.5d
+27(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)210(4.80),238(4.70),255(4.75),275(4.49),298(3.92),311(3.97)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)206(-10.2),219(-8.29),227(-17.1),244(25.4),311(-10.2)nm;红外吸收数据ir(film)
max
=3298,2927,1734,1717,1648,1540,1203,737cm-1
;1h和
13
c nmr数据见表2、4;高分辨质谱hresims m/z:637.3524[m+h]
+
(calcd for c
36h49
n2o8,637.3489)。
[0057]
ansafurantrienins h即化合物8,结构如下:
[0058][0059]
淡黄色粉末;rf值0.60(ch2cl2/meoh 15:1);旋光度[α]
29.5d-99(c 0.5,meoh);紫外吸收数据uv(mecn)λ
max
(logε)220(4.32),272(3.65),286(3.25),307(3.35)nm;ecd值(c 3.1
×
10-5
,mecn)λ
max
(δε)226(-24.9),245(15.5),304(-3.78)nm;红外吸收数据ir(film)
max
=3270,2931,1704,1652,1522,1472,1157,990cm-1
;1h和
13
c nmr数据见表2、4;高分辨质谱hresims m/z:637.3548[m+h]
+
(calcd for c
36h49
n2o8,637.3489)。
[0060]
表1.化合物ansafurantrienins a(化合物1)和b(化合物2)的1h和
13
c nmr数据a[0061]
[0062]
[0063][0064]ain cd3od,600mhz for 1
h and 150mhz for 13
c.
[0065]
表2.化合物ansafurantrienins c-h(3-8)的
13
c nmr数据
[0066]
[0067][0068]ain cd3od,600mhz for 1
h and 150mhz for 13
c.
[0069]
表3.化合物ansafurantrienins c-e(3-5)的1h nmr数据
[0070]
[0071][0072]ain cd3od,600mhz for 1
h and 150mhz for 13
c.
[0073]
表4.化合物ansafurantrienins f-h(6-8)的1h nmr数据
[0074]
[0075][0076]ain cd3od,600mhz for 1
h nmr and 150mhz for 13
c nmr.
[0077]
实施例2
[0078]
本发明的安莎三烯类化合物ansafurantrienins a-h(化合物1-8)的抗胰腺癌细胞的活性测定:
[0079]
(1)实验方法
[0080]
panc-1细胞、cfpac-1细胞、sw1990细胞(购于atcc)细胞经计数后接种于96孔培养板,5000细胞/100ul/孔,每孔加入90ul培养液(含血清)(excell bio,fsp500)培养过夜,再加入10ul药物溶液,各设7个浓度(0.04,0.12,0.37,1.11,3.33,10.0,30.0um);培养72h后,每孔加入cck8(elabscience,e-ck-a362)10ul;37℃培养1h;酶标仪(molecular devices,3)测定各孔吸光值od450。
[0081]
(2)对照化合物:trienomycin a(安莎三烯a)、ansatrienin b(安莎三烯b)、benzoxazomycin(苯并恶唑安莎霉素)和吉西他滨(gemcitabine)分别购买于sigma公司。
[0082]
(3)实验结果
[0083]
以cck8法检测化合物1-8对panc-1细胞、cfpac-1细胞、sw1990细胞的生长抑制效果,化合物1-8对三株细胞系的ic
50
如表5所示:
[0084]
表5.化合物1-8对cfpac-1细胞、sw1990细胞和panc-1细胞的生长抑制
[0085]
[0086][0087]
胰腺癌是消化道常见的恶性肿瘤,在肿瘤领域素有“癌症之王”的称号,根据柳叶刀杂志报道,胰腺癌确诊后的五年生存率约为10%,是预后最差的恶性肿瘤之一,诊断和治疗都很困难。本发明中发现的化合物1-8对胰腺癌cfpac-1细胞和sw1990细胞均有不同程度的细胞毒活性,对panc-1细胞的增殖抑制作用较弱。其中化合物1-2,6-8对cfpac-1细胞和sw1990细胞的抑制活性较强,活性与对照药物rienomycin a、ansatrienin b、benzoxazomycin以及临床一线治疗药物吉西他滨(gemcitabine)的活性相当。化合物3-5的活性较弱,提示侧链结构对活性的影响,为进一步的结构改造和优化提供了参考。
[0088]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1