碱湖杆菌菌株W30、脱氮菌剂及其制备方法和应用
碱湖杆菌菌株w30、脱氮菌剂及其制备方法和应用
技术领域
1.本发明涉及污水处理技术领域,尤其涉及碱湖杆菌菌株w30、脱氮菌剂及其制备方法和应用。
背景技术:
2.膜生物反应器(membrane bio-reactor,简称mbr)系统运行中连续或间接曝气造成的脱硝效果差的问题是其研究和应用的热点与难点。同时mbr的膜污染问题也一直是人们关注的难点。微生物易在滤膜膜丝表面附着形成生物膜,进而堵塞膜孔而导致膜压上升。为了避免膜污染,工程上mbr通常会采用连续曝气或间歇曝气的方式,以气泡鼓动水流与膜组片产生摩擦,使膜丝表面的生物膜脱落,以抑制微生物造成膜污染。然而,增加曝气会造成溶解氧升高,进而导致mbr活性污泥微生物群落的反硝化能力下降,导致膜生物反应器出水中硝酸盐氮含量增加而积累。
技术实现要素:
3.有鉴于此,本公开的目的在于提出一种碱湖杆菌菌株w30、脱氮菌剂及其制备方法和应用。
4.基于上述目的,本公开第一方面提供了保藏编号为cgmcc no.23484 的碱湖杆菌菌株w30。
5.基于相同的目的,本公开第二方面提供了一种脱氮菌剂,所述脱氮菌剂由保藏编号为cgmcc no.23484的碱湖杆菌菌株w30制备得到。
6.基于相同的目的,本公开第三方面提供了一种脱氮菌剂的制备方法,包括以下步骤:
7.取冷冻保存的保藏编号为cgmcc no.23484的碱湖杆菌菌株w30,接种于灭菌后的第一培养基中;
8.将接种后的第一培养基置于温度为30~35℃、转速为140~150rmp的条件下培养18~24h,得到活化菌株;
9.将培养后的第一培养基于转速4800~5000rpm下离心8~10min,收集离心后的沉淀,漂洗,加入磷酸盐缓冲液混匀,得到脱氮菌剂。
10.可选地,所述第一培养基包括lb液体培养基。
11.可选地,还包括:将所述脱氮菌剂与甘油按照1:1的体积比混合后于-80 ℃中保存。
12.可选地,所述甘油为灭菌后的甘油,所述甘油的体积百分比浓度为 25~30%。
13.可选地,还包括:将所述脱氮菌剂接种于含有第二培养基的发酵罐中发酵,并控制发酵液ph为7~8、发酵温度为30~35℃,补充碳源以使发酵液的 c/n比为10~12,发酵罐中溶解氧的浓度为5-6mg/l。
14.可选地,将所述脱氮菌剂按照1~3%的体积百分比接种于含有第二培养基的发酵
罐中,所述第二培养基包括玉米浆培养基,所述碳源包括柠檬酸钠。
15.基于相同的目的,本公开第四方面提供了脱氮菌剂在脱除水体累积氮中的应用。
16.基于相同的目的,本公开第五方面提供了脱氮菌剂在脱除水体中累积的氨氮、硝酸盐氮和/或亚硝酸盐氮中的应用。
17.从上面所述可以看出,本公开提供的碱湖杆菌菌株w30、脱氮菌剂及其制备方法和应用,碱湖杆菌菌株w30是异养硝化有氧反硝化菌,能够在有氧条件下以柠檬酸钠为碳源、以硝酸盐氮或亚硝酸盐氮为氮源,进行同化作用和反硝化作用脱氮,或者能够在有氧条件下以柠檬酸钠为碳源、以氨氮为氮源,进行同化作用、硝化作用和反硝化作用脱氮,具有显著的氨氮、硝酸盐氮和亚硝酸盐氮脱除效果,适用于含高浓度氨氮、硝酸盐氮和/或亚硝酸盐氮的废水的去除,能够高效地实现氨氮、硝酸盐氮和/或亚硝酸盐氮的转化;可以深度脱除膜生物反应器出水中的硝酸盐氮,在解决膜生物反应器出水高浓度硝酸盐氮积累的问题方面具有极大的应用价值。
附图说明
18.图1是本公开实施例提供的碱湖杆菌菌株w30的lb平板菌落形态图;
19.图2是本公开实施例提供的扫描电镜下碱湖杆菌菌株w30的菌体形态图(5μm);
20.图3是本公开实施例提供的扫描电镜下碱湖杆菌菌株w30的另一菌体形态图(500nm);
21.图4是本公开实施例提供的碱湖杆菌菌株w30在氨氮培养基中的生物转化效果图;
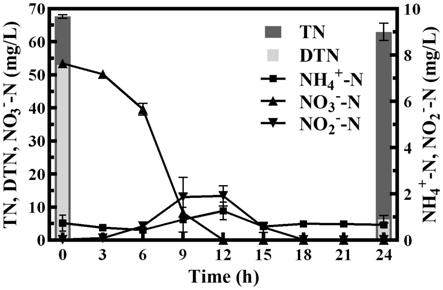
22.图5是本公开实施例提供的碱湖杆菌菌株w30在硝酸盐氮培养基中的生物转化效果图
23.图6是本公开实施例提供的碱湖杆菌菌株w30在亚硝酸盐氮培养基中的生物转化效果图。
具体实施方式
24.为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,对本公开进一步详细说明。
25.需要说明的是,除非另外定义,本发明实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。本公开实施例中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的组成部分。
26.膜生物反应器(membrane bio-reactor,简称mbr)是一种生物处理单元与膜分离装置相结合的新型水处理技术。mbr用膜组件代替二沉池,保持生物反应器内较高的活性污泥浓度,可同时发挥活性污泥生物转化与膜物理过滤的作用,减少污水处理设施的占地面积,通过保持较低的污泥负荷来减少污泥量。
27.mbr系统运行中连续或间接曝气造成的脱硝效果差的问题是其研究和应用的热点与难点。同时mbr的膜污染问题也一直是人们关注的难点。微生物易在滤膜膜丝表面附着形成生物膜,进而堵塞膜孔而导致膜压上升。为了避免膜污染,工程上mbr通常会采用连续曝气或间歇曝气的方式,以气泡鼓动水流与膜组片产生摩擦,使膜丝表面的生物膜脱落,以抑
制微生物造成膜污染。然而,增加曝气会造成溶解氧升高,进而导致mbr活性污泥微生物群落的反硝化能力下降,导致膜生物反应器出水中硝酸盐氮含量增加而积累。
28.相关技术中普遍认为反硝化作用只能在缺氧或厌氧条件下进行,如果能够在有氧甚至好氧条件下进行反硝化作用,则对于生物脱氮具有重大意义。因此,寻找一种高效的有氧反硝化菌对生物脱氮环境保护技术的发展具有重要意义。
29.为了解决上述问题,本公开提供了保藏编号为cgmcc no.23484的碱湖杆菌菌株w30。
30.生物保藏说明
31.碱湖杆菌菌株w30:分类命名为:碱湖杆菌w30(pannonibacter sp.w30),已于2021年9月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏中心地址为:北京市朝阳区北辰西路1号院中国科学微生物研究所,保藏编号为cgmcc no.23484。
32.该碱湖杆菌菌株w30的核苷酸序列如seq id no:1所示,有效序列长度为1380bp。
33.该碱湖杆菌菌株w30具有以下生理生化特征:
34.(1)该碱湖杆菌菌株w30为革兰氏阴性菌;
35.(2)该碱湖杆菌菌株w30的单菌落为规则的圆形,边缘整齐,表面光滑,呈淡黄色,不透明,菌落黏着、湿润、易挑取,培养较长时间后菌落趋于淡红色。
36.(3)该碱湖杆菌菌株w30可分别在lb液体培养基、玉米浆培养基和硝酸盐氮培养基中生长。
37.本公开还提供了一种脱氮菌剂,所述脱氮菌剂由保藏编号为cgmcc no. 23484的碱湖杆菌菌株w30制备得到。
38.本公开还提供了一种脱氮菌剂的制备方法,可以包括以下步骤:
39.s1、取冷冻保存的保藏编号为cgmcc no.23484的碱湖杆菌菌株w30,接种于灭菌后的第一培养基中;例如,可以采用高温灭菌的方式对第一培养基进行灭菌处理;
40.s2、将接种后的第一培养基置于温度为30~35℃、转速为140~150rmp 的条件下培养18~24h,得到活化菌株;例如,可以将第一培养基置于温度为 30~35℃、转速为140~150rmp的恒温震荡培养箱中培养18~24h;恒温震荡培养箱的温度可以为30℃、31℃、32℃、33℃、34℃或35℃等,具体不做限定;恒温震荡培养箱的转速可以为140rpm、142rpm、145rpm、148rpm 或150rmp等,具体不做限定;培养时间可以为18h、19h、20h、21h、22 h、23h或24h等,具体不做限定;
41.s3、将培养后的第一培养基于转速4800~5000rpm下离心8~10min,收集离心后的沉淀,漂洗,加入磷酸盐缓冲液混匀,得到脱氮菌剂;例如,可以将第一培养基于转速4800~5000rpm的离心机中离心8~10min;离心机的转速可以为4800rpm、4850rpm、4900rpm、4950rpm或5000rpm等,具体不做限定;离心时间可以为8min、8.5min、9min、9.5min或10min等,具体不做限定;可以采用1
×
无菌磷酸盐缓冲液漂洗沉淀,可以采用1
×
磷酸盐缓冲液与漂洗后的沉淀混匀。
42.在一些可能的实施方式中,所述第一培养基可以包括lb液体培养基。
43.在一些可能的实施方式中,该方法还可以包括:
44.将所述脱氮菌剂与甘油按照1:1的体积比混合后于-80℃中保存。
45.在一些可能的实施方式中,所述甘油可以为灭菌后的甘油,所述甘油的体积百分
比浓度可以为25~30%。例如,所述甘油的体积百分比浓度可以为 25%、26%、27%、28%、29%或30%等,具体不做限定。
46.在一些可能的实施方式中,该方法还可以包括:
47.将所述脱氮菌剂接种于含有第二培养基的发酵罐中发酵,并控制发酵液 ph为7~8、发酵温度为30~35℃,补充碳源以使发酵液的c/n比为10~12,发酵罐中溶解氧的浓度为5-6mg/l。例如,可以控制发酵液ph为7、7.2、 7.5、7.8或8等,具体不做限定;发酵温度可以为30℃、31℃、32℃、33 ℃、34℃或35℃等,具体不做限定;发酵液的c/n比可以为10、10.5、11、 11.5或12等,具体不做限定;溶解氧的浓度可以为5mg/l、5.2mg/l、5.5 mg/l、5.8mg/l或6mg/l等,具体不做限定。
48.在实际应用中,可以采用0.5~1mol/l的氢氧化钠和0.5~1mol/l的盐酸溶液控制发酵液ph为7~8。发酵期间每隔6h取样并检测发酵液的od值和活菌数(cfu/ml);活菌数的测定采用梯度稀释平板涂布计数法,通过计算菌落形成单位(cfu,colony forming unit)统计活菌数;48h后,菌株w30的生长进入稳定期,最大od
600
值和cfu分别为8.931和9.5
×
109/ml。
49.在一些可能的实施方式中,可以将所述脱氮菌剂按照1~3%的体积百分比接种于含有第二培养基的发酵罐中,所述第二培养基可以包括玉米浆培养基,所述碳源可以包括柠檬酸钠。例如,接种时脱氮菌剂的体积百分比可以为1%、1.5%、2%、2.4%、2.8%或3%等,具体不做限定。
50.本公开还提供了脱氮菌剂在脱除水体累积氮中的应用。
51.该脱氮菌剂可以脱除水体中累积的有机氮和无机氮等,具体不做限定。
52.进一步地,本公开还提供了脱氮菌剂在脱除水体中累积的氨氮、硝酸盐氮和/或亚硝酸盐氮中的应用。
53.碱湖杆菌菌株w30是异养硝化有氧反硝化菌,能够在有氧条件下以柠檬酸钠为碳源、以硝酸盐氮或亚硝酸盐氮为氮源,进行同化作用和反硝化作用脱氮,或者能够在有氧条件下以柠檬酸钠为碳源、以氨氮为氮源,进行同化作用、硝化作用和反硝化作用脱氮。
54.碱湖杆菌菌株w30在初始浓度为50.03mg/l的氨氮培养基中,在温度 30℃、转速150rpm下,总氮去除率可达到93.52%,氨氮去除率可达到97.11%;表明碱湖杆菌菌株w30具有明显的异养硝化能力和氨氮利用能力。
55.碱湖杆菌菌株w30在初始浓度为53.43mg/l的硝酸盐氮培养基中,在温度30℃、转速150rpm下,总氮去除率可达到90.64%,其中4.67mg/l通过反硝化作用去除,56.67mg/l通过同化作用去除,硝酸盐氮去除率可达到 100%,转化过程无亚硝酸盐的持续积累,有氧反硝化过程作用明显;表明碱湖杆菌菌株w30具有明显的有氧反硝化能力和硝酸盐氮利用能力。
56.碱湖杆菌菌株w30在初始浓度为55.00mg/l的亚硝酸盐氮培养基中,在温度30℃、转速150rpm下,总氮去除率可达到87.25%,亚硝酸盐氮去除率可达到99.98%;表明碱湖杆菌菌株w30具有明显的有氧反硝化能力和亚硝酸盐氮利用能力。
57.应用碱湖杆菌菌株w30对膜生物反应器出水进行处理时,补充含400 mg/l c的柠檬酸钠时,24h内硝酸盐氮的去除率可达到65.3%;补充含800 mg/l c的柠檬酸钠时,24h内硝酸盐氮的去除率可达到99.3%。故碱湖杆菌菌株w30在补充充足碳源的条件下可以对膜
生物反应器出水的硝酸盐氮有优异的脱除效果。
58.下述通过具体实施例和附图,对本公开进行详细说明。
59.需要说明的是,本公开各实施例中采用的培养基成分如下:
60.异养硝化富集培养基(nm):包括0.5g/l(nh4)2so4、0.36g/l kno3、4.0 g/l柠檬酸钠和0.05%(体积百分比)微量元素溶液;微量元素溶液包括6.5g/lk2hpo4·
3h2o、2.5g/l mgso4·
7h2o、2.5g/l nacl、0.05g/l feso4·
7h2o和 0.04g/l mnso4·
h2o;nm的ph为7.0;121℃高温灭菌20min。
61.好氧反硝化富集培养基(dm):包括0.36g/l kno3、10.55g/lna2hpo4·
12h2o、1.5g/l kh2po4、0.1g/l mgso4·
7h2o、4.0g/l柠檬酸钠和 0.2%(体积百分比)微量元素溶液;微量元素溶液包括50.0g/l edta-na2、 2.2g/l znso4、5.5g/l cacl2、5.06g/l mncl2·
4h2o、5.0g/l feso4·
7h2o、1.57 g/l cuso4·
5h2o和1.61g/l cocl2·
6h2o;dm的ph为7.0;121℃高温灭菌 20min。
62.显色培养基(gn):包括1.0g/l kno3、8.5g/l柠檬酸钠、1.0g/l l-天冬酰胺、1.0g/l kh2po4、1.0g/l mgso4·
7h2o、0.2g/l cacl2·
6h2o、0.05g/lfecl3·
6h2o和0.1%(体积百分比)的1%(质量百分比)的溴百里酚蓝(btb),调节gn的ph为7.0;在液体显色培养基中加入2%的琼脂即可制备成固体显色培养基;121℃高温灭菌20min。
63.lb培养基:lb液体培养基由lb broth培养基与蒸馏水混合配制,配置固体培养基时则添加2%(质量体积百分比)的琼脂粉(agar)。所有的lb培养基均经过立式压力蒸汽灭菌锅在0.11-0.15mpa和121℃下灭菌30min。
64.氨氮培养基(hnm):每升包括2.8674g c6h5na3o7、0.2359g(nh4)2so4、 50ml hnm微量元素溶液和蒸馏水。hnm微量元素溶液每升含有:5gk2hpo4或6.5g k2hpo4·
3h2o、2.5g mgso4·
7h2o和nacl、0.05gfeso4·
7h2o和mnso4·
4h2o。hnm的ph为7;121℃高温灭菌20min。
65.硝酸盐氮培养基(dm1):每升dm1包括2.867g柠檬酸钠、0.3611g kno3、 0.2g mgso4·
7h2o、1.5g kh2po4、10.55g na2hpo4·
12h2o、2ml的痕量元素和蒸馏水,每升痕量元素包括50.0g edta-na2、2.2g znso4·
7h2o、5.5gcacl2、5.06g mncl2·
4h2o、5.0g feso4·
7h2o、1.57g cuso4·
5h2o和1.61gcocl2·
6h2o;dm1的ph为7.0;121℃高温灭菌20min。
66.亚硝酸盐氮培养基(dm2):每升包括2.867g柠檬酸钠、0.2464g nano2、 0.2g mgso4·
7h2o、1.5g kh2po4、10.55g na2hpo4·
12h2o、2ml的微量元素溶液(组成同上述硝酸盐氮培养基的微量元素溶液)和蒸馏水,每升痕量元素包括50.0g edta-na2、2.2g znso4·
7h2o、5.5g cacl2、5.06g mncl2·
4h2o、 5.0g feso4·
7h2o、1.57g cuso4·
5h2o和1.61g cocl2·
6h2o;dm2的ph为 7;121℃高温灭菌20min。
67.下述实施例中涉及到的总氮、氨氮、硝酸盐氮和亚硝酸盐氮的测定方法分别如下:总氮(tn)采用碱性过硫酸钾消解紫外分光光度法测定;氨氮(nh
4+
‑ꢀ
n)采用纳氏试剂分光光度法测定;硝酸盐氮(no
3-‑
n)采用紫外分光光度法测定;亚硝酸盐氮(no
2-‑
n)采用n-(1-萘基)乙二胺光度法测定。
68.实施例1、碱湖杆菌菌株菌株(pannonibacter sp.w30)的筛选、分离纯化、形态学观察和分子生物学鉴定
69.下述实施例中采用的水样的采集地点位于北京市凉水河(e:116.22
°
,n: 39.90
°
)。
70.1、细菌初筛
71.1.1、异氧硝化微生物的富集和筛选
72.将采集的水样按照10%(体积百分比)的接种量接入250ml灭菌的以硫酸铵为唯一氮源的异养硝化富集培养基中;30℃、150rpm摇床培养;每隔48h按照10%的体积比更换新鲜的异养硝化培养基;连续培养30天进行富集、筛选。
73.1.2、有氧反硝化微生物的富集和筛选
74.将上述异养硝化富集培养基培养30天后,每隔24h弃去25ml的上清液,同时补充25ml新鲜灭菌的好氧反硝化富集培养基,于30℃、150rpm 摇床培养14天,进行进一步富集和驯化。
75.2、细菌复筛
76.2.1、涂布培养
77.取1ml经过初筛的水样的菌液均匀涂布于固体显色培养基;将完成涂布的平板置于30℃恒温培养箱中培养。
78.2.2、菌种的筛选
79.为进一步验证所挑取的单菌落具有使显色培养基变蓝的特性,挑取固体显色培养基中蓝色的单菌落接种于3ml灭菌的液体显色培养基中,30℃、 150rpm摇床培养,观察其颜色变化,选择能使液体显色培养基由绿色变成蓝色的菌株作为复筛菌。
80.3、分离纯化
81.使用lb固体平板培养基培养和传代筛选菌种,筛选具有异养硝化有氧反硝化作用的菌株。
82.4、形态学观察
83.对分离纯化的菌株进行形态学观察,挑选在lb平板培养基上单菌落为规则的圆形、有整齐的边缘和表面的光滑、颜色呈不透明的淡黄色、菌体较为黏着、湿润、易挑取、培养较长时间后菌落趋于淡红色的菌株,命名为w30;图1为w30的lb平板菌落形态图,图2为尺寸为5μm时w30的菌体形态图,图3位尺寸为500nm时w30的菌体形态图,由图2和图3所示,电子显微镜下观察其状态呈杆状,尾部似生有鞭毛,菌体平均长度为1.2μm。进行革兰氏染色鉴定w30为革兰氏阴性。
84.5、分子生物学鉴定
85.对w30的16s rdna基因片段进行扩增和测序,将得到的序列片段(长度为1380bp,如seq id no:1所示)提交到genbank数据库,登录号为: kt380575,与ncbi数据库进行blastn序列比对,w30与碱湖杆菌 (pannonibacter sp.)的多个菌株均有较高相似度。其中w30与pannonibacterphragmitetus strain c6-19(nr_028009.1)的同源性最高达到99.78%,初步鉴定 w30属于碱湖杆菌,已于2021年9月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏中心地址为:北京市朝阳区北辰西路1号院中国科学微生物研究所,保藏编号为cgmcc no.23484,其分类命名为碱湖杆菌w30(pannonibacter sp.w30)。
86.实施例2、脱氮菌剂的制备
87.1)取冰箱冷冻保存的已分离纯化并鉴定的碱湖杆菌菌株w30,接种于含有100ml高温灭菌的lb液体培养基的锥形瓶中;
88.2)将接种后的锥形瓶置于恒温震荡培养箱中以150rpm、30℃的条件下培养24小时,得到活化菌株;
89.3)将培养后的锥形瓶置于离心机中在4800rpm下离心8min,收集离心后的沉淀,采用1
×
无菌磷酸盐缓冲液漂洗3次,漂洗后加入10ml 1
×
磷酸盐缓冲液并混合均匀,得到脱氮菌剂。可以将该脱氮菌剂与体积百分比浓度为25%的灭菌甘油以1:1的体积比混合后于-80℃长期保存。
90.为了探究单一菌株作为微生物菌剂在膜生物反应器出水中的实际效果,需要对该菌株进行发酵扩大培养,因此,在使用50l发酵罐扩大繁殖之前,初步探索了碱湖杆菌菌株w30在摇瓶培养中的最佳生长条件。玉米浆营养丰富,常作为补充微生物养分的氮源,其经济特性使其成为工业生产中的常用培养基,适合用于微生物的大规模发酵和扩大培养。
91.玉米浆培养基优化碱湖杆菌菌株w30发酵条件:玉米浆液体培养基c/n 比为4.5,水溶液ph《4.5,用玉米浆培养有氧反硝化菌,制备菌剂,是实现资源化利用的一种方法。以10g/l玉米浆为主要成分,在摇瓶实验条件下,采用单因素试验对c/n比、培养基初始ph、补充碳源和转速四个因素进行优化。除变量外,其他不变量控制为c/n比为10,初始ph值为7,柠檬酸钠为补充碳源,30℃和150rpm。定时取样以确定600nm下的吸光值(od)。结果表明,碱湖杆菌菌株w30在c/n为10、初始ph为7、碳源为柠檬酸钠、转速为150rpm下具有良好的生长曲线和最大od值,且当转速为150 rpm时,发酵液的溶解氧浓度为5-6mg/l。
92.基于玉米浆培养基的菌剂扩大培养发酵:将脱氮菌剂按照1%的体积百分比接种于含有玉米浆培养基的50l发酵罐中发酵,控制发酵条件如下:ph 用0.5mol/l的氢氧化钠和0.5mol/l的盐酸溶液控制在7.5左右,温度30℃,补充柠檬酸钠额外碳源以调节发酵液的c/n比为10,并在发酵过程中适当补料,曝气量联合搅拌器控制发酵罐溶解氧为5-6mg/l,种子液接种量为1%。发酵期间每隔6h取样并检测发酵液的od值和活菌数(cfu/ml)。活菌数的测定采用梯度稀释平板涂布计数法,通过计算菌落形成单位(cfu,colonyforming unit)统计活菌数。48h后,菌株w30的生长进入稳定期,最大od
600
值和cfu分别为8.931和9.5
×
109/ml。
93.应用例.碱湖杆菌菌株w30(pannonibacter sp.w30)的脱氮应用
94.应用例1、碱湖杆菌菌株w30对氨氮、硝酸盐氮和亚硝酸盐氮的生物转化
95.将5ml脱氮菌剂以1%的体积百分比分别接种到含500ml氨氮培养基、硝酸盐氮培养基和亚硝酸盐氮培养基的锥形瓶中。培养基溶液的初始od
600
均控制在0.15左右,将锥形瓶均在30℃、150rpm下培养24小时,每隔3 小时在无菌环境下从锥形瓶中取样,测定od
600
、tn、dtn、nh
4+-n、no
3-ꢀ‑
n和no
2-‑
n。其中,除了od
600
和tn之外,其他指标皆采用0.45μm滤膜过滤培养液后测定,总氮和可溶性总氮在0时和24时测试。
96.1、氨氮培养基中的生物转化
97.如图4所示,氨氮初始浓度为50.03mg/l,24h内氨氮几乎被完全脱除,氨氮脱除率达到97.11%,0-9h的平均脱除速率为5.18mg/l/h,其中3-6h内 nh
4+-n浓度从41.73mg/l下降至11.10mg/l,脱除速率最大为10.21mg/l/h。期间,有少量的亚硝酸盐氮生成,在6h达到最大值为0.127mg/l,随后亚硝酸盐氮被利用而不再积累,no
2-‑
n浓度≤0.025mg/l。表明碱湖杆菌菌株 w30在利用氨氮时通过硝化作用将氨氮代谢为亚硝酸盐氮。
98.此外,0h时的tn浓度为66.33mg/l,经过24h的转化,tn下降至 53.00mg/l,dtn减少
至4.33mg/l。经过计算,13.33mg/l的氨氮经反硝化转化为气态氮而脱除,而48.67mg/l的氨氮经过同化作用因菌体自身生长利用而从培养基中去除。最终,在氨氮培养基中,碱湖杆菌菌株w30的tn脱除效率可以达到93.52%。
99.由此可见,碱湖杆菌菌株w30具有明显的异养硝化能力和氨氮利用能力。
100.2、硝酸盐氮培养基中的生物转化
101.如图5所示,第0小时硝酸盐氮培养基中硝酸盐氮含量为53.43mg/l, no
3-‑
n在第3小时开始逐渐被利用,6h为39.60mg/l,9h为8.21mg/l,在12h则检测不到硝酸盐氮。0-12h内碱湖杆菌菌株w30对硝酸盐氮的脱除率为100%,平均脱除速率为4.45mg/l/h,其中6-9h硝酸盐氮脱除速率达到最大,达到10.46mg/l/h。由图5可见,no
2-‑
n在9h和12h有短暂的积累,其中在12h硝酸盐氮的最大积累量为1.91mg/l,随后从15h之后几乎被完全降解不再积累。同样在9h和12h观察到了氨氮浓度的轻微上升和积累,在9h和12h时氨氮浓度分别为0.89mg/l和1.26mg/l,但随后氨氮也被降解。进一步表明碱湖杆菌菌株w30可脱除氨氮和亚硝酸盐氮。
102.此外,0h时的tn浓度为67.67mg/l,转化24h后,tn为63.00mg/l, dtn为6.33mg/l。经计算,4.67mg/l的硝酸盐氮通过反硝化作用去除,而 56.67mg/l的硝酸盐氮用于细菌生长的同化作用进而从培养基中去除。最终,在硝酸盐氮培养基中,w30的tn去除效率可以达到90.64%。
103.由此可见,碱湖杆菌菌株w30具有明显的有氧反硝化能力和硝酸盐氮利用能力。
104.3、亚硝酸盐氮培养基中的生物转化
105.如图6所示,0h时no
2-‑
n浓度为55.00mg/l,从6h开始no
2-‑
n逐渐被利用。相比于对nh
4+-n和no
3-‑
n的利用,碱湖杆菌菌株w30对no
2-ꢀ‑
n的利用明显较为迟缓。随着碱湖杆菌菌株w30的生长,no
2-‑
n的脱除速率逐渐提高。12h时亚硝酸盐氮浓度为32.33mg/l,15h则下降至0.088mg/l,几乎被完全脱除,因此碱湖杆菌菌株w30对亚硝酸盐氮的最大去除速率在 12-15h之间,达到10.77mg/l/h。随后,亚硝酸盐氮培养基中积累的残余no
3-ꢀ‑
n最终被完全消耗(≤0.016mg/l)。24h内亚硝酸盐氮的脱除率为99.98%, 0-15h的平均去除率达到3.66mg/l/h。
106.此外,0h时的tn浓度为68.00mg/l,经过24h的转化,tn为62.33 mg/l,dtn为8.67mg/l。经计算,5.67mg/l的亚硝酸盐氮通过反硝化作用脱除为气态氮,53.67mg/l的亚硝酸盐氮通过同化作用用于细菌生长进而从培养基中脱除。最终,在亚硝酸盐氮培养基中,碱湖杆菌菌株w30的tn去除率可以达到87.25%。
107.由此可见,碱湖杆菌菌株w30具有明显的有氧反硝化能力和亚硝酸盐氮利用能力。
108.应用例2、碱湖杆菌菌株w30(pannonibacter sp.w30)脱除膜生物反应器出水硝酸盐氮的应用
109.为探索碱湖杆菌菌株w30用于实际废水处理的应用前景,以mbr的高硝态氮出水水样作为硝酸盐培养基,考察了碱湖杆菌菌株w30在实际高硝酸盐生活污水中的硝酸盐去除效果。膜生物反应器的水质特征如表1所示:
110.表1.膜生物反应器出水水质特征
[0111][0112]
取100ml mbr出水加入250ml锥形瓶中,进行以下五组实验对照处理。处理1使用未接种并且不补充碳源的mbr出水,处理2脱氮菌剂按1%的接种量加入mbr出水中,控制初始od
600
在0.18左右,在处理2的基础上接种脱氮菌剂并添加400mg/l碳浓度和800mg/l碳浓度的柠檬酸钠作为碳源分别作为处理3和处理4。在振荡培养箱中以30℃、150rpm的速度培养24h后检测和计算脱氮效率。结果如表2所示:
[0113]
表2.碱湖杆菌菌株w30对mbr出水的硝酸盐氮去除效果
[0114][0115]
注:
‘
+’代表“添加”,
‘‑’
代表
‘
不添加’[0116]
由表2中结果可以看出,处理1中没有接种脱氮菌剂和无碳源补充时仅去除了8.7%的硝酸盐氮,处理2中仅接种脱氮菌剂而不补充碳源时,只去除了8.0%的硝酸盐氮,说明碱湖杆菌菌株w30在营养不足的条件下几乎没有脱氮功能。处理3和处理4表明提供柠檬酸钠作为补充碳源以及碱湖杆菌菌株w30作为生物强化菌剂接种的结果,其中补充400mg/l c时65.3%的硝酸盐氮被脱除,而在补充两倍于处理3的碳源时,处理4中的硝酸盐氮几乎被完全脱除。可见,补充充足的碳源可以满足碱湖杆菌菌株w30生长所需的营养条件,是维持反硝化能力和细胞生长的重要因素。因此,在废水处理的实际应用中,需要保持cod和tn等营养成分以保持微生物的活性。
[0117]
综上所述,本公开提供的碱湖杆菌菌株w30是异养硝化有氧反硝化菌,能够在有氧条件下以柠檬酸钠为碳源、以硝酸盐氮或亚硝酸盐氮为氮源,进行同化作用和反硝化作用脱氮,或者能够在有氧条件下以柠檬酸钠为碳源、以氨氮为氮源,进行同化作用、硝化作用和反硝化作用脱氮,具有显著的氨氮、硝酸盐氮和亚硝酸盐氮脱除效果,适用于含高浓度氨氮、硝酸盐氮和/或亚硝酸盐氮的废水的去除,能够高效地实现氨氮、硝酸盐氮和/或亚硝酸盐氮的转化;可以深度脱除膜生物反应器出水中的硝酸盐氮,在解决膜生物反应器出水高浓度硝酸盐氮积累的问题方面具有极大的应用价值。
[0118]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本公开的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本说明书一个或多个实施例的不同方面的许多其它变化,为了简明它们没有在细
节中提供。
[0119]
本说明书一个或多个实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本说明书一个或多个实施例的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本公开的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1