一种新金色分枝杆菌工程菌的基因编辑方法及系统
1.本发明属于基因工程技术领域,具体涉及一种新金色分枝杆菌工程菌的基因编辑方法及系统。
背景技术:
2.甾体类药物已批准上市的有300多种,是人类用于治疗疾病最重要的药品之一。其市场需求巨大,且生产规模逐年增长,这样的趋势归功于它广泛的治疗用途。甾体类药物主要分为两类,性激素和肾上腺皮质激素。其中性激素包括雄性激素,雌激素等,可用于治疗男性性器官功能障碍、妇科疾病和避孕等用途。肾上腺皮质激素包括糖皮质激素,盐皮质激素等,可用于治疗炎症、类风湿性关节炎、休克等症状。除此之外,甾体类药物还广泛应用于抗肿瘤、抗病毒、抗过敏和内分泌失调等疾病的治疗中。
3.甾体药物及甾体药物中间体在我国有着较大的生产和出口规模,有关于甾体合成、提取和优良菌种的研究从未中断,但与世界先进国家相比依旧存在着诸多不足,导致在该领域中始终处于市场的中低端地位。因此,急需打破国外在甾体类药物生产与研发的技术垄断。甾体类药物主要来源于各种甾体中间体,是一些包含甾烷核的分子,主要有4-雄烯-3,17-二酮(ad)、1,4-雄二烯-3,17-二酮(add)、9-羟基-4-雄烯-3,17-二酮(9-oh-ad)、22一羟基-23,24-二降胆-4-烯-3-酮(4-hbc)、22-羟基-23,24-二降胆-1,4-二烯-3-酮(1,4-hbc)和9,22-二羟基-23,24-二降胆-4-烯-3-酮(9-oh-4-hbc)等(见附图1)。
4.当前,微生物转化是制备甾体中间体的常见手段。虽然,化学合成的方法曾经在这一领域中拥有绝对的统治力,但最近的几十年中,正在被具有安全温和、成本低廉、生态友好的生物技术所替代。越来越多的利用微生物修饰类固醇的技术被报道,总体来说,这类技术可以实现在甾醇分子的特定位置引入或者改变需要的基团,且能够保证分子的特异性,并将多个反应步骤集成在一个生物中进行,甚至根据需求设计或创造新的代谢路径。能够合成甾体中间体产物的微生物种类十分繁多,其中放线菌属的新金色分枝杆菌(mycobacterium neoaurum,mn),可转化植物甾醇制备add、hbc和ad等甾体中间体,因具有摄取、利用胆固醇的天然能力,和良好的生长特性,是一种极具潜力的工业化生产菌。
5.新金色分枝杆菌从植物甾醇转化为甾体化合物这一过程,涉及十余种酶,路径复杂且繁琐。野生型新金色分枝杆菌很难积累大量的甾体中间体,这就需要利用基因技术改造菌株,如果需要积累hbc,则需要敲除或阻断3-甾酮-δ1-脱氢酶(ksdd)、17β胆固醇脱氢酶(hsd)和3-甾酮-9α-羟化酶(ksh)这些下游代谢的关键酶(见附图2)。传统的同源重组技术可以实现对这些基因的敲除与整合,但由于新金色分枝杆菌自身重组效率低(10-6
~10-5
)的影响,这一技术的使用,存在着操作繁杂、周期长、筛选难、效率低等诸多问题。近些年来,crispr/cas(规律间隔成簇短回文重复序列,clustered regularly interspaced short palindromic repeats)技术也被引入到新金色分枝杆菌的基因敲除中,可以精准地实施dna编辑,但受限于dna双链断开影响生长,同源、非同源修复效率低,大片段敲除扰乱邻近基因表达等缺点。
6.单碱基编辑(base editing,be)技术,crispr-n/d cas9(ncas9:cas9 d10a,dcas9:cas9 d10a/h840a)系统不具备dna链的切割功能,而保留了其特定位点的识别能力,避免了对宿主活性的影响。偶联胞嘧啶脱氨酶,可以将胞嘧啶(c)脱氨生成尿嘧啶(u),它将被解读为胸腺嘧啶(t),并在随后的dna复制中引起g:c到a:t碱基对的转换,可在编码链的特定位置引入终止密码子,起到沉默相关基因的作用。尿嘧啶dna糖化酶抑制基因(ugi)的表达可以抑制尿嘧啶糖苷酶对u的糖基化,避免细胞内的修复机制对突变位点的修复,提高编辑效率。这将是一种可获得的、简单的、高效的遗传工具,更有利于推动生产甾体的新金色分枝杆菌的改造和研究。
技术实现要素:
7.针对现有技术存在的问题,本发明的目的在于设计提供一种新金色分枝杆菌工程菌的基因编辑系统及其应用的技术方案,该发明首次在野生型分枝杆菌mycobacteriumneoaurum atcc 25795中构建了快速、高效和稳定的rapobec-n/dcas9-ugi+sgrna单碱基编辑系统,对ksha1和ksha2两个基因进行定点碱基编辑,获得可高效积累add的基因工程菌株。
8.本发明具体通过以下技术方案实现:
9.本发明一方面提供了一种新金色分枝杆菌工程菌的基因编辑系统,其包括pmv261-rapobec/n(d)cas9/ugi质粒和ptarget-sgrna质粒;
10.所述pmv261-rapobec/n(d)cas9/ugi质粒通过以下步骤得到:
11.以pmv261为骨架,包含分枝杆菌复制子orim、启动子hsp60、大肠杆菌复制子orie和终止子rrnb与卡那抗性基因kan,在启动子hsp60和终止子rrnb之间插入rapobec、n(d)cas9和ugi基因片段,rapobec与n(d)cas9通过linker1连接,n(d)cas9和ugi通过linker2连接,用gibson组装的方式形成一个完整可表达的质粒,在大肠杆菌中克隆得到pmv261-rapobec/n(d)cas9/ugi质粒;
12.所述ptarget-sgrna质粒通过以下步骤得到:
13.以ptarget为骨架,包含不同于pmv261的orim的高拷贝复制子orime、潮霉素抗性基因hyg和大肠杆菌复制子orie,连接sgrna基因片段,所述sgrna为靶向序列,可特异性靶向靶序列,在大肠杆菌中克隆得到ptarget-sgrna质粒。
14.进一步,所述rapobec的核苷酸序列如seq id no:1所示,所述ugi基因的核苷酸序列如seq id no:2所示;所述ncas9基因的核苷酸序列如seq id no:3所示;所述dcas9基因的核苷酸序列如seq id no:4所示;所述linker1的核苷酸序列如seq id no:5所示;所述linker2的核苷酸序列如seq id no:6所示。
15.进一步,所述ptarget的核苷酸序列如seq id no:7所示,所述orime的核苷酸序列如seq id no:8所示;所述hyg的核苷酸序列如seq id no:9所示;所述orie的核苷酸序列如seq id no:10所示。
16.进一步,所述ptarget-sgrna质粒还包括ptarget-sgrna_(ksha1-1),ptarget-sgrna_(ksha1-2),ptarget-sgrna_(ksha2)质粒,所述ptarget-sgrna_(ksha1-1),ptarget-sgrna_(ksha1-2),ptarget-sgrna_(ksha2)质粒具体是以ptarget-sgrna为模板,分别用ksha1和ksha2基因相关的靶向引物pcr扩增突变。
7.2;
34.潮霉素b:母液100mg/ml,工作浓度200mg/l;
35.卡那霉素:母液50mg/ml,工作浓度50mg/l;
36.固体培养基:液体培养基加2%琼脂粉;
37.植物甾醇溶液:100g/l植物甾醇,370g/l羟丙基环糊精。
38.(2)下述实施例中涉及的pcr反应如下:
39.pcr片段扩增体系:上下游引物各2μl,模板50-100ng,dntp 1μl,2x buffer25μl,dna聚合酶1μl,ddh2o补足至50μl;
40.pcr片段扩增程序:95℃~5min,95℃~15s,(tm-5℃)~15s,72℃~30s/kb,72℃~10min,30个循环。
41.(3)下述实施例中涉及gibson组装连接反应如下:
42.线性化载体:(0.02*载体大小)ng,插入片段:(0.04*片段大小)ng,2xclonexpress mix 10μl,ddh2o补足至20μl,50℃~20min,化转至大肠杆菌dh5α感受态中。
43.(4)下述实施例中涉及新金色分枝杆菌感受态细胞的制备与电转化方法如下:
44.从甘油管中取一环菌液,在lb固体培养基上三区划线,30℃培养36h;挑单克隆于5ml lb液体中,30℃振荡培养36h;2%转接到50ml lb中,30℃振荡培养6h,待od
600
为1.5-2时;培养液冰上静置30min,4000g,4℃离心10min,去上清;用预冷的10%甘油水溶液,30ml重悬,冰上放置10min,4000g,4℃离心10min,去上清,重复3次;再用2ml 10%甘油水溶液重悬,分装到ep管中,每管100μl,于-80℃保存。
45.100-300ng质粒加入分枝杆菌感受态(已于冰上溶解)中,4℃静置20min;gene pulser xcell型电穿孔仪设定电压2.5kv,电击杯孔径选择2mm,电击2次;确认电击频率为(4-5ms)-1
范围,电击后4℃静置3min;加入600μl新鲜lb培养基,转移至无菌离心管;37℃低速振荡复苏3-4h,5000g离心3min,取100μl上清重悬,全部涂布在抗性平皿上,37℃培养5-7d。
46.(5)下述实施例中涉及基因编辑效率的计算方法:
47.基因编辑总效率=(测序验证进行碱基编辑的菌落数量/挑取转化子的总数量)
×
100%;
48.基因编辑成功效率=(测序验证已形成终止密码子的菌落数量/挑取转化子的总数量)
×
100%。
49.(6)下述实施例中涉及新金色分枝杆菌转化植物甾醇的方法如下:
50.挑单克隆于5ml lb液体中,30℃振荡培养36h;2%转接到100ml lb中,30℃振荡培养12h,加入已灭菌的植物甾醇底物溶液(工作浓度为5g/l),30℃继续振荡培养。
51.(7)下述实施例中涉及的检测方法如下:
52.样品处理方式:乙酸乙酯萃取2:1,氮吹挥发,甲醇复溶。
53.液相检测方法:产物检测,c18柱(5μm,4.6*250mm),75%甲醇,254nm,1ml/min,35℃;底物检测,c18柱(5μm,4.6*250mm),100%甲醇,210nm,1ml/min,35℃。
54.实施例1:单碱基编辑质粒pmv261-rapobec/n(d)cas9/ugi(pbe)的构建
55.(1)质粒线性化与插入片段的获取
56.质粒pmv261的线性化,以pmv-f1:5
’‑
ccattgcgaagtgattcctccgg-3’,pmv-r1:5
’‑
gttaactagcgtacgatcgactgcc-3’为引物,pcr扩增和凝胶电泳验证(见附图5),并加入0.5μldpni37℃~2h消化模板,产物纯化回收。
57.rapobec(核苷酸序列如seq id no:1)、ugi(核苷酸序列如seq id no:2)与n(d)cas9(核苷酸序列如seq id no:3,seq id no:4)三个基因通过基因合成获得,并插入到pet28a质粒的多克隆位点,保存在大肠杆菌dh5α中。
58.提取pet28a-rapobec,pet28a-ugi,pet28a-ncas9和pet28a-dcas9质粒作为模板,用引物apo-f:ggaggaatcacttcgcaatggatgtcgtcggagaccggcccc和apo-r:ggactccggggtggcggactccgaggtgcccggggtctcggagccggacttcaggccggtggcccacaggatg(小写为linker1,核苷酸序列如seq id no:5),pcr扩增得到rapobec基因片段;用引物cas9-f:agtccgccaccccggagtccgataagaaatactcaataggcttagcgatcggcac和cas-r:gtcacctcctagctgactcaaatcaatgcg,pcr扩增得到n(d)cas9基因片段;用引物ugi-f:ttgagtcagctaggaggtgactcgggcggctcgaccaacctgtcgg(小写为linker2,核苷酸序列如seq id no:6)和ugi-r:tcgatcgtacgctagttaactcacagcatcttgatcttgttctcgccgttgctgt,pcr扩增得到ugi基因片段。
59.(2)多片段连接与克隆
60.将rapobec、ugi、n(d)cas9基因片段(见附图5)与pmv261线性质粒,按照比例加入到pcr管中,再加入clonexpress mix和双蒸水,连接后化转至大肠杆菌dh5α中,涂布于kanr平板,37℃倒置培养16h,挑取转化子进行pcr(见附图5)和测序验证,pcr和测序引物为pmv-f2:ataggcgagtgctaagaataacg和pmv-r2:atggctcataacaccccttg。测序正确的阳性转化子转接至lb液体培养基中(含kanr),37℃-180rpm振荡培养16h,提取得到pmv261-rapobec/ncas9/ugi(pbe)和pmv261-rapobec/dcas9/ugi(pbed)质粒。pmv261-rapobec/ncas9/ugi的质粒图谱见附图3。
61.实施例2:单碱基编辑质粒ptarget-sgrna、ptarget-sgrna_(ksha1-1),ptarget-sgrna_(ksha1-2),ptarget-sgrna_(ksha2)的构建
62.(1)质粒线性化与插入片段的获取
63.通过基因合成得到ptarget质粒骨架(核苷酸序列如seq id no:7),其包含能够在分枝杆菌中独立复制的orime复制子(核苷酸序列如seq id no:8)、潮霉素抗性基因hyg(核苷酸序列如seq id no:9)和大肠杆菌复制子orie(核苷酸序列如seq id no:10),保存在大肠杆菌dh5α中,lb中培养和提取得到质粒ptarget。以pt-f:agactcgagtctagagtttaaacagtattaaacgc和pt-r:aaataaaacgaaaggctcagtcgaaagact为引物,pcr扩增和和凝胶电泳验证(见附图5),并加入0.5μldpni37℃~2h消化模板,产物纯化回收得到线性化质粒。
64.通过基因合成得到sgrna序列(核苷酸序列如seq id no:11),以c9sg-f:taaactctagactcgagtctgatttaggtgacactatagatttcacacatagtgg和c9sg-r:ctgagcctttcgttttattttcgacggatcctatgtatgcaccga为引物,pcr扩增和和凝胶电泳验证(见附图5),产物纯化回收得到带有20bp同源序列的基因片段。
65.(2)多片段连接与克隆
66.将sgrna基因片段与ptarget线性质粒,按照比例加入到pcr管中,再加入clonexpress mix和双蒸水,连接后化转至大肠杆菌dh5α中,涂布于kanr平板,37℃倒置培养16h,挑取转化子进行pcr和测序验证(见附图5),pcr和测序引物为sg-f:
gggaaacgcctggtatctttatagt和sg-r:aagcttaagagtttgtagaaacgca。测序正确的阳性转化子转接至lb液体培养基中(含hygr),37℃-180rpm振荡培养16h,提取得到ptarget-sgrna(pts)质粒。
67.(3)n20突变
68.以pts为模板,分别用引物ka1-sg-f1:atttcacacaagccagtacctgcacaacgtgttttagagctagaa和ka1-sg-r1:acgttgtgcaggtactggcttgtgtgaaatctata、ka1-sg-f2:atttcacacatcctgcaggatgtcgagatcgttttagagctagaa和ka1-sg-r2:gatctcgacatcctgcaggatgtgtgaaatctata、ka2-sg-f:atttcacacaggcgccaggattcaccgtgggttttagagctagaa和ka2-sg-r:ccacggtgaatcctggcgcctgtgtgaaatctata(下划线部分为pam位点的n20序列)pcr扩增,电泳和测序验证后,纯化pcr产物即可得到ptarget-sgrna_(ksha1-1),ptarget-sgrna_(ksha1-2),ptarget-sgrna_(ksha2)质粒,可用于新金色分枝杆菌的ksha1(核苷酸序列如seq id no:12)和ksha2(核苷酸序列如seq id no:13)基因的编辑。ptarget-sgrna的质粒图谱见附图4。
69.实施例3:单碱基编辑系统的应用
70.将构建好的pbe和pbed质粒分别电转化进入新金色分枝杆菌中,在kanr平板上筛选阳性转化子,菌落pcr和测序引物同为pmv-f2和pmv-r2,验证正确的转化子转接至5ml液体lb(kanr)中,30℃~180rpm振荡培养3d,再2%转接到50ml lb(kanr)中30℃~180rpm振荡培养用于电转感受态的制备,得到mn-pbe和mn-pbed感受态。
71.实施例4:新金色分枝杆菌中ksha1和ksha2的基因编辑
72.提取pts_(ksha1-1),pts_(ksha1-2),pts_(ksha2)质粒,分别加入200ng到mn-pbe感受态细胞中进行电转化,复苏后涂布于kanr和hygr双抗平板上进行培养,待转化子生成,挑取20个转化子测序分析其目的基因pam-n20区域的碱基编辑情况。
73.提取pts_(ksha1-1)质粒,200ng加入到mn-pbed感受态细胞中进行电转化,复苏后涂布于kanr和hygr双抗平板上进行培养,待转化子生成,挑取20个转化子测序分析其目的基因pam-n20区域的碱基编辑情况。
74.表1:ksha1-1基因的基因编辑效率
[0075][0076]
表2:ksha1-2基因的基因编辑效率
[0077][0078]
表3:ksha2基因的基因编辑效率
[0079][0080]
表4:ksha1基因的基因编辑效率(pbed)
[0081][0082]
实施例5:ptarget质粒消除与迭代沉默基因
[0083]
将在n20区域形成终止密码子的mn-pbe-pts_(ksha1-1)菌株,在kanr抗性液体lb中反复传代5次,即可消除pts_(ksha1-1)质粒,获得mn-ksh1(be)菌株。并进一步制备新金色分枝杆菌电转化感受态,转入pts_(ksha2)质粒,进行ksh酶的双基因编辑,最终再次传代消除pts_(ksha2)质粒,获得mn-ksh12(be)菌株。
[0084]
实施例6:表型验证实验
[0085]
以mn-ksh1(be)和mn-ksh12(be)两株菌发酵转化植物甾醇,挑单克隆于5ml lb(kanr)液体中,30℃振荡培养36h。2%转接到100ml lb(kanr)中,30℃振荡培养12h,加入已灭菌的植物甾醇底物溶液(工作浓度为5g/l),30℃继续振荡培养100h和150h取样,液相检
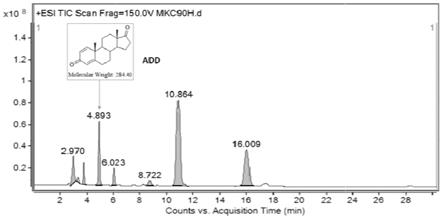
测产物add,mn-ksh1(be)在100h有add产物积累(见附图6),但在150h产物降低较多,而mn-ksh12(be)150h的add产量高于120h,摩尔转化率分别为67.9%和53.6%。
[0086]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0087]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1