芽孢杆菌属新菌种及其用途的制作方法
1.本发明属于酿酒微生物技术领域,具体涉及芽孢杆菌属新菌种及其用途。
背景技术:
2.自然环境中可培养的微生物的种类百分比很低,如海水中为0.1%以下,在土壤中约为0.3%。传统固态白酒中可培养微生物也不例外,通过高通量测序,我们发现大多数不可培养微生物,然而,使用传统的细菌培养方法仅能培养自然环境中的一小部分细菌。应用传统方法培养出的微生物都是已知微生物,尚未发现新的微生物物种。
3.酿酒原料是富含蛋白质和淀粉的粮食谷物,富集了庞大的微生物体系。微生物所产酶系对白酒酿造具有至关重要的作用,其中淀粉酶能够将淀粉分解成微生物可以利用的发酵性糖,而蛋白酶能水解蛋白产生氨基酸,可以促进美拉德反应,且能有利于微生物生长和生成醇类等风味物质。产蛋白酶的微生物主要有枯草芽孢杆菌、地衣芽孢杆菌(bacillus licheniformis)、短小芽孢杆菌(bacillus pumilus)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、嗜碱性芽孢杆菌(bacillus sp)和最新报道的克劳氏芽孢杆菌(bacillus clausii)。有报道从浓香型酒醅中筛选到地衣芽孢杆菌,其产蛋白酶活力达到51.84u/ml;另外,从高温大曲中筛选到苏云金芽孢杆菌,其蛋白酶获达到142.81u/ml;还有报道从白酒大曲和酒醅中筛选到产蛋白酶活力为163.82u/ml的枯草芽孢杆菌,将其作为菌剂添加到大曲中,发酵产酒率和酒品品质都有明显提高。然而,目前发现的能够高产蛋白酶和淀粉酶的功能微生物种类还较少,还有待进一步开发。
4.另外,众所周知,酒中的基本组分一致,主要是乙醇和水,约占总量的98%,剩余2%的组分才是形成白酒独特风格的色谱骨架成分和微量香气物质。目前白酒中香气组分已检出2000多种,主要包含酯类、有机酸、醇类、醛酮化合物、芳香族化合物等物质。它们的含量虽然极少,但却决定着白酒的风格特征。目前发现的能够风味物质的功能微生物还较少,利用微生物发酵来对白酒增香的技术还有待进一步开发。
技术实现要素:
5.本发明要解决的技术问题为:绝大多数新的微生物物种还没培养出来,需要开发;现有白酒功能微生物种类较少,需要开发。
6.本发明解决上述技术问题的技术方案为:提供一种芽孢杆菌属新菌种。本发明所述的芽孢杆菌属新菌种,保藏编号为cgmcc no.22045。保藏日期为2021年3月22日,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101。
7.其中,上述芽孢杆菌属新菌种的16s rdna的核苷酸序列如seq id no:1所示。
8.seq id no:1芽孢杆菌属新菌种的16s rdna核苷酸序列
9.cgaaccgattaagagcttgctcttaagaagttagcggcggacgggtgagtaacacgtgggtaacctgcctataagactgggataactccgggaaaccggggctaataccggataacattttgcaccgcatggtgcgaaattgaa
no.22045。本发明的芽孢杆菌的温度耐受为20-40℃,乙醇耐受浓度为≤8%,盐度耐受为≤2%,ph耐受为5-10。且能够同时高产蛋白酶和淀粉酶;还能够同时高产2-哌啶酮、苯乙醇、3-苯丙酸、乙偶姻等多种功能性风味物质,产风味物质含量分别为:2-哌啶酮22.0ppm、苯乙醇19.1ppm、3-苯丙酸18.6ppm、乙偶姻7.6ppm。因此,本发明的菌种可以广泛应用于浓香型白酒酿造中提升白酒的酒体品质。本发明为提高浓香型白酒质量和产率方面提供了一种新的微生物,在酿酒领域具有很广阔的应用空间。
21.本发明的芽孢杆菌属新菌种于2021年3月22日保藏在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为:cgmcc no.22045。保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101。分类命名为bacillus sp.。
附图说明
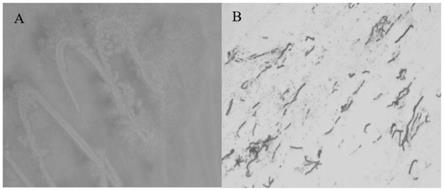
22.图1为本发明芽孢杆菌属新菌种形态图,其中a:菌落图;b:细胞图;
23.图2为本发明芽孢杆菌属新菌种的16s rdna系统发育树图;
24.图3为本发明芽孢杆菌属新菌种的产蛋白酶平板图;
25.图4为本发明芽孢杆菌属新菌种的耐受温度图;
26.图5为本发明芽孢杆菌属新菌种的耐乙醇能力图;
27.图6为本发明芽孢杆菌属新菌种的耐受盐度图;
28.图7为本发明芽孢杆菌属新菌种的耐受ph图;
29.图8为本发明芽孢杆菌属新菌种在曲坯中发酵后的hs-spme图。
具体实施方式
30.本发明提供了一株菌株:芽孢杆菌属新菌种,其是在宜宾五粮液股份有限公司浓香型白酒窖泥中筛选得到的,命名为wly-b-l8。本发明的新菌种已于2021年3月22日进行保藏,保藏编号为cgmcc no.22045,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101。
31.本发明所述的新菌种菌株芽孢杆菌wly-b-l8的温度耐受为20-40℃,乙醇耐受浓度为≤8%,盐度耐受为≤2%,ph耐受为5-10。
32.本发明所述的新菌种菌株芽孢杆菌wly-b-l8产蛋白酶,活力为119u/ml。
33.本发明所述的新菌种菌株芽孢杆菌wly-b-l8产淀粉酶,活力为7.1u/ml。
34.本发明所述的新菌种菌株芽孢杆菌wly-b-l8产2-哌啶酮、苯乙醇、乙偶姻等功能性风味物质,含量分别为:2-哌啶酮22.0ppm、苯乙醇19.1ppm、3-苯丙酸18.6ppm、乙偶姻7.6ppm。
35.本发明芽孢杆菌wly-b-l8为新菌种菌株,补充了新的宝贵的菌种资源,具有很高的应用价值。
36.下面将通过实施例对本发明的具体实施方式做进一步的解释说明,但不表示将本发明的保护范围限制在实施例所述范围内。
37.若未特别指明,实施例中所用的化学试剂均为常规市售试剂,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
38.实施例中使用的分离培养基pca组成包括:胰蛋白胨5份、酵母浸粉2.5份,葡萄糖
一份,纳他霉素2份、溶于1000份蒸馏水中,再混合后用naoh调节ph至7.2。
39.实施例中使用的培养基na组成包括:牛肉浸膏3份、蛋白胨5份、葡萄糖2.5份,1000ml蒸馏水,naoh调节ph至7.0。
40.实施例中使用的斜面和平板为相应培养基中加入2%的琼脂粉。
41.实施例中所提及到的乙醇浓度为体积浓度。
42.实施例1新菌种菌株芽孢杆菌wly-b-l8的分离、筛选和鉴定
43.(一)分离、筛选
44.将取自宜宾五粮液股份有限公司酿酒车间的空气样品,利用pca培养基筛选细菌。用浮游菌采样器(浙江苏净净化设备有限公司,fkc-i型)采样一分钟(100l空气),采样重复3次。37℃静置培养3天,挑选平板上的菌落进行划线后培养,重复三次,直至分离获得纯化的菌株,斜面保存。菌株命名为wly-b-l8。
45.(二)分类、鉴定
46.1、菌株的形态学特征
47.分离得到的wly-b-l8菌株为革兰氏阳性,菌落呈白色,表面干燥,边缘不整齐;细胞形态为:呈杆状。
48.2、生理生化特性
49.上述芽孢杆菌属新菌种的生物学特征为:能够利用d-葡萄糖、d-果糖、n-乙酰葡萄糖胺、七叶灵(柠檬酸铁)、d-麦芽糖、d-蔗糖、淀粉、糖原,不能利用丙三醇、赤藻糖醇、d-阿拉伯糖、l-阿拉伯糖、d-核糖、d-木糖、l-木糖、d-核糖醇、甲基-β-d吡喃木糖苷、d-半乳糖、d-甘露糖、l-山梨糖、l-鼠李糖、卫矛醇、肌醇、d-甘露醇、山梨醇、甲基-α-d-吡喃甘露糖苷、甲基-α-d-吡喃葡萄糖苷、苦杏仁苷、熊果苷、水杨苷、d-纤维二糖、d-乳糖、d-密二糖、d-海藻糖、菊粉、d-松三糖、d-棉子糖、木糖醇、d-龙胆二糖;过氧化氢试验呈阳性。
50.3、16s rdna鉴定
51.将菌株wly-b-l8接种于na培养基中,37℃静置培养3天,取1ml菌液,离心收集菌体,用细菌基因组提取试剂盒提取基因组dna,-20℃保藏备用。
52.利用引物27f和1492r对细菌基因组16s rdna进行扩增,27f:agtttgatcmtggctcag(seq id no:2),1492r:ggttaccttgttacgactt(seq id no:3)。
53.扩增体系(共25μl):10
×
pcr buffer 2.5μl,dntp(2.5mmol/l each)1μl,dna 10ng,引物f(10μmol/l)0.5μl,引物r(10μmol/l)0.5μl,加双蒸水至25μl。扩增程序::94℃4min;94℃45s,55℃45s,72℃60s,共30个循环;72℃10min,4℃终止反应。
54.16s rdna序列测定:利用胶回收试剂盒(上海生工,b110092)进行pcr扩增产物的纯化;纯化产物的测序工作由中国工业微生物菌种保藏管理中心完成,测定结果得到菌株wly-b-l9的16s rdna序列如seq id no:1所示。
55.系统发育树构建:将所测定的细菌16s rdna基因序列分别与genbank数据库进行blastn相似性分析,与实验菌株亲缘关系最近的模式菌株bacillus pseudomycoides dsm 12442
t
(acmx01000133)相似度为98.21%,小于临界值98.65%。选取与实验菌株亲缘关系相对较近的标准菌株用clustalw软件进行序列比对,采用mega 7软件进行系统发育分析,构建系统发育树,如图2所示。
56.4、全基因组dddh和ani分析
57.将芽孢杆菌wly-b-l8送至中国工业微生物菌种保藏管理中心(cicc)进行全基因组dddh和ani分析。结果显示其与模式菌株bacillus pseudomycoides dsm 12442
t
(acmx01000133)的dddh值为26.1%,远低于临界值70%;结果显示其与模式菌株bacillus pseudomycoides dsm 12442
t
(gca-000161455)和bacillus cytotoxicus nvh 391-98
t
(gca-000017425)的ani值分别为80.57%和78.70%,远低于临界值95%。
58.综合菌体形态、生理生化特性、16s rdna基因序列和全基因dddh分析,将菌株wly-b-l8鉴定为芽孢杆菌(bacillus sp.)新菌种。该菌株wly-b-l8于2021年3月22日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏编号为cgmcc no.22045。
59.实施例2新菌种菌株芽孢杆菌wly-b-l8产蛋白酶测定
60.蛋白酶是分解蛋白质肽键一类水解酶的总称,它能有效水解原料种的蛋白质,破坏原料颗粒间质细胞壁的结构,使原料种可利用碳源增加,同时由于蛋白质的水解作用,提高了发酵料种氨基态氮的含量,促进酵母生长繁殖,加快发酵速率。因此,在白酒生产过程中,蛋白酶起到了至关重要的作用。
61.(一)定性测定
62.1.方法
63.将新菌种菌株wly-b-l8划线接种于pca平板,30℃培养3天长出单菌落。
64.将上述单菌落接种于蛋白酶测定培养基平板中央,配方为:脱脂奶粉20g,自来水600ml,搅拌均匀后于115℃高压灭菌20min;琼脂20g,自来水400ml,搅拌均匀后于121℃高压灭菌20min,灭菌完后的脱脂奶粉和琼脂溶液混匀。在30℃培养3天。共做3个平行。
65.2.结果
66.上述平板的菌落周围形成透明圈,测定透明圈直径为2.1cm-2.2cm(见图3),说明产生了蛋白酶。
67.(二)定量测定
68.1.方法
69.(1)酪氨酸标准曲线的绘制
70.采用参考文献中(fan weiye et al.metaproteomic analysis of enzymatic composition in baobaoqu fermentation starter for wuliangye baijiu[j].international journal of food science&technology,2021,56(8):4170-4181.)的方法配置酪氨酸标准溶液,并根据660nm波长处吸光值制作酪氨酸标准曲线,设置3个平行。测得酪氨酸溶液与其吸光度值的回归方程为:y=8.2778x-0.0087,r2=0.9998(y表示吸光度,x表示酪氨酸浓度)。
[0071]
(2)蛋白酶粗酶液制备
[0072]
将新菌种菌株wly-b-l8单菌落接种至发酵培养基(参照上述文献)中,于28℃,160rpm摇床中恒温发酵3天。吸取发酵后的培养液,在10000rpm条件下离心10min,上清液即为粗酶液。
[0073]
(3)蛋白酶活力测定
[0074]
蛋白酶活力测定方法参照上述文献进行。
[0075]
蛋白酶活力定义:1ml液体酶,温度在40℃、ph在7.2的条件下,1min水解酪蛋白产
生1μg酪氨酸,即为1个蛋白酶活力单位(u/ml)。根据此和标准曲线计算酶活。试验作3个平行。
[0076]
2.结果
[0077]
三组平行吸光度值分别为0.3316,0.3651和0.3325,平均值为0.3431,代入标准曲线方程,计算出新菌种菌株芽孢杆菌wly-b-l8最终蛋白酶活力为119u/ml。
[0078]
实施例3新菌种菌株芽孢杆菌wly-b-l8产淀粉酶测定
[0079]
α-淀粉酶能迅速水解α-1,4葡萄糖苷键,将庞大的淀粉分子断裂成较小分子,使淀粉浆黏度急速降低,生成糊精及少量麦芽糖和低聚糖进入下一步发酵过程中,因此,在白酒生产过程种,α-淀粉酶起到了至关重要的作用。
[0080]
(一)定性测定
[0081]
1.方法
[0082]
将新菌种菌株wly-b-l8划线接种于pca平板,30℃培养3天长出单菌落。
[0083]
将上述单菌落接种于淀粉酶测定培养基平板中央,配方为:可溶性淀粉20g,蛋白胨20g,酵母粉10g,曲利酚蓝溶液0.1g,琼脂20g,水1 000ml,ph自然,搅拌均匀后于121℃高压灭菌20min,在30℃培养3天。共做3个平行。
[0084]
2.结果
[0085]
上述平板的菌落周围形成透明圈,测定透明圈直径为1.4cm-1.5cm,说明产生了淀粉酶。
[0086]
(二)α-淀粉酶定量测定
[0087]
1.方法
[0088]
(1)麦芽糖标准曲线的绘制
[0089]
参考上述文献的方法配置麦芽糖标准溶液,并根据520nm波长处吸光值制作酪氨酸标准曲线,设置3个平行。测得麦芽糖溶液与其吸光度值的回归方程为:y=0.8796x+0.0049,r2=0.9995(y表示吸光度,x表示麦芽糖浓度)。
[0090]
(2)淀粉酶粗酶液制备
[0091]
将新菌种菌株wly-b-l8单菌落接种至发酵培养基(参照上述文献)中,于28℃,160rpm摇床中恒温发酵3天。吸取发酵后的培养液,在10000rpm条件下离心10min,上清液即为粗酶液。
[0092]
(3)α-淀粉酶活力测定
[0093]
α-淀粉酶活力测定方法参照上述文献进行。
[0094]
α-淀粉酶定义:温度在时,1ml液体酶,于60℃、ph6.0条件下,1min液化淀粉产生1mg麦芽糖量,将此定义为1个α-淀粉酶活力单位(u/ml)。根据此和标准曲线计算酶活。试验作3个平行。
[0095]
2.结果
[0096]
三组平行吸光度值分别为1.1404,0.9930和1.0062,平均值为1.0465,代入标准曲线方程,计算出新菌种菌株芽孢杆菌wly-b-l8最终α-淀粉酶活力为7.1u/ml。
[0097]
实施例4新菌种菌株芽孢杆菌wly-b-l8的耐温度能力试验
[0098]
将菌株wly-b-l8接种于液体na培养基中活化,培养到对数生长期od
600
=1.8,按照体积比5%的接种量接种到50ml液体na培养基,分别放置在不同温度(15、20、25、30、35、40
和45℃)的培养箱中培养3天。利用紫外/可见光分光光度计(eppendorf bio spectrometer)测定吸光度od
600
。计算培养后与前的od
600
差值,结果如图4所示。
[0099]
由图4可知,菌株wly-b-l8在20℃和40℃培养后其od
600
差值分别为0.85和1.26,而当温度为15℃和45℃时,其od
600
差值几乎为0,表明基本不生长。因此菌株wly-b-l8的温度耐受能力为20-40℃。
[0100]
实施例5新菌种菌株芽孢杆菌wly-b-l8的耐乙醇能力试验
[0101]
将菌株wly-b-l8接种于液体na培养基中活化,培养到对数生长期od
600
=1.8,按照体积比5%的接种量接种到含不同浓度乙醇(2%、4%、6%、8%和10%)的100ml液体na培养基,37℃培养3天。利用紫外/可见光分光光度计(eppendorf bio spectrometer)测定吸光度od
600
。计算培养后与前的od
600
差值,结果如图5所示。
[0102]
由图5可知,菌株wly-b-l8在乙醇浓度为8%的na培养基中培养后其od
600
差值为0.12,而当乙醇浓度为10%时,其od
600
差值几乎为0,表明基本不生长。因此菌株wly-b-l8的乙醇耐受能力为8%。
[0103]
实施例6新菌种菌株芽孢杆菌wly-b-l8的耐盐能力
[0104]
将菌株wly-b-l8接种于液体na培养基中活化,培养到对数生长期od
600
=1.8,按照体积比5%的接种量接种到含不同nacl(0%、2%、2%和6%)的100ml液体na培养基,37℃培养3天。利用紫外/可见光分光光度计(eppendorf bio spectrometer)测定吸光度od
600
。计算培养后与前的od
600
差值,结果如图6所示。
[0105]
由图6可知,菌株wly-b-l8在nacl为2%的na培养基中培养后其od
600
差值为0.76,而当盐度为4%时,其od
600
差值几乎为0,表明不生长。因此菌株wly-b-l8的nacl耐受能力为2%。
[0106]
实施例7新菌种菌株芽孢杆菌wly-b-l8的耐酸能力
[0107]
将菌株wly-b-l8接种于液体na培养基中活化,培养到对数生长期od
600
=1.8,按照体积比5%的接种量接种到含不同ph(4、5、6、7、8、9、10和11)的100ml液体na培养基,37℃培养3天。利用紫外/可见光分光光度计(eppendorfbiospectrometer)测定吸光度od
600
。计算培养后与前的od
600
差值,结果如图7所示。
[0108]
由图7可知,菌株wly-b-l8在ph为5和10的na培养基中培养后其od
600
差值分别为0.65和0.58,而当ph为4和11时,其od
600
差值几乎为0,表明不生长。因此,菌株wly-b-l8的ph耐受能力为5-10。
[0109]
实施例8新菌种菌株芽孢杆菌wly-b-l8的产风味物质试验
[0110]
将菌株wly-b-l8接种于液体na培养基中活化,培养到对数生长期od
600
=1.8,接种5ml至250ml三角瓶装50g曲坯的培养基中,曲坯为小麦按照五粮液制曲生产工艺经润料、磨粉、拌料所得,空白组接相同量无菌水,37℃培养3天后测风味成分。
[0111]
1、检测方法:称取10g培养物,加入10ml二氯甲烷,充分振荡10min,超声提取20min,利用0.22μm滤膜过滤液体2ml,加入10μl内标(4-辛醇),经气相色谱-质谱联用(gc-ms)测定其可挥发性风味成分。
[0112]
(1)gc条件:tg-waxms(30.0m
×
0.25mm
×
0.25μm),进样口温度250℃,载气(he)流速1ml/min,不分流模式进样;气相色谱升温程序:起始柱温40℃,保持5min,以4℃/min升至230℃,保持15min。
[0113]
(2)ms条件:质谱ei源,电子轰击能量70ev;离子源温度200℃,四级杆温度150℃,质量数扫描范围35~350amu。
[0114]
以4-辛醇(0.5ppm)为内标,采用峰面积归一化法进行半定量分析。采用选择离子(sim)计算各化合物的峰面积,并与内标物质的峰面积之比计算各化合物的浓度。
[0115]
2、结果:在曲坯培养基中,芽孢杆菌wly-b-l8产的主要风味物质为2-哌啶酮、苯乙醇、乙偶姻等。
[0116]
(1)gc-ms色谱图
[0117]
出峰见图8。
[0118]
(2)风味物质信息见表1。
[0119]
表1新菌种芽孢杆菌wly-b-l8及空白风味物质信息表(ppm)
[0120]
名称wly-b-l8空白乙偶姻7.58-3-甲基戊酸8.80-4-甲基戊酸7.42-苯乙醇19.08-2-哌啶酮21.95-3-苯丙酸18.60-[0121]
注:
“‑”
表示没有检测出。
[0122]
由表1可知,芽孢杆菌wly-b-l8在曲坯培养基中培养后的主要风味物质为2-哌啶酮、苯乙醇、3-苯丙酸、乙偶姻等,含量分别为:2-哌啶酮22.0ppm、苯乙醇19.1ppm、3-苯丙酸18.6ppm、乙偶姻7.6ppm。空白培养基中几乎没有检出。哌啶酮类化合物及其衍生物都是具有一定生物活性的物质,具有抗癌活性,能够治疗中枢神经疾病等;苯乙醇是一种芳香烃的衍生物,具有玫瑰香气,是重要的活性成分,具有抗氧化作用;3-苯丙酸可作香料的定香剂,有轻微的甜香,是重要的香味物质。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1