高表达高比活蛋白酶K突变体序列、毕赤酵母表达质粒的构建及菌株筛选和纯化方法与流程
高表达高比活蛋白酶k突变体序列、毕赤酵母表达质粒的构建及菌株筛选和纯化方法
技术领域
1.本发明涉及酶基因功能改造技术领域,具体涉及高表达高比活蛋白酶k(proteinase k) 序列的确认、该序列毕赤酵母表达载体的构建、分泌表达蛋白酶k的毕赤酵母菌株proteinase k
ꢀ‑
m/ pgapzα-a/gs115构建、构建结果及利用它来生产高表达高活性蛋白酶k的纯化方法。
背景技术:
2.蛋白酶k( proteinase k) 是从白色念珠菌林伯氏白色念球菌(tritirachium album limber)分离出来的强力蛋白溶解酶,是一种切割活性较广的丝氨酸蛋白酶。它切割脂族氨基酸和芳香族氨基酸的羧基端肽键。由于蛋白酶k在尿素和sds中稳定,还具有降解天然蛋白质的能力,因而它应用很广泛,包括制备脉冲电泳的染色体dna,蛋白质印迹以及去除dna和rna制备中的核酸酶。蛋白酶k已广泛应用在皮革、毛皮、丝绸、医药、食品、酿造等方面。皮革工业的脱毛和软化已大量利用蛋白酶,既节省时间,又改善劳动卫生条件。蛋白酶还可用于蚕丝脱胶、肉类嫩化、酒类澄清。临床上可作药用,如用胃蛋白酶治疗消化不良,用酸性蛋白酶治疗支气管炎,用弹性蛋白酶治疗脉管炎以及用胰蛋白酶、胰凝乳蛋白酶对外科化脓性创口的净化及胸腔间浆膜粘连的治疗。加酶洗衣粉是洗涤剂中的新产品,含碱性蛋白酶,能去除衣物上的血渍和蛋白污物。而来自自然界微生物产生的蛋白酶k,由于菌体内含量低,活性低,提取工艺复杂,生产成本高,市场价格居高不下,阻碍了蛋白酶k的推广使用。
技术实现要素:
3.为解决上述技术问题,本发明提供一种高表达高比活蛋白酶k突变体序列、毕赤酵母表达质粒的构建及菌株筛选和纯化方法。
4.本发明提供如下技术方案:我们选择重组表达的蛋白酶k是白色念珠菌林伯氏白色念球菌(tritirachium album limber)分离出来的强力蛋白溶解酶,是一种切割活性较广的丝氨酸蛋白酶,成熟的蛋白酶k含有384个氨基酸,分子量为40299道尔顿,ph值为6.68。根据对蛋白酶k分子结构及序列的分析,我们设计将第66位的缬氨酸(val)突变为丝氨酸(ser),以提高蛋白酶k的比活性并增加蛋白酶k在毕赤酵母表达系统的表达量。
5.一种蛋白酶k突变体,蛋白酶k突变体的氨基酸序列为seq id no.1所示。
6.该序列的特点是将第66位的缬氨酸(val)突变为丝氨酸(ser),以提高蛋白酶k的比活性。同时,本发明采用毕赤酵母分泌表达系统,该系统产量高、生产成本低兼有真核表达系统翻译后修饰功能等优点,可以用于大量生产蛋白酶k,降低生产成本。
7.蛋白酶k毕赤酵母重组菌株的构建方法为:将修饰突变的蛋白酶kproteinase k基因插入pgapzα-a空载体的gap启动子/α-factor信号肽下游位点,并删除载体上的kex2位点
lys-arg之后的ste13位点glu-ala-glu-ala,构建成蛋白酶k基因分泌型表达载体proteinase k-m/ pgapzα-a;利用电转化的方法将proteinase k-m/ pgapzα-a载体转化毕赤酵母(pichia pastoris)的菌株gs115,构建成分泌型表达蛋白酶k突变体的毕赤酵母工程菌株proteinase k-m/ pgapzα-a/gs115;通过抗生素筛选、sds-page电泳分析及生物比活性测定,获得高表达高活性的蛋白酶k突变体毕赤酵母重组菌株。
8.上述的毕赤酵母重组菌株目标蛋白:蛋白酶k突变体(proteinase k-m)的表达量达到366.7毫克/升,比活性为26.8国际单位/毫克;目标蛋白蛋白酶k突变体比天然的蛋白酶k比活性高7-8倍,且具有很高的稳定性。
9.蛋白酶k突变体的纯化方法为:利用获得高活性的蛋白酶k突变体毕赤酵母重组菌株进行发酵,离心收集上清液,以氢氧化钠调节ph值,过阴离子交换层析柱,收集目标洗脱峰,得到纯度约70%的蛋白酶k突变体粗品,透析除盐,超滤浓缩,过分子筛层析柱,收集目标蛋白,得到纯度大于95%的蛋白酶k突变体蛋白。
10.与现有技术相比,本发明的有益效果是:本发明采用基因工程表达的方法生产高活性的蛋白酶k突变体,比活性达到26.8国际单位/毫克,表达量达到366.7毫克/升蛋白,通过纯化可获得纯度达95%以上的目标蛋白蛋白酶k,为蛋白酶k今后的推广使用奠定良好基础。
附图说明
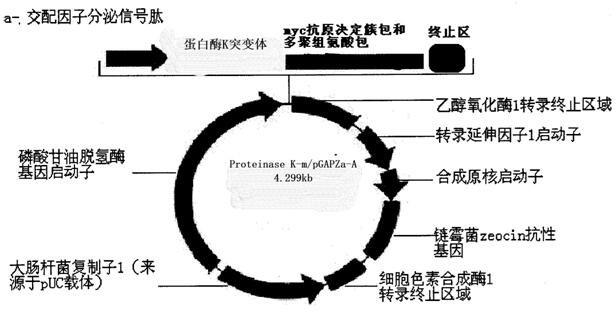
11.图1为蛋白酶k突变体(proteinase k-m)表达载体构建图。
12.proteinase k-m/ pgapzα-a表达载体分子大小为4.299kb。其中pgapzα-a为3.147kb,proteinase k-m为1152bp(包含终止子密码);proteinase k-m插入于载体pgapzα-a第747与824bp(xbai位点)之间。
13.pgapzα-a载体结构为:磷酸甘油酸脱氢酶基因(gap)启动子区域:第1-483bp,磷酸甘油酸脱氢酶基因启动子引物位点:第455-476bp,α-交配因子分泌信号肽序列:第493-759bp,α-交配因子分泌信号肽引物位点:第696-716bp,载体多克隆位点:第760-828bp,myc抗原决定簇包:第827-856bp,3
’‑
乙醇氧化酶1基因引物位点:第974-994bp,乙醇氧化酶1转录终止区域:第593-1233bp,转录延伸因子1启动子区域:第1234-1644bp,合成原核启动子:第1645-1712bp,链霉菌zeocin抗性基因阅读框:第1713-2087bp,细胞色素合成酶1转录终止区域:第2088-2405bp,大肠杆菌复制子1(来源于puc载体):第2416-3089bp。
具体实施方式
14.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
15.实施例1蛋白酶k突变体(proteinase k-m)毕赤酵母工程菌的构建1、根据蛋白酶k突变体的氨基酸序列和酵母对密码子的偏好,设计蛋白酶k突变体全核苷酸序列,并在序列两端引入相应的酶切位点xhoi和xbai,由大连宝生物公司合成该序列。
16.2、采用基因克隆技术将蛋白酶k突变体基因经xhoi/xbai双酶切后插入pgapzα-a之gap启动子/α-factor信号肽下游的xhoi/xbai位点,构建成含α-factor信号肽的分泌型毕赤酵母表达载体;proteinase k-m/ pgapzα-a表达载体分子大小为3.876kb。其中pgapzα-a为3.147kb,proteinase k-m为732bp(包含终止子密码),蛋白酶k突变体插入于载体pgapzα-a第747bp与824bp(xbai位点)之间,具体情况见附图。
17.3、通过电转化方法,将线性化的proteinase k-m/ pgapzα-a质粒转入毕赤酵母gs115感受态(购于invitrogen公司)中,通过zeocin抗生素筛选获得阳性菌株,进一步用pcr和southern blotting技术鉴定筛选出的阳性菌株,再用sds-page电泳方法和sds-page活性测定方法筛选高表达高活性的proteinase k-m/ pgapzα-a/gs115工程菌株。
18.实施例2蛋白酶k突变体的纯化方法1、从-80℃种子库中取出proteinase k-m/ pgapzα-a/gs115工程菌,接种平板,使菌株活化;2、从平板中挑单菌落于200毫升ypd+zeocin100毫克/升培养基中,30℃,250转/分钟,培养48小时,此为一级种子液;3、吸取100毫升的一级种子液接种于2升的ypd培养基中,30℃,250转/分钟,培养24小时,此为二级种子液;4、将2升的二级种子液接种于含40升ypd培养基的发酵罐中,发酵72小时,离心收集发酵上清液,以1摩尔氢氧化钠溶液调节ph7.5-8.0,过deae sepharoseff层析柱,收集0.5摩尔/升氯化钠溶液洗脱峰,透析过夜除盐,此时可得到纯度大约为70%左右的蛋白酶k突变体蛋白粗品,超滤浓缩,过g75层析柱,收集目标蛋白峰,得到纯度大于95%的蛋白酶k突变体蛋白原液,将原液冻干保存。
19.实施例3蛋白酶k突变体活性检测1、标准曲线制备 准确称取预先于105 ℃干燥至恒重的l-酪氨酸标准品0.1000 g,用1 mol/l盐酸溶液60 ml溶解后定容至100 ml,即为1 mg/ml酪氨酸溶液。吸取1 mg/ml酪氨酸溶液10.00 ml,用 0.1 mol/l盐酸溶液定容至100 ml,即得到100 μg/ml的l-酪氨酸标准储备液。按10、20、30、40、50、60、70、80、90μg/ml的浓度进行标准溶液配制。分别取3 ml酪氨酸标准溶液至比色皿中,置于紫外可见分光光度计中测量275 nm处各个浓度 酪氨酸标准溶液的吸光度值。
20.2、吸取2 ml实施例2得到的蛋白酶k突变体蛋白原液至10 ml离心管中,于55 ℃水
浴锅温浴2 min。加入2 ml 10 g/l酪蛋白溶液,混匀后置于55 ℃水浴锅温浴5 min。加入4 ml 0.4 mol/l三氯乙酸溶液混匀,终止反应,静止5 min。于快速定量滤纸中过滤,吸取 3 ml滤液至比色皿275 nm处测量其吸光度值。测量前先用2 ml相应缓冲液代替酶液进行反应后,将滤液于275 nm处调零。测定结果为比活性为26.8国际单位/毫克。
21.本发明采用基因工程表达的方法生产高活性的蛋白酶k突变体,比活性达到26.8国际单位/毫克,表达量达到366.7毫克/升蛋白,目标蛋白蛋白酶k突变体比天然的蛋白酶k比活性高7-8倍,且具有很高的稳定性。通过纯化可获得的目标蛋白蛋白酶k的纯度高达95%以上,为蛋白酶k今后的推广使用奠定良好基础。
22.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1