一种与小麦抗条锈QTL连锁的KASP分子标记及应用
一种与小麦抗条锈qtl连锁的kasp分子标记及应用
技术领域
1.本发明属于作物分子遗传育种技术领域,尤其涉及一种与小麦抗条锈qtl连锁的kasp分子标记及应用。
背景技术:
2.目前,小麦条锈病是由条形柄锈菌puccinia striiformis f.sp.tritici(pst)引起的一种气传真菌病害,严重危害小麦生产。发掘、鉴定及利用有效的抗病基因,开发与其紧密连锁的分子标记并应用于培育持久抗条锈病小麦品种是控制条锈病危害的最有效措施。
3.至今为止,已经被正式命名的抗条锈病基因有83个(yr1-yr83)。由于条锈菌致病性变异快,新毒性小种的出现和流行,导致多数抗条锈病性基因相继丧失了抗性,而失去抗病育种利用价值。因此,不断挖掘新的条锈病抗源并将其应用到小麦生产是抗病品种培育极其重要的事情。分子标记可以实现抗病基因的快速发掘定位,与抗病性状相关联的分子标记可以用于分子标记辅助选择,实现抗病基因的快速检测和有效育种利用。然而,传统分子标记检测通量低,效率低下,无法实现大规模筛选。近年来,随着基因芯片和高通量测序技术的发展,基于生物个体间基因组序列单碱基多态性(single nucleotidepolymorphism,snp)标记被成功开发。以snp为基础的第三代kasp(kompetitive allele specific pcr)分子标记具有高通量、位点丰富、成本低、稳定性好等优点,在作物基因定位、克隆及分子标记辅助选择育种中发挥了重要作用。
4.目前,国际上已报道了一大批抗小麦条锈病的qtl位点。这些抗病位点分布在小麦的21条染色体上。但是,多数抗条锈病qtl为微效位点,仅在部分试验环境中检测到,qtl在染色体上的连锁区间较大,部分位点具有不可重复性。此外,多数被报道的qtl位点缺乏可用于育种选择的紧密连锁的高通量检测的分子标记。因此,不断发掘小麦主效抗条锈病新位点并开发与其紧密的高通量检测标记,对抗病品种培育工作具有重要的意义。
5.前期通过qtl定位的方法,从四川农业大学小麦所选育的小麦品种蜀麦126中鉴定到一个抗条锈病位点qyr.sicau-2as,位于2a染色体短臂上的7.58cm区间。但是,目前尚未有关于qyr.sicau-2as紧密连锁kasp分子标记的报道,无法实现对该抗病位点进行快速、高效的选择,极大的限制该抗性位点在小麦抗病育种中的利用。
技术实现要素:
6.针对现有技术存在的问题,本发明提供了一种与小麦抗条锈qtl连锁的kasp分子标记及应用,尤其涉及一种与小麦抗条锈病位点qyr.sicau-2as连锁的特异kasp分子标记及其应用。所述分子标记与抗条锈病位点qyr.sicau-2as紧密连锁,可用于对该位点进行分子标记辅助选择,选择准确性高,可显著提高不同环境下抗条锈病小麦品种的选择鉴定效率。
7.基于以上目的,本发明利用小麦55k snp芯片对来自文献[程宇坤.2019.长江中下
游麦区小麦地方种质条锈病抗性与产量相关性状多样性评价及其qtl定位[d].博士毕业论文](甘肃农科院植保所)的台长29(感病亲本)与四川农业大学小麦所选育的四川省审定小麦品种蜀麦126(抗病亲本)杂交获得的f6代重组自交系群体进行条锈病抗性位点的qtl分析。小麦55k snp芯片是在小麦660k snp芯片的基础上开发的一款经济型中密度snp芯片。芯片包含55,000个左右的小麦snp标记,均匀分布在21条染色体上,每条染色体上平均有2,600个标记,标记间的平均遗传距离约为0.1cm,平均物理距离小于300kb,适合于一般的种质资源多样性分析、遗传作图与新基因发掘、比较基因组分析、品种注册与鉴别(指纹分析)。
[0008]
根据55k snp芯片数据,利用joinmap4.0构建遗传图谱。结合群体的抗病表型数据,用qtl icimapping4.1定位抗条锈病qtl位点,在2a染色体短臂上的7.58cm区间定位出在所有检测环境均稳定表达的主效抗条锈病位点qyr.sicau-2as,对获得的多态性snp位点进行分子标记的开发,最终得到2对kasp分子标记的核苷酸序列包括第一核苷酸序列和第二核苷酸序列与抗条锈病位点qyr.sicau-2as紧密连锁。
[0009]
本发明提供的分子标记不仅可以高效、准确检测含抗条锈病位点qyr.sicau-2as的小麦株系,还可用该标记进行高通量的分子标记辅助选择,有效提高育种效率,服务于小麦抗病分子育种。
[0010]
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
[0011]
一种与小麦抗条锈qtl连锁的kasp分子标记,所述与小麦抗条锈qtl连锁的kasp分子标记的核苷酸序列包括第一核苷酸序列和第二核苷酸序列;
[0012]
所述第一核苷酸序列为seq id no:1,所述第二核苷酸序列为seq id no:2。
[0013]
本发明的另一目的在于提供一种应用所述的与小麦抗条锈qtl连锁的kasp分子标记与小麦抗条锈qtl连锁的kasp分子标记的引物组,所述与小麦抗条锈qtl连锁的kasp分子标记的引物组包括第一核苷酸序列的引物组和第二核苷酸序列的引物组。
[0014]
进一步,所述第一核苷酸序列的引物组包括核苷酸序列为seq id no:3的引物组1、核苷酸序列为seq id no:4的引物组2和核苷酸序列如seq id no:5的引物组3。
[0015]
进一步,所述第二核苷酸序列的引物组包括核苷酸序列为seq id no:6的引物组4、核苷酸序列为seq id no:7的引物组5和核苷酸序列为seq id no:8的引物组6。
[0016]
本发明的另一目的在于提供一种应用所述的与小麦抗条锈qtl连锁的kasp分子标记的引物组的筛选含有抗条锈病位点qyr.sicau-2as的小麦株系方法,所述筛选含有抗条锈病位点qyr.sicau-2as的小麦株系方法包括:
[0017]
以待测植株样品的基因组dna作为模板,利用所述与小麦抗条锈qtl连锁的kasp分子标记的引物组对模板进行荧光定量pcr扩增,利用扩增结果进行基因型分型。
[0018]
具体地,在本发明的一个实施例中,上述的应用,包括如下步骤:
[0019]
1.提取植物基因组dna;
[0020]
2.以待测植物基因组dna为模板,利用所述分子标记的引物组,在仪器cfx96 real-time system,进行pcr扩增反应并读值;
[0021]
进一步,所述荧光定量pcr的反应体系为:5μl sybr green、1.4μl混合引物、5ng模板dna、双蒸水加至总量为10μl。
[0022]
进一步,所述荧光定量pcr的反应程序为:95℃预变性10min;95℃变性20s,61~55
℃退火延伸40s,10个循环,每个循降退火延伸低0.6℃;95℃变性20s,55℃退火延伸60s,30个循环。
[0023]
本发明的另一目的在于提供一种所述的与小麦抗条锈qtl连锁的kasp分子标记在作物分子育种、筛选具抗条锈病抗性的小麦品种或品系中的应用。
[0024]
本发明的另一目的在于提供一种所述的与小麦抗条锈qtl连锁的kasp分子标记的引物组在作物分子育种、筛选具抗条锈病抗性的小麦品种或品系中的应用。
[0025]
结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的与小麦抗条锈qtl连锁的kasp分子标记及应用,公开了基于荧光定量pcr平台精确检测小麦抗条锈病位点qyr.sicau-2as的分子标记的核苷酸序列包括第一核苷酸序列和第二核苷酸序列,且为共显性标记,检测准确高效、扩增方便稳定。公开的kasp分子标记与抗条锈病位点qyr.sicau-2as呈现紧密连锁标记特征,用于分子标记辅助选择的准确性高,可显著提高抗病小麦品种的选择鉴定效率。
[0026]
本发明提供了位于小麦2a染色体上的与小麦抗条锈病连锁的分子标记的核苷酸序列包括第一核苷酸序列和第二核苷酸序列,所述分子标记是小麦2a染色体短臂上抗条锈病位点qyr.sicau-2as的侧翼标记,连锁度高。本发明提供的标记可用来检测小麦2a染色体上的抗条锈病位点qyr.sicau-2as,快速筛选具有该位点的植株,进而提高小麦抗病育种效率。
附图说明
[0027]
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
[0028]
图1是本发明实施例提供的筛选含有抗条锈病位点qyr.sicau-2as的小麦株系方法流程图。
[0029]
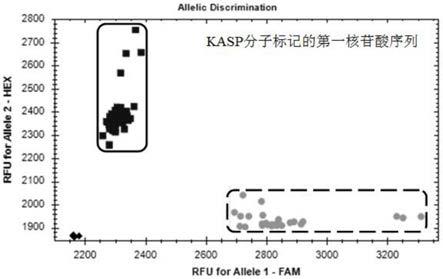
图2是本发明实施例提供的kasp分子标记的第一核苷酸序列检测亲本蜀麦126、台长29及其重组自交系群体的分型图;
[0030]
图中:虚线框为感条锈病品种台长29一致的分型图;实线框为抗条锈病品种蜀麦126一致的分型图;黑色为空白对照。
[0031]
图3是本发明实施例提供的kasp分子标记的第二核苷酸序列检测亲本蜀麦126、台长29及其重组自交系群体的分型图;
[0032]
图中:虚线框为与感条锈病品种台长29一致的分型;实线框为与抗条锈病品种蜀麦126一致的分型;黑色为空白对照。
具体实施方式
[0033]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0034]
针对现有技术存在的问题,本发明提供了一种与小麦抗条锈qtl连锁的kasp分子
标记及应用,下面结合附图对本发明作详细的描述。
[0035]
如图1所示,本发明实施例提供的筛选含有抗条锈病位点qyr.sicau-2as的小麦株系方法包括以下步骤:
[0036]
s101,以待测植株样品的基因组dna作为模板;
[0037]
s102,利用所述与小麦抗条锈qtl连锁的kasp分子标记的引物组对模板进行荧光定量pcr扩增;
[0038]
s103,利用扩增结果进行基因型分型。
[0039]
下面结合具体实施例对本发明的技术方案作进一步描述。
[0040]
实施例1:小麦抗条锈病病位点qyr.sicau-2as连锁kasp分子标记的获得
[0041]
1.供试材料
[0042]
利用小麦感病品种台长29为父本,以小麦抗病品种蜀麦126为母本杂交,得到杂种f1,f1代自交获得f2,使用单粒传法到f6代,获得含有154个单株的重组自交系,构成遗传作图群体。
[0043]
2.苗期和成株期条锈病抗性表型鉴定
[0044]
苗期抗性鉴定:苗期2叶期,利用我国当前流行条锈菌生理小种cyr34(来自甘肃省农科院植保所),采用喷雾法对蜀麦126、台长29及154个重组自交系进行条锈菌接种。待诱发感病品系sy95-71(四川农业大学小麦所选育)完全发病时(接种后14-18天),鉴定条锈病抗性,鉴定标准采用侵染类型(it)值参考0~9级[lineand qayoum1992.virulence,aggressiveness,evolution and distribution of races of puccinia striiformis(the causes of stripe rust of wheat)in north america,1968-1987.tech.bull.1788:42-46],其中0~2级为高抗,3~5级中抗,6级中感,7~9级感病。调查疾病严重度(ds)值,ds值标准参考修改的cobbscale方法(peterson et al.1948.can.j.res.26:496-500)。
[0045]
田间条锈病抗性鉴定:田间利用混合小种(cyr32,cyr33,cyr34,zhong4,andhy46)采用涂抹法进行接种。混合小种来自甘肃省农科院植保所。待诱发材料sy95-71充分发病时进行条锈病抗性的表型鉴定。分别调查it值和疾病严重度(ds)值。
[0046]
3. 55k snp芯片分析
[0047]
用植物dna提取试剂盒(tiangenbiotech co.ltd,beijing,china)提取亲本蜀麦126、台长29和重组自交系群体植株dna。送样至公司进行基因型分析,在本发明中双亲和作图群体的基因型分析由北京中玉金生物技术有限公司(http://www.cgmb.com.cn/)与贾继增课题组合作开发的55k snp芯片完成,该芯片市售可得。根据55k snp芯片数据,利用joinmap4.0构建遗传图谱。结合群体的抗病表型数据,用qtl icimapping4.1中的完备区间作图法(inclusive composite interval mapping-add,icim-add),设置阀值lod≥2.5的条件下,用2020-2021年6个成株期和1个苗期共7个环境的mds值来检测qtl,定位出小麦抗条锈病位点qyr.sicau-2as。
[0048]
4.抗条锈病位点qyr.sicau-2as连锁标记开发
[0049]
利用55k snp芯片数据定位结果,根据snp标记的多态性位点设计kasp分子标记,利用小麦族多组学数据网站(http://202.194.139.32/)检测引物特异性。
[0050]
利用该kasp标记对抗病亲本蜀麦126、感病亲本台长29及重组自交系群体的基因
组dna进行kasp扩增反应,抗感材料能够明显分型,第一核苷酸序列(见seq id no:1)和第二核苷酸序列(见seq id no:2)。
[0051]
第一核苷酸序列的核苷酸序列(见seq id no:1),如下所示:
[0052]
5'-tatactacaacaattgtggtacatcctcatttggt[c/t]gttttccaagaactacaaagacccaagtagctagg-3';
[0053]
第二核苷酸序列的核苷酸序列(见seq id no:2),如下所示:
[0054]
5'-ctgacgtaagacgtgtttcttctgtttgccgtgta[c/t]attttgatgcacgctcgatgtatcctctcgtaagc-3'。
[0055]
用于扩增第一核苷酸序列的kasp分子标记引物(加荧光序列)组包括3条引物,分别为:引物组1、引物组2和引物组3。
[0056]
引物组1的核苷酸序列(见seq id no:3),如下所示:
[0057]
5'-gaaggtgaccaagttcatgcttgtggtacatcctcatttggtc-3';
[0058]
引物组2的核苷酸序列(见seq id no:4),如下所示:
[0059]
5'-gaaggtcggagtcaacggatttgtggtacatcctcatttggtt-3';
[0060]
引物组3的核苷酸序列(见seq id no:5,共用下游引物c),如下所示:
[0061]
5'-cctagctacttgggtctttgt-3';
[0062]
用于扩增第二核苷酸序列的kasp分子标记引物(加荧光序列)组包括3条引物,分别为:引物组4、引物组5和引物组6。
[0063]
引物组4的核苷酸序列(见seq id no:6),如下所示:
[0064]
5'-gaaggtgaccaagttcatgcttgtttcttctgtttgccgtgtat-3';
[0065]
引物组5的核苷酸序列(见seq id no:7),如下所示:
[0066]
5'-gaaggtcggagtcaacggatttgtttcttctgtttgccgtgtac-3';
[0067]
引物组6的核苷酸序列(见seq id no:8,共用下游引物c),如下所示:
[0068]
5'-ttgcgacaagtattagcgga-3';
[0069]
第一核苷酸序列的引物和第二核苷酸序列的引物的pcr扩增体系一致。pcr扩增体系均为:5μl sybr green(takara)、0.5μl的基因组dna(100ng/μl)、1.4μl的引物混合物和3.1μl的ddh2o。
[0070]
pcr扩增程序,具体如下:
[0071]
(1)95℃预变性10min;
[0072]
(2)95℃变性20s,61~55℃退火延伸40s,10个循环,每个循降退火延伸低0.6℃;
[0073]
(3)95℃变性20s,55℃退火延伸60s,30个循环。
[0074]
本发明实施例提供的kasp分子标记第一核苷酸序列检测亲本蜀麦126、台长29及其重组自交系群体的分型图如图2所示,本发明实施例提供的kasp分子标记第二核苷酸序列检测亲本蜀麦126、台长29及其重组自交系群体的分型图如图3所示。
[0075]
pcr扩增结果,基因分型为虚线框(台长29)为感条锈病株系,实线框(蜀麦126)为抗条锈病株系;黑色为空白对照。
[0076]
实施例2:小麦抗条锈病位点qyr.sicau-2as连锁kasp分子标记的应用
[0077]
利用与qyr.sicau-2as区段连锁的kasp分子标记第一核苷酸序列和第二核苷酸序列对台长29和蜀麦126杂交获得的154个重组自交系单株进行kasp标记检测。按照实施例1
的方法提取叶片dna为模板,利用本发明提供的kasp分子标记第一核苷酸序列和第二核苷酸序列的荧光引物组进行扩增,用于扩增第一核苷酸序列和第二核苷酸序列标记的荧光引物组如实施例1中所示。pcr扩增体系、pcr扩增程序和基因分型同实施例1。
[0078]
通过标记分型结果,筛选在第一核苷酸序列和第二核苷酸序列扩增基因分型与蜀麦126一致的株系30个。获得的这些株系携带蜀麦126抗病位点qyr.sicau-2as区段。对这30个株系进行条锈病抗性鉴定,条锈病抗性鉴定方法同实施例1。每个株系的基因型与苗期和成株期表型鉴定值如表1所示。试验结果表明,这30个含有抗条锈病位点qyr.sicau-2as的株系在苗期和成株期均表现对条锈病的抗性。
[0079]
综上所述,利用本发明开发的与抗条锈病位点qyr.sicau-2as连锁的kasp分子标记的第一核苷酸序列和第二核苷酸序列,可以实现对抗条锈病位点qyr.sicau-2as的高通量准确检测,并用于跟踪鉴定抗条锈病位点qtl qyr.sicau-2as。含有qyr.sicau-2as位点的株系均表现对条锈病抗性。因此,本发明开发的与抗条锈病位点qyr.sicau-2as紧密连锁的kasp分子标记第一核苷酸序列和第二核苷酸序列,在抗条锈病基因的分子标记辅助选择育种中具有重要实践意义。
[0080]
表1台长29
×
蜀麦126重组自交系基因型与表型鉴定结果
[0081]
[0082][0083]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1