作为Nav1.8抑制剂的并环化合物及其用途的制作方法
作为nav1.8抑制剂的并环化合物及其用途
技术领域
1.本发明涉及对钠离子通道nav1.8具有抑制活性的并环化合物及其用途。
背景技术:
2.疼痛是一种复杂的生理心理活动,是临床上最常见的症状之一。疼痛原本作为人体的一种保护机制,意在提醒人们注意潜在的危险,但异常的疼痛则会造成生理功能紊乱,尤其是慢性疼痛,严重影响人们的生活质量。据2019年的一份报告显示(http://news.medlive.cn/anes/info-progress/show-153086_201.html),全球慢性疼痛的患病率达12%~30%。在美国,疼痛的患者人数已经超过了糖尿病、心脏病和癌症的患病人数,每年因疼痛造成的经济损失高达5600~6350亿美元(https://www.physio-pedia.com/epidemiology_of_pain);而中国2015年的统计数据显示,疼痛市场也高达208亿人民币(https://paindoctor.com/resources/chronic-pain-statistics/)。目前常用的止痛药阿片类受体激动剂、环氧合酶抑制剂、gaba受体激动剂等,或存在成瘾性、呼吸抑制问题,或存在胃肠道副作用,或导致心血管不良反应、中枢抑制等,临床需求远未得到满足。由此可见,疼痛市场潜力巨大(nora d.volkow,a.thomas mclellan.opioid abuse in chronic pain-misconceptions and mitigation strategies.n engl j med,2016,374(13):1253-63.sheng h g,shao j y,kir kland s c,et al.inhibition of human colon cancer cell growth by selective inhibition of cyclooxygenase-2.j chm invest,1997,99:2254.janette brohan,basavana g.goudra.the role of gaba receptor agonists in anesthesia and sedation.cns drugs,2017.)。
3.疼痛包含多种类型,按刺激性质可分为机械痛、温度性疼痛、化学性疼痛;按炎症病因可分为炎性痛、非炎性痛;按神经部位可分为中枢神经性疼痛、周围神经性疼痛、植物神经性痛;按病程长短则可分为急性痛和慢性痛。无论哪种形式的疼痛,都离不开钠离子通道(voltage-gated sodium channels,navs)的参与。
4.人体痛觉的产生源于遍布全身的周围神经末梢的痛觉感受器,其可将机械刺激、热刺激、冷刺激、化学刺激转化为神经冲动,经传入神经传递到背根神经节(dorsal root ganglia,drg),再经传出神经传至神经中枢,从而使人感知疼痛(bennett dl,clark aj,huang j,et al.the role of voltage-gated sodium channels in pain signaling.physiol rev,2019,99:1079-1151.)。而navs的作用则是在神经冲动信号传递的过程中,扮演着信号的触发和传递的角色,是动作电位(即神经冲动)上升支的主要介质(mark d.baker,john n.wood.involvement of na
+
channels in pain pathways.trends in pharmacological sciences,2001,22(1):27-31.alan l goldin.resurgence of sodium channel research.annu.rev.physiol.2001.63:871-894.)。因此,抑制navs有助于疼痛的缓解和治疗。但现有的navs抑制剂如利多卡因、卡马西平、拉莫三嗪等,均因对navs无选择性而存在治疗窗口窄、副作用大的缺陷。因此,人们转向了对选择性nav抑制剂的研究。
al.a novel selective and orally bioavailable nav 1.8channel blocker,pf-01247324,attenuates nociception and sensory neuron excitability.br jpharmacol.2015;172(10):2654-2670.)。最重要的是,vertex公司开发的高选择性nav1.8抑制剂vx150在疼痛相关的三个二期临床上已取得成功。综上所述,nav1.8是一个治疗疼痛或者疼痛相关疾病非常有潜力的靶点。
6.表1.navs各亚型概况
[0007][0008][0009]
目前报导的nav1.8抑制剂在研公司并不多,国外主要有雅培、辉瑞(wo2013114250a1)、吉利德(au2015224425a1)、住友(wo2015008861a1)、艾伯维(wo2016149169a1)、raqualia(wo2020138271a1)、默沙东(wo2020092187a1)、lieber(wo2020014243a1)和vertex(wo2019014352a1),国内主要有恒瑞(wo2020151728a1)、上海济煜医药(cn111808019a)。其中,大多数公司的专利中并未公布nav1.8的具体抑制活性,或活性并不佳,唯有辉瑞的pf-04531083和vertex的vx-150进入过ii期临床,且pf-04531083因在术后牙痛中未表现出优于安慰剂的活性而终止开发;vx-150在炎性痛、术后急性痛、神经病理性疼痛三个ii期临床上均获得成功,使nav1.8在疼痛中的作用得到了初步验证,但据vertex官方报导因其药代动力学性质(pharmacokinetics,pk)不够理想已止步,不过他们在继续寻找pk性质和活性更优的化合物推上临床。因此,开发新的nav1.8抑制剂仍然有着广阔的前景,也十分必要。
技术实现要素:
[0010]
本发明的目的是提供对钠离子通道,特别是nav1.8钠离子通道具有抑制活性的并环类化合物及其用途。
[0011]
为了实现上述目的,本发明提供了由下式i,其溶剂化物、互变异构体或药学上可接受的盐:
[0012][0013]
其中,
[0014]
x选自碳或氮;
[0015]
环a为3-8元取代或未取代脂肪环或脂肪杂环;
[0016]
环b为取代或未取代的苯环或6元芳杂环;
[0017]
环c为取代或未取代的3-10元脂肪环或脂肪杂环。
[0018]
在某些实施方案中,环a选自含有0-3个选自n、o和s的杂原子的3-8元脂肪环或脂肪杂环,任选地,脂肪环或脂肪杂环被卤素、羰基、nh2、cn、oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、c
1-c6烷基氨基、c
3-c6环烷基取代,或与c
3-c6环烷基形成并环。
[0019]
在某些实施方案中,环a选自含有0-3个选自n、o和s的杂原子的5-7元脂肪环或脂肪杂环,所述脂肪环或脂肪杂环被c
1-c4烷基取代。
[0020]
在某些实施方案中,环a选自:
[0021][0022]
在某些实施方案中,环b为含有0-3个n原子的六元芳环或芳杂环,其中所述芳环或芳杂环任选被氢、卤素、nh2、cn、oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、c
1-c6烷基氨基、-so2r2、-s(o)(nh)r2、-cor2、-conr2r3或-por2r3取代;其中r2、r3独立地选自氢、nh2、c
1-3
烷基。
[0023]
在某些实施方案中,环b为其中r1为氢、卤素、nh2、cn、oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、c
1-c6烷基氨基、-so2r2、-s(o)(nh)r2、-cor2、-conr2r3或-por2r3;其中r2、r3独立地选自氢、nh2、c
1-3
烷基,或r2、r3与p一起形成3-8元环。
[0024]
在某些实施方案中,环b选自:
[0025][0025][0026]
在某些实施方案中,环c选自含有0-3个选自n、o和s的杂原子的3-10元脂肪环或脂肪杂环,任选地,所述脂肪环或脂肪杂环被卤素、羰基、nh2、cn、oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、c
1-c6烷基氨基、c
3-c6环烷基、c
3-c6环杂烷基取代。
[0027]
在某些实施方案中,环c为:其中,y选自碳、氮;环c被m个r4取代,r4为氢、卤素、nh2、cn、oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基或c
1-c6烷基氨基;m为0-2(n+3)的整数,n为0-6的整数。
[0028]
在某些实施方案中,n为1-4的整数。
[0029]
在某些实施方案中,n为3;r4为氢或卤素。
[0030]
在某些实施方案中,环c为:
[0031][0032]
在某些实施方案中,化合物选自:
[0033]
[0034][0035]
本发明的第二目的在于提供一种药物组合物,所述组合物包含本发明第一目的所述的化合物或其药学上可接受的盐,和药学上可接受的赋形剂。
[0036]
本发明的第三目的在于提供本发明第一目的所述的化合物或其药学上可接受的盐在制备用于治疗疼痛的药物中的用途。
[0037]
在另一实施方案中,疼痛选自:慢性疼痛、肠痛、神经性疼痛、肌肉骨骼痛、急性疼痛、炎性疼痛、癌症疼痛、原发性疼痛、手术后疼痛、内脏痛、多发性硬化症、夏-马-图三氏综合症、失禁和心律失常。
[0038]
定义
[0039]
如本文所用,术语“烷基”自身或作为另一取代基的部分意指(除非另外说明)具有指定碳原子数目的直链或支链烃基(即,c
1-8
意指一至八个碳)。烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基等。
[0040]
如本文所用,术语“芳杂环”是指具有5到10个杂环原子,优选5或6元单环芳杂环或8至10元双环芳杂环;且除碳原子外还具有1到3个杂原子的基团。“杂原子”是指氮、氧或硫。
[0041]
术语“脂肪环”指具有饱和或不饱和键的单环或多环烷烃,优选饱和单环烷烃,例如环丙烷、环丁烷、环戊烷、环己烷、环庚烷。多环烷烃按结合方式的不同,可以分为螺环和桥环。
[0042]
术语“脂肪杂环”指具除碳原子外还具有一个或多个杂原子的饱和或不饱和键的单环或多环烷烃。杂原子例如氮、氧或硫。
[0043]
术语“被...取代”是指特定原子上的任意一个或多个氢原子被取代基取代,可以包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。术语“任选被取代的”是指可以被取代,也可以不被取代,除非另有规定,取代基的种类和数目在化学上可以实现的基础上可以是任意的。
[0044]
如本文所用,术语“卤素”自身或作为另一取代基的部分,意指(除非另外说明)氟、氯、溴或碘原子。另外,术语“卤代烷基”意在包括单卤代烷基和多卤代烷基。例如,术语“c
1-4
卤代烷基”意在包括三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基、二氟甲基等。
[0045]
如本文所用,“烷氧基”代表通过氧桥连接的具有特定数目碳原子的上述烷基,除非另有规定,c
1-6
烷氧基包括c1、c2、c3、c4、c5和c6的烷氧基。烷氧基的例子包括但不限于:甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、正戊氧基和s-戊氧基。
[0046]
除非另有规定,本文所描绘的结构也意味着包括该结构的所有异构(例如对映异构、非对映异构和几何异构(或构象异构))形式;例如每一不对称中心的r与s构型,(z)与(e)双键异构体,和(z)与(e)构象异构体。因此,这些化合物的单一立体化学异构体以及对映异构、非对映异构和几何异构(或构象异构)混合物都属于本发明的范围。除非另有规定,本发明化合物的所有互变异构形式都属于本发明的范围。另外,除非另有规定,本文所描绘的结构也意味着包括仅在一个或多个同位素富集原子的存在上有所不同的化合物。例如,除了氢被氘或氚代替或者碳被
13
c-或
14
c-富集的碳代替以外具有本发明结构的化合物都属于本发明的范围。
[0047]
除非另有规定,本文所描绘的结构也意味着包括该结构的溶剂化物,溶剂化物指本技术化合物与一个或多个溶剂分子的物理缔合;该物理缔合涉及各种程度的离子键和共价键,其包括氢键;在某些情况下,例如当将一个或多个溶剂分子引入到结晶固体的晶格中时,溶剂化物将能够被分离;“溶剂化物”涵盖溶液相和可分离的溶剂化物;合适的溶剂非限制性实例包括但不限于异丙醇、乙醇、甲醇、dmso、乙酸乙酯、乙酸和乙醇胺等;“水合物”为其中溶剂分子为h2o的溶剂化物。
[0048]
如本文所用,术语“组合物”意欲涵盖包含规定量的规定成分的产品,以及直接或间接源于规定量的规定成分的组合的任何产品。短语“药学上可接受的”意指载体、稀释剂或赋形剂必须与制剂中的其它成分相容并且对其药物接受者无害。
[0049]
如本文所用,术语“药学上可接受的盐”意在包括用相对无毒的酸或碱制备活性化合物的盐。当本发明化合物含有相对酸性官能团时,可通过将此类化合物的中性形式与足量的纯的或在合适的惰性溶剂中的所需碱接触获得碱加成盐。衍生自药学上可接受的无机碱的盐的实例包括铝、铵、钙、铜、铁、亚铁、锂、镁、锰盐、亚锰、钾、钠、锌等。衍生自药学上可接受的有机碱的盐包括伯胺、仲胺和叔胺(包括取代的胺、环胺、天然存在的胺等)的盐,诸如精氨酸、甜菜碱、咖啡因、胆碱、n,n'-二苄基乙二胺、二乙胺、2-二乙基氨基乙醇、2-二甲基氨基乙醇、乙醇胺、乙二胺、n-乙基吗啉、n-乙基哌啶、葡糖胺、葡萄糖胺、组氨酸、异丙基胺、赖氨酸、甲基葡糖胺、吗啉、哌嗪、哌啶、聚胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺、氨丁三醇等。当本发明化合物含有相对碱性官能团时,可通过将此类化合物的中性形式与足量的纯的或在合适的惰性溶剂中的所需酸接触获得酸加成盐。药学上可接受的酸加成盐的实例包括衍生自无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等,以及衍生自相对无毒的有机酸如乙酸、丙酸、异丁酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲烷磺酸等的盐。还包括氨基酸诸如精氨酸等的盐以及有机酸如葡糖醛酸或半乳糖醛酸。
[0050]
术语“药学上可接受的载体”是指能够递送本发明有效量活性物质、不干扰活性物质的生物活性并且对宿主或者患者无毒副作用的任何制剂或载体介质代表性的载体包括水、油、蔬菜和矿物质、膏基、洗剂基质、软膏基质等。这些基质包括悬浮剂、增粘剂、透皮促进剂等。它们的制剂为化妆品领域或局部药物领域的技术人员所周知。
[0051]
包含式i化合物的组合物通常根据作为药物组合物的标准药学实践配制。典型的制剂通过将本发明化合物与稀释剂、载体或赋形剂混合制备。制剂还可以包括缓冲剂、稳定剂、表面活性剂、湿润剂、润滑剂、乳化剂、悬浮剂、防腐剂、抗氧化剂、不透明剂、助流剂、加
工助剂、着色剂、增甜剂、芳香剂、调味剂、稀释剂和其它已知的添加剂中的一种或多种。
[0052]
本发明化合物可以以任何便利的使用形式被施用,如片剂、粉末、胶囊、溶液、分散体、悬浮液、糖浆剂、喷雾剂、栓剂、凝胶剂、乳剂、贴剂等。此类组合物可以包含药物制剂中常规的组分,如稀释剂、载体、ph调节剂、增甜剂、填充剂和另外的活性剂。
[0053]
本发明化合物可以通过任何合适的方式施用,包括口服、局部(包括颊部和舌下)、直肠、阴道、透皮、肠胃外、皮下、腹膜内、肺内、皮肤内、鞘内和硬膜外以及鼻内,并且,如果需要用于局部治疗,病灶内施用。肠胃外输注包括肌肉内、静脉内、动脉内、腹膜内、大脑内、眼内、病灶内或皮下施用。
[0054]
本发明的“疼痛”指与电压门控钠通道异常相关的疼痛,特别地,电压门控钠通道是nav1.8。本发明的疼痛包括但不限于慢性疼痛、肠痛、神经性疼痛、肌肉骨骼痛、急性疼痛、炎性疼痛、癌症疼痛、原发性疼痛、手术后疼痛、内脏痛、多发性硬化症、夏-马-图三氏综合症、失禁和心律失常。
[0055]
其中肠痛例如炎性肠病疼痛、克罗恩病疼痛或间质膀胱炎疼痛。肌肉骨骼痛例如骨关节炎痛,背痛,冷痛,灼痛或牙痛。炎性疼痛例如类风湿性关节炎疼痛或外阴痛,特发性疼痛包含纤维肌痛。神经性疼痛例如疱疹后神经痛,糖尿病性神经痛,疼痛性hiv相关性感觉神经病,三叉神经痛,口灼伤综合征,切断术后疼痛,幻觉痛,疼痛性神经瘤;创伤性神经瘤;morton神经瘤;神经卡压损伤,椎管狭窄,腕管综合征,神经根痛,坐骨神经痛;神经撕脱损伤,臂丛撕脱损伤;复合性局部疼痛综合征,药物治疗诱导的神经痛,癌症化疗诱导的神经痛,抗逆转录病毒疗法诱导的神经痛;脊髓损伤后疼痛,特发性小纤维神经病,特发性感觉神经病或三叉。
[0056]
疼痛药效可以采用本领域常规的疼痛模型进行验证,例如参考文献michael f.jarvis et al.,a-803467,a potent and selective nav1.8 sodium channel blocker,attenuates neuropathic and inflammatory pain in the rat.pnas.,2007,140(20):8520
–
8525。在一些具体的实施方案中,本发明的药效模型例如为角叉菜胶或cfa(完全弗氏佐剂)诱导的热痛模型,snl(脊神经结扎)疼痛模型,切口疼痛模型等。当采用角叉菜胶或cfa诱导的热痛模型,在一些实施方式中,本发明的化合物ed50小于200mg/kg;在一些具体实施方案中,本发明化合物ed50小于150mg/kg;在一些具体实施方案中,本发明化合物ed50小于100mg/kg;在一些具体实施方案中,本发明化合物ed50小于80mg/kg;在一些具体实施方案中,本发明化合物ed50小于70mg/kg;在一些具体实施方案中,本发明化合物ed50小于60mg/kg;在一些具体实施方案中,本发明化合物ed50小于50mg/kg;在一些具体实施方案中,本发明化合物ed50小于40mg/kg;在一些具体实施方案中,本发明化合物ed50小于30mg/kg;在一些具体实施方案中,本发明化合物ed50小于20mg/kg。当采用snl(脊神经结扎)疼痛模型,在一些具体实施方案中,本发明化合物ed50小于150mg/kg;在一些具体实施方案中,本发明化合物ed50小于100mg/kg;在一些具体实施方案中,本发明化合物ed50小于80mg/kg;在一些具体实施方案中,本发明化合物ed50小于70mg/kg;在一些具体实施方案中,本发明化合物ed50小于60mg/kg;在一些具体实施方案中,本发明化合物ed50小于50mg/kg;在一些具体实施方案中,本发明化合物ed50小于40mg/kg;在一些具体实施方案中,本发明化合物ed50小于30mg/kg;在一些具体实施方案中,本发明化合物ed50小于20mg/kg。当采用切口疼痛模型,在一些具体实施方案中,本发明化合物ed50小于150mg/kg;在一些具体实
施方案中,本发明化合物ed50小于100mg/kg;在一些具体实施方案中,本发明化合物ed50小于80mg/kg;在一些具体实施方案中,本发明化合物ed50小于70mg/kg;在一些具体实施方案中,本发明化合物ed50小于60mg/kg;在一些具体实施方案中,本发明化合物ed50小于50mg/kg;在一些具体实施方案中,本发明化合物ed50小于40mg/kg;在一些具体实施方案中,本发明化合物ed50小于30mg/kg;在一些具体实施方案中,本发明化合物ed50小于20mg/kg。
[0057]
本发明的化合物经人工或者chemdraw软件命名,市售化合物采用供应商目录名称。
[0058]
与现有技术相比,本发明的主要优点在于:
[0059]
提供了一系列结构新颖的并环类化合物,其对nav1.8具有抑制活性,可用作广泛疼痛治疗的药物。
具体实施方式
[0060]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。实施例(制备)中描述的化学反应可容易地被修改以制备许多本发明的其它化合物,并且用于制备本发明化合物的替代方法被认为在本发明的范围内。除非另行定义,本文所用的术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或同等的方法及材料皆可应用于本发明中。
[0061]
化合物的结构是通过核磁共振(nmr)和/或质谱(ms)来确定的。nmr位移(δ)以10-6
(ppm)的单位给出。nmr的测定采用bruker avance iii hd(400mhz)或bruker neo(400mhz)核磁仪,溶剂为氘代二甲基亚砜(dmso-d6)或氘代氯仿(cdcl3),内标为四甲基硅烷(tms)。ms的测定采用液质联用(lc-ms):岛津的lc-20ad/lcms-2020或安捷伦的agilent 1260/6125。高效液相(hplc)分析采用岛津的lc-20ad或lc-2030c,或安捷伦的agilent 1100/1200。制备纯化采用的是waters2767或gilson gx281。
[0062]
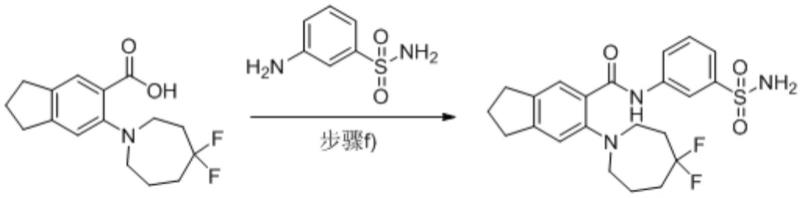
实施例1
[0063]
2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh01)的制备
[0064][0065]
步骤a):2-(二甲氨基)亚甲基环戊酮的制备
[0066][0067]
在氮气保护下将环戊酮(10g,119mmol)和dmf-dma(21.24g,178.5mmol)的混合体系于100℃反应24h。tlc监测反应完全后,将反应液浓缩得棕褐色油状物粗品2-(二甲氨基)亚甲基环戊酮(15g,收率91%),无需进一步纯化,直接作为下一步反应原料使用。
[0068]
步骤b):2-羟基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯的制备
[0069][0070]
向2-(二甲氨基)亚甲基环戊酮(15g,108mmol)的甲醇(75ml)溶液中加入氰乙酸甲酯(16g,162mmol),于70℃搅拌反应6h。减压浓缩除去甲醇,然后加入甲苯(75ml)和醋酸(6.48g,108mmol),于100℃下继续回流12h。反应完全后将反应液减压除去溶剂,然后倒入到冰水中用饱和碳酸氢钠溶液调节ph至8左右。再用二氯甲烷萃取三次,合并有机层,用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品用硅胶柱层析纯化(二氯甲烷/甲醇(v/v)=50/1)后得黄色固体2-羟基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯(6g,收率28%)。1h nmr(400mhz,cdcl3)δ8.07(s,1h),3.94(s,3h),3.02(t,j=7.7hz,2h),2.86(t,j=7.4hz,2h),2.20-2.11(m,2h)。esi-ms(m/z):194.0[m+h]
+
。
[0071]
步骤c):2-氯-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯的制备
[0072][0073]
向2-羟基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯(1g,5.15mmol)的1,4-二
氧六环(20ml)溶液中加入三氯氧磷(3.94g,25.75mmol),于100℃下搅拌过夜。反应完全后将反应液中的三氯氧磷减压除去,所得粗品倒入到冰水中,再用饱和碳酸氢钠水溶液调节ph至7到8左右,用乙酸乙酯萃取有机层,无水硫酸钠干燥,真空减压浓缩。所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)后得黄色固体2-氯-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯(800mg,收率73%)。1h nmr(400mhz,dmso-d6)δ8.05(s,1h),3.86(s,3h),3.01-2.89(m,4h),2.19-2.05(m,2h)。esi-ms(m/z):212.0[m+h]
+
。
[0074]
步骤d):2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯的制备
[0075][0076]
向2-氯-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯(200mg,0.947mmol)的dmf溶液中加入无水碳酸钾(326mg,2.368mmol)和4.4-二氟氮杂环庚烷盐酸盐(323mg,1.894mmol),氮气保护下于100℃搅拌过夜。反应完全后将反应液倒入水中,用乙酸乙酯萃取,有机相经饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=100/1)后得浅黄色固体2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯,(120mg,收率41%)。1h nmr(400mhz,cdcl3)δ7.71(s,1h),3.85(s,3h),3.74-3.62(m,2h),3.29(t,j=5.9hz,2h),2.86-2.82(m,4h),2.48-2.30(m,2h),2.14-2.05(m,2h),2.04-1.88(m,4h)。esi-ms(m/z):311.2[m+h]
+
。
[0077]
步骤e):2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸的制备
[0078][0079]
向2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸甲酯(120mg,0.387mmol)的四氢呋喃(1ml)与甲醇(1ml)溶液中加入氢氧化钾(433mg,1.935mmol)水溶液(1ml),于60℃搅拌反应2h。反应完全后,用乙酸乙酯进行萃取,水相用1.0m的盐酸水溶液调节ph至6左右,再用乙酸乙酯进行萃取,有机相经饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩后得白色固体2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸,(80mg,收率70%)。esi-ms(m/z):297.2[m+h]
+
。
[0080]
步骤f):2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0081][0082]
氮气保护下向2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(50mg,0.169mmol)的dmf溶液中加入hatu(64.2mg,0.169mmol)和diea(87.2mg,0.676mmol),于室温搅拌1h后加入间氨基苯磺酰胺(87mg,0.507mmol),随后升温至60℃反应4h。反应完全后,用反相制备色谱纯化得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊[b]吡啶-3-甲酰胺,(28.4mg,收率31%)。1h nmr(400mhz,dmso-d6)δ10.58(s,1h),8.31(s,1h),7.79(d,j=3.8hz,1h),7.57-7.53(m,3h),7.38(s,2h),3.57-3.53(m,4h),2.83-2.79(m,4h),2.37-2.25(m,2h),2.07-1.92(m,4h),1.87-1.76(m,2h)。esi-ms(m/z):451.1[m+h]
+
。
[0083]
实施例2
[0084]
2-(4,4-二氟氮杂-1-基)-n-(3-二甲磷酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh02)的制备
[0085][0086]
步骤a):3-硝基苯基二甲基氧化膦的制备
[0087][0088]
向1-碘-3-硝基苯(200mg,0.806mmol)的1,4-二氧六环溶液中依次加入二甲基氧化膦(125mg,1.6mmol)、碳酸铯(365mg,1.12mmol)、pd2(dba)3(37mg,0.08mmol)、xant-phos(47mg,0.08mmol),在氮气保护下升温至90℃反应3h。待反应完全后,向反应液中加入乙酸乙酯,过滤,再向滤液中加入适量的水,用乙酸乙酯萃取有机相。有机相经无水硫酸钠干燥、过滤浓缩后,所得粗产物经硅胶柱层析(二氯甲烷/甲醇(v/v)=10/1)纯化得黄色固体3-硝基苯基二甲基氧化膦(130mg,收率81%)。1h nmr(400mhz,cdcl3)δ8.52(d,j=11.8hz,1h),8.40(dd,j=8.2,1.0hz,1h),8.16(dd,j=10.8,7.6hz,1h),7.75(dd,j=7.8,2.4hz,1h),1.83(s,3h),1.80(s,3h)。esi-ms(m/z):199.9[m+h]
+
。
[0089]
步骤b):3-氨基苯基二甲基氧化膦的制备
[0090]
[0091]
向3-硝基苯基二甲基氧化膦(170mg,0.85mmol)的甲醇(7ml)和水(1.3ml)混合溶液中加入氯化铵(68.5mg,1.28mmol)及铁粉(191mg,3.4mmol),于75℃反应1h。待反应完全后用硅藻土过滤,甲醇洗涤,将滤液减压浓缩,所得粗品经硅胶柱层析(二氯甲烷/甲醇(v/v)=10/1)纯化得黄色固体3-氨基苯基二甲基氧化膦(91.8mg,收率63%)。1h nmr(400mhz,dmso-d6)δ7.15-7.10(m,1h),6.97-6.91(m,1h),6.81(dd,j=11.4,7.4hz,1h),6.71-6.66(m,1h),5.30(s,2h),1.57(s,3h),1.54(s,3h)。
[0092]
步骤c):2-(4,4-二氟氮杂1-基)-n-(3-二甲磷酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0093][0094]
操作过程同实施例1,只是将步骤f中的间氨基苯磺酰胺用3-氨基苯基二甲基氧化膦代替,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-二甲磷酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(30.5mg,收率31%)。1h nmr(400mhz,dmso-d6)δ10.46(s,1h),8.08(d,j=12.6hz,1h),7.89(d,j=7.5hz,1h),7.58(s,1h),7.51-7.46(m,1h),7.46-7.40(m,1h),3.64-.54(m,2h),3.44-3.37(m,2h),2.86-2.77(m,4h),2.40-2.25(m,2h),2.09-1.91(m,4h),1.86-1.78(m,2h),1.65(s,3h),1.62(s,3h)。esi-ms(m/z):448.3[m+h]
+
。
[0095]
实施例3
[0096]
2-(4,4-二氟氮杂-1-基)-n-(3-甲磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh03)的制备
[0097][0098]
操作过程同实施例1,只是将步骤f中的间氨基苯磺酰胺用3-甲磺酰基苯胺代替,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-甲磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(48.3mg,收率26.5%)。1h nmr(400mhz,dmso-d6)δ10.66(s,1h),8.36(s,1h),8.00-7.92(m,1h),7.63(d,j=0.8hz,1h),7.62(d,j=2.4hz,1h),7.60(s,1h),3.65-3.54(m,2h),3.42-3.36(m,2h),3.23-3.19(m,3h),2.85-2.78(m,4h),2.40-2.25(m,2h),2.08-2.03(m,2h),2.02-1.91(m,2h),1.88-1.76(m,2h)。esi-ms(m/z):450.3[m+h]
+
。
[0099]
实施例4
[0100]
2-(4,4-二氟氮杂-1-基)-n-(3-氨甲酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh04)的制备
[0101][0102]
操作过程同实施例1,只是将步骤f中的间氨基苯磺酰胺用3-氨基苯甲酰胺代替,反应过程无需加热,保持室温反应24h即可,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨甲酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(68.1mg,收率60%)。1h nmr(400mhz,dmso-d6)δ10.40(s,1h),8.17(s,1h),7.93(s,1h),7.82(d,j=8.1hz,1h),7.56(d,j=5.7hz,2h),7.39(t,j=7.9hz,1h),7.34(s,1h),3.65-3.53(m,2h),3.46-3.38(m,2h),2.88-2.76(m,4h),2.38-2.23(m,2h),2.11-1.92(m,4h),1.87-1.76(m,2h)。esi-ms(m/z):415.3[m+h]
+
。
[0103]
实施例5
[0104]
2-(4,4-二氟氮杂-1-基)-n-(3-氨基亚氨基磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh05)的制备
[0105][0106]
步骤a):n-(叔丁基二苯基硅烷基)-3-硝基苯磺酰胺的制备
[0107][0108]
向3-硝基苯磺酰胺(5.00g,24.73mmol)的四氢呋喃溶液(300ml)中加入三乙胺(7.56ml,54.41mmol)和tbdpscl(8.04ml,30.91mmol),在氮气保护下于50℃搅拌反应过夜。
待反应完全后,将反应液减压旋干,所得粗品用硅胶柱层析纯化(pe/ea(v/v)=1/0-20/1,pe/dcm(v/v)=5/1-2/1-1/1),得到白色固体n-(叔丁基二苯基硅烷基)-3-硝基苯磺酰胺(8.20g,收率75%)。1h nmr(400mhz,cdcl3)δ8.25-8.19(m,1h),8.07(t,j=1.9hz,1h),7.65-7.62(m,1h),7.61-7.60(m,2h),7.60-7.58(m,2h),7.46-7.39(m,3h),7.35-7.29(m,4h),1.07(s,9h)。esi-ms(m/z):439.1[m-h]-。
[0109]
步骤b):n
’‑
(叔丁基二苯基硅烷基)-3-硝基苯磺酰亚胺的制备
[0110][0111]
在氮气保护下,将pph3(1.43g,5.45mmol)和c2cl6(1.29g,5.45mmol)的chcl3溶液(14ml)搅拌反应6h,待反应液冷却至室温得到ph3pcl2的chcl3溶液(14ml,5.45mmol,0.39m,收率~100%),再向其中加入三乙胺(1.0ml,7.26mmol),室温下搅拌反应0.5h。随后于0℃下向反应液中加入n-(叔丁基二苯基硅烷基)-3-硝基苯磺酰胺和chcl3(4ml),0.5h后再向反应液中通入氨气,继续于室温下搅拌反应1h。待反应完全后,将反应液用水淬灭,用乙酸乙酯萃取。有机相用无水硫酸钠干燥,过滤,旋干。所得粗品用硅胶柱层析纯化(pe/ea(v/v)=1/0-15/1-10/1-5/1)得到黄色油状化合物n
’‑
(叔丁基二苯基硅烷基)-3-硝基苯磺酰亚胺(465mg,收率47%)。esi-ms(m/z):440.1[m+h]
+
。
[0112]
步骤c):n
’‑
(叔丁基二苯基硅烷基)-3-氨基苯磺酰亚胺的制备
[0113][0114]
向n
’‑
(叔丁基二苯基硅烷基)-3-硝基苯磺酰亚胺(465mg,1.06mmol)的乙醇溶液(10ml)中加入pd/c(112mg,0.11mmol),在氢气气氛下室温搅拌6h。反应完全后,将反应液过滤旋干得到黄色油状化合物n
’‑
(叔丁基二苯基硅烷基)-3-氨基苯磺酰亚胺(305mg,收率70%)。esi-ms(m/z):410.2[m+h]
+
。
[0115]
步骤d):n-(3-(n
’‑
(叔丁基二苯基硅烷基))氨基亚氨基磺酰苯基)-2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0116][0117]
2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸的合成同实施例1中的步骤a-e。
[0118]
在氮气保护下,向2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(50mg,0.17mmol)、n
’‑
(叔丁基二苯基硅烷基)-3-氨基苯磺酰亚胺(104mg,0.25mmol)和hatu(96mg,0.25mmol)的dmf(2ml)溶液中加入diea(0.09ml,0.51mmol),于室温下搅拌过
夜后,继续在70℃下反应6h。反应完全后,将反应液用水(20ml)淬灭,并用乙酸乙酯(30ml
×
3)萃取。合并有机相,并用饱和nacl(20ml
×
3)溶液洗涤,无水na2so4干燥,过滤旋干,所得粗品用制备板(pe/ea(v/v)=2/1)纯化,得到黄色油状化合物n-(3-(n
’‑
(叔丁基二苯基硅烷基))氨基亚氨基磺酰苯基)-2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(75mg,收率64.61%)。esi-ms(m/z):688.4[m+h]
+
。
[0119]
步骤e):2-(4,4-二氟氮杂-1-基)-n-(3-氨基亚氨基磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0120][0121]
向n-(3-(n
’‑
(叔丁基二苯基硅烷基))氨基亚氨基磺酰苯基)-2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(75mg,0.109mmol)的1,4-二氧六环(1ml)溶液中加入hcl/dioxane(1ml),在室温下搅拌过夜。反应完全后,将反应液旋干,所得粗品用反相制备(nh3·
h2o)纯化,所得制备液用乙酸乙酯(30ml
×
3)萃取,合并有机相,并用无水na2so4干燥,过滤旋干,所得粗品用反相制备(nh3·
h2o)二次纯化,所得制备液再用乙酸乙酯(30ml
×
3)萃取,有机相用无水na2so4干燥,过滤旋干,所得粗品经冻干得到白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨基亚氨基磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(18.05mg,收率36.83%)。1h nmr(400mhz,dmso-d6)δ10.52(s,1h),8.34(s,1h),7.77(d,j=8.0hz,1h),7.62(d,j=8.3hz,1h),7.56(s,1h),7.46(t,j=7.9hz,1h),3.62-3.53(m,2h),3.43-3.38(m,2h),2.81(t,j=7.5hz,4h),2.38-2.24(m,2h),2.08-2.02(m,2h),2.00-1.88(m,2h),1.88-1.76(m,2h)。esi-ms(m/z):450.1[m+h]
+
。
[0122]
实施例6
[0123]
2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh06)的制备
[0124][0125]
步骤a):2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0126]
[0127]
2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸的合成同实施例1中的步骤a-e。
[0128]
氮气保护下向2-(4,4-二氟氮杂-1-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(150mg,0.507mmol)的乙腈(3ml)溶液中加入2-甲氧基吡啶-4-胺(251mg,2.028mmol)和nmi(207mg,2.535mmol),于室温下搅拌0.5h,然后加入tcfh(284mg,1.014mmol),升温至60℃继续搅拌4h。反应完全后,将反应液倒入水中,用乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,真空浓缩,所得粗品经硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=5/1)后得白色固体2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(90mg,收率44%)。esi-ms(m/z):403.3[m+h]
+
。
[0129]
步骤b):2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0130][0131]
向2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(155mg,0.385mmol)的乙腈(5ml)溶液中加入tmsi(766mg,3.85mmol),于70℃下搅拌16h。反应完全后,将反应液真空浓缩,加入dmf(3ml)溶解,然后用反向制备色谱进行纯化后得到白色固体2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(45mg,收率30%)。1h nmr(400mhz,dmso-d6)δ11.19(s,1h),10.36(s,1h),7.55(s,1h),7.29(d,j=7.2hz,1h),6.79(s,1h),6.41(d,j=5.5hz,1h),3.60-3.51(m,2h),3.37-3.33(m,2h),2.86-2.76(m,4h),2.38-2.24(m,2h),2.09-2.00(m,2h),2.00-1.89(m,2h),1.87-1.78(m,2h)。esi-ms(m/z):389.3[m+h]
+
。
[0132]
实施例7
[0133]
2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环己烷并[b]吡啶-3-甲酰胺(kh07)的制备
[0134][0135]
操作过程同实施例1,只是将步骤a中的环戊酮用环己酮替代,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环己烷并[b]吡啶-3-甲酰胺(22.7mg,收率22.63%)。1h nmr(400mhz,dmso-d6)δ10.59(s,1h),8.30(s,1h),7.80(d,j=5.5hz,1h),7.56-7.50(m,2h),7.44(s,1h),7.38(s,2h),3.58-3.56(m,2h),3.37-3.31(m,
2h),2.73-2.61(m,4h),2.31(d,j=9.8hz,2h),1.98-1.91(m,2h),1.86-1.69(m,6h)。esi-ms(m/z):465.0[m+h]
+
。
[0136]
实施例8
[0137]
2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环庚烷并[b]吡啶-3-甲酰胺(kh08)的制备
[0138][0139]
操作过程同实施例1,只是将步骤a中的环戊酮用环己酮替代,步骤e的反应2h改为15h,步骤f中的60℃下反应4h改为室温下反应15h,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环庚烷并[b]吡啶-3-甲酰胺(60.1mg,收率20%)。1h nmr(400mhz,cd3od)δ8.33(d,j=1.7hz,1h),7.80(d,j=9.2hz,1h),7.66(d,j=8.4hz,1h),7.59(s,1h),7.52(t,j=8.0hz,1h),3.72-3.65(m,2h),3.49(t,j=5.8hz,2h),3.00-2.93(m,2h),2.79-2.73(m,2h),2.40-2.28(m,2h),2.08-1.95(m,2h),1.94-1.85(m,4h),1.72-1.61(m,4h)。esi-ms(m/z):479.0[m+h]
+
。
[0140]
实施例9
[0141]
6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺(kh09)的制备
[0142][0143]
步骤a):6-碘-2,3-二氢-1h-茚-5-氨的制备
[0144][0145]
向2,3-二氢-1h-茚-5-氨(500mg,3.76mmol)的甲醇(20ml)溶液中加入硫酸银(1169mg,3.76mmol)和碘(951.3mg,3.76mmol),于室温搅拌过夜。待反应完全后,将反应液过滤,用少量甲醇洗涤滤饼,再将滤液倒入到饱和的硫代硫酸钠溶液中,加入二氯甲烷萃取,有机相经饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩后,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)得棕色固体6-碘-2,3-二氢-1h-茚-5-氨(620mg,收率64%)。esi-ms(m/z):260.1[m+h]
+
。
[0146]
步骤b):6-氨基-2,3-二氢-1h-茚-5-腈的制备
[0147][0148]
向6-碘-2,3-二氢-1h-茚-5-氨(1g,3.86mmol)的dmf(15ml)溶液中加入氰化亚铜(691mg,7.72mmol),于160℃下反应1.5h。待反应液冷却至室温后倒入水中,过滤,加入乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=25/1)后得棕色固体6-氨基-2,3-二氢-1h-茚-5-腈(457mg,收率75%)。1h nmr(400mhz,dmso-d6)δ7.18(s,1h),6.66(s,1h),5.72(s,2h),2.75(t,j=7.5hz,2h),2.68(t,j=7.3hz,2h),1.98-1.89(m,2h)。esi-ms(m/z):159.4[m+h]
+
。
[0149]
步骤c):6-碘-2,3-二氢-1h-茚-5-腈的制备
[0150][0151]
向6-氨基-2,3-二氢-1h-茚-5-腈(500mg,3.14mmol)的氯仿(25ml)溶液中加入碘(874mg,3.45mmol)搅拌5min后,滴入亚硝酸叔丁酯(646mg,6.28mmol),于室温搅拌16h。反应完全后,将反应液倒入饱和硫代硫酸钠溶液中,加入二氯甲烷萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)后得黄色固体6-碘-2,3-二氢-1h-茚-5-腈(600mg,收率65%)。1h nmr(400mhz,cdcl3)δ7.76(s,1h),7.46(s,1h),2.95(t,j=7.6hz,2h),2.89(t,j=7.6hz,2h),2.15-2.07(m,2h)。
[0152]
步骤d):6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-腈的制备
[0153][0154]
向6-碘-2,3-二氢-1h-茚-5-腈(600mg,2.23mmol)的nmp(12ml)溶液中加入4.4-二氟氮杂环庚烷盐酸盐(760mg,4.46mmol)、碳酸铯(1430mg,6.69mmol)、xantphos(130mg,0.22mmol),然后在氮气保护下加入pd2(dba)3(100mg,0.11mmol),于130℃搅拌过夜。反应完全后将反应液倒入水中,加入乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,
真空减压浓缩,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=100/1)后得浅黄色固体6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-腈(90mg,收率15%)。esi-ms(m/z):277.2[m+h]
+
。1h nmr(400mhz,cdcl3)δ7.35(s,1h),6.84(s,1h),3.50-3.41(m,4h),2.88(t,j=7.5hz,2h),2.83(t,j=7.4hz,2h),2.48-2.35(m,2h),2.26-2.15(m,2h),2.12-2.03(m,2h),2.02-1.94(m,2h)。
[0155]
步骤e):6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-甲酸的制备
[0156][0157]
向50%硫酸(3ml)中加入6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-腈(90mg,0.326mmol),于100℃下反应5h。反应完全后,将反应液倒入水中,加入乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=1/1)后得白色固体6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-甲酸(48mg,收率50%)。
[0158]
步骤f):6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺的制备
[0159][0160]
氮气保护下向6-(4,4-二氟氮杂-1-基)-2,3-二氢-1h-茚-5-甲酸(80mg,0.271mmol)的dmf(1.5ml)溶液中加入hatu(92.6mg,0.244mmol)和diea(139.8mg,1.084mmol),于室温搅拌1h后加入间氨基苯磺酰胺(93.2mg,0.542mmol),继续搅拌16h。反应完全后,将反应液用水(15ml)淬灭,乙酸乙酯(20ml
×
3)萃取。有机相用饱和nacl(60ml
×
3)洗涤,无水na2so4干燥,过滤旋干。所得粗品用反相制备色谱纯化得白色固体6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺(80mg,收率66%)。esi-ms(m/z):450.3[m+h]
+
。1h nmr(400mhz,dmso-d6)δ11.20(s,1h),8.45(s,1h),7.73-7.67(m,1h),7.54(d,j=5.1hz,2h),7.47(s,1h),7.39(s,2h),7.18(s,1h),3.26-3.15(m,4h),2.92-2.81(m,4h),2.34-2.19(m,2h),2.18-1.98(m,4h),1.81-1.71(m,2h)。
[0161]
实施例10
[0162]
2-环庚基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酰胺(kh10)的制备
[0163]
步骤a):环庚烯-1-基三氟甲磺酸酯的制备
[0164][0165]
在冰水浴及氮气保护下,向环庚酮(1.00g,1.05ml,8.91mmol)的dcm溶液(50ml)中加入na2co3(1.89g,17.83mmol)和tf2o(2.40ml,14.26mmol),于室温下搅拌过夜。反应完全后,将反应液倒入冰水(80ml)中,用dcm(80ml
×
3)萃取。有机相用饱和nacl(50ml)洗,用无水na2so4干燥,过滤旋干。所得粗品用硅胶柱层析(石油醚)纯化,得到无色油状物环庚烯-1-基三氟甲磺酸酯(1.72g,收率79%)。1h nmr(400mhz,cdcl3)δ5.88(t,j=6.4hz,1h),2.64-.40(m,2h),2.28-2.02(m,2h),1.75-1.67(m,4h),1.66-1.59(m,2h)。
[0166]
19
f nmr(376mhz,cdcl3)δ-73.96(s)。
[0167]
步骤b):2-(环庚烯-1-基)硼酸频哪醇酯的制备
[0168][0169]
在氮气保护下,向环庚烯-1-基三氟甲磺酸酯(1.22g,5.00mmol)和联硼酸频那醇酯(1.65g,6.49mmol)的甲苯溶液(25ml)中加入pd(dppf)cl2(183mg,0.25mmol)、kbr(892mg,7.49mmol)和koph(991mg,7.49mmol),于50℃搅拌反应2h。反应完全后,将反应液用水(30ml)淬灭,乙酸乙酯(50ml
×
3)萃取有机相,并用饱和nacl(30ml)洗涤,无水na2so4干燥,过滤旋干。所得粗品经硅胶柱层析(石油醚/二氯甲烷(v/v)=1/0-5/1)纯化,得到无色油状物2-(环庚烯-1-基)硼酸频哪醇酯(565mg,收率50.92%)。1h nmr(400mhz,cdcl3)δ6.77
(t,j=6.2hz,1h),2.29-2.20(m,4h),1.76-1.71(m,2h),1.49-1.44(m,4h),1.25(s,12h)。
[0170]
步骤c):2-(环庚烯-1-基)-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯的制备
[0171][0172]
在氮气保护下,向2-氯-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰甲酯(350mg,1.65mmol)和2-(环庚烯-1-基)硼酸频哪醇酯(565mg,2.54mmol)的甲苯(9ml)和水(3ml)混合溶液中加入pd(dppf)cl2(121mg,0.16mmol)和na2co3(526mg,4.96mmol),于100℃搅拌反应过夜。反应完全后,将反应液用水(30ml)淬灭,乙酸乙酯(40ml
×
3)萃取有机相,并用饱和nacl(30ml)洗涤,无水na2so4干燥,过滤旋干。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=1/0-40/1-20/1-10/1)纯化,得无色油状物2-(环庚烯-1-基)-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯(385mg,收率85.79%)。esi-ms(m/z):272.2[m+h]
+
。
[0173]
步骤d):2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯的制备
[0174][0175]
室温下向2-(环庚烯-1-基)-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯(385mg,1.42mmol)的甲醇溶液(10ml)中加入pd/c(151mg,0.14mmol),通入氢气,搅拌反应过夜。反应完全后,将反应液过滤旋干,所得粗品用制备板(pe/ea(v/v)=10/1)纯化,得白色固体2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯(120mg,收率30.94%)。esi-ms(m/z):274.1[m+h]
+
。
[0176]
步骤e):2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸的制备
[0177][0178]
在氮气保护下,向2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸甲酯(120mg,0.44mmol)的四氢呋喃(2ml)、甲醇(2ml)和水(0.5ml)的混合溶液中加入koh(49mg,0.88mmol),于60℃搅拌反应4h。反应完全后,将反应液减压除去溶剂,再加水(10ml)溶解,用浓hcl酸化至ph=5,用乙酸乙酯(20ml
×
4)萃取。有机相用无水na2so4干燥,过滤旋干,得到白色固体2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸(粗品,120mg,0.44mmol)。esi-ms(m/z):260.1[m+h]
+
。
[0179]
步骤f):2-环庚基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酰胺的制备
[0180][0181]
在氮气保护下,向2-环庚烷基-6,7-二氢-5h-环戊基并[b]吡啶-3-甲酸(100mg,0.39mmol)的dmf(2ml)溶液中加入hatu(147mg,0.39mmol)和dipea(0.19ml,1.16mmol),室温下搅拌反应0.5h,再加入间氨基苯磺酰胺(100mg,0.58mmol),室温反应过夜。反应完全后,将反应液用水(20ml)淬灭,乙酸乙酯(30ml
×
3)萃取。有机相用饱和nacl(20ml
×
3)洗涤,无水na2so4干燥,过滤旋干。所得粗品用反相制备(nh3·
h2o)纯化,得到白色固体化合物(24.48mg,收率15.35%)。1h nmr(400mhz,dmso-d6)δ10.65(s,1h),8.36(s,1h),7.83-7.74(m,1h),7.63(s,1h),7.58-7.50(m,2h),7.37(s,2h),3.18-3.05(m,1h),2.98-2.83(m,4h),2.12-2.02(m,2h),1.89-1.65(m,6h),1.63-1.47(m,4h),1.47-1.34(m,2h)。esi-ms(m/z):414.1[m+h]
+
。
[0182]
实施例11
[0183]
2-(4,4-二氟氮杂-1-基)-7-甲基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh11)的制备
[0184][0185]
操作过程同实施例1,只是将步骤a中的环戊酮用2-甲基环戊酮替代,得白色固体2-(4,4-二氟氮杂-1-基)-7-甲基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(53.40mg,收率35.68%)。1h nmr(400mhz,dmso-d6)δ10.58(s,1h),8.31(s,1h),7.85-7.73(m,1h),7.56(s,1h),7.55-7.48(m,2h),7.38(s,2h),3.72-3.52(m,2h),3.51-3.40(m,2h),3.10-2.95(m,1h),2.87-2.64(m,2h),2.45-2.22(m,3h),2.06-1.88(m,2h),1.88-1.75(m,2h),1.67-1.50(m,1h),1.24(d,j=6.9hz,3h)。esi-ms(m/z):465.2[m+h]
+
。
[0186]
实施例12
[0187]
2-(4,4-二氟氮杂-1-基)-7,7-二甲基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh12)的制备
[0188][0189]
操作过程同实施例1,只是将步骤a中的环戊酮用2,2-二甲基环戊酮替代,得淡粉色固体2-(4,4-二氟氮杂-1-基)-7,7-二甲基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(17.8mg,收率57.45%)。1h nmr(400mhz,dmso-d6)δ10.59(s,1h),8.32(s,1h),7.79(s,1h),7.55-7.52(m,3h),7.38(s,2h),3.62(br s,2h),3.41(br s,2h),2.76(t,j=6.6hz,2h),2.33(br s,2h),2.03-1.88(m,4h),1.83(br s,2h),1.20(s,6h)。esi-ms(m/z):479.3[m+h]
+
。
[0190]
实施例13
[0191]
2-(4,4-二氟氮杂-1-基)-7-甲基-n-(3-氨磺酰基苯基)-5,7-二氢呋喃并[3,4-b]吡啶-3-甲酰胺(kh13)的制备
[0192][0193]
操作过程同实施例1,只是将步骤a中的环戊酮用4-甲基二氢呋喃-3(2h)-酮替代,得白色固体5-(4,4-二氟氮杂-1-基)-3-甲基-n-(3-氨磺酰基苯基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酰胺(78.05mg,收率35%)。1h nmr(400mhz,dmso-d6)δ10.67(s,1h),8.31(s,1h),7.84-7.76(m,1h),7.71(s,1h),7.54(d,j=6.0hz,2h),7.39(s,2h),5.05-4.96(m,2h),4.91(d,j=11.2hz,1h),3.71-3.55(m,2h),3.52-3.37(m,2h),2.40-2.25(m,2h),2.06-1.90(m,2h),1.89-1.78(m,2h),1.39(d,j=6.3hz,3h)。esi-ms(m/z):467.3[m+h]
+
。
[0194]
实施例14
[0195]
2-(2,2-二氟-6-氮杂双环[3.2.1]辛烷-6-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh14)的制备
[0196]
[0197]
操作过程同实施例1,只是将步骤d中的4.4-二氟氮杂环庚烷盐酸盐换成2,2-二氟-6-氮杂双环[3.2.1]辛烷盐酸盐,将步骤f中加入间氨基苯磺酰胺的时间由1h改为30min后,且于60℃反应24h,得白色固体2-(2,2-二氟-6-氮杂双环[3.2.1]辛烷-6-基)-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(28.3mg,收率31%)。1h nmr(400mhz,dmso-d6)δ10.72(s,1h),8.32(s,1h),7.78(t,j=6.3,2.3hz,1h),7.56-7.51(m,3h),7.39(s,2h),4.50(d,j=4.3hz,1h),3.60-3.50(m,2h),3.24(d,j=11.0hz,1h),2.86-2.70(m,5h),2.30(br s,1h),2.09-1.99(m,2h),1.97-1.82(m,3h),1.49(d,j=8.5hz,1h)。esi-ms(m/z):463.1[m+h]
+
。
[0198]
实施例15
[0199]
2-(2,2-二氟-6-氮杂双环[3.2.1]辛烷-6-基)-n-(3-氨磺酰基苯基)-5,6,7,8-四氢-5,8-甲桥喹啉-3-甲酰胺(kh15)的制备
[0200][0201]
操作过程同实施例1,只是将步骤a中的环戊酮换成2-降冰片酮;将步骤d中的4.4-二氟氮杂环庚烷盐酸盐换成2,2-二氟-6-氮杂双环[3.2.1]辛烷盐酸盐,并将反应温度由100℃调整为115℃;将步骤f中加入间氨基苯磺酰胺的时间由1h改为30min后,且于60℃反应24h,得白色固体2-(2,2-二氟-6-氮杂双环[3.2.1]辛烷-6-基)-n-(3-氨磺酰基苯基)-5,6,7,8-四氢-5,8-甲桥喹啉-3-甲酰胺(22.8mg,收率20%)。1h nmr(400mhz,dmso-d6)δ10.70(s,1h),8.34(s,1h),7.76(d,j=4.7hz,1h),7.55-7.49(m,2h),7.43(s,1h),7.38(s,2h),4.53(d,j=36.5hz,1h),3.62-3.41(m,1h),3.36(br s,1h),3.29(br s,1h),3.21(br s,1h),3.09(d,j=10.4hz,1h),2.73(br s,1h),2.00-1.81(m,5h),1.68(d,j=7.5hz,1h),1.57-1.43(m,3h),1.14(d,j=6.6hz,2h)。esi-ms(m/z):489.2[m+h]
+
。
[0202]
实施例16和实施例17
[0203]
2-(4,4-二氟氮杂1-基)-n-(3-氨磺酰基苯基)-5,7-二氢螺[环戊烷并[b]吡啶-6,1
’‑
环丙烷]-3-甲酰胺(kh16)和2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢螺[环戊烷并[b]吡啶-5,1
’‑
环丙烷]-3-甲酰胺(kh17)的制备
[0204][0205]
操作过程同实施例1,只是将步骤a中的环戊酮换成螺[2.4]庚烷-5-酮,得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5,7-二氢螺[环戊烷并[b]吡啶-6,1
’‑
环丙烷-3-甲酰胺(26.2mg)和2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-6,7-二氢螺[环戊烷并[b]吡啶-5,1
’‑
环丙烷]-3-甲酰胺(40.1mg),总收率28%。
[0206]
kh16:1h nmr(400mhz,dmso-d6)δ10.59(s,1h),8.31(s,1h),7.80(d,j=3.7hz,1h),7.56(s,1h),7.53(d,j=5.7hz,2h),7.38(s,2h),3.58(s,2h),3.40(t,j=5.7hz,2h),2.83(s,2h),2.80(s,2h),2.32(s,2h),1.94(d,j=13.9hz,2h),1.83(d,j=4.8hz,2h),0.65(s,2h),0.60(d,j=7.0hz,2h)。esi-ms(m/z):477.1[m+h]
+
。
[0207]
kh17:1h nmr(400mhz,dmso-d6)δ10.52(s,1h),8.27(s,1h),7.81(d,j=3.4hz,1h),7.52(d,j=5.9hz,2h),7.37(s,2h),7.13(s,1h),3.57(d,j=3.3hz,2h),3.39(t,j=5.9hz,2h),2.94(t,j=7.7hz,2h),2.30(d,j=16.7hz,2h),2.12-2.07(m,2h),1.93(d,j=14.2hz,2h),1.82(d,j=5.2hz,2h),0.88(d,j=6.2hz,4h)。esi-ms(m/z):477.0[m+h]
+
。
[0208]
实施例18
[0209]
2-(4,4-二氟氮杂-1-基)-5-羰基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh18)的制备
[0210][0211]
2-羟基-5-羰基-6,7-环戊烷并[b]吡啶-3-甲酸乙酯的合成步骤同实施例1中的步骤a-b,只是将步骤a中的环戊酮换成1,3-环戊二酮,室温反应过夜;将步骤b中的甲醇换成乙醇,氰乙酸甲酯换成氰乙酸乙酯,于85℃下反应64h即可。
[0212]
步骤c):2-(4,4-二氟氮杂-1-基)-5-羰基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯的制备
[0213][0214]
氮气保护下,向化合物2-羟基-5-羰基-6,7-环戊烷并[b]吡啶-3-甲酸乙酯(1.18g,5.33mmol)和六氟磷酸苯并三唑-1-氧基三(二甲氨基)磷(3.54g,8.00mmol)的二氯甲烷(25ml)溶液中加入1,8-二氮杂二环十一碳-7-烯(1.20ml,8.00mmol),室温反应0.5h后,加入1,8-二氮杂二环十一碳-7-烯(1.20ml,8.00mmol)和4,4-二氟氮杂环庚烷盐酸盐(1.37g,8.00mmol),室温反应过夜。反应完全后,反应液用水(40ml)淬灭,用乙酸乙酯(50ml
×
3)萃取。有机相用无水na2so4干燥,过滤旋干。所得粗品用硅胶柱层析(石油醚/乙酸乙酯
(v/v)=1/0-10/1-5/1-2/1)纯化,得到黑色油状化合物2-(4,4-二氟氮杂-1-基)-5-羰基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(1.18g,收率65.38%,含hobt)。1h nmr(400mhz,cdcl3)δ8.23(s,1h),4.33(q,j=7.1hz,2h),3.86-3.79(m,2h),3.37(t,j=5.1hz,2h),3.07-2.99(m,2h),2.77-2.65(m,2h),2.49-2.31(m,2h),2.03-1.97(m,4h),1.36(t,j=7.1hz,3h)。esi-ms(m/z):339.1[m+h]
+
。
[0215]
步骤d-e操作同实施例1中的步骤e-f,得白色固体2-(4,4-二氟氮杂-1-基)-5-羰基-n-(3-氨磺酰基苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(20.22mg,收率30.37%)。1h nmr(400mhz,dmso-d6)δ10.82(s,1h),8.28(s,1h),7.91(s,1h),7.87-7.81(m,1h),7.59-7.51(m,2h),7.39(s,2h),3.82-3.73(m,2h),3.53(t,j=5.4hz,2h),3.04-2.98(m,2h),2.66-2.59(m,2h),2.44-2.30(m,2h),2.04-1.87(m,4h)。esi-ms(m/z):465.3[m+h]
+
。
[0216]
实施例19
[0217]
6-(4,4-二氟氮杂-1-基)-3-羰基-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺(kh19)的制备
[0218][0219]
步骤a):5-溴-6-硝基-2,3-二氢-1h-茚-1-酮的制备
[0220][0221]-20℃下,向80ml发烟硝酸中分批加入5-溴-2,3-二氢-1h-茚-1-酮(8g,37.90mmol),于-15℃以下反应1h。反应完成后,将反应液倒入冰水中,加入二氯甲烷萃取有机相(100ml
×
3),再用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=5/1)后得黄色固体5-溴-6-硝基-2,3-二氢-1h-茚-1-酮(6g,收率61%)。1h nmr(400mhz,cdcl3)δ8.14(s,1h),7.90(s,1h),3.26-3.20(m,
2h),2.83-2.77(m,2h)。
[0222]
步骤b):6-氨基-5-溴-2,3-二氢-1h-茚-1-酮的制备
[0223][0224]
向化合物5-溴-6-硝基-2,3-二氢-1h-茚-1-酮(3.8g,14.9mmol)的无水乙醇(40ml)溶液中加入氯化亚锡二水合物(16.7g,74.5mmol),于75℃下反应5h。反应完成后,将反应液倒入冰水中,用饱和碳酸氢钠溶液调节ph至8左右,过滤,滤饼用适量二氯甲烷洗涤三次,将滤液减压浓缩除去乙醇和二氯甲烷,然后加入二氯甲烷萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥。粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=5/1)后得黄色固体6-氨基-5-溴-2,3-二氢-1h-茚-1-酮(1.6g,收率46%)。1h nmr(400mhz,cdcl3)δ7.58(s,1h),7.08(s,1h),4.21(s,2h),3.07-2.97(m,2h),2.70-2.61(m,2h)。esi-ms(m/z):226.1[m+h]
+
。
[0225]
步骤c):6-溴-3-羰基-2,3-二氢-1h-茚-5-甲腈的制备
[0226][0227]
向2.5ml水中加入6-氨基-5-溴-2,3-二氢-1h-茚-1-酮(0.5g,2.2mmol)和盐酸(6m,1ml),降温至0℃,滴入亚硝酸钠水溶液(182mg,2.64mmol);滴毕,继续搅拌0.5h,然后分批加入碳酸氢钠(850mg,10.12mmol),调解ph至8左右,得重氮盐,备用。向kcn(793.5mg,12.1mmol)的水(12ml)溶液中加入cucn(881mg,9.9mmol)和甲苯(1.65ml);然后加入制备好的重氮盐,于50℃下反应1h,恢复至室温继续反应16h。反应完成后,将反应液倒入水中,过滤,滤饼用二氯甲烷洗涤两次,合并滤液,分层,水相用二氯甲烷萃取一次,合并有机层并用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩;所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=10/1)后得黄色固体6-溴-3-羰基-2,3-二氢-1h-茚-5-甲腈(350mg,收率67%)。1h nmr(400mhz,cdcl3)δ8.02(s,1h),7.87(s,1h),3.25-3.19(m,2h),2.79-2.74(m,2h)。
[0228]
步骤d):5-溴-2,3-二氢螺[茚-1,2
’‑
[1,3]二噻茂烷]-6-甲腈的制备
[0229][0230]
向6-溴-3-羰基-2,3-二氢-1h-茚-5-甲腈(2.2g,9.32mmol)的二氯甲烷溶液中加入1,2-乙二硫醇(1.32g,14mmol)和三氟化硼乙醚溶液(1.99g,14mmol),于室温搅拌16h。反应完成后,将反应液倒入水中,加入二氯甲烷萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩;所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)后得黄色固体5-溴-2,3-二氢螺[茚-1,2
’‑
[1,3]二噻茂烷]-6-甲腈(2.33g,收率80%)。1h nmr(400mhz,cdcl3)δ7.80(s,1h),7.50(s,1h),3.58-3.51(m,2h),3.50-3.42(m,2h),3.01(t,j=6.7hz,2h),2.70(t,j=6.8hz,2h)。
[0231]
步骤e):2,6-二溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈的制备
[0232][0233]
氮气保护下,将二溴海因(9.93g,34.7mmol)的二氯甲烷(65ml)溶液降温至-78℃,滴入氟化氢-吡啶(9.72ml),反应0.5h;然后滴入5-溴-2,3-二氢螺[茚-1,2
’‑
[1,3]二噻茂烷]-6-甲腈(2.7g,8.65mmol)的二氯甲烷溶液,于此温度下继续反应1h。反应完成后,将反应液倒入冰水中,用二氯甲烷萃取有机相,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=20/1)后得黄色固体2,6-二溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(2g,收率69%)。1h nmr(400mhz,cdcl3)δ7.91(s,1h),7.71(s,1h),4.72-4.50(m,1h),3.82-3.60(m,1h),3.44-3.22(m,1h)。
[0234]
步骤f):5-溴-1,1-二氟-1h-茚-6-甲腈的制备
[0235][0236]
向2,6-二溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(1.5g,4.48mmol)的二氯甲烷(15ml)溶液中加入1,8-二氮杂二环十一碳-7-烯(1.36g,8.96mmol),于室温搅拌1h。反应完成后,将反应液倒入水中,加入二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=10/1)后得黄色固体5-溴-1,1-二氟-1h-茚-6-甲腈(1g,收率87%)。1h nmr(400mhz,cdcl3)δ7.68(s,1h),7.51(s,1h),6.81(dd,j=6.0,0.6hz,1h),6.42(d,j=6.0hz,1h)。
[0237]
步骤g):6-溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈的制备
[0238][0239]
冰浴下向5-溴-1,1-二氟-1h-茚-6-甲腈(950mg,3.72mmol)的乙腈(35ml)溶液中加入邻硝基苯磺酰氯(3.288g,14.88mmol),慢慢滴入水合肼(1.488g,29.76mmol),室温搅拌48h。反应完成后,将反应液倒入水中,加入二氯甲烷萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=10/1)后得黄色固体6-溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(725mg,收率76%)。1h nmr(400mhz,cdcl3)δ7.83(s,1h),7.67(s,1h),3.15-3.07(m,2h),2.70-2.58(m,2h)。
[0240]
步骤h):6-(4,4-二氟氮杂-1-基)-3,3-二氟-2,3-二氢-1h-茚-5-甲腈的制备
[0241][0242]
向6-溴-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(288mg,1.116mmol)的1,4-二氧六环(20ml)溶液中,加入4.4-二氟氮杂环庚烷盐酸盐(381.7mg,2.232mmol),碳酸铯(1088.1mg,3.348mmol),binap(69.664mg,0.112mmol),pd2(dba)3(51mg,0.056mmol),氮气保护,于100
℃下反应16h。反应完成后,将反应液倒入水中,加入乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经所得粗品经硅胶柱柱层析纯化(pe/ea(v/v)=10/1)后得白色固体6-(4,4-二氟氮杂-1-基)-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(35mg,收率10%)。esi-ms(m/z):313.0[m+h]
+
。
[0243]
步骤i):6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲腈的制备
[0244][0245]
向50%的硫酸水溶液(2ml)中加入化合物6-(4,4-二氟氮杂-1-基)-3,3-二氟-2,3-二氢-1h-茚-5-甲腈(100mg,0.32mmol),于100℃下搅拌0.5h;反应完全后,将反应液倒入水中,加入乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=10/1)后得白色固体6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲腈(74.3mg,收率80%)。1h nmr(400mhz,dmso-d6)δ7.83(s,1h),7.10(s,1h),3.77-3.64(m,4h),3.12-3.00(m,2h),2.64-2.56(m,2h),2.44-2.32(m,2h),2.22-2.09(m,2h),2.00-1.91(m,2h)。esi-ms(m/z):291.0[m+h]
+
。
[0246]
步骤j):6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲酸的制备
[0247][0248]
向50%的硫酸水溶液中加入6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲腈(100mg,0.34mmol),于100℃下搅拌6h;反应完全后,将反应液倒入水中,加入乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩。所得粗品经硅胶柱柱层析纯化(石油醚/乙酸乙酯(v/v)=1/1)后得白色固体6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲酸(30mg,收率28%)。esi-ms(m/z):310.1[m+h]
+
。
[0249]
步骤k):6-(4,4-二氟氮杂-1-基)-3-羰基-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺的制备
[0250][0251]
氮气保护下向6-(4,4-二氟氮杂-1-基)-3-羰基-2,3-二氢-1h-茚-5-甲酸(30mg,0.097mmol)的dmf(1ml)溶液中加入hatu(33mg,0.087mmol),和diea(62.5mg,0.485mmol),于室温搅拌1h后加入间氨基苯磺酰胺(50mg,0.291mmol),然后将反应液温度
升至60℃反应4h。反应完全后,用反相制备色谱纯化得白色固体6-(4,4-二氟氮杂-1-基)-3-羰基-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺(9.6mg,收率21%)。1h nmr(400mhz,dmso-d6)δ10.74(s,1h),8.32(s,1h),7.83(s,1h),7.59(s,1h),7.55(s,2h),7.38(s,2h),7.06(s,1h),3.51(br s,2h),3.47(br s,2h),3.06(br s,2h),2.58(br s,2h),2.30(br s,2h),2.05(d,j=15.9hz,2h),1.85(br s,2h)。esi-ms(m/z):464.3[m+h]
+
。
[0252]
实施例20
[0253]
2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-5,7-二氢螺[环戊烷并[b]吡啶-6,1
’‑
环丙烷]-3-甲酰胺(kh20)的制备
[0254][0255]
操作过程同实施例16,只是将最后一步的间氨基苯磺酰胺替换成2-甲氧基吡啶-4-胺,再按照实施例6的步骤b脱掉甲基,即得黄色固体2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-5,7-二氢螺[环戊烷并[b]吡啶-6,1
’‑
环丙烷]-3-甲酰胺(14.4mg,收率9%)。1h nmr(400mhz,dmso-d6)δ11.19(s,1h),10.36(s,1h),7.54(s,1h),7.29(d,j=7.2hz,1h),6.79(s,1h),6.40(dd,j=7.2,1.8hz,1h),3.55(d,j=3.0hz,2h),3.34(t,j=5.8hz,2h),2.82(s,2h),2.79(s,2h),2.30(s,2h),2.07(s,1h),1.94(d,j=14.3hz,2h),1.83(d,j=5.0hz,2h),0.64-0.60(m,4h)。esi-ms(m/z):415.1[m+h]
+
。
[0256]
实施例21
[0257]
6-(4,4-二氟氮杂-1-基)-2,2-二氟-n-(3-氨磺酰基苯胺基)-2,3-二氢-1h-茚-5-甲酰胺(kh21)的制备
[0258][0259]
步骤a):5-硝基-1,3-二氢-2h-茚-2-酮的制备
[0260]
[0261]
在-30℃下向装有发烟硝酸(100ml)的单口瓶中缓慢加入1,3-二氢-2h-茚-2-酮(11.5g,87.01mmol),加料完毕后,在-30℃下继续反应20min。待反应完全后,将反应液滴加至冰水中,有固体析出,抽滤,用甲醇冲洗固体,将滤饼干燥后得5-硝基-1,3-二氢-2h-茚-2-酮(15g,收率100%)。1h nmr(400mhz,cdcl3)δ8.18(d,j=8.9hz,2h),7.48(d,j=8.1hz,1h),3.67(d,j=5.9hz,4h)。
[0262]
步骤b):2,2-二氟-5-硝基-2,3-二氢-1h-茚的制备
[0263][0264]
在0℃下向5-硝基-1,3-二氢-2h-茚-2-酮(10g,56.45mmol)的二氯甲烷(100ml)溶液中加入二乙胺基三氟化硫(29.8ml,225.79mmol),氮气保护,于室温下反应过夜。反应完全后置于冰水浴中,用饱和nahco3水溶液调节ph至7-8,用乙酸乙酯萃取三次,合并有机相,并用无水na2so4干燥,过滤,减压浓缩。所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=30/1),得淡绿色固体2,2-二氟-5-硝基-2,3-二氢-1h-茚(3.1g,收率27.6%)。1h nmr(400mhz,cdcl3)δ8.20-8.06(m,2h),7.39(d,j=8.3hz,1h),3.60-3.47(m,4h)。
[0265]
步骤c):2,2-二氟-2,3-二氢-1h-茚-5-胺的制备
[0266][0267]
向2,2-二氟-5-硝基-2,3-二氢-1h-茚(4.5g,22.60mmol)的甲醇(45ml)溶液中加入pd(oh)2(2.12g,2.26mmol),在-40℃下氢气氛围中反应16h。待反应完全后用硅藻土过滤,将滤液旋干,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=1/0-20/1-10/1)后得橙色固体2,2-二氟-2,3-二氢-1h-茚-5-胺(3.1g,收率70%)。1h nmr(400mhz,cdcl3)δ6.98(d,j=7.8hz,1h),6.59-6.53(m,2h),3.61(s,2h),3.36-3.27(m,4h)。esi-ms(m/z):170.2[m+h]
+
。
[0268]
步骤d):6-溴-2,2-二氟-2,3-二氢-1h-茚-5-胺的制备
[0269][0270]
在-16℃及氮气保护下向2,2-二氟-2,3-二氢-1h-茚-5-胺(3.1g,18.32mmol)的乙腈(30ml)溶液中缓慢加入n-溴代丁二酰亚胺(3.26g,18.32mmol),于-15℃下反应20min。待反应完全后,加入30ml水淬灭反应,并用乙酸乙酯萃取(50ml
×
3)。有机相用无水na2so4干燥,过滤,旋干滤液,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=20/1-10/1)后得白色固体6-溴-2,2-二氟-2,3-二氢-1h-茚-5-胺(4.3g,收率94%)。esi-ms(m/z):247.8[m+h]
+
。
[0271]
步骤e):6-溴-2,2-二氟-2,3-二氢-1h-茚-5-腈的制备
[0272][0273]
在-10℃及氮气保护下向6-溴-2,2-二氟-2,3-二氢-1h-茚-5-胺(3g,12.09mmol)
的二氯甲烷(30ml)溶液中加入亚硝酸叔丁酯(1.53g,14.87mmol)和三氟化硼乙醚溶液(884mg,6.13mmol),反应30min后加入乙醚(30ml)并过滤。滤饼干燥后用甲苯(30ml)溶解,并在0℃及氮气保护下缓慢滴加nacn(2g,40.51mmol)和cucn(1.45g,16.21mmol)的水(10ml)溶液,升至室温反应30min。反应完全后用水(20ml)淬灭,乙酸乙酯(30ml
×
3)萃取,有机相用无水na2so4干燥,过滤旋干,所得粗品经硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=20/1)后得橙红色固体6-溴-2,2-二氟-2,3-二氢-1h-茚-5-腈(1.4g,收率44.8%)。1h nmr(400mhz,cdcl3)δ7.57(s,1h),7.52(s,1h),3.52-3.39(m,4h)。
[0274]
步骤f):6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-腈的制备
[0275][0276]
向6-溴-2,2-二氟-2,3-二氢-1h-茚-5-腈(500mg,1.94mmol)的甲苯(10ml)溶液中加入4,4-二氟氮杂环庚烷盐酸盐(837mg,4.84mmol)、pd2(dba)3(177mg,0.194mmol)、cs2co3(2.21g,6.78mmol)和联萘二苯膦(241mg,0.387mmol),用氮气保护体系,于110℃下反应16h。反应完全后用水(10ml)淬灭反应,并用乙酸乙酯(15ml
×
3)萃取,所得有机相用无水na2so4干燥,过滤,旋干,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=20/1)后得黄色固体6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-腈(170mg,收率28%)。1h nmr(400mhz,cdcl3)δ7.37(s,1h),6.80(s,1h),3.51(d,j=5.8hz,2h),3.48-3.30(m,6h),2.46-2.36(m,2h),2.24-2.14(m,2h),2.03-1.97(m,2h)。esi-ms(m/z):312.9[m+h]
+
。
[0277]
步骤g):6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-甲酸的制备
[0278][0279]
向6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-腈(75mg,0.24mmol)中加入h2so4(40%,1ml)水溶液,在100℃、氮气保护下反应16h。反应完全后于0℃下用氨水调节ph至弱酸性,再用乙酸乙酯(30ml
×
3)萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,过滤旋干,所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=10/1)后得白色固体6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-甲酸(40mg,收率50%)。1h nmr(400mhz,cdcl3)δ8.16(s,1h),7.25(s,1h),3.52-3.41(m,6h),3.18(d,j=5.2hz,2h),2.51-2.27(m,6h)。esi-ms(m/z):332.0[m+h]
+
。
[0280]
步骤h):6-(4,4-二氟氮杂-1-基)-2,2-二氟-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺的制备
[0281][0282]
氮气保护下向6-(4,4-二氟氮杂-1-基)-2,2-二氟-2,3-二氢-1h-茚-5-甲酸(45mg,0.136mmol)的dmf溶液中加入hatu(43.9mg,0.115mmol),和diea(43.9mg,0.339mmol),于室温反应1h后加入间氨基苯磺酰胺(35mg,0.204mmol),室温反应过夜。反应完全后用反相制备色谱纯化得白色固体6-(4,4-二氟氮杂-1-基)-2,2-二氟-n-(3-氨磺酰基苯基)-2,3-二氢-1h-茚-5-甲酰胺(42.0mg,收率47.8%)。1h nmr(400mhz,dmso-d6)δ10.90(s,1h),8.41(s,1h),7.76-7.70(m,1h),7.56-7.52(m,2h),7.42(s,1h),7.39(s,2h),7.15(s,1h),3.51-3.38(m,4h),3.28-3.20(m,4h),2.24-2.21(m,2h),2.14-2.03(m,2h),1.76-1.74(m,2h)。esi-ms(m/z):486.0[m+h]
+
。
[0283]
实施例22-24
[0284]
(r)-6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(kh22)、(s)-6-(4,4-二氟氮杂-1-基l)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(kh23)、6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-3-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(kh24)的制备
[0285][0286]
步骤a):5-溴-3-羟基-3-三氟甲基异苯并呋喃-1(3h)-酮&6-溴-3-羟基-3-三氟甲基异苯并呋喃-1(3h)-酮的制备
[0287][0288]
向5-溴异苯并呋喃-1,3-二酮(1g,4.4mmol)的四氢呋喃(22ml)溶液中加入cui
(83.6mg,0.44mmol)、,kf(510mg,8.8mmol)、1,10-邻二氮杂菲(79.2mg,0.44mmol),氮气保护,滴入tms-cf3(750mg,5.28mmol),于50℃下反应8h。反应完全后,将反应液倒入水中,用乙酸乙酯萃取三次,合并有机相,并用饱和盐水洗涤,无水硫酸钠干燥,过滤,将滤液减压浓缩,所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=20/1)纯化后得浅黄色液体5-溴-3-羟基-3-三氟甲基异苯并呋喃-1(3h)-酮和6-溴-3-羟基-3-三氟甲基异苯并呋喃-1(3h)-酮的混合物(490mg,收率38%)。1h nmr(400mhz,dmso-d6)δ9.95(s,2h),8.25(d,j=1.5hz,1h),8.14(dd,j=8.1,1.8hz,1h),8.10(s,1h),8.06(dd,j=8.1,1.6hz,1h),7.95(d,j=8.1hz,1h),7.79(d,j=8.1hz,1h)。
[0289]
步骤b):1-(5-溴-2-羟甲基苯基)-2-三氟甲基乙醇&1-(4-溴-2-羟甲基苯基)-2-三氟甲基乙醇的制备
[0290][0291]
冰浴下向步骤a所得混合物(1.1g,3.73mmol)的四氢呋喃(20ml)溶液中分批加入氢化铝锂(566mg,14.9mmol),室温搅拌2h。反应完全后,向反应液中缓慢加入乙酸乙酯淬灭反应,然后倒入冰水中,分相,有机层用饱和盐水洗涤,无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=20/1)纯化后得黄色油状的1-(5-溴-2-羟甲基苯基)-2-三氟甲基乙醇和1-(4-溴-2-羟甲基苯基)-2-三氟甲基乙醇混合物(300mg,收率30%)。esi-ms(m/z):283.0[m-h]-。
[0292]
步骤c):6-溴-1-三氟甲基-1,3-二氢异苯并呋喃&5-溴-1-三氟甲基-1,3-二氢异苯并呋喃的制备
[0293][0294]
向步骤b所得混合物(700mg,2.456mmol)的甲苯(30ml)溶液中加入bu3p(992mg,4.912mmol),n,n,n’,n
’‑
四甲基偶氮二甲酰胺(971mg,5.649mmol),室温搅拌过夜。反应完全后,将反应液倒入水中,用乙酸乙酯萃取3次,合并有机相,并用饱和nacl溶液洗涤,无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)后得黄色固体6-溴-1-三氟甲基-1,3-二氢异苯并呋喃和5-溴-1-三氟甲基-1,3-二氢异苯并呋喃的混合物(320mg,收率48%)。1h nmr(400mhz,cdcl3)δ7.56-7.52(m,2h),7.49(d,j=8.2hz,1h),7.45(s,1h),7.28(s,1h),7.17(d,j=8.5hz,1h),5.47-5.38(m,2h),5.29-5.20(m,2h),5.19-5.11(m,2h)。
[0295]
步骤d):6-溴-5-硝基-1-三氟甲基-1,3-二氢异苯并呋喃&5-溴-6-硝基-1-三氟甲基-1,3-二氢异苯并呋喃的制备
[0296][0297]
冰浴下向步骤c所得混合物(3.8g,14.28mmol)的硫酸(20ml)溶液中滴入硝酸钾(1.44g,14.28mmol)的硫酸(60ml)溶液。反应完全后,将反应液倒入碎冰中,加入乙酸乙酯萃取有机相,再用饱和盐水洗涤,无水硫酸钠干燥,抽滤,滤液经减压浓缩后得6-溴-5-硝基-1-三氟甲基-1,3-二氢异苯并呋喃和5-溴-6-硝基-1-三氟甲基-1,3-二氢异苯并呋喃的混合物(3.6g,收率90%)。1h nmr(400mhz,cdcl3)δ7.87(s,1h),7.77(s,1h),7.75(s,1h),7.70(s,1h),5.54-5.46(m,2h),5.31(t,j=12.7hz,2h),5.26-5.20(m,2h)。
[0298]
步骤e):6-溴-1-三氟甲基-1,3-二氢异苯并呋喃-5-胺&6-溴-3-三氟甲基-1,3-二氢异苯并呋喃-5-胺的制备
[0299][0300]
向步骤d所得混合物(4g,12,8mmol)的乙醇(80ml)溶液中加入氯化铵(1.35g,25.6mmol)、水(20ml)和铁粉(3.6g,64mmol),于75℃下反应4h。反应完全后,将反应液过滤,用二氯甲烷萃取有机相3次,合并有机相,并用饱和盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析纯化后得6-溴-1-三氟甲基-1,3-二氢异苯并呋喃-5-胺和6-溴-3-三氟甲基-1,3-二氢异苯并呋喃-5-胺的混合物(2.7g,收率80%)。esi-ms(m/z):282.0[m+h]
+
。
[0301]
步骤f):6-溴-1-三氟甲基-1,3-二氢异苯并呋喃-5-腈&6-溴-3-三氟甲基-1,3-二氢异苯并呋喃-5-腈的制备
[0302][0303]
0℃下向步骤e所得混合物(1124mg,4mmol)中加入4ml盐酸(6m)和6ml水,再滴入6ml亚硝酸钠(331.2mg,4.8mmol)水溶液。0.5h后用碳酸氢钠(4.2g)调节反应液的ph至中性,并将其滴入到cucn(1.6g,18mmol)、kcn(1.43g,22mmol)、甲苯(4ml)和水(20ml)的混合液中,于50℃下反应1h后恢复至室温搅拌过夜。反应完全后,将反应液过滤,用二氯甲烷洗涤滤饼,分相,有机层用饱和盐水洗涤,无水硫酸钠干燥,抽滤,滤液减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=20/1)纯化后得6-溴-1-三氟甲基-1,3-二氢异苯并呋喃-5-腈和6-溴-3-三氟甲基-1,3-二氢异苯并呋喃-5-腈的混合物(600mg,收率50%)。1h nmr(400mhz,cdcl3)δ7.74(s,1h),7.69(s,1h),7.67(s,1h),7.61(s,1h),5.55-5.42(m,2h),5.34-5.16(m,4h)。
[0304]
步骤g):6-(4,4-二氟氮杂-1-基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-腈&6-(4,4-二氟氮杂-1-基)-3-三氟甲基-1,3-二氢异苯并呋喃-5-腈的制备
d6)δ10.81(s,1h),8.41(s,1h),7.82-7.71(m,1h),7.55(d,j=6.1hz,2h),7.51(s,1h),7.40(s,2h),7.15(s,1h),5.82(d,j=6.2hz,1h),5.15(s,2h),3.33-3.24(m,4h),2.23(t,j=10.5hz,2h),2.14-2.00(m,2h),1.82-1.72(m,2h)。esi-ms(m/z):520.2[m+h]
+
。
[0313]
步骤j):(r)-6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺&(s)-6-(4,4-二氟氮杂-1-基l)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺的制备
[0314][0315]
步骤i所得外消旋体(60mg)经sfc拆分后得(r)-6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(13.15mg,收率43%),1h nmr(400mhz,dmso-d6)δ10.81(s,1h),8.40(s,1h),7.79-7.73(m,1h),7.54(d,j=5.9hz,2h),7.51(s,1h),7.40(s,2h),7.15(s,1h),5.82(d,j=6.4hz,1h),5.15(s,2h),3.31-3.24(m,4h),2.21(d,j=14.7hz,2h),2.07(d,j=8.0hz,2h),1.77(d,j=5.6hz,2h);和(s)-6-(4,4-二氟氮杂-1-基l)-n-(3-氨磺酰基苯基)-1-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(11.95mg,收率40%),1h nmr(400mhz,dmso-d6)δ10.81(s,1h),8.40(s,1h),7.82-7.72(m,1h),7.57-7.53(m,2h),7.51(s,1h),7.40(s,2h),7.15(s,1h),5.82(d,j=6.5hz,1h),5.20-5.09(m,2h),3.28(dd,j=12.0,5.8hz,4h),2.22(t,j=10.8hz,2h),2.14-1.98(m,2h),1.81-1.70(m,2h)。
[0316]
实施例24的制备同实施例22和23,只是得到外消旋体后不进行拆分,即直接制备得到白色固体6-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-3-三氟甲基-1,3-二氢异苯并呋喃-5-甲酰胺(kh24)(36.03mg,收率31.8%)。1h nmr(400mhz,dmso-d6)δ10.78(s,1h),8.39(s,1h),7.80-7.73(m,1h),7.54(d,j=5.5hz,2h),7.44(s,1h),7.39(s,2h),7.20(s,1h),5.76(d,j=6.1hz,1h),5.16(d,j=13.6hz,2h),3.33(s,2h),3.31-3.28(m,2h),2.26(s,2h),2.06(s,2h),1.78-1.76(m,2h)。esi-ms(m/z):520.1[m+h]
+
。
[0317]
实施例25和实施例26
[0318]
(s)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh25)、(r)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(kh26)的制备
[0319][0320][0321]
起始原料2-(4,4-二氟氮杂-1-基)-5-羰基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯的制备过程与实施例18的步骤c相同。
[0322]
步骤a):2-(4,4-二氟氮杂-1-基)-5-羟基-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯的制备
[0323][0324]
氮气保护下向2-(4,4-二氟氮杂-1-基)-5-羰基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(1g,2.96mmol)的四氢呋喃(10ml)溶液中加入tms-cf3(504mg,3.6mmol),然后滴入四丁基氟化铵(3.7ml,14.8mmol),室温反应16h。反应完全后,将反应液倒入水中,用乙酸乙酯萃取,有机相用饱和盐水洗涤,无水硫酸钠干燥,抽滤,滤液减压浓缩。所得粗品经flash柱纯化后得2-(4,4-二氟氮杂-1-基)-5-羟基-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(700mg,收率58%)。1h nmr(400mhz,cdcl3)δ7.94(s,1h),4.32(q,j=7.1hz,2h),3.73(dt,j=8.1,5.1hz,2h),3.29(d,j=6.2hz,2h),3.10-2.89(m,2h),2.68-2.65(m,1h),2.54(s,1h),2.39-2.36(m,2h),2.03-1.90(m,4h),1.37(t,j=7.1hz,3h)。esi-ms(m/z):409.3[m+h]
+
。
[0325]
步骤b):2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯的制备
[0326][0327]
向2-(4,4-二氟氮杂-1-基)-5-羟基-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(408mg,1mmol)的三氟乙酸(10ml)溶液中加入三乙基硅烷(1.16g,10mmol),于75℃下反应16h。反应完全后,将其倒入冰水中,用饱和碳酸氢钠溶液调节ph至中性,用乙酸乙酯萃取,将有机相用饱和盐水洗涤,无水硫酸钠干燥,抽滤后将滤液减压浓缩,所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=10/1)纯化后得白色固体2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(294mg,收率75%)。1h nmr(400mhz,cdcl3)δ7.84(s,1h),4.33(q,j=7.1hz,2h),3.81-3.61(m,3h),3.33-3.28(m,2h),3.06-3.00(m,1h),2.91-2.79(m,1h),2.45-2.19(m,4h),2.01-1.95(m,4h),1.37(t,j=7.1hz,3h)。esi-ms(m/z):393.2[m+h]
+
。
[0328]
步骤c):2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸的制备
[0329][0330]
向2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸乙酯(100mg,0.255mmol)的四氢呋喃(3ml)溶液中加入3ml甲醇和氢氧化锂(54mg,1.275mmol)水溶液(3ml),于60℃下反应2h。反应完全后,加入乙酸乙酯萃取,水相用1.0m盐酸调节ph至5左右,再用乙酸乙酯萃取,所得有机相用饱和盐水洗涤,无水硫酸钠干燥,抽滤,滤液减压浓缩后得白色固体2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(83mg,收率90%)。esi-ms(m/z):365.1[m+h]
+
。
[0331]
步骤d):2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0332][0333]
向2-(4,4-二氟氮杂-1-基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(60mg,0.164mmol)的二氯甲烷(5ml)溶液中加入氯化亚砜(29.4mg,0.247mmol)和一滴dmf,室温反应0.5h。将反应液减压浓缩后加入2ml四氢呋喃,并将其滴入到三乙胺(66.2mg,0.656mmol)和间氨基苯磺酰胺(56.4mg,0.328mmol)的四氢呋喃(2ml)溶液中。反应4h后将其倒入水中,加入乙酸乙酯萃取,有机相用饱和盐水洗涤,无水硫酸钠干燥,抽滤,减压浓
缩。所得粗品经反相色谱制备纯化后得白色固体2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(10mg,收率12%)。1h nmr(400mhz,dmso-d6)δ10.66(s,1h),8.28(s,1h),7.82(d,j=6.1hz,1h),7.62(s,1h),7.56-7.50(m,2h),7.38(s,2h),4.17-4.01(m,1h),3.63(br s,2h),3.43(t,j=5.8hz,2h),2.97-2.86(m,2h),2.43-2.26(m,3h),2.16-2.11(m,1h),1.96-1.94(m,2h),1.84-1.82(m,2h)。esi-ms(m/z):519.4[m+h]
+
。
[0334]
步骤e):(s)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺&(r)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0335][0336]
2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(120mg)经sfc拆分后得白色固体(s)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(48.24mg),1h nmr(400mhz,dmso-d6)δ10.66(s,1h),8.28(s,1h),7.86-7.77(m,1h),7.62(s,1h),7.57-7.51(m,2h),7.38(s,2h),4.16-4.03(m,1h),3.63(d,j=5.3hz,2h),3.43(t,j=5.8hz,2h),2.94-2.88(m,2h),2.44-2.26(m,3h),2.19-2.13(m,1h),2.03-1.90(m,2h),1.84(d,j=5.0hz,2h);esi-ms(m/z):519.1[m+h]
+
;和白色固体(r)-2-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-5-三氟甲基-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(29.73mg),1h nmr(400mhz,dmso-d6)δ10.66(s,1h),8.28(s,1h),7.84-7.79(m,1h),7.62(s,1h),7.56-7.52(m,2h),7.38(s,2h),4.15-4.03(m,1h),3.63(d,j=3.9hz,2h),3.43(t,j=5.8hz,2h),2.94-2.87(m,2h),2.42-2.36(m,3h),2.18-2.12(m,1h),2.04-1.78(m,4h),esi-ms(m/z):519.1[m+h]
+
。二者总收率65%。
[0337]
实施例27
[0338]
5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢苯并呋喃-6-甲酰胺(kh27)的制备
nmr(400mhz,dmso-d6)δ9.69(s,1h),7.48(s,1h),7.18(d,j=8.5hz,1h),6.66(d,j=8.5hz,1h),4.47(t,j=8.7hz,2h),3.14(t,j=8.6hz,2h),1.98(s,3h)。esi-ms(m/z):178.3[m+h]
+
。
[0349]
步骤d):n-(6-硝基-2,3-二氢苯并呋喃-5-基)乙酰胺的制备
[0350][0351]
向n-(2,3-二氢苯并呋喃-5-基)乙酰胺(1g,5.65mmol)的醋酸(10ml)溶液中加入发烟硝酸(0.5g,7.9mmol),于30℃下搅拌1h。反应完全后将其倒入冰水中,用饱和碳酸氢钠水溶液调节ph至弱碱性,再用乙酸乙酯萃取,所得有机相经饱和盐水洗涤及无水硫酸钠干燥后抽滤,将滤液减压浓缩得黄色固体n-(6-硝基-2,3-二氢苯并呋喃-5-基)乙酰胺(1.1g,收率90%)。esi-ms(m/z):223.1[m+h]
+
。
[0352]
步骤e):6-硝基-2,3-二氢苯并呋喃-5-胺的制备
[0353][0354]
向n-(6-硝基-2,3-二氢苯并呋喃-5-基)乙酰胺(1g,4.48mmol)的乙醇(10ml)溶液中加入盐酸(5ml),回流2h。反应完全后将其倒入冰水中,用饱和碳酸氢钠溶液调节ph至弱碱性,加入乙酸乙酯萃取有机相,盐水洗涤,无水硫酸钠干燥,减压浓缩得黄色固体6-硝基-2,3-二氢苯并呋喃-5-胺(720mg,收率90%)。esi-ms(m/z):181.2[m+h]
+
。
[0355]
步骤f):6-硝基-2,3-二氢苯并呋喃的制备
[0356][0357]
0℃下向6-硝基-2,3-二氢苯并呋喃-5-胺(3g,16.7mmol)的硫酸(27ml)溶液中滴入亚硝酸钠(1.38g,20mmol)水溶液,搅拌1h后滴入60℃的硫酸铜乙醇溶液中,继续搅拌1h。反应完全后,将反应液浓缩,倒入冰水中,加入乙酸乙酯萃取有机相,饱和盐水洗涤,无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=20/1)纯化后得黄色固体6-硝基-2,3-二氢苯并呋喃(1.7g,收率62%)。1h nmr(400mhz,cdcl3)δ7.76(dd,j=8.1,2.0hz,1h),7.58(d,j=2.0hz,1h),7.29(d,j=8.1hz,1h),4.70(t,j=8.8hz,2h),3.30(t,j=8.8hz,2h)。
[0358]
步骤g):2,3-二氢苯并呋喃-6-胺的制备
[0359][0360]
向6-硝基-2,3-二氢苯并呋喃(3.0g,18.1mmol)的四氢呋喃(15ml)溶液中加入乙醇(15ml)、pd/c(0.3g,10%wt),氢气置换,于室温搅拌16h。反应完全后,将反应液过滤,滤液浓缩后得黄色固体2,3-二氢苯并呋喃-6-胺(2.1g,收率86%)。esi-ms(m/z):136.2[m+h]
+
。
[0361]
步骤h):5-碘-2,3-二氢苯并呋喃-6-胺的制备
[0362][0363]
冰浴下向2,3-二氢苯并呋喃-6-胺(1.6g,11.85mmol)的乙腈(48ml)溶液中分批加入n-碘代琥珀酰亚胺(2.53g,11.26mmol),搅拌0.33h。反应完全后,将反应液浓缩,经柱层析(石油醚/乙酸乙酯(v/v)=10/1)纯化后得黄色固体5-碘-2,3-二氢苯并呋喃-6-胺(2.6g,收率89%)。1h nmr(400mhz,cdcl3)δ7.38(s,1h),6.27(s,1h),4.53(t,j=8.5hz,2h),4.01(s,2h),3.10(t,j=8.5hz,2h)。
[0364]
步骤i):5-碘-2,3-二氢苯并呋喃-6-腈的制备
[0365][0366]
将氰化亚铜(931mg,10.46mmol)加入到dmso(50ml)中,升温至60℃使其溶解,然后加入亚硝酸叔丁酯(2.48g,24.12mmol),滴入5-碘-2,3-二氢苯并呋喃-6-胺(2.1g,8.04mmol)的dmso(14ml)溶液,于60℃下继续搅拌1h,然后降温至45℃,加入4.0m的盐酸(4.1ml),继续搅拌10min。将反应液倒入冰水中,加入乙酸乙酯萃取有机相,饱和盐水洗涤,无水硫酸钠干燥,抽滤,减压浓缩。粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=20/1)纯化后得黄色固体5-碘-2,3-二氢苯并呋喃-6-腈(0.45g,收率21%)。1h nmr(400mhz,cdcl3)δ7.48(s,1h),7.23(s,1h),4.70(t,j=8.8hz,2h),3.29(t,j=8.8hz,2h)。
[0367]
步骤j):5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-腈的制备
[0368][0369]
向5-碘-2,3-二氢苯并呋喃-6-腈(220mg,0.812mmol)的1,4二氧六环(8ml)溶液中加入4.4-二氟氮杂环庚烷盐酸盐(278mg,1.624mmol)、碳酸铯(1.055g,3.248mmol)、binap(101mg,0.162mmol)、pd(oac)2(18mg,0.0812mmol),氮气保护,于120℃下搅拌48h。反应完全后将反应液倒入水中,加入乙酸乙酯萃取,有机相用饱和食盐水洗涤,无水硫酸钠干燥,抽滤,将滤液真空减压浓缩。所得粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=20/1)后得浅黄色固体5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-腈(120mg,收率53%)。1h nmr(400mhz,cdcl3)δ6.94(s,1h),6.90(s,1h),4.58(t,j=8.7hz,2h),3.35-3.28(m,4h),3.21(t,j=8.6hz,2h),2.46-2.32(m,2h),2.29-2.23(m,2h),1.96-1.94(m,2h)。esi-ms(m/z):279.1[m+h]
+
。
[0370]
步骤k):5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-甲酸的制备
[0371][0372]
向5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-腈(130mg)中加入40%硫酸
(10ml),于100℃下反应16h。反应完全后将反应液倒入碎冰中,加入乙酸乙酯萃取有机相,饱和盐水洗涤,无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经flash柱纯化后得白色固体5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-甲酸(85mg,收率61%)。esi-ms(m/z):298.0[m+h]
+
。
[0373]
步骤l):5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢苯并呋喃-6-甲酰胺的制备
[0374][0375]
向5-(4,4-二氟氮杂-1-基)-2,3-二氢苯并呋喃-6-甲酸(25mg,0.084mmol)的二氯甲烷(5ml)溶液中加入一滴dmf和socl2(30mg,0.252mmol),室温搅拌0.5h后浓缩,加入四氢呋喃(2ml)将其溶解,然后滴入到四氢呋喃(1ml)、三乙胺(34mg,0.336mmol)和间氨基苯磺酰胺(36mg,0.21mmol)的混合物中。反应完全后将反应液倒入水中,加入乙酸乙酯萃取,有机相用饱和盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经反向制备色谱纯化后得白色固体5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢苯并呋喃-6-甲酰胺(8.06mg,收率21%)。1h nmr(400mhz,dmso-d6)δ11.72(s,1h),8.44(s,1h),7.67(dd,j=7.8,3.3hz,1h),7.54(d,j=5.0hz,2h),7.38(s,2h),7.34(s,1h),7.08(s,1h),4.55(t,j=8.6hz,2h),3.22(t,j=8.6hz,2h),3.19-3.14(m,2h),3.14-3.08(m,2h),2.35-2.22(m,2h),2.16-2.13(m,2h),1.81-1.71(m,2h)。esi-ms(m/z):452.3[m+h]
+
。
[0376]
实施例28
[0377]
5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酰胺(kh28)的制备
[0378][0379]
步骤a):1-(3-羟基吡啶-2-基)-n,n,n-三甲基亚甲胺碘盐的制备
[0380][0381]
0℃下向2-(二甲胺基亚甲基)吡啶-3-羟基(10g,65.8mmol)的丙酮(100ml)溶液中滴入碘甲烷(38g,261mmol),搅拌3h;反应完全后将反应液过滤,滤饼经真空干燥后得白色固体1-(3-羟基吡啶-2-基)-n,n,n-三甲基亚甲胺碘盐(1g,收率91%)。esi-ms(m/z):167.2[m-i]
+
。
[0382]
步骤b):2,3-二氢呋喃并[3,2-b]吡啶的制备
[0383][0384]
向三甲基碘化亚砜(1.776g,8.08mmol)的dmso(30ml)溶液中加入nah(0.673g,16.8mmol),氮气置换,室温搅拌3h,再加入1-(3-羟基吡啶-2-基)-n,n,n-三甲基亚甲胺碘盐(2.0g,6.73mmol),于室温搅拌16h。反应完全后,将反应体系倒入冰水中,加乙酸乙酯萃取三次,合并有机层,用饱和氯化钠水溶液洗涤有机相三次,加无水硫酸钠干燥,抽滤,减压浓缩;所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=5/1)纯化后得浅黄色固体2,3-二氢呋喃并[3,2-b]吡啶(470mg,收率11%)。1h nmr(400mhz,cdcl3)δ8.02(d,j=2.6hz,1h),7.00(d,j=2.8hz,2h),4.65(t,j=8.9hz,2h),3.32(t,j=8.9hz,2h)。esi-ms(m/z):122.1[m+h]
+
。
[0385]
步骤c):5-硝基-2,3-二氢呋喃并[3,2-b]吡啶的制备
[0386][0387]
冰浴下向2,3-二氢呋喃并[3,2-b]吡啶(600mg,4.96mmol)的硫酸(4ml)溶液中滴加发烟硝酸(5ml)与浓硫酸(1ml)的混合液,反应1h。反应完成后,将反应体系倒入冰水中,用乙酸乙酯萃取三次,合并有机相,再用饱和食盐水洗涤三次,加入无水硫酸钠干燥,抽滤,减压浓缩得黄色固体5-硝基-2,3-二氢呋喃并[3,2-b]吡啶(500mg,收率61%)。esi-ms(m/z):166.9[m+h]
+
。
[0388]
步骤d):2,3-二氢呋喃并[3,2-b]吡啶-5-胺的制备
[0389][0390]
将5-硝基-2,3-二氢呋喃并[3,2-b]吡啶(3.1g,18.7mmol)溶在甲醇(10ml)中,加入pd/c(310mg,1.5mmol),氢气置换后室温下搅拌16h。反应完后过滤反应液,将滤液减压浓缩,得黑色固体2,3-二氢呋喃并[3,2-b]吡啶-5-胺(2.4g,收率98%)。1h nmr(400mhz,cdcl3)δ6.90(d,j=8.5hz,1h),6.26(d,j=8.5hz,1h),4.57(t,j=8.9hz,2h),4.11(br s,2h),3.19(t,j=8.8hz,2h)。esi-ms(m/z):137.1[m+h]
+
。
[0391]
步骤e):6-溴-2,3-二氢呋喃并[3,2-b]吡啶-5-胺的制备
[0392][0393]
向2,3-二氢呋喃并[3,2-b]吡啶-5-胺(1.5g,11.03mmol)的乙酸(10ml)溶液中滴加液溴(1.85g,11.6mmol)与乙酸(10ml)的混合液,室温搅拌16h。反应完成后,向反应体系中加入碳酸氢钠调成弱碱性,再用乙酸乙酯萃取三次,所得有机相经饱和食盐水洗涤三次,无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=5/1)纯化后得淡黄色油状物6-溴-2,3-二氢呋喃并[3,2-b]吡啶-5-胺(1.54g,收率65%)。1h nmr(400mhz,cdcl3)δ7.14(s,1h),4.59(d,j=8.9hz,2h),3.16(t,j=8.8hz,2h)。esi-ms(m/z):217.0[m+h]
+
。
[0394]
步骤f):5-氨基-2,3-二氢呋喃并[3,2-b]吡啶-6-腈的制备
[0395][0396]
向微波管中加入6-溴-2,3-二氢呋喃并[3,2-b]吡啶-5-胺(200mg,0.93mmol),再依次加入nmp(5ml),zn(cn)2(164mg,1.39mmol),pd(pph3)4(107.8mg,0.09mmol)。在120℃体系中微波反应1.5h。反应完成后加水,用乙酸乙酯萃取三次,合并有机相,并用饱和食盐水洗涤三次,加入无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经反相体系纯化得黄色固体5-氨基-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(119mg,收率79%)。esi-ms(m/z):162.2[m+h]
+
。
[0397]
步骤g):5-氯-2,3-二氢呋喃并[3,2-b]吡啶-6-腈的制备
[0398][0399]
用盐酸(6m,10ml)溶解5-氨基-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(600mg,3.7mmol),等反应体系降温至-5℃时,向体系中加nano2(511mg,7.4mmol)溶液,-5℃下反应10min后升温至常温继续反应3h。待反应完全后,加水淬灭反应,再用nahco3调节反应液ph至弱碱性,乙酸乙酯萃取三次,用饱和食盐水洗涤有机层三次,加入无水硫酸钠干燥,抽滤,减压浓缩。所得粗品经制备硅胶板(石油醚/乙酸乙酯(v/v)=1/1)纯化得白色固体5-氯-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(409mg,收率61%)。esi-ms(m/z):181.2[m+h]
+
。
[0400]
步骤h):5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-腈的制备
[0401][0402]
用5ml的1,4-二氧六环溶解5-氯-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(150mg,0.83mmol),再加入4,4-二氟氮杂环庚烷盐酸盐(285mg,1.67mmol),cs2co3(948mg,2.92mmol),binap(104mg,0.17mmol)和pd(oac)2(18.7mg,0.08mmol),130℃下反应48h。反应完成后加水淬灭,再加乙酸乙酯萃取三次,饱和食盐水洗涤三次,无水硫酸钠干燥,抽滤,减压浓缩,经硅胶板((石油醚/乙酸乙酯(v/v)=10/1)纯化后得白色固体5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(63mg,收率27%)。esi-ms(m/z):280.3[m+h]
+
。
[0403]
步骤i):5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酸的制备
[0404][0405]
向5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-腈(70mg,0.25mmol)中加入30ml 10%koh水溶液,于110℃下反应16h,反应完全后用乙酸乙酯萃取,弃去有机相,水相经稀盐酸调节ph至5~6后再用乙酸乙酯萃取三次,合并有机层,并用饱和食盐水洗涤三次,加入无水硫酸钠干燥,抽滤,减压浓缩,得白色固体5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酸(45mg,收率60%)。esi-ms(m/z):299.1[m+h]
+
。
[0406]
步骤j):5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酰胺的制备
[0407][0408]
向5-(4,4-二氟氮杂-1-基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酸(60mg,0.2mmol)中加入socl2(1.2ml)反应1h,减压浓缩后加四氢呋喃(1.5ml)、三乙胺(1.5ml)反应1h。反应完成后旋干溶剂,加入乙酸调节ph至中性,再加入乙酸乙酯萃取三次,饱和食盐水洗涤,无水硫酸钠干燥,抽滤,减压浓缩得白色固体5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-2,3-二氢呋喃并[3,2-b]吡啶-6-甲酰胺(15mg,收率16%)。1h nmr(400mhz,dmso)δ10.69(s,1h),8.33(s,1h),7.82-7.74(m,1h),7.57-7.51(m,2h),7.38(s,2h),7.22(s,1h),4.60(t,j=8.8hz,2h),3.50-3.44(m,2h),3.35(s,2h),3.21(t,j=8.8hz,2h),2.31(d,j=11.2hz,2h),1.98(t,j=13.1hz,2h),1.80(d,j=5.6hz,2h)。esi-ms(m/z):453.1[m+h]
+
。
[0409]
实施例29
[0410]
5-(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-甲酰胺(kh29)的制备
[0411][0412]
步骤a):[1,3]二氧环戊烷并[4,5-b]吡啶的制备
[0413][0414]
向2,3-二羟基吡啶(25g,225.2mmol)的nmp(150ml)溶液中加入二溴甲烷(58g,337.8mmol)和碳酸钾(46.6g,337.8mmol),氮气置换,于80℃下搅拌24h。待反应液冷却至室温后加入乙酸乙酯稀释,过滤,向滤液中加水分相,有机相用饱和盐水洗涤两次,加入无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析纯化后得浅黄色液体[1,3]二氧环戊烷并[4,5-b]吡啶(2.5g,收率9%)。1h nmr(400mhz,cdcl3)δ7.65(br s,1h),6.98(dd,j=7.6,1.3hz,1h),6.79-6.71(m,1h),6.04(s,2h)。esi-ms(m/z):124.0[m+h]
+
。
[0415]
步骤b):5-硝基-[1,3]二氧环戊烷并[4,5-b]吡啶的制备
[0416][0417]
0℃下向硫酸(10ml)中加入[1,3]二氧环戊烷并[4,5-b]吡啶(1g,8.13mmol),再缓慢滴入硝酸钾(1.23g,12.2mmol)的硫酸(5ml)溶液,于室温反应2h。反应完全后将反应液倒入碎冰中,用乙酸乙酯萃取有机相,饱和碳酸氢钠溶液洗涤,饱和盐水洗涤,无水硫酸钠干燥,抽滤,滤液浓缩后得黄色固体5-硝基-[1,3]二氧环戊烷并[4,5-b]吡啶(1.05g,收率77%)。esi-ms(m/z):169.1[m+h]
+
。
[0418]
步骤c):[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺的制备
[0419][0420]
冰浴下向5-硝基-[1,3]二氧环戊烷并[4,5-b]吡啶(500mg,2.97mmol)的甲醇(10ml)溶液中加入雷尼镍(0.2ml),然后滴入水合肼(744mg,14.88mmol),室温反应2h;反应完全后过滤,将滤液浓缩后得浅黄色固体[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺(370mg,收率90%)。esi-ms(m/z):139.1[m+h]
+
。
[0421]
步骤d):6-溴-[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺的制备
[0422][0423]
向[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺(500mg,3.62mmol)的醋酸(20ml)溶液中滴入溴素(640mg,4mmol)醋酸(5ml)溶液,室温反应2h;反应完全后,将其倒入冰水中,加入碳酸氢钠调节ph至8,用乙酸乙酯萃取有机相,饱和盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=5/1)纯化后得白色固体6-溴-[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺(600mg,收率76%)。1h nmr(400mhz,cdcl3)δ7.08(d,j=1.0hz,1h),5.98(d,j=0.9hz,2h),4.50(br s,2h)。esi-ms(m/z):217.0[m+h]
+
。
[0424]
步骤e):5-氨基-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈的制备
[0425][0426]
向6-溴-[1,3]二氧环戊烷并[4,5-b]吡啶-5-胺(1.9g,8.75mmol)的nmp(20ml)溶液中加入zn(cn)2(1.57g,17.55mmol),120℃反应16h;反应完全后,将其倒入水中,加入乙酸乙酯萃取有机相,饱和盐水洗涤,硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=5/1)纯化后得白色固体5-氨基-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(750mg,收率52%)。esi-ms(m/z):164.1[m+h]
+
。
[0427]
步骤f):5-碘-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈的制备
[0428][0429]
向5-氨基-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(750mg,4.6mmol)的氯仿(20ml)溶液中加入碘单质(1402mg,5.5mmol),缓慢加入亚硝酸叔丁酯(948mg,9.2mmol),室温反应16h;反应完全后,将其倒入冰水中,加入乙酸乙酯萃取有机相,有机相经硫代硫酸钠水溶液洗涤,饱和盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=10/1)纯化后得淡黄色固体5-碘-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(550mg,收率44%)。1h nmr(400mhz,dmso-d6)δ7.67(s,1h),6.29(s,2h)。esi-ms(m/z):274.9[m+h]
+
。
[0430]
步骤g):5-(4,4-二氟氮杂-1-基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈的制备
[0431][0432]
向5-碘-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(500mg,0.1824mmol)的1,4-二氧六环(20ml)溶液中加入4,4-二氟氮杂环庚烷盐酸盐(780mg,0.4562mmol),binap(340mg,0.05824mmol),碳酸铯(2080mg,0.6385mmol),醋酸钯(81mg,0.364mmol),氮气置换3次,110℃反应16h;反应完全后,加水淬灭,用乙酸乙酯萃取有机相,饱和食盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析(石油醚/乙酸乙酯(v/v)=100/1)纯化后得淡黄色固体5-(4,4-二氟氮杂-1-基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(220mg,收率43%)。1h nmr(400mhz,dmso-d6)δ7.43(s,1h),6.13(s,2h),3.74-3.64(m,4h),2.29-2.25(m,2h),2.15-2.08(m,2h),1.95-1.85(m,2h)。esi-ms(m/z):282.1[m+h]
+
。
[0433]
步骤h):5-(4,4-二氟氮杂-1-基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-甲酰胺的制备
[0434][0435]
向5-(4,4-二氟氮杂-1-基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-腈(140mg,0.49mmol)的二甲基亚砜(3ml)溶液中加入碳酸钾(750mg,5.4mmol),冰浴下缓慢加入30%的过氧化氢溶液(1ml),自然升至室温反应4h;反应完全后,冰水淬灭,加入二氯甲烷萃取有机相,饱和食盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所得粗品经硅胶柱层析(二氯甲烷/甲醇(v/v)=20/1)纯化后得白色固体5-(4,4-二氟氮杂-1-基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-甲酰胺(42mg,收率28%)。1h nmr(400mhz,dmso-d6)δ7.77(s,1h),7.29(d,j=6.1hz,1h),7.23(s,1h),6.07(d,j=7.6hz,2h),3.40(dd,j=6.7,3.9hz,2h),3.29(t,j=6.0hz,2h),2.35-2.24(m,2h),2.00(dd,j=14.8,7.3hz,2h),1.83(dd,j=11.2,5.6hz,2h)。esi-ms(m/z):300.1[m+h]
+
。
[0436]
步骤i):3-溴-n,n-二(2,4-二甲氧基苄基)苯磺酰胺的制备
[0437][0438]
向3-溴-苯磺酰氯(600mg,2.34mmol)的二氯甲烷(6ml)溶液中加入二(2,4-二甲氧基苄)胺(820mg,2.58mmol)和三乙胺(470mg,4.69mmol),室温反应2h;反应完全后,加水淬灭,用二氯甲烷萃取有机相,饱和食盐水洗涤,无水硫酸钠干燥,抽滤,将滤液减压浓缩。所
(4,4-二氟氮杂-1-基)-n-(3-氨磺酰基苯基)-[1,3]二氧环戊烷并[4,5-b]吡啶-6-甲酰胺(15.3mg,收率33%)。1hnmr(400mhz,dmso-d6)δ10.53(s,1h),8.30(s,1h),7.78(s,1h),7.55-7.50(m,2h),7.36(d,j=9.4hz,3h),6.10(s,2h),3.46(s,3h),2.67(d,j=1.7hz,1h),2.38-2.23(m,3h),1.97(s,2h),1.81(d,j=5.9hz,2h)。esi-ms(m/z):455.2[m+h]
+
。
[0445]
实施例30
[0446]
2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(kh30)的制备
[0447][0448]
步骤a):1-醛基-2-环己酮-1-基钠盐的制备
[0449][0450]
将环己酮(30g,305.6mmol)和甲酸乙酯(23.78g,320.9mmol)溶于乙醚(150ml),置于冰水浴中,加入乙醇钠(20.8g,305.6mmol),在室温下搅拌10h,过滤,将滤饼用乙醚洗涤,得白色固体1-醛基-2-环己酮-1-基钠盐(42g,收率92.1%)。1h nmr(400mhz,dmso-d6)δ9.19(s,1h),2.12-2.04(m,2h),1.90-1.83(m,2h),1.54(dd,j=11.9,5.8hz,2h),1.45-1.40(m,2h).
[0451]
步骤b):2-羰基-1,2,5,6,7,8-六氢喹啉-3-甲腈的制备
[0452][0453]
向1-醛基-2-环己酮-1-基钠盐(20g,134.1mmol)的甲苯(300ml)溶液中加入氰基乙酰胺(28.1g,335.2mmol),于室温搅拌1h后加入2m乙酸哌啶二氯甲烷溶液(30ml),升温至110℃反应16h。反应完全后,加入乙酸酸化后过滤,将滤液旋干,并用乙醚洗涤,得到白色固体2-羰基-1,2,5,6,7,8-六氢喹啉-3-甲腈(6.7g,收率28.6%)。esi-ms(m/z):175.1[m+h]
+
。
[0454]
步骤c):2-氯-5,6,7,8-四氢喹啉-3-甲腈的制备
[0455]
[0456]
向2-羰基-1,2,5,6,7,8-六氢喹啉-3-甲腈(6.7g,38.4mmol)的甲苯(100ml)溶液中加入diea(34.8g,269.2mmol)和三氯氧磷(23.5g,153.8mmol),于110℃下搅拌4h。待反应液冷却至室温后将其浓缩,加入100ml饱和nh4cl水溶液淬灭反应,用乙酸乙酯(100ml
×
3)萃取,合并有机相,并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩,所得粗品经硅胶层析柱(石油醚/乙酸乙酯(v/v)=5/1)纯化后得黄色固体2-氯-5,6,7,8-四氢喹啉-3-甲腈(6.6g,收率89.0%)。esi-ms(m/z):193.1[m+h]
+
。
[0457]
步骤d):2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲腈的制备
[0458][0459]
将2-氯-5,6,7,8-四氢喹啉-3-甲腈(2.5g,12.9mmol)溶于nmp(50ml),加入diea(5.03g,38.9mmol)和4.4-二氟氮杂环庚烷盐酸盐(2.4g,14.2mmol),于140℃下反应16h。待反应液冷却至室温后加入50ml饱和nh4cl水溶液淬灭反应,用乙酸乙酯(60ml
×
3)萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后所得粗品经正相制备色谱纯化(石油醚/乙酸乙酯(v/v)=3/1)得白色固体2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲腈(2.2g,收率58.2%)。1h nmr(400mhz,dmso-d6)δ7.65(s,1h),3.75(dd,j=12.1,6.1hz,4h),2.67(t,j=6.4hz,2h),2.58(t,j=6.2hz,2h),2.37-2.25(m,2h),2.15-2.00(m,2h),1.95-1.85(m,2h),1.80-1.64(m,4h)。esi-ms(m/z):292.1[m+h]
+
。
[0460]
步骤e):2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0461][0462]
将2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲腈(2g,6.8mmol)溶于dmso(20ml)中,加入碳酸钾(2.8g,20.5mmol),置于冰水浴中,缓慢滴加双氧水(1.17g,34.3mmol,30%wt),随后恢复室温反应3h。反应完全后,加入20ml饱和nh4cl水溶液淬灭反应,用乙酸乙酯(30ml
×
3)萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后所得粗品经正相制备色谱纯化后得白色固体2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(1.4g,收率66.0%)。esi-ms(m/z):310.1[m+h]
+
。
[0463]
步骤f):2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0464][0465]
向2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(100mg,0.332mmol)的甲苯(8ml)的溶液中加入4-溴-2-甲氧基吡啶(72.7mg,0.387mmol),ruphos-pd-g2(25mg,0.033mmol),碳酸铯(210mg,0.645mmol),于110℃下反应16h。反应完全后,加水淬灭,用乙酸乙酯萃取有机相(100ml),并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后用硅胶板纯化(乙酸乙酯/石油醚(v/v)=1/3),得白色固体2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(120mg,收率89%)。1h nmr(400mhz,dmso-d6)δ10.61(s,1h),8.04(d,j=5.6hz,1h),7.43(s,1h),7.20(br s,1h),7.18(s,1h),3.82(s,3h),3.55(d,j=5.0hz,2h),3.35(d,j=6.0hz,2h),2.68(t,j=6.1hz,2h),2.63(t,j=6.0hz,2h),2.30(d,j=11.7hz,2h),1.99(br s,2h),1.80(br s,4h),1.72(d,j=5.2hz,2h)。esi-ms(m/z):417.1[m+h]
+
。
[0466]
步骤g):2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0467][0468]
向2-(4,4-二氟氮杂-1-基)-n-(2-甲氧基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(150mg,0.362mmol)的四氢呋喃(10ml)溶液中加入碘化钠(135mg,0.905mmol),三甲基氯硅烷(98mg,0.905mmol),于50℃下反应5h。反应完全后,加水淬灭,用乙酸乙酯萃取有机相,并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩,所得粗品经c18反向柱甲酸制备,得白色固体2-(4,4-二氟氮杂-1-基)-n-(2-羰基-1,2-二氢吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(66.87mg,收率%)。1h nmr(400mhz,dmso-d6)δ11.20(s,1h),10.37(s,1h),7.40(s,1h),7.29(d,j=7.2hz,1h),6.79(s,1h),6.51-6.35(m,1h),3.55(br s,2h),3.34(br s,2h),2.68(t,j=6.1hz,2h),2.63(t,j=6.0hz,2h),2.31(d,j=12.5hz,2h),2.01-1.91(m,2h),1.81(dd,j=10.2,5.3hz,4h),1.72(d,j=5.0hz,2h)。esi-ms(m/z):403.1[m+h]
+
。
[0469]
实施例31
[0470]
2-(4,4-二氟氮杂-1-基)-n-(2-氨磺酰基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(kh31)的制备
[0471][0472]
步骤a):n-(2-(n,n-二(2,4-二甲氧基苄基)氨磺酰基)吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0473][0474]
3-溴-n,n-二(2,4-二甲氧基苄基)苯磺酰胺的制备与实施例29的步骤i相同,2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备过程与实施例30的步骤a-e相同。
[0475]
将3-溴-n,n-二(2,4-二甲氧基苄基)苯磺酰胺(127mg,0.2mmol)和2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(87.7mg,0.2mmol)溶于甲苯(2ml),加入碳酸铯(230.9mg,0.7mmol)和ruphos pd g2(18.3mg,0.02mmol),氮气保护,于110℃下反应16h。待反应完全后,将反应液浓缩,加入10ml饱和nh4cl水溶液淬灭,用二氯甲烷(10ml
×
3)萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后,所得粗品经反向制备色谱纯化后得白色固体n-(2-(n,n-二(2,4-二甲氧基苄基)氨磺酰基)吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(52mg,收率28.7%)。esi-ms(m/z):766.2[m+h]
+
。
[0476]
步骤b):2-(4,4-二氟氮杂-1-基)-n-(2-氨磺酰基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0477][0478]
将n-(2-(n,n-二(2,4-二甲氧基苄基)氨磺酰基)吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(50mg,0.06mmol)溶于二氯甲烷(1ml)中,加入三氟乙酸(74.4mg,0.6mmol),室温反应2h。反应完全后,将反应体系浓缩。加入10ml饱和nahco3水
溶液淬灭反应,用二氯甲烷(10ml
×
3)萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后所得粗品经反向制备色谱纯化后得白色固体2-(4,4-二氟氮杂-1-基)-n-(2-氨磺酰基吡啶-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(13.49mg,收率43.6%)。1h nmr(400mhz,dmso-d6)δ10.98(s,1h),8.58(d,j=5.4hz,1h),8.31(d,j=1.7hz,1h),7.82(dd,j=5.5,2.0hz,1h),7.49(s,1h),7.43(s,2h),3.57(br s,2h),3.34(br s,1h),3.30(br s,1h),2.70(t,j=6.2hz,2h),2.64(t,j=5.8hz,2h),2.32(d,j=8.9hz,2h),1.93(br s,2h),1.85-1.77(m,4h),1.73(d,j=4.5hz,2h)。esi-ms(m/z):466.0[m+h]
+
。
[0479]
实施例32
[0480]
n-(2-氨甲酰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(kh32)的制备
[0481][0482]
步骤a):n-(2-氰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0483][0484]
2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备过程与实施例30的步骤a-e相同。
[0485]
向2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(200mg,0.645mmol)的甲苯(15ml)的溶液中加入4-溴吡啶-2-甲腈(140mg,0.774mmol),ruphos-pd-g2(50mg,0.0645mmol),碳酸铯(420mg,1.29mmol),于110℃下反应16h。反应完全后,加水淬灭,用乙酸乙酯萃取有机相(30ml),饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩,所得粗品经硅胶制备板纯化(乙酸乙酯/石油醚(v/v)=1/3)得白色固体n-(2-氰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(170mg,收率64%)。1h nmr(400mhz,dmso-d6)δ11.02(s,1h),8.62(d,j=5.6hz,1h),8.20(d,j=1.8hz,1h),7.90(dd,j=5.6,2.1hz,1h),7.49(s,1h),3.59-3.53(m,2h),2.70(t,j=6.2hz,2h),2.64(t,j=6.0hz,2h),2.32(d,j=5.7hz,2h),1.97(d,j=13.4hz,2h),1.91(d,j=14.1hz,2h),1.84-1.76(m,4h),1.73(d,j=4.3hz,2h)。esi-ms(m/z):412.1[m+h]
+
。
[0486]
步骤b):n-(2-氨甲酰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0487][0488]
向n-(2-氰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(150mg,0.364mmol)的dmso(5ml)溶液中加入碳酸铯(356g,1.09mmol),于0℃下缓慢滴加30%双氧水(2.5ml)。待反应完全后,用冰水淬灭反应,再用乙酸乙酯萃取,所得有机相用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后,所得粗品经c18反相柱甲酸制备纯化得白色固体n-(2-氨甲酰基吡啶-4-基)-2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(82.2mg,收率52.7%)。1h nmr(400mhz,dmso-d6)δ10.82(s,1h),8.50(d,j=5.4hz,1h),8.34(s,1h),8.07(s,1h),7.86(d,j=5.3hz,1h),7.61(s,1h),7.48(s,1h),3.58(br s,2h),3.37-3.33(m,2h),2.69(t,j=6.2hz,2h),2.65(d,j=6.1hz,2h),2.30(br s,2h),1.93(br s,2h),1.81(br s,4h),1.73(d,j=5.4hz,2h)。esi-ms(m/z):430.1[m+h]
+
。
[0489]
实施例33
[0490]
2-(4,4-二氟氮杂-1-基)-n-(6-羰基-1,6-二氢哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(kh33)的制备
[0491][0492]
步骤a):2-(4,4-二氟氮杂-1-基)-n-(6-甲氧基哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0493][0494]
2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备过程与实施例30的步骤a-e相同。
[0495]
将5-溴-3-甲氧基哒嗪(70mg,0.3mmol)和2-(4,4-二氟氮杂-1-基)-5,6,7,8-四氢喹啉-3-甲酰胺(137.4mg,0.4mmol)溶于甲苯(3ml),加入碳酸铯(362mg,1.1mmol)和ruphos pd g2(28.7mg,0.03mmol),氮气保护,于110℃下反应16h。待反应完全后,将反应液浓缩,加入10ml饱和nh4cl水溶液淬灭反应,用二氯甲烷(15ml
×
3)萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后所得粗品经反向制备色谱纯化
后得白色固体2-(4,4-二氟氮杂-1-基)-n-(6-甲氧基哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(45mg,收率28.5%)。esi-ms(m/z):418.1[m+h]
+
。
[0496]
步骤b):2-(4,4-二氟氮杂-1-基)-n-(6-羰基-1,6-二氢哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺的制备
[0497][0498]
将2-(4,4-二氟氮杂-1-基)-n-(6-甲氧基哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(45mg,0.1mmol)溶于四氢呋喃(1ml)中,加入碘化钠(40.3mg,0.2mmol)和三甲基氯硅烷(29.2mg,0.2mmol),于50℃下反应4h。将反应液浓缩后加入10ml水淬灭,用二氯甲烷(15ml
×
3)进行萃取,分离出有机相并用饱和食盐水洗涤,无水硫酸钠干燥,抽滤。将滤液减压浓缩后所得粗品经反向制备色谱纯化后得白色固体2-(4,4-二氟氮杂-1-基)-n-(6-羰基-1,6-二氢哒嗪-4-基)-5,6,7,8-四氢喹啉-3-甲酰胺(24.68mg,收率56.7%)。1h nmr(400mhz,dmso-d6)δ12.75(s,1h),10.71(s,1h),7.95(d,j=2.2hz,1h),7.48(s,1h),7.24(s,1h),3.55(br s,2h),3.33(br s,1h),3.30-3.28(m,1h),2.69(t,j=6.3hz,2h),2.64(t,j=6.0hz,2h),2.31(d,j=10.8hz,2h),1.94(br s,2h),1.80(d,j=6.0hz,4h),1.73(d,j=5.0hz,2h)。esi-ms(m/z):404.1[m+h]
+
。
[0499]
实施例34(vx150原药)
[0500]
2-(4-氟-2-甲基苯酚基)-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺的制备
[0501][0502]
步骤a):2-氟-n-(2-甲氧基吡啶-4-基)-4-(三氟甲基)苯甲酰胺的制备
[0503][0504]
在氮气保护下,向2-氟-4-三氟甲基苯甲酸(1g,4.8mmol)、2-甲氧基-4-氨基吡啶(0.626g,5mmol)、hatu(2.741g,7.2mmol)的二氯甲烷(30ml)溶液中加入三乙胺(1.7g,16.8mmol),室温搅拌反应16h,反应完全后加入纯水50ml搅拌均匀,分液、取下层有机相留用,上层水相用二氯甲烷(30ml
×
3)萃取,再合并所有有机相,并用饱和nacl溶液(30ml
×
2)洗涤,无水硫酸钠干燥、过滤,将滤液减压旋干,所得粗品经硅胶柱层析纯化(pe/ea(v/v)=8/1-3/1)得白色固体2-氟-n-(2-甲氧基吡啶-4-基)-4-(三氟甲基)苯甲酰胺(1.179g,收率78.1%)。
[0505]
步骤b):2-氟-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺的制备
[0506][0507]
在氮气保护下,向2-氟-n-(2-甲氧基吡啶-4-基)-4-(三氟甲基)苯甲酰胺(0.5g,1.6mmol)中加入氢溴酸/冰乙酸溶液(10ml,33%),于100℃反应5h,随后室温反应12h,加入纯水40ml并搅拌30min,过滤,将滤饼用纯水(10ml
×
2)洗涤,50℃减压烘干得灰色固体2-氟-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺(0.215g,收率45%)。
[0508]
步骤c):2-(4-氟-2-甲基苯酚基)-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺的制备
[0509][0510]
在氮气保护下,向2-氟-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺(0.21g,0.7mmol)、4-氟-2-甲基苯酚(0.261g,2mmol)、碳酸铯(0.684g,2mmol)中加入dmf(6ml),于80℃反应2h,反应完全后将体系冷却至室温,加入纯水50ml,搅拌30min,过滤,将滤饼依次用纯水(20ml
×
2)、石油醚(20ml
×
2)洗涤后减压烘干得0.278g粗品。将粗品用乙酸乙酯(约5ml)完全溶解并搅拌5min,缓慢滴加石油醚(约15ml),析出大量沉淀,继续搅拌2h,过滤,将滤饼用石油醚(10ml
×
2)洗涤后减压烘干得白色固体2-(4-氟-2-甲基苯酚基)-n-(2-羰基-1,2-二氢吡啶-4-基)-4-(三氟甲基)苯甲酰胺(0.212g,收率75.6%)。1h nmr(400mhz,dmso-d6)δ11.29(s,1h),10.64(s,1h),7.84(d,j=7.9hz,1h),7.60(d,j=8.5hz,1h),7.31(d,j=7.2hz,1h),7.27-7.20(m,1h),7.10(dd,j=6.7,3.1hz,1h),6.97(s,1h),
6.75(s,1h),6.38(dd,j=7.2,2.0hz,1h),2.16(s,3h)。esi-ms(m/z):407.2[m+h]
+
。
[0511]
实施例35(wo2020014246中的化合物120)
[0512]
2-(4-氟-2-甲氧基苯酚基)-n-(3-甲磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺的制备
[0513][0514]
步骤a):(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰甲酯制备
[0515][0516]
向2-氯-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰甲酯(300mg,1.42mmol)的dmf(8ml)溶液中加入k2co3(392mg,2.84mmol)和4-氟-2-甲氧基苯酚(403mg,2.84mmol),于100℃下反应16h。反应完全后将反应液倒入水中,加入乙酸乙酯萃取,饱和食盐水洗涤,无水硫酸钠干燥,真空减压浓缩后得粗品;再将粗品用硅胶柱层析纯化(石油醚/乙酸乙酯(v/v)=50/1)得白色固体(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰甲酯(65mg,收率14%)。esi-ms(m/z):318.2[m+h]
+
。
[0517]
步骤b):(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸制备
[0518][0519]
向(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰甲酯(65mg,0.205mmol)的四氢呋喃(0.5ml)与甲醇(0.5ml)溶液中加入氢氧化钾(57.4mg,1.025mmol)水(0.5ml)溶液,室温搅拌16h。反应完全后,用乙酸乙酯进行反萃,所得水相用1.0m的盐酸调节ph至6左右,再用乙酸乙酯萃取有机相,并用饱和nacl水溶液洗涤,无水硫酸钠干燥,真空减压浓缩后得白色固体(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(55mg,收率88%)。1h nmr(400mhz,dmso-d6)δ12.81(s,1h),8.03(s,1h),7.11-7.01(m,2h),6.82-6.74(m,1h),3.69(s,3h),2.85(t,j=7.4hz,2h),2.70(t,j=7.7hz,2h),2.08-2.00(m,2h)。esi-ms(m/z):304.0[m+h]
+
。
[0520]
步骤c):2-(4-氟-2-甲氧基苯酚基)-n-(3-甲磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺制备
[0521][0522]
在氮气保护下,向(4-氟-2-甲氧基苯酚基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酸(85mg,0.280mmol)的dmf(1.5ml)溶液中加入hatu(127.68mg,0.336mmol)和diea(144.48mg,1.120mmol),于室温搅拌1h后加入3-(甲基磺酰基)苯胺(95.76mg,0.560mmol),然后将反应液温度升至60℃反应4h。反应完全后,将反应液用水(15ml)淬灭,乙酸乙酯(20ml
×
3)萃取。有机相用饱和nacl(60ml
×
3)洗涤,无水na2so4干燥,过滤旋干。所得粗品用反相制备色谱纯化得白色固体2-(4-氟-2-甲氧基苯酚基)-n-(3-甲磺酰苯基)-6,7-二氢-5h-环戊烷并[b]吡啶-3-甲酰胺(51mg,收率40%)。1h nmr(400mhz,dmso-d6)δ10.60(s,1h),8.41(s,1h),7.95(d,j=7.5hz,2h),7.69-7.59(m,2h),7.29(d,j=8.6,6.0hz,1h),7.07(d,j=10.7,2.9hz,1h),6.82(t,j=8.5,2.9hz,1h),3.71(s,3h),3.21(s,3h),2.89(t,j=7.3hz,2h),2.75(t,j=7.7hz,2h),2.10
–
2.01(m,2h)。esi-ms(m/z):457.1[m+h]
+
。
[0523]
实施例36电生理学测定
[0524]
膜片钳技术被称为研究离子通道的“金标准”,其利用玻璃微电极与细胞膜封接可测量多种膜通道电流。而navs是一类跨膜蛋白,包含三种不同的状态,静息状态、激活状态、失活状态,膜片钳技术则通过测定不同化合物结合到navs的不同状态上后膜通道电流的变化,来评估化合物对navs不同状态的抑制强弱。
[0525]
本发明的代表性化合物用转染特定离子通道的稳定cho细胞系,通过手动膜片钳
试验测定化合物对nav1.8电流的作用,进而评估其抑制强弱。
[0526]
手动膜片钳实验方案如下:
[0527]
1)细胞培养
[0528]
37℃恒温条件下,将稳定表达hnav1.8的cho细胞系在含有10%胎牛血清的f12培养基中培养,并将二氧化碳浓度维持在5%。除去旧培养基并用pbs洗涤一次,然后加入1ml 0.25%-trypsin-edta溶液,37℃下孵育1min。当细胞从皿底脱离后,加入5ml 37℃预热的完全培养基,并用吸管轻轻吹打使聚集的细胞分离。将细胞悬液转移至无菌的离心管中,1000rpm离心5min收集细胞,再将细胞接种于直径为6cm的细胞培养皿中(2.5
×
105cells/培养皿,5ml培养基),扩增或维持培养,。
[0529]
为维持细胞的电生理活性,细胞密度必须低于80%。
[0530]
实验前细胞用0.25%-trypsin-edta分离,将5
×
103细胞铺到盖玻片上,在24孔板中培养(最终体积:500μl),18h后,进行实验检测。
[0531]
2)制备化合物样品
[0532]
将本发明实施例中制备的化合物溶解于二甲亚砜(dmso)并配成浓度为10mm的dmso储备液用于实验。10mm的dmso储备液用细胞外液(140mm nacl,3.5mm kcl,1mm mgcl2,2mm cacl2,10mm glucose,10mm hepes,1.25mm nah2po4,naoh调节ph=7.4)稀释至各种浓度,并使每种化合物中dmso的最终浓度为0.1%或以下。
[0533]
3)膜片钳测量钠离子通道阻滞效应
[0534]
用微电极拉制仪(p97,sutter instruments)将毛细玻璃管(bf150-86-10,sutter instruments)拉制成记录电极。在倒置显微镜(ix71,olympus)下操纵微电极操纵仪(mp285,sutter instruments)将记录电极接触到细胞上,给予负压抽吸,形成gω封接。随后进行快速电容补偿,继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻,不给予漏电补偿。当全细胞记录的电流稳定后开始给药,每个药物浓度作用5分钟后检测下一个浓度,在记录期间独立重复检测多个细胞。所有电生理实验均在室温下进行。具体而言,每个化合物设置6个浓度(测ic
50
)或2个浓度(初步筛选),通过计算各浓度化合物处理细胞前后产生的峰值电流相对百分比来确定化合物对钠通道的抑制百分比,并利用igor pro软件计算ic
50
值或某特定浓度下的抑制百分比。
[0535]
全细胞膜片钳记录hnav1.8钠通道电流的电压刺激方案如下:膜电位钳制于-120mv,命令电压从-130mv开始,以10mv为步阶维持8s,除极至0mv(或电流大小为0pa),维持30ms,测得半失活电压;当形成全细胞封接后细胞膜电压钳制于-120mv,钳制电压除极至0mv维持50ms,然后电压恢复至测得的半失活电压维持8s,接着细胞膜电位恢复至-120mv,维持时间为20ms,然后再除极至0mv维持50ms,最后恢复至钳制电压-120mv,维持30ms。每隔20s重复采集数据,观察药物对hnav1.8钠通道电流峰值的作用。
[0536]
部分实施例化合物对hnav1.8的抑制活性计算结果如下表2-3所示。
[0537]
表2
[0538][0539][0540]
表3
[0541]
编号10nm抑制百分比kh362.11%kh449.13%kh1198.87%kh1289.56%kh1376.77%kh1510.77%kh1695.94%kh2285.74%kh2348.87%kh2470.58%kh2570.71%kh2696.76%kh277.38%kh2833.61%kh2941.48%实施例3438.12%
[0542]
实施例36动力学溶解度的测定
[0543]
1.缓冲液的配制
[0544]
ph7.4和ph3.5的50mm磷酸盐缓冲液(pb)的制备:
[0545]
a.50mm nah2po4溶液的制备:将3.000g nah2po4溶于500ml水,所得溶液测得ph为4.5;
[0546]
b.50mm na2hpo4溶液的制备:将3.549g na2hpo4溶于500ml水,所得溶液测得ph为9.4;
[0547]
c.50mm h3po4溶液的制备:将14.7m的h3po4用水稀释至50mm,所得溶液测得ph为1.8;
[0548]
d.50mm pb(ph7.4)的制备:取15ml 50mm na2hpo4溶液于50ml的试管中,用50mm nah2po4溶液调节ph至7.4;
[0549]
e.50mm pb(ph3.5)的制备:取15ml 50mm nah2po4溶液于50ml的试管中,用50mm h3po4溶液调节ph至3.5。
[0550]
2.实验步骤
[0551]
a.将供试品和阳性对照品(实施例34化合物)分别配制成10mm的dmso储液,各取10μl于whatman mini-uniprep(ge halthcare whatman)瓶的低隔间中;
[0552]
b.向供试品和阳性对照品中分别加入490μl 50mm pb(ph7.4或3.5);
[0553]
c.将上述溶液样品至少涡旋2min;
[0554]
d.随后将其置于振荡器上,于室温下摇晃24h,转速800rpm;
[0555]
e.离心20min(转速4000rpm);
[0556]
f.压缩mini-uniprep瓶通过滤膜过滤,将滤液注射进hplc系统进行检测,通过标准曲线计算溶液浓度。
[0557]
3.结果
[0558]
表4水溶性测试结果
[0559]
化合物ph3.5(μm)ph7.4(μm)kh594.759.9kh7151《1.56kh30160《1.56kh311327.86kh3210.5《1.56kh33152104实施例34《1.56《1.56
[0560]
实施例37药代动力学评价
[0561]
1.实验目的
[0562]
本试验以sd雄性大鼠为受试动物,采用高效液相色谱-串联质谱(lc-ms/ms)测定化合物在血浆中的浓度,研究本发明所述的化合物在大鼠体内的药代动力学特征。
[0563]
2.试验方案
[0564]
2.1试验动物
[0565]
健康雄性sd大鼠6只,7-10周龄,体重260~310g,平均分成2组,每组3只,购自北京维通利华实验动物技术有限公司。
[0566]
2.2药物配制
[0567][0568]
注:其中实施例34前药根据文献cn108395452a所述方法进行制备。
[0569]
2.3给药
[0570]
所有大鼠给药前禁食至少12小时,给药4小时后恢复供食,整个试验期间自由饮水。化合物kh33静脉注射剂量均为1mg/kg,灌胃剂量均为10mg/kg;实施例34的前药(vx150)静脉注射剂量为2mg/kg,灌胃剂量为10mg/kg。
[0571]
3.操作过程
[0572]
对大鼠进行灌胃给药,在给药前及给药后0.25、0.5、1.0、2.0、4.0、8.0、24.0小时通过颈静脉穿刺方式在规定的时间采集(或其他合适的采血位点)全血样品(约0.2ml),并在试验记录中记录实际采血时间。采集时间点可接受的误差为给药1小时内时间点
±
1分钟,其他时间点的为理论时间
±
5%。所有血样立即转移至贴有标签的含k2-edta的商品化离心管中。血样采集后,4(c,3200g离心10min吸取上清血浆,迅速至于干冰中,保持-70
±
10(c冰箱,用于lc-ms/ms分析。其中,实施例34给药采用前药(vx150),分析时测试原药即实施例34。尾静脉注射给药在给药前及给药后5min,0.25、0.5、1.0、2.0、4.0、8.0、24.0小时通过颈静脉穿刺方式在规定的时间采集(或其他合适的采血位点)全血样品(约0.2ml),其余操作与灌胃给药处理相同。
[0573]
4.灌胃给药药代动力学参数结果
[0574]
表5灌胃给药药代动力学参数结果
[0575][0576]
注:f%表示绝对生物利用度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1