一种靶向猪伪狂犬病毒gD蛋白的纳米抗体、制备方法和应用与流程
一种靶向猪伪狂犬病毒gd蛋白的纳米抗体、制备方法和应用
技术领域
1.本发明涉及生物技术领域,特别是涉及一种靶向猪伪狂犬病毒(porcine pseudoraibies virus,prv)gd蛋白的纳米抗体、制备方法和应用。
背景技术:
2.猪伪狂犬病(porcine pseudoraibies,pr)是猪的一种急性传染病,又称aujeszky病,由猪伪狂犬病毒(porcine pseudoraibies virus,prv)引起。猪作为prv的天然宿主,对病毒感染更为敏感,是可在急性感染中存活并具有潜伏感染力的唯一动物物种。感染后新生仔猪以高死亡率与神经系统紊乱为特征,怀孕母猪出现流产与繁殖障碍,老年猪以呼吸道疾病为主,以神经症状为特征的仔猪死亡率大于20%,猪感染野生型病毒的几率高达50%,使我国养猪业损失巨大。
3.prv目前已知的只有一种血清型,为线性双链的dna病毒,约145kda大小,gc的含量平均为73.59%。prv共编码70多种蛋白,主要蛋白除gg蛋白外,其余10个(gb、gc、gd、ge、gh、gi、gk、gl、gm、gn)均为囊膜结构蛋白。其中糖蛋白b(gb),糖蛋白c(gc),糖蛋白d(gd)与糖蛋白h(gh)在易感动物中,诱导其保护性免疫应答,产生具有中和作用的抗体与抗病毒性的细胞免疫,为主要的具有保护性的抗原。
4.从敏感性与特异性上来说,病毒的分离与鉴定是检测prv的黄金标准,但该分耗时长(至少2-3天),且灵敏度较低,且需要较高的细胞培养水平,病毒培养过程也易出现细节性操作失误而最终影响诊断结果,因此很难在基层兽医单位得到推广。病毒中和试验(vnt)为prv检测中常用的方法之一,此方法高效且敏感。但是,在感染的急性阶段此方法敏感性低,而且容易使结果呈现假阴性。间接夹心elisa等免疫学诊断方法虽然具有很高的灵敏性和很强的特异性,但需要较多纯度的蛋白,且需要精细操作且易出现假阳性,尤其依赖敏感性和特异性高的检测抗体,可以说检测抗体的性质就直接决定了检测的准确性和精度。
5.单克隆抗体(mab)自问世以来,在医学诊断、制药、治疗与科学研究等领域得到了广泛的应用。而近些年发现的纳米抗体不仅实现了与传统抗体相当的特异性结合力,作为新一代抗体衍生物其具有诸多传统抗体没有的优势。因此,近来纳米抗体被认为是高价值的蛋白,并被应用于包括基础研究、诊断、治疗、食品科学等多个领域中。但是目前关于纳米抗体在prv诊断方法中的应用却未见相关研究报道,也未有商品化产品。
技术实现要素:
6.针对上述现有技术中的不足,本发明的目的是提供一种靶向猪伪狂犬病毒gd蛋白的纳米抗体、制备方法和应用,以解决上述现有技术存在的问题。
7.为实现上述目的,本发明提供一种可以高精确度和敏感性识别猪伪狂犬病毒的纳米抗体,所述纳米抗体靶向的是prv的gd蛋白,将其命名为prv-dnd,氨基酸序列如seq id no.3所示。
8.进一步的,本发明还提供一种核苷酸分子,所述核苷酸分子编码上述纳米抗体
prv-dnd的氨基酸序列。
9.进一步的,本发明还提供一种含有所述纳米抗体prv-dnd的表达盒、载体、宿主细胞、表达系统。
10.进一步的,所述的含有所述纳米抗体prv-dnd的表达盒、载体、宿主细胞、表达系统中包含可以编码prv-dnd的核苷酸序列。
11.进一步的,本发明提供一种纳米抗体prv-dnd的制备方法,包括以下步骤:
12.(1)重组真核表达载体的构建:通过pcr扩增、酶切,将编码纳米抗体prv-dnd的dna序列连接至表达载体中获得阳性质粒;
13.(2)将步骤(1)中阳性质粒转化宿主细胞,诱导表达纳米抗体prv-dnd。
14.进一步的,所述表达载体可以为真核表达载体或原核表达载体,优选的,所述表达载体为真核表达载体,所述表达载体可选自:pcrii、pcr3和pcdna3.1(invitrogen,san diego,ca)、pb sii(stratagene,la jolla,ca)、pet 15(novagen,madison,wi)、pgex(pharmacia biotech,piscataway,nj)、pegfp-n1(clontech,palo alto,ca)、petl(bluebacii,invitrogen)、pdsr-α(pct pub.no.wo90/14363)和pfastbacdual(gibco-brl,grand island,ny)等。
15.所述宿主细胞为大肠杆菌、酵母或真核细胞,优选的,所述宿主细胞为真核细胞,可选自例如:中国仓鼠的卵巢细胞cho、猴的肾脏细胞cos细胞、人的胚肾细胞hek-293、人的子宫颈癌细胞hela等。
16.进一步的,本发明提供一种纳米抗体prv-dnd与多种标记酶(如辣根过氧化物酶、生物素等)进行偶联形成的融合蛋白。优选的,所述标记酶为hrp,所述融合蛋白为prv-dnd-hrp。
17.进一步的,本发明还提供一种所述的纳米抗体prv-dnd在制备检测样品中prv抗体的产品中的应用。
18.优选的,所述的应用为竞争性elisa检测,所述竞争性elisa包括以下步骤:
19.(1)将prv的gd蛋白包被elisa板;
20.(2)将所述融合蛋白prv-dnd-hrp与样品混合后加入步骤(1)的elisa板中,孵育;
21.(3)在步骤(2)的elisa板中加入显色液避光显色,加入3m浓h2so4终止反应;
22.(4)观察elisa板的颜色变化,若样品中有prv抗体,则elisa板内孔为无色;若样品中无prv抗体,则elisa板内孔为黄色。
23.进一步的,本发明还提供prv检测试剂盒,所述试剂盒中含有所述的纳米抗体prv-dnd或者融合蛋白prv-dnd-hrp。
24.有益效果
25.本发明提供了一种特异性靶向prv的纳米抗体prv-dnd,并公开了所述纳米抗体的氨基酸序列。同时提供了所述纳米抗体prv-dnd或融合蛋白prv-dnd-hrp的制备方法。尤其是利用耦合的标记酶形成的融合蛋白作为竞争探针,提供了一种检测样本中prv抗体的竞争elisa,基于纳米抗体分子量小和易于基因工程改造的优点,可以将纳米抗体与酶或荧光蛋白等进行融合表达,从而直接用于免疫学检测中,无需抗体标记和使用二抗,从而简化了生产工艺和大大降低了生产成本。因此,筛选和制备prv抗原蛋白的纳米抗体,将其作为免疫学检测的材料,具有非常广阔的应用前景。
26.本发明提供的特异性纳米抗体,测序结果显示纳米抗体prv-dnd的序列与人的vh高度相似,elisa结果显示其具有很高的结合力,推测有可能是骆驼体内自然存在的vh-hcabs。其既有纳米抗体的特性,又与人源vh具有高度的相似性,可能会拥有很大的应用前景。
附图说明
27.图1为prv的gd蛋白表达与纯化,其中,m为marker,1为pet-28a-gd重组阳性质粒sds-page鉴定图,2为镍柱层析法纯化获得可溶性prv-gd蛋白sds-page鉴定图;
28.图2为elisa方法检测双峰驼血清效价,其中,阴性对照为免疫前骆驼血清;
29.图3为3轮淘选后gd蛋白特异性纳米抗体elisa结果;
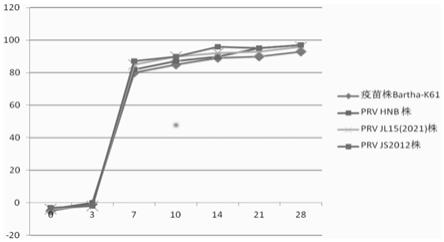
30.图4为竞争elisa检测方法检测prv js2012株、prv hnb株、prv jl15(2021)株、疫苗株bartha-k61感染血清结果示意图;
31.图5为竞争elisa检测其它动物疫病抗体分析,其中包括;猪伪狂犬病毒prv抗体阳性血清、猪繁殖与呼吸综合征病毒prrsv抗体阳性血清、猪传染性胃肠炎病毒tgev抗体阳性血清、猪流行性腹泻病毒pedv抗体阳性血清、猪细小病毒ppv抗体阳性血清和猪瘟病毒sfv抗体阳性血清以及鸡新城疫病毒ndv病阳性血清、犬瘟热病毒cdv病阳性血清和兔戊型hev肝炎病毒病阳性血清。
32.图6a为利用本技术所使用的纳米抗体竞争elisa检测结果,图6b而商品化idexx elisa试剂盒检测结果,其中,横坐标皆为感染后天数。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
34.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
35.实施例1猪伪狂犬病毒gd蛋白的可溶性表达及其纯化
36.在生长良好的pk15细胞上接种prv hn1201病毒(hn1201株(pseudorabiesvirus,strainhn1201),保藏号为cctccno.v201311;保藏于中国典型培养物保藏中心;保藏地址为湖北省武汉武汉大学,保藏日期为2013年5月20日),利用本领域常规手段分离猪伪狂犬病病毒基因组dna做模板,使用引物进行pcr扩增,利用takara的高保真酶hs dna polymerase with gc buffer,扩增条件为:94℃3min;94℃30s,68℃90s,30cycles;72℃5min。pcr产物命名为prv-gd
37.gd上游扩增引物:ggatccatgcacgtcgca(seq id no.1)
38.gd下游扩增引物:gcggccgcctagcgacgcgg(seq id no.2)
39.经测序正确的pcr产物prv-gd克隆至pet-28a(购自invitrogen公司,货号a11499),挑取单克隆鉴定插入方向,插入方向正确的质粒送invitrogen公司测序,测序正确的质粒命名为pet-28a-gd。将pet-28a-gd重组阳性质粒进行表达,经sds-page(见图1)验
证后经镍柱层析法纯化获得可溶性prv-gd蛋白。
40.实施例2抗prv的gd蛋白的特异性纳米抗体的筛选与鉴定
41.纯化后的可溶性prv-gd蛋白与结合弗氏佐剂充分乳化后,经颈部皮下注射免疫双峰驼,每两次免疫之间每隔2周的时间,前后共进行共6次免疫。抽取第6次免疫后血液分离血清后以gd蛋白为抗原测定抗体效价,监测免疫效果。阴性对照为免疫前骆驼血清,取免疫结束后离心处理过的血清,elisa方法检测其抗体效价(图2),结果显示血清中抗体效价达到1:256000。利用试剂盒(购自invitrogen公司)提取淋巴细胞rna,以所提取出的rna为模板利用oligo(dt)20引物反转录酶(iii)合成cdna,进一步经过巢式pcr扩增vhh片段。将扩增后的vhh基因片段通过酶切位点克隆入酶切后pcantab 5e噬菌体展示载体。利用噬菌体展示技术经过3轮淘选,筛选针对gd蛋白特异性纳米抗体elisa结果由0.28上升至3.0,表明针对ge重组蛋白的特异性纳米抗体得到了明显的富集(图3)。将通过elisa检测结果确定为的阳性(大于阴性值3倍以上)的单克隆菌液,测序。通过软件megalign进行对测序结果的比对,并进行分类。根据序列分类结果,elisa方法检测所筛选出的纳米抗体粗提物按1:2、1:20、1:200、1:2000倍比稀释,再次测定其效价。利用elisa分析纳米抗体的特异性和亲和力,最终筛选到的针对prv的gd蛋白的纳米抗体氨基酸序列如seq id no.3所示(evqlveaprgvkpggslrlscaasgftfndyamswirqtpekrlewvqlrptckarykvgssntwyqqkpgqspkllarqstrhtgvpdwgqgedlrhtgvqqygsyplywagqgtqvtvssaa)。将此纳米抗体命名为prv-dnd。
42.实施例3 prv-dnd-hrp融合蛋白的制备
43.利用引物fdnd(seq id no.4ctgcaggaagtacagctggtggagtc)和rdnd(seq id no.5gcggccgctttcagaaccagcttggtccc)将prv-dnd序列连接到pegfp-n1-hrp载体(sheng,y.,et al.,nanobody-horseradish peroxidasefusion protein as an ultrasensitive probe to detect antibodies againstnewcastle disease virus in the immunoassay.j nanobiotechnology,2019.17(1):p.35.)中,构建成pegfp-dnd
–
hrp表达质粒,所述表达质粒中同时携带分泌信号肽,ha标签,多克隆酶切位点,prv-dnd、辣根过氧化物酶和his标签,测序正确后保存待用。
44.取状态良好的hek-293t细胞铺6孔板,铺板密度为2-3
×
105个细胞/ml,2ml/孔,37℃培养箱培养;镜下观察待细胞达到80%汇合度时,利用脂质法将pegfp-dnd
–
hrp转入到hek-293t细胞中(罗氏x-tremegene hp dna transfection reagent),具体操作为:
45.a:转染前2h,弃掉6孔板内旧培养基,1ml pbs/孔,洗1次;弃掉pbs,每孔加入1.8mlopti-mem,放置37℃培养箱继续培养;
46.b:于超净工作台内取1.5ml ep管,按照200μl/孔的体积加入opti-mem,然后加入质粒,2μg/孔,轻轻吹打混匀;
47.c:向稀释好的质粒中加入转染试剂,按照6μl/孔的量加入;轻轻吹打混匀,室温静置20min;
48.d:将转染复合物加入细胞培养孔中,200μl/孔,轻摇混匀,放入细胞培养箱中继续培养48h。
49.待细胞长满后,在超净工作台内收取细胞上清,12,000g,4℃离心10min,除去细胞碎片,上清转移至新的1.5ml ep管中,分装保存至-80℃,待用;
50.ifa和elisa验证prv-dnd-hrp融合蛋白的表达分泌以及亲和力和特异性,结果显示,prv-dnd-hrp融合蛋白在hek-293t细胞中成功表达。直接elisa方法检测prv-dnd-hrp融合蛋白与prv的gd结合的特异性,结果显示prv-dnd-hrp融合蛋白可以特异性结合prv gd蛋白,具有良好的亲和力,与prv的gb、gc、gh都没有交叉反应。
51.实施例4利用prv-dnd-hrp融合蛋白建立竞争性elisa检测方法
52.(1)包被抗原:不同浓度prv gd蛋白包板,4℃包被过夜;加入不同稀释比例的pegfp-dnd
–
hrp细胞培养上清,进行直接elisa检测,当od450值为1.0时,即确定gd蛋白与prv-dnd-hrp融合蛋白的最佳稀释比例;
53.(2)封闭:每孔加入100μl/的2.5%脱脂奶粉37℃封闭1h;
54.(3)孵育:用pbs冲洗2次,在吸水纸上拍干,加入梯度稀释的已知prv感染猪的阳性血清,阴性血清和nb1-hrp融合蛋白的复合物,室温孵育;
55.(4)显色:用pbs冲洗2次,在吸水纸上拍干,每孔加入100μl商品化的tmb底物显色液,室温避光孵育,加入3m h2so4终止显色,读取od450吸光度值,进行结果判断。
56.通过优化试验,获得最佳反应条件如下:prv gd抗原包被量为290ng/孔;样品血清最佳稀释比为1:10,最佳孵育时间为1h;nb1-hrp融合蛋白上清最佳稀释比例为1:10,最佳孵育时间为1h;tmb最佳显色时间为10min。
57.实施例5竞争性elisa检测方法的重复性分析
58.按照已经优化好的竞争性elisa检测方法,在不同时间,不同人员操作的情况下对20份血清(15份阳性,5份阴性)进行了3次重复试验,每次试验每份血清做3个重复孔,对结果进行统计分析,评价所建立方法的重复性。结果表明,在三次重复试验中,未出现假阴性与假阳性情况,说明本技术建立的竞争性elisa检测方法的重复性好,可以作为临床检测的标准化操作。
59.同时,虽然猪伪狂犬病毒虽然只有一个血清型,但其毒力有强弱之分,毒株的致病性也有高有低。为了检测该方法对其他不同来源的prv毒株是否也能产生交叉反应,对prv js2012株、prv hnb株、prv jl15(2021)株、疫苗株bartha-k61感染猪后不同天数的血清(由本实验室保存)分别用竞争elisa进行检测,试验结果如图4所示prv js2012株、prv hnb株、prv jl15(2021)株、疫苗株bartha-k61感染后第7天至28天,所有猪血清gd抗体均为阳性。上述结果表明,该竞争elisa检测方法可以应用于临床各种prv病毒株的抗体检测。
60.实施例6竞争性elisa检测方法的特异性分析
61.按照已经优化好的竞争性elisa检测方法分别检测猪伪狂犬病毒prv抗体阳性血清、猪繁殖与呼吸综合征病毒prrsv抗体阳性血清、猪传染性胃肠炎病毒tgev抗体阳性血清、猪流行性腹泻病毒pedv抗体阳性血清、猪细小病毒ppv抗体阳性血清和猪瘟病毒sfv抗体阳性血清以及鸡新城疫病毒ndv病阳性血清、犬瘟热病毒cdv病阳性血清和兔戊型hev肝炎病毒病阳性血清,分析上述阳性血清能否阻断prv-dnd-hrp融合蛋白与prv的gd蛋白结合。检测结果表明(图5),除阳性对照血清外,其余血清均显示阴性结果,表明建立的竞争性elisa检测方法与目前猪场主要疫病阳性血清不发生交叉反应,也不与其它物种病毒病阳性血清反应,本发明建立的竞争性elisa检测方法具有高度的特异性,可以直接应用在畜牧农场的检测中,不需要担心其他病毒的污染和干扰。
62.实施例7竞争性elisa检测方法的敏感性分析
63.为了验证本技术所筛选到的纳米抗体的敏感性,将5份prv阳性血清样品分别以1:5,1:10,1:20,1:40,1:80,1:160,1:320,1:640,1:1280,1:2560,1:5120,1:10240和1:20480比例稀释,然后利用竞争性elisa检测方法对上述血清进行检测。检测结果表明,当血清稀释比例为1:5120时,仍能检测到阳性结果,具有很高的灵敏性。
64.进一步的,为了评价本技术所涉及到的检测方法的实际应用敏感性,与商业化的检测试剂盒进行平行试验。用prv hn1201病毒感染prv阴性猪(每组3头),分别于感染后1、2、3、4、5、6、7、8、9、10天采血,分离血清,分别用本技术的竞争性elisa检测方法和idexx elisa试剂盒进行检测。试验结果如图6a所示,利用本技术所使用的纳米抗体,竞争elisa检测结果显示,在感染后第4天即可检测到血清阳性(1/3),其余两头猪也分别于第5天和第6天可以检测到血清阳性;而商品化idexx elisa试剂盒,在感染后7天血清首次转阳(2/3),甚至有一头猪在第8天才检测到相应的血清阳性(图6b)。以上结果表明竞争elisa的灵敏度高于商品化idexx elisa试剂盒。
65.实施例8竞争性elisa检测方法的临床应用
66.按照建立的竞争性elisa检测方法,检测120份灭活临床样品(包括血清样品、器官组织样品,其中器官组织样品利用实验室常规手段用pbs缓冲液匀浆研磨后离心取上清液进行检测)。检测结果显示,120份样品中,95份为阳性样品,25份为阴性血清。
67.而相应的,使用商品化idexx elisa试剂盒检测结果表明,120份血清样品中有91份阴性样品,29份asfv抗体阳性样品。
68.参照《gb/t 18641伪狂犬诊断技术》设计引物(由成都康迪生物技术有限公司合成),序列为上游引物fprv:caggaggacgagctggggct(seq id no.6),下游引物rprv:gtccacgcccc gcttgaagct(seq id no.7)。反应体系(20μl):样品1μl,上、下游引物各1μl,dna-mix10μl,ddh2o7μl。pcr反应条件:94℃变性30s,55℃退火30s,72℃延伸1min,共40个循环;72℃延伸10min。经pcr验证,120份样品中,96份为阳性样品,24份为阴性血清。
69.由此可见,本实验所建立的方法与prv检测金标准的pcr结果更为接近,也就更为可靠,表明该elisa检测方法与商品化elisa检测试剂盒相比,具有更高的敏感性和可靠性,表明建立的阻断elisa能有效应用于临床样品检测。
70.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1