一种筛选D2R与NR2B相互作用阻断剂的方法
一种筛选d2r与nr2b相互作用阻断剂的方法
技术领域
1.本发明涉及生物医学技术领域,尤其涉及一种筛选d2r与nr2b相互作用阻断剂的方法。
2.
背景技术:
3.服用成瘾性药物可导多巴胺致在杏仁核累积,进而持续改变兴奋性谷氨酸递质释放并劫持自然奖励信号通路。有研究揭示,从小鼠到人类,成瘾性药物均可激活谷氨酸受体(nmdar)与多巴胺受体2(d2r)形成异源二聚体。打断该异源二聚体的形成,既可有效阻断药物成瘾又可避免机体本身的奖励信号通路的干扰。虽然目前已有多种小分子药物可以单独抑制谷氨酸受体(nmdar)或者多巴胺受体2(d2r)的生物学活性,因为这两个受体在体内有非常重要的生理功能,因此,这类抑制剂不适合用于药物成瘾治疗。单独筛选谷氨酸受体(nmdar)与多巴胺受体2(d2r)抑制剂的技术路线已经非常成熟,但是目前尚没有可行的技术用于高通量筛选谷氨酸受体(nmdar)与多巴胺受体2(d2r)相互作用的抑制剂。本发明解决了这方面的技术难题,可以用高通量筛选的方法,发现小分子化合物,并利用它们特异性的阻断谷氨酸受体(nmdar)与多巴胺受体2(d2r)形成异源二聚体。
4.在一般的分子生物学实验中,常用的检测蛋白互作的方法在分子水平是免疫共沉淀,在细胞水平一般是应用抗体共标进行鉴定。这两个方法的共同缺点是试验周期比较长,检测的样品数目有限。对于检测的分子数量比较多时,这两个方法实际操作上不具备可行性。
5.
技术实现要素:
6.本发明的目的是为了解决现有技术中常规实验方法对于检测的分子数量比较多时,这两个方法实际操作上不具备可行性。
7.为了实现上述目的,本发明采用了如下技术方案:一种筛选d2r与nr2b相互作用阻断剂的方法,包含以下步骤:s1:在d2r受体的羧基端融合nano荧光素酶的大亚基lgbit;在nr2b的羧基端融入nano荧光素酶低亲和力的小亚基smbit;s2:利用脂质体将d2r-lgbit和nr2b-smbit表达质粒共转染到hek293细胞,并在48小时后,洗脱细胞并计数;然后将细胞分别利用移液器接种到384孔板,离心沉淀细胞;s3:将有生物学活性的化合物以适当的浓度稀释到dmem中,每孔加入5微升化合物,让化合物与d2r-nr2b二聚体充分结合;s4:30分钟后,在每孔细胞加入20微升nano荧光素酶底物加入荧光素酶底物,室温孵育15分钟后利用高速酶标仪读板。
8.优选的,在d2r受体的羧基端融合nano荧光素酶的大亚基lgbit;在nr2b的羧基端
融入nano荧光素酶低亲和力的小亚基smbit优选的,所述s2中细胞数的数值范围为2000-20000个/20微升/孔;读板时间为2-30分钟。
9.优选的,所述s2中细胞数为2000个/20微升/孔;读板时间为10分钟。
10.优选的,所述s3中dmso的浓度为0.5%。
11.优选的,所述s4中,化合物的终浓度为20
µ
m。
12.优选的,所述s4中室温孵育15分钟。
13.上述所述的一种筛选d2r与nr2b相互作用阻断剂的方法,通过简单表达两个蛋白在同一个细胞中,细胞中d2r和nr2b的相互作用可以以酶学反应的形式得到检测。表达d2r和nr2b的细胞可以通过分液器快速均匀的分到384孔板,化合物也可以通过分液器快速加入到384孔板,最后简单的加入nano荧光素酶的底物就可以准确知道化合物是否可以干扰d2r和nr2b在细胞中的互作。
14.常规的实验方法,检测10个样本,需要至少两天的时间。我们的高通量筛选,两天可以检测20,000个以上的样本。
15.附图说明
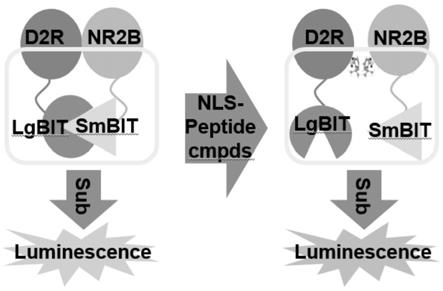
16.图1为本发明中谷氨酸受体(nr2b)与多巴胺受体2(d2r)相互作用抑制剂的高通量筛选示意图;图2为本发明中谷氨酸受体(nr2b)与多巴胺受体2(d2r)中细胞完整表达示意图,其中a为d2r-lgbit在细胞中完整表达,分子量大小符合预期、b为nr2b-smbit在细胞中完整表达,分子量大小符合预期;图3为本发明中细胞数量、读板时间与发光单元的柱形示意图;图4为dmso的浓度与发光单元的柱形示意图;图5为利用该方法筛选3200个有活性的药物化合物。
17.具体实施方式
18.为使本发明的目的、技术方案和优点更加清楚,以下结合具体实施例,对本发明作进一步地详细说明。
19.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用不同于在此描述的其他方式来实施,因此,本发明并不限于下面公开说明书的具体实施例的限制。
20.一种筛选d2r与nr2b相互作用阻断剂的方法,包含以下步骤:s1:在d2r受体的羧基端融合nano荧光素酶的大亚基lgbit;在nr2b的羧基端融入nano荧光素酶的小亚基smbit。
21.请参阅图1,nano荧光素酶的大亚基lgbit与nano荧光素酶的小亚基smbit的亲和力比较弱,因此这二者之间并不会存在相互作用。
22.因为d2r与nr2b之间的相互作用,进而使nano荧光素酶的大亚基lgbit与nano荧光
素酶的小亚基smbit形成有功能的nano荧光素酶。
23.请参阅图2,本技术中,d2r受体的羧基端融合上nano荧光素酶的大亚基lgbit和在nr2b的羧基端融入nano荧光素酶的小亚基smbit可在293hek细胞中完整表达。
24.s2:利用脂质体将d2r-lgbit和nr2b
ꢀ‑
smbit表达质粒共转染到hek293细胞。并在48小时后,洗脱细胞并计数。然后将细胞分别利用移液器接种到384孔板。离心沉淀细胞,每孔细胞加入20微升nano荧光素酶底物。
25.其中,细胞数为2000,5000,10000,20000个/20微升/孔,在2,5,10,20和30分钟五个时间点上读板,结果如图三所示。细胞数目越多,相互作用的分子数目越多,信号也越强。
26.优选的,在一实施方式中,细胞数目以20,000个/20微升/孔为宜,读板时间以加入底物后10分钟为宜。
27.s3:在细胞中加入dmso。
28.在实际的筛选过程中,化合物是直接溶于dmso中的。较高浓度的dmso,有利于化合物的溶解,但是反应体系中太高的dmso同时也会影响蛋白分子之间的互作和抑制荧光素酶的生物学活性。因此,一个理想的dmso的浓度是dmso浓度足够高有利于化合物的溶解又对反应体系没有显著影响。
29.在一实施方式中,请参阅图4,dmso浓度为0.5%。
30.s4:将有生物学活性的化合物一适当的浓度稀释到dmem中,在一实施方式中,化合物的终浓度为20
µ
m,dmso的终浓度为0.5%;在加入化合物30分钟后,加入荧光素酶底物,室温孵育10分钟,利用高速酶标仪读板。
31.读值小于1的化合物,我们认为该化合物有可能抑制d2r-lgbit和nr2b
ꢀ‑
smbit的相互作用或者直接抑制nano荧光素酶的活性。读值大于1的化合物,我们认为该化合物有可能激活d2r-lgbit和nr2b
ꢀ‑
smbit的相互作用或者直接激活nano荧光素酶的活性。请参阅图5,图5为通过本技术的方法筛选了10块板的化合物,可以看出每块板的样品值用对照值标准化以后,绝大部分样品的值,在0-1之间。
32.本技术中通过单表达两个蛋白在同一个细胞中,细胞中d2r和nr2b的相互作用可以以酶学反应的形式得到检测。表达d2r和nr2b的细胞可以通过分液器快速均匀的分到384孔板,化合物也可以通过分液器快速加入到384孔板,最后简单的加入nano荧光素酶的底物就可以准确知道化合物是否可以干扰d2r和nr2b在细胞中的互作。常规的实验方法,检测10个样本,需要至少两天的时间。我们的高通量筛选,两天可以检测20,000个以上的样本。
33.以上所述仅为本发明的实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的权利要求范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1