一种检测核酸样本变异的寡核苷酸体系及应用、以及基于该体系的检测方法与流程
1.本发明涉及基因检测技术领域,尤其涉及一种检测核酸样本变异的寡核苷酸体系及应用、以及基于该体系的检测方法。
背景技术:
2.随着人们对疾病机理的深入认识,迫切要求dna分子诊断技术朝着灵敏度和特异性越来越高的方向发展,在二代测序(next generation sequencing)技术领域,配合分子标签技术,当dna投入量足够多、测序深度足够深和成本投入足够多的时候,人们可以检测到万分之一以下、乃至十万分之一以下的变异信息,这些技术可以用在微小病灶残留(minimal residual disease,mrd)这一重要应用领域,mrd现象是指恶性疾病患者,比如癌症患者,在治疗中或者治疗后,体内仍然残留有恶性肿瘤细胞的现象,这种残留会导致复发或者其他不良预后。
3.比如,在靶向药治疗白血病的过程中,我们需要用分子学反应(简称mr),来反应治疗方案的效果。mr是一个数量级概念,用数字来标识,比如mr3.0(这个级别也称主要分子学反应,mmr),表示白血病细胞下降了3个对数级,残留数量是0.1%;mr4.5,就是白血病细胞下降了4.5个对数级,残留数量是0.0032%;mr5,就是白血病细胞下降了5个对数级,残留数量是0.001%。因此,可以看到mr是表示白血病细胞被清除到什么程度的指标,对用药效果和治疗方案的起到指示的作用,从治疗效果上来说,如果病患转阴,代表着白血病细胞减少到了某一个被医生认可的程度,那么,少到什么程度完全依赖于实验室的检测灵敏度,换句话说,如果某个检测方法的检测灵敏度只能达到mr3.0的水平且被医生认可,那么这个阴性就只能说白血病细胞的残留数量在0.1%以下,如果能达到mr4.5,那么阴性就代表白血病细胞残留数量在0.0032%以下,意味着复发的可能性要比mr3.0小,由此可见,mr值越小,病患痊愈的可能性就越大,越不容易复发,目前国内大多数实验室的检测灵敏度只能达到mr3.0(mmr)的水平,就医生认可的角度上来说,其实临床上非常需要mr4.5水平,甚至mr5.0水平的技术。
4.现有的指南和专家共识都明确了临床上需要对mrd残留细胞的进行监控,当前能够进行mrd监控需求的技术主要包括:(1)多参数流式细胞术(mfc),是一种比较快速、能定量鉴定癌细胞的方法,流式细胞术可以检测血液中的循环肿瘤细胞,其峰值灵敏度为0.01%,即1万个正常细胞中的1个癌细胞,6色(或更多)流式细胞术分析是检测异常mrd免疫表型的最常用方法;(2)二代测序ngs是一种极为敏感的dna测序方法,配合分子标签技术,其峰值灵敏度为0.0001%,即100万个正常细胞中有1个癌细胞。ngs可以检测b/t细胞抗原受体基因的克隆性重排,作为新兴的mrd检测方法,已受到国内外专家认可并推荐。2017年版国际临床实践指南(nccn)、和2017年版《中国多发性骨髓瘤诊治指南》均推荐ngs作为mrd检测方法。ngs技术检测mrd虽然极其敏感,为保证检测结果具有良好的特异性,会要求测序深度很高,导致检测成本高、耗时长,在不同的应用领域需要加以选择;(3)第三种技术
方案是聚合酶链式反应技术,分为qpcr或rt-qpcr,其灵敏度为0.1%千分之一,该技术平台具有操作简单、医院装机数量大、适用面广、成本低廉等优势,但其灵敏度和特异性不如前两种技术方案,因此,在pcr技术平台上开发灵敏度高、特异性好的技术能够更利于推广,更符合中国国情。因此,本发明旨在基于pcr技术寻找一种能够检测核酸样本超低频率变异的方法。
技术实现要素:
5.为解决上述技术问题,本发明提供了一种用于检测核酸样本变异的寡核苷酸体系,该体系基于多重竞争机制设置,能够检测区分目标模板分子绝对数目在4个以上,目标模板在样本中大于等于三万分之一的超低频变异信息,同时基于pcr技术平台,提供了一种检测核酸样本超低频率变异的pcr技术,在微小病灶残留的检测方面具有巨大潜力。
6.本发明提供了一种检测核酸样本变异的寡核苷酸体系,至少包括三种寡核苷酸链:
7.第一寡核苷酸链上设有相连的第一序列和第二序列,第一序列与非目标模板碱基互补,与目标模板的互补序列有一个或数个碱基的差异且与第二寡核苷酸链竞争性结合目标模板;
8.第二寡核苷酸链与目标模板碱基互补,与非目标模板的互补序列有一个或数个碱基的差异且与第一寡核苷酸链竞争性结合非目标模板,与第三寡核苷酸链不结合、不重叠;
9.第三寡核苷酸链上设有相连的第三序列和第四序列,第三序列与第二序列的碱基序列相同,并竞争性结合目标模板和非目标模板,第四序列与目标模板和非目标模板的差异序列的上游序列碱基互补;
10.目标模板相对于非目标模板至少存在一个碱基的变异,目标模板的变异位点以及非目标模板中与变异位点对应的位点位于第一序列或第二寡核苷酸链覆盖的范围内。
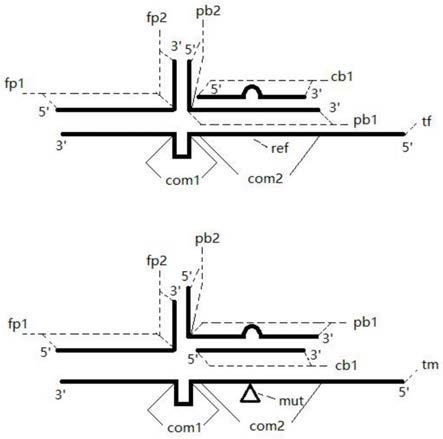
11.本发明的寡核苷酸体系示意图如图1所示。寡核苷酸链fp(对应第三寡核苷酸链)自5
′
向3
′
端方向分成fp1(对应第四序列)和fp2(对应第三序列)两个部分;寡核苷酸链pb(对应第一寡核苷酸链)自5
′
向3
′
端方向分成pb2(对应第二序列)和pb1(对应第一序列)两个部分;寡核苷酸链cb(对应第二寡核苷酸链)只有cb1一个部分;tm代表目标模板,tf代表非目标模板,其上都含有com1和com2两段序列,com1代表fp2和pb2竞争结合部分,com2代表cb1和pb1竞争结合部分。本示意图以突变一个位点为例,tf和tm的区别在于mut和ref三角形标记处的信息不同,本发明所述的检测核酸样本变异即指检测tm上的mut区域,mut区域位于寡核苷酸链pb或寡核苷酸链cb覆盖的范围内。其中,寡核苷酸链fp、pb和cb能与样本中非目标模板tf和目标模板tm对应区域互补,寡核苷酸链fp与cb没有重叠的部分,不存在竞争。
12.本发明的寡核苷酸体系中存在多重竞争机制,为便于理解,以图1为例进行描述:(1)第一重竞争关系为fp2与pb2的竞争。fp2和pb2的碱基序列相同,且与tf和tm上的com1区域碱基互补,因此,当寡核苷酸链pb和fp同时要与非目标模板tf和目标模板tm结合时,fp2和pb2形成竞争关系,即竞争性的与com1区域结合;(2)第二重竞争关系为cb1与pb1对非目标模板tf的竞争。cb1和pb1区域内的碱基序列有重合,pb1与非目标模板tf互补,cb1序列虽然与非目标模板tf有一个或数个碱基的差异,但会与pb1区域形成竞争,通过共同竞争非目
标模板tf形成选择性差异,有助于促进cb1与目标模板tm的高特异性结合;(3)第三重竞争关系为cb1与pb1对目标模板tm的竞争。pb1和cb1区域内的碱基序列有重合,cb1与目标模板tm互补,pb1序列虽然与目标模板tm有一个或数个碱基的差异,但是pb1会与cb1区域形成竞争,共同竞争目标模板tm,有助于形成cb1与目标模板tm的高特异性结合。
13.进一步地,对于目标模板,第三寡核苷酸链的吉布斯自由能小于第一寡核苷酸链的吉布斯自由能,第一序列的吉布斯自由能大于第二寡核苷酸链的吉布斯自由能;那么,相同温度下,第二寡核苷酸链和第三寡核苷酸链更自发的与目标模板结合;
14.对于非目标模板,第三寡核苷酸链的吉布斯自由能大于第一寡核苷酸链的吉布斯自由能,第一序列的吉布斯自由能小于第三寡核苷酸链的吉布斯自由能;那么,相同温度下,第一寡核苷酸链更自发的与非目标模板结合。
15.进一步地,在45℃、1m na
+
浓度下,
16.第一寡核苷酸链的吉布斯自由能、第二寡核苷酸链的吉布斯自由能或第三寡核苷酸链的吉布斯自由能满足-57.96kcal/mol≤δg≤-14.81kcal/mol;
17.第二序列或第三序列的吉布斯自由能满足-1.27kcal/mol≤δg≤-16.96kcal/mol;
18.第一寡核苷酸链的吉布斯自由能与第二寡核苷酸链的吉布斯自由能的差值满足0.42kcal/mol≤|δg|≤14.64kcal/mol;第一寡核苷酸链的吉布斯自由能与第三寡核苷酸链的吉布斯自由能的差值满足8.36kcal/mol≤|δg|≤15.91kcal/mol。
19.进一步地,寡核苷酸体系中包括两种及以上第一寡核苷酸链,两种及以上第一寡核苷酸链分别与不同的非目标模板特异性结合,每种第一寡核苷酸链的序列之间相差数个碱基,但都能与对应的某种非目标模板匹配,功能在于阻止第二寡核苷酸链以及第三寡核苷酸链与非目标模板的结合。换句话说,待测样本中的非目标模板tf可能存在多种形式,记作tf(m1),m1》=1,对于每一种非目标模板tf,需要设计对应的寡核苷酸链pb,记作pb(m2),m2》=1;例如,当m1=m2=3时,pb(1)与tf(1)、pb(2)与tf(2)、pb(3)与tf(3)是对应匹配的,同时pb(1)能够竞争性的干扰pb(2)与tf(2)、pb(3)与tf(3)的结合,目的是为了提高pb(2)与tf(2)、pb(3)与tf(3)结合的特异性,同理,pb(2)对pb(1)与tf(1)、pb(3)与tf(3),pb(3)对pb(1)与tf(1)、pb(2)与tf(2)也有类似的作用。
20.进一步地,非目标模板的种类数大于等于第一寡核苷酸链的种类数。
21.进一步地,寡核苷酸体系中包括两种及以上第二寡核苷酸链,两种及以上第二寡核苷酸链分别与不同的目标模板特异性结合,每种第二寡核苷酸链的序列之间相差数个碱基,但都能与对应的某种目标模板匹配。换句话说,待测样本的目标模板tm中可能存在多种形式,记作tm(n1),n1》=1,对于每一种tm模板,需要设计对应的寡核苷酸链cb,记作cb(n2),n2》=1;例如,当n1=n2=3时,cb(1)与tm(1)、cb(2)与tm(2)、cb(3)与tm(3)是对应匹配的,同时cb(1)能够竞争性的干扰cb(2)与tm(2)、cb(3)与tm(3)的结合,目的是为了提高cb(2)与tm(2)、cb(3)与tm(3)结合的特异性,同理,cb(2)对cb(1)与tm(1)、cb(3)与tm(3),cb(3)对cb(1)与tm(1)、cb(2)与tm(2)也有类似的作用。
22.进一步地,目标模板的种类数大于等于第二寡核苷酸链的种类数。
23.进一步地,第三寡核苷酸链和第一寡核苷酸链的分子数比例为1:1~1:100。
24.进一步地,第一寡核苷酸链或第二寡核苷酸链的3
′
端修饰有防止延伸的结构或基
团,如4个及以上与对应模板不同的碱基、c3 spacer、氨基基团、磷酸基团等。
25.进一步地,第二寡核苷酸链修饰有用于识别或捕获的基团,如两端分别修饰有荧光基团和荧光淬灭基团,正常情况下体系内无荧光,pcr扩增后,该寡核苷酸链被pcr酶水解,荧光淬灭基团与荧光基团分离,释放出荧光,其荧光信号指示与该第二寡核苷酸链特异性结合的某种目标模板的存在。若要区分不同种类的目标模板,可以将第二寡核苷酸链分别修饰不同颜色或激发波长的荧光基团,根据荧光情况进行区分。
26.一种采用上述寡核苷酸体系检测核酸样本变异的方法,包括以下步骤:将所述寡核苷酸体系加入待测样本中,进行qpcr扩增,根据荧光信号的强度识别核酸变异样本。
27.进一步地,扩增体系中还包括dna聚合酶以及其他进行pcr扩增的必要组分,比如形成pcr扩增所必须的、与第三寡核苷酸链配合的寡核苷酸链(对应实施例中的寡核苷酸链rp)。其中dna聚合酶需要具有5
′‑3′
外切活性。
28.使用上述方法进行核酸变异样本检测时,第一寡核苷酸链特异性地与非目标模板结合,而与目标模板的结合有差异导致结合较弱,从而在不影响目标模板扩增的基础上阻碍非目标模板的非特异性扩增;第二寡核苷酸链和第三寡核苷酸链特异性地与目标模板结合,而与非目标模板的结合有差异导致结合较弱,双重特异性保障促进目标模板特异性扩增出来,实现对超低频率变异的检测。
29.本发明提供的寡核苷酸体系能够检测核酸样本的低丰度变异(低丰度变异是指目标模板的绝对数量在低至4~10个、且目标模板在样本中低至三万分之一的变异),基于这一用途,该体系可用来制备微小病灶残留检测试剂。实际应用时,通过检测特定位点的变异,对疾病阳性细胞进行定量,灵敏度可达到mr4.5水平,甚至mr5.0水平。
30.借由上述方案,本发明至少具有以下优点:
31.本发明通过三重复杂竞争关系,公开了一种检测核酸样本超低频率变异的pcr技术,它能够在检测核酸样本中低至三万分之一(0.0033%)的变异信息的同时保证足够的特异性。基于多条寡核苷酸链的吉布斯自由能竞争机制,在保证目标模板扩增效率的同时,压制非目标模板的扩增,并且还能进一步降低非目标模板引起的非特异性信号,确保超低频率变异信息的特异性,为临床检测提供了一种灵敏度和特异性都很优异的方法,也为临床患者提供了一种快捷低廉的mrd监控手段。
32.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
33.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
34.图1为本发明的寡核苷酸体系原理示意图;
35.图2为本发明中不同实验组的寡核苷酸链种类布置示意图;
36.图3为实施例1中效果组qpcr结果图;
37.图4为实施例1中对比组一的qpcr结果图;
38.图5为实施例1中对比组二的qpcr结果图;
39.图6为实施例1中对比组三的qpcr结果;
40.图7为实施例2中效果组的qpcr结果图;
41.图8为实施例2中对比组四的qpcr结果图
42.图9为实施例2中对比组五的qpcr结果图;
43.图10为实施例2对比组六的qpcr结果图;
44.图11为实施例3中效果组的qpcr结果图;
45.图12为实施例3中对比组七的qpcr结果图;
46.图13为实施例3中对比组八的qpcr结果图;
47.图14为实施例3中对比组九的qpcr结果图;
48.图15为实施例4效果组qpcr结果图;
49.图16为实施例4对比组十qpcr结果图;
50.图17为实施例4对比组十一qpcr结果图;
51.图18为实施例4对比组十二qpcr结果图;
52.图19为chek2 exon14 qpcr结果;
53.图20为chek2 exon14不同pcr产物的比较;
54.图21为实施例6对比组十五qpcr结果图;
55.图22为实施例6效果组十六qpcr结果图;
56.图23为实施例6效果组十七qpcr结果图。
具体实施方式
57.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
58.实施例1
59.急性骨髓性白血病(acute myeloid leukemia,aml)是一种骨髓性血液细胞过度增生造成的癌症。flt3、npm和kit等基因的突变是目前用来确认是否带有白血病细胞的特定基因突变。近年来,matsuno n,et al.(2005),duployez n,et al.(2016),和papaemmanuil e,et al.(2016)等的研究已经证实flt3的激活突变在aml的发生及疾病的进展中起到十分重要的病理作用。本实施例以flt3为目的基因,c.2523c》a突变为目的突变,目的是为了展示本专利技术方案在目标变异分子的绝对数量在1~10个时,占总体比例0.1%时候的检测效果。能检测到0.1%的判断标准为0.1%的ct值与0.00%的ct值之差大于4。
60.1本实施例目的是为了展示目标变异分子的绝对数量在1~10个时,占总体比例0.1%时候的技术效果。
61.1.1效果组:三重竞争体系的设置;
62.1.2比对组:
63.1.2.1对比组一:组分只有寡核苷酸链fp、寡核苷酸链rp以及pcr产物中间的taqman探针,不加入寡核苷酸链pb和寡核苷酸链cb;普通taqman探针用来替代寡核苷酸链cb带有荧光的功能,展示没有寡核苷酸链pb和寡核苷酸链cb的竞争性作用时,是否能获得0.1%的检测效果;
64.1.2.2对比组二:组分只有寡核苷酸链fp、寡核苷酸链rp以及寡核苷酸链cb,展示
没有寡核苷酸链pb与寡核苷酸链cb发生竞争性作用时,是否能获得0.1%的检测效果;
65.1.2.3对比组三:组分只有寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb以及taqman探针,展示在只有寡核苷酸链fp和寡核苷酸链pb发生竞争,而没有寡核苷酸链cb与寡核苷酸链pb发生竞争性作用时,是否能获得0.1%的检测效果;
66.寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb、寡核苷酸链cb与taqman探针在各个设置组的相对位置如图2所示。
67.1.3四个组的寡核苷酸链的序列和设置如下:
[0068][0069]
2具体实施过程
[0070]
2.1需要准备的标准品与试剂
[0071]
标准品由阳性质粒与基因组dna(gdna)梯度混合稀释而成。其中,阳性质粒和gdna均通过数字pcr进行定量,并稀释至1000拷贝。将稀释定量好的阳性质粒与gdna按1:1的比例混合,获得变异分子占总体比例为50.00%的标准品;将变异分子占总体比例为50.00%的标准品与gdna按1:1的比例混合,获得变异分子占总体比例为25.00%的标准品。按照以上的配置方法,对获得新标准品与gdna按1:1的比例进行稀释,直到获得变异分子占总体比例为0.10%的标准品;gdna为变异分子占总体比例为0.00%的标准品。
[0072]
寡核苷酸链fp,寡核苷酸链rp,寡核苷酸链pb,寡核苷酸链cb和taqman探针的干粉首先用te buffer溶解,按照出厂标识稀释至100μm作为母液,然后用nanodrop
tm lite spectrophotometer进行二次定量,再按照二次定量的结果,将寡核苷酸链fp和寡核苷酸链rp的母液用te buffer稀释至10μm;寡核苷酸链cb和taqman探针的母液用te buffer稀释至20μm。
[0073]
其他试剂还包括hot start 2
×
master mix with standard buffer和nuclease free water。
[0074]
2.2配置反应体系
[0075]
2.2.1不同浓度梯度的标准品为待测样本,按照以下体系在灭菌96孔qpcr管中配置qpcr反应体系;30μl qpcr反应体系如下:
[0076][0077][0078]
其中,对于对比组一,使用nuclease free water代替寡核苷酸链pb;使用taqman探针用来替代寡核苷酸链cb;对于对比组二,使用nuclease free water代替寡核苷酸链pb;对于对比组三,使用taqman探针用来替代寡核苷酸链cb。标准品分别采用变异分子占总体比例为25.00%、3.13%、1.56%、0.78%、0.39%、0.20%、0.10%、0.00%的标准品。各个标准品种目标变异分子的绝对数量如下:
[0079]
标准品目标变异分子的绝对数量(个)25.00%1250.03.13%156.51.56%78.00.78%39.00.39%19.50.20%10.00.10%5.00.00%0.0
[0080]
2.2.2将加好样本的96孔qpcr管放置于applied7500实时荧光定量pcr仪上,设置如下扩增程序并启动qpcr反应,qpcr程序如下:
[0081]
[0082][0083]
2.3qpcr结果如下:
[0084]
图3为效果组的qpcr结果。由于三重竞争关系的存在,即寡核苷酸链pb更倾向于与非目标模板(带有gdna上的野生型信息,也可称为野生型模板)的结合,因此对非目标模板的扩增产生抑制效果;同时,带有荧光基团与荧光淬灭基团的寡核苷酸链cb更倾向于与含有变异的dna分子的目标模板(阳性质粒)特异性结合,而且,寡核苷酸链cb与寡核苷酸链pb的相互竞争又进一步降低了寡核苷酸链cb与非目标模板(野生型模板)可能产生的非特异性信息,获得了更加特异的荧光信号,比如在0.00%样本中,荧光值在55个循环之后,几乎没有增加,与0.10%标准品形成鲜明对比,无需使用循环差值来判断阴性与阳性,由此说明效果组拥有检测到0.1%的直观技术效果。
[0085]
图4为对比组一的qpcr结果。由于没有寡核苷酸链pb对非目标模板的抑制效果,没有寡核苷酸链cb提供更加特异的荧光信号,所有标准品呈现了相同的ct值的荧光信号,因此对比组一的方案无法拥有检测到0.1%的技术效果。其实对比组一是常规的taqman技术设置方式,没有针对目标位点设计taqman探针,必然是区分不了变异信息的。
[0086]
图5为对比组二的qpcr结果。由于没有寡核苷酸链pb压制野生型模板的扩增,目标模板(含有突变信息)也就没有得到富集,因此,虽然寡核苷酸链cb能特异性识别突变信号,但是只可以检测到变异分子占总体比例较高的标准品(25.00%)的荧光信号,但无法区分比例较低的标准品和0.00%的标准品,可见,对比组二的方案无法拥有检测到0.1%的技术效果。其实本组探针布置方式也是常规的一种taqman技术设置方式,即将taqman探针设置在变异信息处,但是这种设置对野生型信息和变异信息的区分能力有限,本次实验中,只能区分25%左右的变异信息,不足以用于mrd领域的检测。
[0087]
图6为对比组三的qpcr结果。寡核苷酸链pb的存在,引入了与寡核苷酸链fp的竞争关系,非目标模板得到了抑制,不同于对比组一的是,虽然用了相同的taqman探针,但是各个不同梯度的标准品之间能够被区分开了,基于变异分子所占总体比例的不同,其ct值也呈现出了一一对应的关系,但是,由于寡核苷酸链cb在对比组三中不存在,不能提供进一步的特异性,变异分子占总体比例为0.00%的标准品也产生了较为明显的信号,在实际样本的检测过程中,有将样品判断为假阳性的风险,对比组三的设置方式,与实施例2和实施例3的对比组六合对比组九的设置方式是相同的,对0.00%特异性不高的缺憾在需要检测更低丰度变异的应用场景中逐渐变得明显起来了,因此,我们认为对比组三的方案拥有检测到0.1%的技术效果的可能性,但是不如效果组的效果好,可以明显看到需要改善特异性。
[0088]
综上,本实施例展示了利用相同的oligo对比组一和对比组二是常规的方案设置,可以看到并没有能检测0.1%的技术效果;对比组三是可能会有类似的技术方案,虽然具有检测到0.1%的技术能力,但是特异性需要提高;因此可见,寡核苷酸链fp、寡核苷酸链pb与寡核苷酸链cb的相互三重作用以及严谨的设计,才能保证0.1%的检测灵敏度以及更好的特异性。
[0089]
实施例2
[0090]
本实施例继续以flt3为目的基因,c.2523c》a突变为目的突变,目的是为了展示目标变异分子的绝对数量在4~10个时,占总体比例0.01%时候的技术效果,能检测到0.01%
的判断标准为0.01%的ct值与0.00%的ct值之差大于4。
[0091]
3本实施例目的是为了展示目标变异分子的绝对数量在4~10个时,占总体比例0.01%时候的技术效果。
[0092]
3.1效果组:三重竞争体系的设置
[0093]
3.2比对组:
[0094]
3.2.1对比组四:组分只有寡核苷酸链fp、寡核苷酸链rp以及pcr产物中间的taqman探针,不加入寡核苷酸链pb和寡核苷酸链cb;普通taqman探针用来替代寡核苷酸链cb带有荧光的功能,展示没有寡核苷酸链pb和寡核苷酸链cb的竞争性作用时,是否能获得0.01%的检测效果;
[0095]
3.2.2对比组五:组分只有寡核苷酸链fp、寡核苷酸链rp以及寡核苷酸链cb,展示没有寡核苷酸链pb与寡核苷酸链cb发生竞争性作用时,是否能获得0.01%的检测效果;
[0096]
3.2.3对比组六:组分只有寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb以及taqman探针,展示在只有寡核苷酸链fp和寡核苷酸链pb发生竞争,而没有寡核苷酸链cb与寡核苷酸链pb发生竞争性作用时,是否能获得0.01%的检测效果;
[0097]
3.2.4寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb、寡核苷酸链cb与taqman探针在各个设置组的相对位置如图2所示。
[0098]
四个组的寡核苷酸链的序列和设置如下:
[0099][0100]
4具体实施过程
[0101]
4.1需要准备的标准品与试剂
[0102]
本实施例使用与实施例1相同的试剂,但标准品为满足占总体比例0.01%的要求进行了重新的配置:标准品由阳性质粒与基因组dna(gdna)梯度混合稀释而成。其中,阳性质粒和gdna均通过数字pcr进行定量,并稀释至7000拷贝。将稀释定量好的阳性质粒与gdna按1:1的比例混合,获得变异分子占总体比例为50.00%的标准品;将变异分子占总体比例为50.00%的标准品与gdna按1:1的比例混合,获得变异分子占总体比例为25.00%的标准品;按照以上的配置方法,对获得新标准品与gdna按1:1的比例进行稀释,直到获得变异分子占总体比例为0.01%的标准品;gdna为变异分子占总体比例为0.00%的标准品。
[0103]
4.2配置反应体系
[0104]
4.2.1不同浓度梯度的标准品为待测样本,按照以下体系在灭菌96孔qpcr管中配置qpcr反应体系。30μl qpcr反应体系如下:
[0105][0106]
其中,对于比组四,使用nuclease free water代替寡核苷酸链pb;使用taqman探针用来替代寡核苷酸链cb;对于对比组五,使用nuclease free water代替寡核苷酸链pb。对于对比组六,使用taqman探针用来替代寡核苷酸链cb。标准品分别采用变异分子占总体比例为6.25%、0.39%%、0.20%、0.10%、0.05%、0.02%、0.01%、0.00%的标准品。各个标准品种目标变异分子的绝对数量如下:
[0107]
标准品目标变异分子的绝对数量(个)6.25%2625.00.39%163.80.20%84.00.10%42.00.05%21.00.02%8.40.01%4.20.00%0.0
[0108]
4.2.2将加好样本的96孔qpcr管放置于applied
ꢀꢀ
7500实时荧光定量pcr仪上,设置如下扩增程序并启动qpcr反应。qpcr程序:
[0109][0110]
4.3qpcr结果如下:
[0111]
图7为效果组的qpcr结果。寡核苷酸链pb和寡核苷酸链cb同时存在,既可以对非目标模板的扩增效率进行抑制,寡核苷酸链cb和寡核苷酸链pb的相互作用也可以减少非目标
模板的非特异性信号,同时,寡核苷酸链cb与目标模板(阳性质粒)特异性结合,产生特异性的荧光信号。从结果可以看出,当扩增反应进行了55个循环之后,目标模板含量为0.00%的标准品仍然没有荧光信号,目标模板分子占总体比例为0.01%的标准品产生了明显的区别于0.00%标准品的荧光信号。我们可以从图中看到在rn=25000时,0.01%的ct值=42.5左右,由此说明效果组拥有检测到0.01%的技术效果。
[0112]
图8为对比组四的qpcr结果。由于没有寡核苷酸链pb对非目标模板的抑制作用,且也没有寡核苷酸链cb提供特异性的荧光信号,所有标准品呈现了相同的ct值的荧光信号,因此对比组四的方案无法拥有检测到0.01%的技术效果。
[0113]
图9为对比组五的qpcr结果。寡核苷酸链cb具有一定的识别位点的特异性,但由于非目标模板(野生型)没有被寡核苷酸链pb压制,来自目标模板的信号不足以支持去区分6.25%~0.00%的标准品,因此对比组五的方案无法拥有检测到0.01%的技术效果。其实本组探针布置方式也是一种常规的taqman技术设置方式,即将taqman探针设置在变异信息处,但是这种设置对野生型信息和变异信息的区分能力有限,本次实验中,连6.25%的变异信息比例都无法区分,与实施例1的对比组二结果类似,可见这种设置方式不足以支持mrd领域的检测。
[0114]
图10为对比组六的qpcr结果。本组设置中存在寡核苷酸链pb与寡核苷酸链fp的竞争,不同于对比组四和五,这种竞争关系可以获得一定的分辨性能,基于变异分子所占总体比例的不同,其ct值也呈现出了一一对应的关系,但是,由于不存在寡核苷酸链cb,无法进一步提供信号的特异性,在浓度比例差异比较大的情况下,qpcr ct值差异较大,比如6.25%与0.39%之间ct值差异较大,比如0.39%与0%之间ct值差异较大,但本实施例的目标是希望能够区分0.01%和0.00%,从结果可以看出,它们的ct值差异很小,无法像本实施例效果组那样获得巨大的差异性,因此对比组六的方案无法拥有检测到0.01%的技术效果。
[0115]
综上,对比组四是行业中常规的taqman方案设置,可以看到并没有能检测0.01%的技术效果;对比组五和六是有可能被预见到的技术方案,同样没有能检测到0.01%的技术效果;可见,寡核苷酸链fp与寡核苷酸链pb与寡核苷酸链cb的相互作用,在经过严谨的设计才能保证能检测到0.01%。
[0116]
实施例3
[0117]
微小残留病灶(minimal residual disease,mrd)是指治疗期间或治疗后(没有症状或疾病迹象)体内残留的少量癌细胞,它是癌症特别是白血病复发的主要原因。通常mrd的灵敏度的最低要求为在总数为100,000的样本中,可以检验出3.3个阳性样本,即三万分之一。但是目前还没有同时达到可以快速、准确、高灵敏度的检测方式。本实施例继续以flt3为目的基因,c.2523c》a突变为目的突变,目的是为了展示目标变异分子的绝对数量在4~10个时,占总体比例三万分之一时候的技术效果。
[0118]
5本实施例目的是为了展示目标变异分子的绝对数量在4~10个时,占总体比例三万分之一时候的技术效果;
[0119]
5.1效果组:三重竞争体系的设置
[0120]
5.2比对组:
[0121]
5.2.1对比组七:组分只有寡核苷酸链fp、寡核苷酸链rp以及pcr产物中间的
taqman探针,不加入寡核苷酸链pb和寡核苷酸链cb;普通taqman探针用来替代寡核苷酸链cb带有荧光的功能,展示没有寡核苷酸链pb和寡核苷酸链cb的竞争性作用时,是否能获得0.0033%的检测效果;
[0122]
5.2.2对比组八:组分只有寡核苷酸链fp、寡核苷酸链rp以及寡核苷酸链cb,展示没有寡核苷酸链pb与寡核苷酸链cb发生竞争性作用时,是否能获得0.0033%的检测效果;
[0123]
5.2.3对比组九:组分只有寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb以及taqman探针,展示在只有寡核苷酸链fp和寡核苷酸链pb发生竞争,而没有寡核苷酸链cb与寡核苷酸链pb发生竞争性作用时,是否能获得0.0033%的检测效果;
[0124]
5.2.4寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb、寡核苷酸链cb与taqman探针的相对位置如图2所示。
[0125]
5.3四个组的寡核苷酸链的序列和设置如下:
[0126][0127]
6需要准备的标准品与试剂
[0128]
本实施例使用与实施例1和实施例2相同的试剂,但标准品为满足占总体比例三万分之一的要求,增加了部分标准品:将实施例2中变异分子占总体比例为0.01%的标准品与gdna按1:1的比例混合,获得变异分子占总体比例为0.005%的标准品。将实施例2中20μl变异分子占总体比例为0.1%的标准品与580μl的gdna混合,获得变异分子占总体比例为0.0033%的标准品,即变异分子占总体比例为三万分之一的标准品;将实施例2中20μl变异分子占总体比例为0.1%的标准品与980μl的gdna混合,获得变异分子占总体比例为0.002%的标准品,即变异分子占总体比例为五万分之一的标准品。实施例2中的变异分子占总体比例为3.13%、0.39%、0.10%、0.01%和0.00%的标准品仍用于本实施例3。
[0129]
6.1不同浓度梯度的标准品为待测样本,按照以下体系在灭菌96孔qpcr管中配置qpcr反应体系,其中寡核苷酸链fp:pb:cb的分子数比例是1:10:0.25,50μl qpcr反应体系如下:
[0130][0131]
其中,对于对比组七,使用nuclease free water代替寡核苷酸链pb;使用taqman探针用来替代寡核苷酸链cb;对于对比组八,使用nuclease free water代替寡核苷酸链pb。对于对比组九,使用taqman探针用来替代寡核苷酸链cb。标准品分别采用变异分子占总体比例为3.13%、0.39%、0.10%、0.01%、0.005%、0.0033%、0.002%、0.000%的标准品。各个标准品种目标变异分子的绝对数量如下:
[0132][0133][0134]
6.2将加好样本的96孔qpcr管放置于applied7500实时荧光定量pcr仪上,设置如下扩增程序并启动qpcr反应。qpcr程序:
[0135][0136]
6.3qpcr结果如下:
[0137]
图11为效果组的qpcr结果。由于三重竞争关系的存在,即寡核苷酸链pb可以对非目标模板的扩增产生抑制效果,同时寡核苷酸链cb可以与目标模板的含有变异分子的pcr产物进行特异性结果,产生荧光信号。当扩增反应进行了55个循环之后,变异分子占总体比例为0.00%的标准品仍然没有荧光信号,说明具有很好的特异性,不会产生非特异性信号。变异分子占总体比例为0.003%的标准品产生了明显的荧光信号。此外,变异分子占总体比例为0.002%的标准品也产生了明显的荧光信号。由此说明效果组拥有检测到三万分之一的技术效果,甚至拥有可以检测到低至五万分之一的技术效果,即效果组可以快速、准确高灵敏的检测到mrd。
[0138]
图12对比组七的qpcr结果。由于没有寡核苷酸链pb抑制非目标模板的扩增的,也没有寡核苷酸链cb提供特异性的荧光信号。所有标准品呈现了相同的ct值的荧光信号,因此对比组一的方案无法拥有检测到三万分之一的技术效果。
[0139]
图13为对比组八的qpcr结果。虽然寡核苷酸链cb能特异性的识别变异位点,但是,由于没有寡核苷酸链pb对非目标模板的抑制,也就不具备富集放大目标模板的作用,导致在目标模板标准品中,目标模板产物在总产物的比例也在3.13%~0.002%之间,导致寡核苷酸链cb就算产生信号,也是微弱的,无法区分不同标准品的梯度。显而易见,对比组八的方案无法拥有检测到三万分之一的技术效果。与图5的实施例1对比组二结果和图9的实施例2对比组五结果相比,也有信号逐渐降低的趋势,再次说明如果只有寡核苷酸链cb,没有寡核苷酸链pb的竞争性配合,无法检测低浓度的目标信息。
[0140]
图14为对比组九的qpcr结果。由于引入了寡核苷酸链pb与寡核苷酸链fp的竞争,不同于对比组七,基于变异分子所占总体比例的不同,其ct值也呈现出了一一对应的关系。但是,变异分子占总体比例为0.000%的标准品与变异分子占总体比例为0.010%,0.005%,0.003%,和0.002%的标准品的ct值相同,虽然结果显示,对比组九的设置可以很好的分辨0.10%和0.00%,但是无法具备检测到三万分之一的技术效果。与本实施例的效果组相比,缺少了寡核苷酸链cb的特异性,只要增加寡核苷酸链cb,就能将区分度从0.1%提高到0.0033%,进一步说明了本专利方案的独特创造性。
[0141]
综上,对比组七是行业中常规的taqman方案设置,可以看到并没有能检测0.0033%的技术效果;对比组八和九是有可能被同行从业者预见的技术方案,也没有能检测到0.0033%的技术效果,但是对比组九具备有检测0.1%的技术效果;可见,只有寡核苷酸链fp与寡核苷酸链pb、寡核苷酸链cb的相互作用,且通过严谨的设计才能保证能检测到0.0033%。
[0142]
实施例4
[0143]
idh2基因的相关突变也是与白血病的发生密切相关的。yoshimi et al.(2019)的研究表明,idh2的突变可以通过表观基因组和rna拼接的协调作用导致并促进白血病的发生。因此,除flt3等前文提到的基因,idh2也是一种对于白血病需要检测的mrd相关基因。本实施例以idh2为目的基因,c.419g》a突变为目的突变,目的是为了再次展示目标变异分子的绝对数量在4~10个时,占总体比例三万分之一时候的技术效果。从而证明本专利声明的方法可以用于不同基因的突变的检测。
[0144]
7本实施例的目的在于说明本专利方案是可以拓展的,不是一个只有实施例1~3中flt基因c.2523c》a突变这样的一个案例,与前面的实施例3一样,本实施例展示了idh2基因目标变异分子的绝对数量在4~10个时、占总体比例三万分之一时候的技术效果;
[0145]
7.1效果组:三重竞争体系的设置
[0146]
7.2比对组:
[0147]
7.2.1对比组十:组分只有寡核苷酸链fp、寡核苷酸链rp以及pcr产物中间的taqman探针,不加入寡核苷酸链pb和寡核苷酸链cb;普通taqman探针用来替代寡核苷酸链cb带有荧光的功能,展示没有寡核苷酸链pb和寡核苷酸链cb的竞争性作用时,是否能获得0.0033%的检测效果;
[0148]
7.2.2对比组十一:组分只有寡核苷酸链fp、寡核苷酸链rp以及寡核苷酸链cb,展示没有寡核苷酸链pb与寡核苷酸链cb发生竞争性作用时,是否能获得0.0033%的检测效果;
[0149]
7.2.3对比组十二:组分只有寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb以及taqman探针,展示只有寡核苷酸链fp和寡核苷酸链pb的竞争关系,而没有寡核苷酸链cb与寡核苷酸链pb发生竞争性作用时,是否能获得0.0033%的检测效果;
[0150]
7.2.4寡核苷酸链fp、寡核苷酸链rp、寡核苷酸链pb、寡核苷酸链cb与taqman探针的相对位置如图2所示,对比组十、十一和十二分别与对比组一、二、三布置相同。
[0151]
7.3四个组的寡核苷酸链的序列和设置如下:
[0152][0153]
8需要准备的标准品与试剂
[0154]
本实施例使用与实施例3相同的方法配置标准品,反应体系、qpcr程序也与实施例3相同,因此不再赘述。
[0155]
8.1qpcr结果如下:
[0156]
图15为效果组的qpcr结果。由于三重竞争关系的存在,即寡核苷酸链pb可以对非目标模板基因组dna的扩增产生抑制效果,同时寡核苷酸链cb可以与含有变异信息的目标模板dna分子的阳性质粒特异性结合,产生荧光信号。当扩增反应进行了55个循环之后,变异分子占总体比例为0.00%的标准品仍然没有荧光信号,说明具有很好的特异性;但是变异分子占总体比例为0.003%的标准品产生了明显的荧光信号。此外,变异分子占总体比例为0.002%的标准品也产生了明显的荧光信号。由此说明效果组拥有检测到三万分之一的技术效果,甚至拥有可以检测到五万分之一或更低的技术效果,即效果组可以快速、准确高灵敏的检测到mrd。
[0157]
图16对比组十的qpcr结果。本组具有利用行业中通行方法设计的taqman荧光探针提供信号,并没有寡核苷酸链pb对非目标模板dna的扩增抑制效果,且也没有寡核苷酸链cb提供特异性的荧光信号,所有标准品呈现了相同的ct值的荧光信号,可以看出,对比组十的方案无法拥有检测到三万分之一的技术效果,也没有区分0.1%的技术效果。
[0158]
图17为对比组十一的qpcr结果。由于没有寡核苷酸链pb压制非目标模板的扩增,目标模板(含有突变信息)没有得到富集,虽然寡核苷酸链cb能特异性识别突变信号,但是只可以检测到变异分子占总体比例较高的标准品(3.125%)的荧光信号,但无法区分比例较低的标准品和0.000%的标准品。因此对比组十一的方案无法拥有检测到三万分之一的技术效果。
[0159]
图18为对比组十二的qpcr结果。由于引入了寡核苷酸链pb与寡核苷酸链fp的竞争,不同于对比组十,基于变异分子所占总体比例的不同,其ct值略有差异。但是,变异分子占总体比例为0.000%的标准品与变异分子占总体比例为0.100%,0.010%,0.005%,0.003%,和0.002%的标准品的ct值相同。因此对比组十二的方案无法拥有检测到三万分之一的技术效果。
[0160]
综上,对比组十是行业中常规的taqman荧光探针设置方案,可以看到并没有能检测0.0033%的技术效果;对比组十一和十二是有可能被同行从业者预见的技术方案,没有能检测到0.0033%的技术效果;再次证明了,寡核苷酸链fp、寡核苷酸链pb与寡核苷酸链cb的相互作用,并且需要严谨的设计才能保证能检测到0.0033%,并且这种方案是可以进行推广的。
[0161]
实施例5展示两条寡核苷酸链pb同时存在时的检测效果
[0162]
9目的:实施例1~4的效果组展示了mut和ref位置上一条寡核苷酸链fp、一条寡核苷酸链pb和一条寡核苷酸链cb同时存在时,即三条寡核苷酸链相互竞争时,达到的技术效果,同时也对比了寡核苷酸链pb和寡核苷酸链cb存在和不存在时的结果。本实施例通过chek2基因展示mut和ref位置上同时存在一条寡核苷酸链fp、两条寡核苷酸链pb和一条寡核苷酸链cb时,即四条寡核苷酸相互竞争,所能具备的技术效果。
[0163]
chek2基因在人类基因组中有7种同源性为95%左右的假基因,在临床应用中,如果chek2基因发生位点变异,那么我们需要确定这个位点变异的确是发生在chek2真基因上,这就需要我们将chek2真基因不受假基因干扰的扩增出来。本实施例展示了,针对chek2真基因14号外显子区域设计的寡核苷酸链fp、pb和cb组合物,如下表所示,其中寡核苷酸链pb和寡核苷酸链cb均设计在chek2真假基因序列差异的地方,两条寡核苷酸链pb(exon14pb-1、exon14pb-2)与假基因序列(即为非目标模板)完全匹配,分别抑制不同的假
基因,而寡核苷酸链cb与真基因序列(即目标模板)完全匹配。其中,寡核苷酸链fp和寡核苷酸链pb中的每一条的比例均是1:10;寡核苷酸链fp与寡核苷酸链rp比例为1:1。实验设置为效果组、对比组十三和对比组十四,三组间的差异为效果组添加两种寡核苷酸链pb、对比组十三只添加一种寡核苷酸链pb(即exon14pb-1);对比组十四不添加任何一条寡核苷酸链pb。
[0164][0165]
10具体实施过程
[0166]
将寡核苷酸链fp、pb和rp干粉用0.1
×
te溶液稀释至100μm作为母液,将fp和rp的母液用0.1
×
te溶液稀释至10μm作为工作液。按照下列步骤进行扩增:
[0167]
10.1 5
×
oligo mix体系:
[0168][0169][0170]
10.2配置相应实验组和对比组5
×
oligo mix扩增体系
[0171][0172]
10.3 qpcr过程条件
[0173][0174]
10.4qpcr荧光收集情况如图19所示,图19为chek2 exon14各组荧光信号情况。对比组十四由于未添加任意一种寡核苷酸pb,其对假基因的扩增没有阻滞作用,ct值为32;对比组十三添加了一种寡核苷酸pb,其对假基因的扩增有部分阻滞作用,ct值为33;效果组为添加所有pb组,可以阻滞所有假基因的扩增,ct值为34。
[0175]
10.5将chek2 exon14的效果组和对比组十三、十四的pcr扩增产物进行sanger测序;
[0176]
10.6chek2 exon14不同设置的pcr产物sanger测序结果分析如图20所示,在图20中展示了96个chek2 exon14所含碱基,同源性在90%~98%之间,在109c位置上(左起第一个箭头处),有两条假基因在该位置上是t,未添加任何一种寡核苷酸链pb的对比组十四的结果在该点显示为c,该位置上,不区分真假基因的情况下,c占约4/5,在sanger结果中c的信号大于t的信号,符合预期;添加一种寡核苷酸链pb的对比组十三在该点显示为t,说明含有t的假基因被抑制的效果比较差,含有c的假基因被抑制的效果比较好,导致在该位置上t信号占大多数;添加所有寡核苷酸链pb的对比组在该点对所有假基因的抑制十分出色,来自真基因的c所占比例非常高。
[0177]
117g位置上(左起第二个箭头处),6条假基因都与真基因相同为g,只有1条假基因在此处为a,未添加寡核苷酸链pb的对比组十四没有抑制作用,sanger在该点显示为g,符合预期;添加部分寡核苷酸链pb的对比组十三在该点显示为a/g的杂峰,其中a信号大于g信号,说明含有a的假基因没有被很好的抑制,结合109c、116c位置的情况,我们可以判断出没有被很好抑制的假基因是假基因序列中由上而下的第三条;在效果组中,无论109c、116c位置,还是117g位置,都与真基因相同,证明两条寡核苷酸链pb同时存在时,对所有假基因都有很好的抑制作用。
[0178]
同理,在140c位置上(左起第三个箭头处),假基因全部是del c,未添加寡核苷酸链pb的对比组十四的结果中,该位置为del c,且前面139位置出现c/t杂峰;含有部分抑制
效果的对比组十三的扩增产物的140位置也出现了del c,139位置抑制一部分的假基因c信号,结合109c、116c、117g位置的情况,再次说明第三条假基因序列没有得到很好的抑制;在效果组中,140位置上全部显示为c,结合109c、116c、117g位置的情况,我们确认两条寡核苷酸链pb同时存在时,扩增出来了chek2真基因exon14序列。
[0179]
综上,对比效果组和对比组十三、十四的sanger结果可以看出,如果不抑制假基因,很难直接和明显地获得真基因的信息;抑制部分假基因的体系能获得一定的真基因信息,但只有经过合理的设置,针对不同的情况,采用两条甚至多条寡核苷酸链pb才能抑制所有的假基因,获得纯的真基因产物,证明了基于复杂竞争机制的体系能够适用于复杂的应用场景,能够特异性很高的识别目标信息。
[0180]
实施例6展示两种寡核苷酸链cb同时存在时的检测效果
[0181]
11目的:展示2种寡核苷酸链cb同时存在时的检测效果,以印证权利要求对应的所述内容,根据应用场景的需要,设计多个寡核苷酸链cb具有提高检测特异性的效果,进一步说明基于复杂竞争机制的本专利方案是具有足够的创新性和可行性的。
[0182]
12本实施例所用到的寡核苷酸链序列如下表所示,其中egfr_858_cb1、egfr_858_cb2是分别针对粗体斜体所示的目标模板差别而设计;另外,gapdh是作为样本的内参。
[0183]
序列名称寡核苷酸链fp序列egfr_858_fpgcagcatgtcaagatcacagatt
ꢀꢀ
gapdh_fpccttcttgcctcttgtctcttag 寡核苷酸链pb序列egfr_858_pbgatcacagattttgggctggccaaactg-nh
3 寡核苷酸链rp序列egfr_858_rpccacctccttactttgcctccgapdh_rptcattgatggcaacaatatccact 寡核苷酸链cb序列egfr_858_cb1fam/tgggc gt gccaaa/mgbegfr_858_cb2cy5/agc g ggccaaac/mgb
ꢀꢀ
gapdh_tmrox/ccagagttaaaagcagccctggtgaccag
[0184]
将fp、rp、cb和pb干粉用0.1
×
te溶液稀释至100μm作为母液,将fp、rp和cb母液用0.1
×
te溶液稀释至10μm作为工作液。
[0185]
13具体实施过程:
[0186]
13.1准备两种l858r标准品,分别是egfr_l858r(c.2573_2574tg》gt)(对应egfr_858_cb1)和egfr_l858r(c.2573t》g)(对应egfr_858_cb2);浓度均为0.1%;通过ddpcr来定量标准品的浓度;
[0187]
14组别设置
[0188]
14.1对比组十五:野生型cfdna 标准品,l858r含量为0%;
[0189]
14.2效果组十六:0.1%egfr_l858r(c.2573_2574tg》gt)(对应egfr_858_cb1)cfdna 标准品;
[0190]
14.3效果组十七:0.1%egfr_l858r(c.2573t》g)(对应egfr_858_cb2)cfdna标准品;
[0191]
14.4配置5
×
oligo mix体系:
[0192]
egfr_l858r实验组分引物浓度(μm)体积(μl)egfr_858_fp1012egfr_858_rp1012egfr_858_pb10024egfr_858_cb1103egfr_858_cb2103gapdh_fp1012gapdh_rp1012gapdh_tm103nuclease free water 9total 90
[0193]
配置扩增体系
[0194][0195]
14.5 qpcr过程条件
[0196][0197][0198]
14.6pcr结果如图21所示,我们可以看到,在对比组十五的结果中,由于只有l858r阴性0%的样本,只能看到内参gapdh rox的信号,而fam和cy5的信号是没有的,说明对于阴性样本来说,本实施例的寡核苷酸链cb并没有产生非特异性信号,具有足够好的特异性。
[0199]
14.7效果组十六的结果如图22所示,由于只有一种egfr_l858r突变,且对应的是fam信号,从结果中可以看出,也的确只有内参rox信号和egfr_l858r(c.2573_2574tg》gt)的fam信号。虽然egfr_858_cb2和egfr_858_cb1在体系中都存在,但在本效果组中,cy5是没有扩增曲线的,说明egfr_858_cb2探针对于不是自己对应模板的底物具有足够的特异性,不会产生非特异性信号;同样的道理,在效果组十七对应的图23结果中,只有rox信号和cy5信号,没有fam信号,说明egfr_858_cb2在识别自己对应模板的同时,对于相似模板egfr_l858r(c.2573_2574tg》gt)不会发生错误识别,特异性足够。
[0200]
由此说明效果组拥有检测千分之一egfr_l858r的能力,可与对比组(野生型)进行明显区分。说明该技术对于低丰度变异的检测,有着特异性良好的检出能力。
[0201]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1