一种RSV融合前F蛋白、表达质粒、细胞株和RSV疫苗组合物
一种rsv融合前f蛋白、表达质粒、细胞株和rsv疫苗组合物
技术领域
1.本发明属于生物医药技术领域,具体涉及一种rsv融合前f蛋白、表达质粒、细胞株和rsv疫苗组合物。
背景技术:
2.人呼吸道合胞病毒(humanrespiratory syncytial virus,rsv)是导致婴幼儿、老年人和免疫力低下成年人下呼吸道感染(lower respiratory tract infections,lrti)的最重要病毒病原,几乎100%的婴幼儿在2岁以内感染过1次以上。在1月至1岁儿童全因死亡的单病原感染因素分析中,rsv引起的死亡人数约占总死亡人数的6.7%,排列第二位。rsv还是导致5岁以下的儿童因肺炎死亡的最重要病毒病原。因此,急需rsv疫苗降低rsv感染和rsv相关死亡人数,但是经过多年不懈努力,rsv的预防及治疗依然缺乏有效、可靠的方法。因此who将rsv疫苗列为二十一世纪应优先发展的疫苗。研发可用于预防rsv感染的疫苗,必将有助于提高婴幼儿和老年人的健康水平、助力实现健康中国的发展战略。
3.随着人们对rsv免疫逃逸机制的深入认识,以及对fi-rsv引起erd原因的逐步理解,随着疫苗研究技术和方法的日益丰富,以限制病毒复制和降低rsv感染后严重下呼吸道症状为目的的rsv疫苗研制工作已看到希望,在亚单位疫苗(subunitvaccine)及活疫苗(live virus vaccine)的研究上取得了有意义的进展。亚单位疫苗是指由纯化的一种或几种rsv病毒蛋白组成的非复制型疫苗,能产生很好的抗体应答,但对新生儿仍存在疾病增强作用的风险,适宜于rsv血清阳性儿童、孕妇和老年人群提高免疫力,但是目前没有针对rsv的亚单位疫苗上市。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种rsv融合前f蛋白、表达质粒、细胞株和rsv疫苗组合物,所述rsv疫苗组合物能够诱导产生了th1/th2平衡免疫应答、高滴度的中和抗体,以及细胞免疫,为研制rsv亚单位疫苗奠定基础。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种呼吸道合胞病毒融合前f蛋白nq,所述融合前f蛋白nq为在呼吸道合胞病毒融合前f蛋白的氨基酸序列中引入n70q突变位点,并以gcn4基序替换跨膜区和胞内区。
7.优选的,所述融合前f蛋白nq的编码基因的核苷酸序列如seq id no.1所示。
8.本发明还提供了一种包含上述融合前f蛋白nq的编码基因的表达质粒,所述表达质粒以真核表达质粒pmew为基础载体;
9.所述真核表达质粒pmew的制备方法,包括配利用mar、ef-1a启动子、bgh poly(a)和wpre的基因序列替换pcdna3.1(+)的cmv启动子、多克隆位点和sv40 poly(a)序列。
10.优选的,所述真核表达质粒pmew的核苷酸序列如seq id no.2所示。
11.本发明还提供了上述表达质粒的构建方法,包括以下步骤:将上述融合前f蛋白的
编码基因插入真核表达质粒pmew的ecorv和spei酶切位点之间。
12.本发明还提供了一种稳定表达上述融合前f蛋白nq的细胞株,所述细胞株以cho细胞株为基础细胞。
13.本发明还提供了上述细胞株的构建方法,包括以下步骤:利用上述表达质粒转染cho细胞,筛选获得稳定表达融合前f蛋白nq的cho细胞株。
14.本发明还提供了上述融合前f蛋白nq或上述表达质粒或上述细胞株在制备抗呼吸道合胞病毒感染的制剂中的应用。
15.本发明还提供了一种预防呼吸道合胞病毒感染的疫苗组合物,所述疫苗组合物包括上述融合前f蛋白nq或利用上述重组细胞株生产得到的融合前f蛋白和佐剂(al(oh)3+cpg-x1)。
16.优选的,所述佐剂的类型包括cpg-x1和al(oh)3。
17.有益效果:本发明提供了一种呼吸道合胞病毒融合前f蛋白的融合前f蛋白(nq),在融合前f蛋白(sc-tm)基础上引入n70q突变位点,消除该糖基化位点增强免疫原性,从而获得新的pref(nq)。本发明利用真核表达的方法,成功构建了稳定表达nq的cho细胞系,将表达的nq和佐剂组合后,制备疫苗组合物。
18.本发明实施例中,将制备得到的疫苗组合物,经肌肉注射免疫小鼠诱导产生了th1/th2平衡免疫应答、高滴度的中和抗体,以及细胞免疫,为研制rsv亚单位疫苗奠定基础。
附图说明
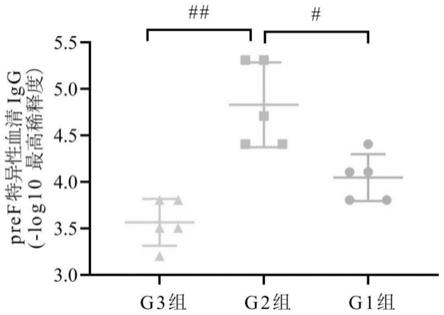
19.图1为本发明实施例所述的血清elisa抗体;
20.图2为本发明实施例所述的血清中和抗体;
21.图3为本发明实施例所述的血清igg1和血清igg2a;
22.图4为本发明实施例所述的细胞免疫。
具体实施方式
23.本发明提供一种呼吸道合胞病毒融合前f蛋白nq,所述融合前f蛋白为nq在呼吸道合胞病毒融合前f蛋白的氨基酸序列中引入n70q突变位点,并以gcn4基序替换跨膜区和胞内区。本发明通过引入所述n70q突变位点,可消除该糖基化位点并增强免疫原性,本发明通过用gcn4基序替换跨膜区和胞内区形成稳定的分泌型三聚体。本发明所述融合前f蛋白nq的编码基因的核苷酸序列优选如seq id no.1所示。本发明所述呼吸道合胞病毒融合前f蛋白已在中国专利cn202010863762.x中进行公开,在此不再赘述。
24.本发明还提供了一种包含上述融合前f蛋白nq的编码基因的表达质粒,所述表达质粒以真核表达质粒pmew为基础载体;
25.所述真核表达质粒pmew的制备方法,包括配利用mar、ef-1a启动子、bgh poly(a)和wpre的基因序列替换pcdna3.1(+)的cmv启动子、多克隆位点和sv40 poly(a)序列。
26.本发明所述替换优选包括利用mluⅰ和pmeⅰ双酶切pcdna3.1(+)后,与人工合成包含mar、ef-1a启动子、bgh poly(a)和wpre的基因序列连接,从而获得真核表达质粒pmew。本发明所述真核表达质粒pmew的核苷酸序列优选如seq id no.2所示。
27.本发明所述表达质粒以pmew为基础载体,并将所述融合前f蛋白nq的编码基因插入真核表达质粒pmew的ecorv和spei酶切位点之间,从而构建得到所述表达质粒。本发明对所述mluⅰ和pmeⅰ双酶切及ecorv和spei双酶切的方法并没有特殊限定,利用本领域的常规双酶切方法即可。
28.本发明还提供了上述表达质粒的构建方法,包括以下步骤:将上述融合前f蛋白nq的编码基因插入真核表达质粒pmew的ecorv和spei酶切位点之间。
29.本发明优选采用双酶切的方法将上述编码基因插入pmew的ecorv和spei酶切位点之间,获得表达质粒pmew-nq。
30.本发明还提供了一种表达上述融合前f蛋白nq的重组细胞株,所述重组细胞株以cho细胞株为基础细胞。
31.本发明优选利用所述表达质粒pmew-nq转染cho细胞,并用抗生素g418进行筛选获得稳定表达pref蛋白(nq)的cho细胞株。
32.本发明还提供了上述重组细胞株的构建方法,包括以下步骤:利用上述表达质粒转染cho细胞株,筛选获得稳定表达融合前f蛋白nq的cho细胞株。本发明所述筛选优选与上述相同,在此不再赘述。
33.本发明所述转染时的cho细胞的丰度优选为90%。本发明所述转染优选包括利用pmew-nq转染90%丰度的cho细胞,37℃5%co2孵育5h后,补加含10%血清的dmem,37℃5%co2,继续培养。转染后24h,按1:20、1:50、1:200、1:500、1:1000等多个稀释梯度传代,同时添加最小致死浓度的g418,待对照组细胞(未转染质粒)全部死亡,即可采用克隆环挑取单克隆。本发明所述最小致死浓度优选为800μg/ml。
34.在本发明中,优选对单克隆细胞进行扩大培养并对目的蛋白进行表达鉴定,筛选表达量高的单克隆进行扩大培养,从而进行融合前f蛋白nq的表达。
35.本发明对所述扩大培养和表达的方法并没有特殊限定,利用本领域的常规方法即可。
36.本发明还提供了上述融合前f蛋白nq或上述表达质粒或上述细胞株在制备抗呼吸道合胞病毒感染的制剂中的应用。
37.本发明所述制剂优选包括药物、抗体、诊断试剂和疫苗。本发明对所述制剂的制备方法并没有特殊限定,利用本领域的常规方法制备相应的制剂即可。
38.本发明还提供了一种预防呼吸道合胞病毒感染的疫苗组合物,所述疫苗组合物包括上述融合前f蛋白nq或利用上述重组细胞株生产得到的融合前f蛋白nq和佐剂。
39.本发明所述疫苗组合物优选为注射剂,采用肌肉注射给药方式,通过两次给予受试者相同用量的有效剂量的疫苗组合物,其中在首次给予疫苗组合物后第21~30d,给予第二次疫苗组合物。在本发明中,所述疫苗组合物中上述融合前f蛋白nq的含量优选为5~100μg/ml,更优选为10~30μg/ml。本发明所述疫苗组合物中,所述佐剂优选包括cpg-x1和al(oh)3,且cpg-x1的含量优选为10μg/ml,al(oh)3的含量优选为100μg/ml。本发明cpg-x1序列已在中国专利zl200810004736.0进行过公开,实施例中所用的具体序列为全链硫代修饰的seq id no.3:tcgttcgttcgttcgttcgtt,本发明所用cpg-x1由cn201010527003.2专利发明人许洪林提供。
40.下面结合实施例对本发明提供的一种rsv融合前f蛋白的融合前f蛋白、表达质粒、
重组细胞株和rsv疫苗组合物进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
41.实施例1
42.构建表达呼吸道合胞病毒(rsv)融合前融合蛋白(nq)的cho细胞株
43.一、pmew真核表达质粒的构建
44.mluⅰ和pmeⅰ双酶切pcdna3.1(+)后,与人工合成包含mar、ef-1a启动子、bghpoly(a)和wpre的基因序列连接获得真核表达质粒pmew。
45.二、pmew-pref真核表达质粒的构建
46.通过ecorv和spei将pref基因(sc-tm)连接到pmew,获得pmew-nq。
47.三、稳定表达nq蛋白的cho细胞株的筛选
48.将cho细胞接种于24孔板,待细胞贴壁后生长丰度约30~40%时,弃去原培养液,分别加入含不同浓度g418(设300、400、500、600、700、800、900和1000μg/ml)的完全培养液,持续培养14d,经14d的筛选后确定g418对筛选目的细胞的最小致死浓度为800μg/ml。
49.在转染前24h将cho细胞接种于100mm细胞培养皿中,转染时细胞的丰度为90%。利用lipofectamine 2000将纯化后的6μg pmew-pref转染至cho细胞上,37℃,5%co2孵育5h后,补加含10%血清的dmem 3000l,37℃,5%co2,继续培养。转染后24小时,按1:20、1:50、1:200、1:500、1:1000等多个稀释梯度传代,同时添加800μg/ml的g418待对照组细胞(未转染质粒)全部死亡,即可采用克隆环挑取单克隆。
50.四、nq表达鉴定及单克隆细胞扩大培养
51.采用斑点印记和免疫印记筛选表达量高的单克隆细胞,并进行扩大培养。
52.五、nq纯化
53.采用镍柱纯化,纯化后采用凝血酶切除his标签。
54.实施例2
55.呼吸道合胞病毒疫苗组合物的初免-加强免疫
56.一、动物免疫
57.6~-8周龄的雌性balb/c小鼠,分成3组,第0d,采集基础血清,第1d,第一次肌肉注射免疫。在免疫后第21d,第一次免疫后血。第28d,第二次肌肉注射免疫,两次免疫剂量均为50μl/鼠(其中,nq或f为2μg,cpg-x1为10μg,al(oh)3为100μg,溶解在pbs中。)。第49d,第二次免疫后血。第56d,经滴鼻途径进行攻毒实验,攻毒的剂量为1
×
106pfu/50μl的wtrsv。
58.分组及处理如下:
59.第一组(g1组):al(oh)3+nq组;
60.第二组(g2组):al(oh)3+cpg-x1+nq组;
61.第三组(g3组):al(oh)3+cpg-x1+野生型rsv f组;
62.二、免疫后小鼠血清igg检测
63.待测溶液为:步骤一中免疫后第49d采集小鼠静脉血,分离获得血清。
64.采用elisa方法检测小鼠的血清抗体滴度。纯化rsv按2500pfu/孔包被酶标板、融合前f蛋白(pref)按450ng/孔包被酶标板,融合后f蛋白(postf)1200ng/孔包被酶标板,elisa方法检测小鼠血清抗体igg。
65.结果如图1和图3所示,al(oh)3+cpg-x1+nq组免疫小鼠后,诱导产生较强的、th1/
th2平衡的血清抗体。
66.三、免疫后小鼠血清中和抗体
67.1、按照2.0
×
104细胞/孔的密度将hep-2细胞接种到96孔板上,培养24h。
68.2、将免疫后小鼠血清于56℃,灭活30min,并用2%胎牛血清的dmem培养液进行2倍稀释。不同稀释度的血清中,加入rsv-mgfp使终浓度为1000pfu/100μl,混合后于37℃孵育1h。
69.3、弃96孔板培养基,pbs洗涤1~2次后,将100μl混合液(含1000pfu的rsv-mgfp)加入到铺有单层hep-2细胞的96孔板中,37℃培养48h。同时设立空白对照(无病毒、无血清或抗体)、阴性对照组(有rsv-mgfp,无血清)和阳性对照组,培养2d。
70.4、完成步骤3后,采用多功能酶标仪spectramax m5e检测每孔中绿色荧光蛋白的荧光强度(激发波长479nm、发射波长517nm,检测10s)。
71.5、实验组、阴性对照组、阳性对照组均分别减去空白对照组,利用spss建立建立实验组的线性回归方程,通过线性回归方程,计算出荧光强度减少50%的抗体滴度(ic
50
)。
72.结果如图2所示,al(oh)3+cpg-x1+nq组免疫小鼠后,诱导产生较强的中和抗体。
73.四、免疫后小鼠细胞免疫效果分析
74.1、分离未免疫babl/c小鼠脾淋巴细胞(分离后的淋巴细胞采用10%fbs的1640完全培养基重悬),一部分淋巴细胞中加入rsv f蛋白h-2kd限制性ctl表位,另一部分淋巴细胞中加入无关蛋白或不加蛋白,4℃孵育过夜或37℃孵育4h。
75.2、孵育结束后,1200rpm室温离心5min。
76.3、pbs洗涤2次去除血清,预热到室温的pbs重悬细胞。
77.4、cfsehigh:rsv f蛋白h-2kd限制性ctl表位刺激过的淋巴细胞中加入的cfse终浓度为5μm,颠倒混匀,室温避光孵育10min。
78.cfselow:无关蛋白刺激或未加蛋白刺激的淋巴细胞中加入的cfse终浓度为0.5μm,颠倒混匀,室温避光孵育10min。
79.5、避光孵育结束后,加入4~5倍体积的含10%fbs的预冷pbs,1200rpm 4℃离心5min,弃上清,加入含10%fbs的pbs重洗一次。
80.6、加入适量预热到室温的pbs重悬细胞,并计数细胞数量。
81.7、将浓度为0.5
×
l07细胞/100μl的cfsehigh和cfselow淋巴细胞按1:1比例混合。
82.8、按1.0
×
l07细胞/200μl/鼠,经尾静脉注射200μl到疫苗免疫鼠和未免疫组体内;
83.9、5~12h后,处死受体小鼠,分离脾淋巴细胞;
84.10、通过流式细胞仪计数的cfsehigh和cfselow淋巴细胞数目;
85.11、%specific lysi=(%cfsehigh-%cfselow)/%cfsehigh
×
100%。
86.或
87.100%
×
[1-(cfselow/cfsehigh cells ofmice)/(cfselow/cfsehigh cells ofimmunized mice)]。
[0088]
结果如图4所示,al(oh)3+cpg-x1+nq组免疫小鼠后,诱导产生较强的体内细胞免疫。
[0089]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1