GTFB突变体及其在制备一系列具有不同抗水解能力异麦芽多糖中的应用
gtfb突变体及其在制备一系列具有不同抗水解能力异麦芽多糖中的应用
技术领域
1.本发明涉及gtfb突变体及其在制备一系列具有不同抗水解能力异麦芽多糖中的应用,属于基因工程技术领域。
背景技术:
2.近年来,随着社会的发展,人类生活环境发生了很大的变化,如生活节奏加快、饮食结构改变、社会竞争激烈、环境污染等。这些变化时刻威胁着人们的健康,使得大多数人处于亚健康状态。为了顺应现代食品科技发展的方向并满足消费者的健康需求,低血糖、低热量具有抗消化能力的功能性碳水化合物已成为21世纪健康食品的发展潮流。
3.据报道,由4,6-α-葡萄糖基转移酶以淀粉为底物合成的异麦芽多糖是一种新型的可溶性膳食纤维,由于其结构中富含人体消化系统不易水解的α,1-6糖苷键,因此其具有抗消化,低热量释放的特性。不同来源的4,6-α-葡萄糖基转移酶合成的产物含有不同比例的α,1-6糖苷键,它们在人体消化到中的抗水解能力也不一样。α,1-6键比例含量高的异麦芽多糖抗水解能力强,通过消化道后只有少部分的葡萄糖被水解释放,适合患有高血糖的人群以及减肥人群食用。而通过调节异麦芽多糖结构中的α,1-6糖苷键比例能够控制其在人体消化道中的葡萄糖释放速率和释放总量,以此满足不同人群肠道对葡萄糖供应的需求。因此调控4,6-α-葡萄糖基转移酶合成产物结构中的α,1-6糖苷键比例,制备一系列具有不同抗水解能力异麦芽多糖产品,在低热量食品以及其他功能性食品的生成应用上具有巨大意义。
技术实现要素:
4.针对合成不同抗水解能力异麦芽多糖产品的需求,本发明首先提供了4,6-α-葡萄糖基转移酶突变体,所述突变体是将氨基酸序列如seq id no.1所示的4,6-α-葡萄糖基转移酶的第346、348以及399位突变得到的,这些突变体能够利用淀粉合成一系列具有不同抗水解能力的异麦芽多糖产物。
5.本发明提供了4,6-α-葡萄糖基转移酶突变体,以氨基酸序列如seq id no.2所示的4,6-α-葡萄糖基转移酶为亲本,将其第346位、348位和/或399位发生取代。
6.在一种实施方式中,所述4,6-α-葡萄糖基转移酶的编码基因核苷酸序列如seq id no.1所示。
7.在一种实施方式中,将其第346位的丝氨酸取代为苏氨酸;将其第348位的丝氨酸取代为亮氨酸、异亮氨酸、缬氨酸和/或苏氨酸。
8.在一种实施方式中,包括以下(1)~(16)任一所述:
9.(1)将亲本的第348位取代为亮氨酸,命名为s348l;
10.(2)将亲本的第348位取代为异亮氨酸,命名为s348i;
11.(3)将亲本的第348位取代为缬氨酸,命名为s348v;
12.(4)将亲本的第348位取代为苏氨酸,命名为s348t;
13.(5)将亲本的第346位取代为苏氨酸,并将第348位取代为亮氨酸,命名为s346t/s348l;
14.(6)将亲本的第346位取代为苏氨酸,并将第348位取代为异亮氨酸,命名为s346t/s348i;
15.(7)将亲本的第346位取代为苏氨酸,并将第348位取代为缬氨酸,命名为s346t/s348v;
16.(8)将亲本的第346位取代为苏氨酸,并将第348位取代为苏氨酸,命名为s346t/s348t;
17.(9)将亲本的第348位取代为亮氨酸,并将第399位取代为异亮氨酸,命名为s348l/l399i;
18.(10)将亲本的第348位取代为亮氨酸,并将第399位取代为缬氨酸,命名为s348l/l399v;
19.(11)将亲本的第348位取代为亮氨酸,并将第399位取代为苏氨酸,命名为s348l/l399t;
20.(12)将亲本的第348位取代为亮氨酸,并将第399位取代为丙氨酸,命名为s348l/l399a;
21.(13)将亲本的第346位取代为苏氨酸,将第348位取代为苏氨酸、并将第399位取代为异亮氨酸,命名为s346t/s348t/l399i;
22.(14)将亲本的第346位取代为苏氨酸,将第348位取代为苏氨酸,并将第399位取代为缬氨酸,命名为s346t/s348t/l399v;
23.(15)将亲本的第346位取代为苏氨酸,将第348位取代为苏氨酸,并将第399位取代为苏氨酸,命名为s346t/s348t/l399t;
24.(16)将亲本的第346位取代为苏氨酸,将第348位取代为苏氨酸,并将第399位取代为丙氨酸,命名为s346t/s348t/l399a;
25.本发明提供了编码所述4,6-α-葡萄糖基转移酶突变体的基因。
26.本发明提供了含有所述编码所述4,6-α-葡萄糖基转移酶突变体的基因的表达载体。
27.在一种实施方式中,所述载体为phy系列载体。
28.优选地,所述载体为phy300plk。
29.本发明提供了表达所述4,6-α-葡萄糖基转移酶突变体或含有所述基因的宿主细胞。
30.在一种实施方式中,所述宿主细胞以枯草芽孢杆菌cctcc no:m 2016536为表达宿主,所述枯草芽孢杆菌cctcc no:m 2016536公开于公开号为cn108102996a。
31.本发明提供了制备异麦芽多糖的方法,所述方法是利用所述4,6-α-葡萄糖基转移酶突变体以淀粉为底物,制备异麦芽多糖。
32.在一种实施方式中,具体步骤为:
33.(1)将淀粉加水调制成15~25%的悬浊液,并升温至60~80℃糊化得到糊化液;
34.(2)将步骤(1)得到的糊化液冷却至30~45℃调节ph值6.5~7.0,同时添加普鲁兰
酶20~40u/g底物和4,6-α-葡萄糖基转移酶突变体3000~4000u/g底物,放入恒温式水浴摇床,30~40℃反应不少于20h;
35.(3)将步骤(2)得到的反应液升温至95℃、10-20min灭酶;
36.(4)将反应产物经离心后取上清,喷雾干燥,最终得到淡黄色粉末成品。
37.在一种实施方式中,所述淀粉为谷物淀粉,或薯类淀粉,或淀粉衍生物:所述谷物淀粉为玉米淀粉、小麦淀粉、大米淀粉、绿豆淀粉、豌豆淀粉;所述薯类淀粉为木薯淀粉、马铃薯淀粉、红薯淀粉等薯类淀粉;所述淀粉衍生物为麦芽糊精、糊精、可溶性淀粉等淀粉衍生物;所述含有淀粉的物质为大米蛋白肽。
38.本发明提供了所述4,6-α-葡萄糖基转移酶突变体,或所述基因,或所述宿主细胞在生产异麦芽多糖中的应用。
39.本发明提供了所述制备异麦芽多糖的方法得到的异麦芽多糖在食品、保健品或化妆品领域中的应用。
40.本发明的有益效果:
41.本发明通过对来源于发酵乳杆菌(lactobacillus fermentum)4,6-α-葡萄糖基转移酶进行突变,得到的一系列突变体能够以淀粉为底物,在淀粉高温糊化后,与普鲁兰酶共同作用于糊化液,制备异麦芽多糖。这些突变体制备得到的异麦芽多糖含有不同比例的α,1-6糖苷键,并且这些异麦芽多糖产物在体外消化模拟实验中具有一系列的抗消化能力,这种性质可以满足食品、保健品或化妆品等领域中对产品不同抗水解能力的需求。
附图说明
42.图1为突变体的异麦芽多糖产物的1h nmr图谱。
43.图2为突变体的异麦芽多糖产物的抗水解曲线。
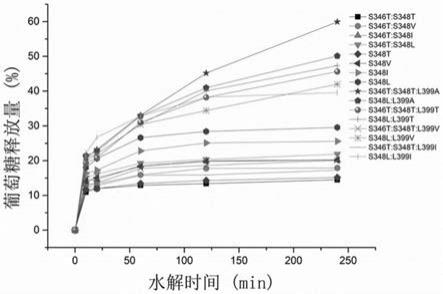
44.图3为16种突变体的异麦芽多糖产物的抗水解曲线。
具体实施方式
45.(一)培养基
46.lb培养基(g/l):蛋白胨10g/l,酵母提取物5,nacl 10。
47.tb培养基(g/l):蛋白胨10,酵母粉24,甘油5,k2hpo4·
3h2o 16.43,kh2po
4 2.31。
48.(二)酶活的定义及测定方法
49.用碘法测定4,6-α-葡萄糖基转移酶的突变体总酶活:1g/l直链淀粉母液:40mg的直链淀粉加入2ml的蒸馏水充分润湿,加入2ml的2m的naoh溶液,漩涡振荡充分溶解;用时取500μl的直链淀粉母液加250μl的2m的hci溶液,然后加入3250μl的磷酸-柠檬酸缓冲液(ph7.0)配成0.125%的底物。
50.鲁戈碘液:0.26g碘与2.60g碘化钾溶于10ml的容量瓶中(提前3天配制,确保碘完全溶解);用时取100μl的鲁戈碘液,加入50μl的2m的hcl溶液然后补水到26ml配成碘显色液。
51.反应时,取200ul的底物于1.5ml离心管中,35℃温浴10min。加入200μl的4,6-α-葡萄糖基转移酶酶液35℃反应10min,反应结束后取200μl反应液加入到3800μl的碘显色液中显示5min,分光光度计测定660nm下的吸光度。对照用缓冲液代替酶液,空白取200μl的缓冲
液加入到3800μl的碘显色液中显示5min。
52.一个相对酶活单位定义为,单位时间吸光值下降一个百分点为一个酶活单位。
53.酶活计算公式:
54.酶活(u/ml)=[100
×
稀释倍数
×
(a
对照-a
实验
)]/[10minх0.1mlх(a
对照-a
空白
)]。
[0055]
实施例1:4,6-α-葡萄糖基转移酶的突变体的构建
[0056]
(1)346和348位点突变体的制备
[0057]
根据核苷酸序列如seq id no.1所示的野生型4,6-α-葡萄糖基转移酶的序列,分别设计并合成s348t、s348v、s348i、s348l、s346t/s348t、s346t/s348v、s346t/s348i、s346t/s348l突变的引物,对4,6-α-葡萄糖基转移酶进行定点突变,分别测序确认4,6-a-葡萄糖基转移酶突变体的编码基因是否正确;将携带突变体基因的载体导入枯草芽孢杆菌cctcc m 2016536中进行表达,得到突变4,6-α-葡萄糖基转移酶。
[0058]
定点突变体编码基因的pcr扩增:利用快速pcr技术,以携带编码4,6-α-葡萄糖基转移酶基因的表达载体phy300plk-gtfb(记载于公开号为c111411117a的中国专利申请文本中)为模板。
[0059]
引入s348t单点突变的定点突变引物为:
[0060]
正向引物:5
’‑
cctgataactcaggtacggtcgatgatgatcag-3’(seq id no.3),
[0061]
反向引物:5
’‑
ctgatcatcatcgaccgtacctgagttatcagg-3’(seq id no.4);
[0062]
引入s348v单点突变的定点突变引物为:
[0063]
正向引物:5
’‑
cctgataactcaggtgttgtcgatgatgatcag-3’(seq id no.5),
[0064]
反向引物:5
’‑
ctgatcatcatcgacaacacctgagttatcagg-3’(seq id no.6);
[0065]
引入s348i单点突变的定点突变引物为:
[0066]
正向引物:5
’‑
cctgataactcaggtattgtcgatgatgatcag-3’(seq id no.7),
[0067]
反向引物:5
’‑
ctgatcatcatcgacaatacctgagttatcagg-3’(seq id no.8);
[0068]
引入s348l单点突变的定点突变引物为:
[0069]
正向引物:5
’‑
cctgataactcaggtctggtcgatgatgatcag-3’(seq id no.9),
[0070]
反向引物:5
’‑
ctgatcatcatcgaccagacctgagttatcagg-3’(seq id no.10);
[0071]
引入s346t/s348t双点突变的定点突变引物为:
[0072]
正向引物:5
’‑
taaacctgataacacgggtacggtcgatgatgatc-3’(seq id no.11),
[0073]
反向引物:5
’‑
gatcatcatcgaccgtacccgtgttatcaggttta-3’(seq id no.12);
[0074]
引入s346t/s348v双点突变的定点突变引物为:
[0075]
正向引物:5
’‑
taaacctgataacacgggtgttgtcgatgatgatc-3’(seq id no.13),
[0076]
反向引物:5
’‑
gatcatcatcgacaacacccgtgttatcaggttta-3’(seq id no.14);
[0077]
引入s346t/s348i双点突变的定点突变引物为:
[0078]
正向引物:5
’‑
taaacctgataacacgggtattgtcgatgatgatc-3’(seq id no.15),
[0079]
反向引物:5
’‑
gatcatcatcgacaatacccgtgttatcaggttta-3’(seq id no.16);
[0080]
引入s346t/s348l双点突变的定点突变引物为:
[0081]
正向引物:5
’‑
taaacctgataacacgggtctggtcgatgatgatc-3’(seq id no.17),
[0082]
反向引物:5
’‑
gatcatcatcgaccagacccgtgttatcaggttta-3’(seq id no.18)。
[0083]
(2)399位点叠加突变体的制备
[0084]
根据核苷酸序列如seq id no.1所示的基因序列,分别设计并合成l399a、l399t、l399v、l399i突变的引物,对4,6-α-葡萄糖基转移酶进行叠加定点突变。
[0085]
利用快速pcr技术,以携带编码4,6-α-葡萄糖基转移酶突变体s348l基因的表达载体为模板。分别测序确认4,6-α-葡萄糖基转移酶突变体的编码基因是否正确;将携带突变体基因的载体导入枯草芽孢杆菌cctcc m 2016536中进行表达,获得叠加突变的4,6-α-葡萄糖基转移酶s348l/l399a、s348l/l399t、s348l/l399v、s348l/l399i。
[0086]
利用快速pcr技术,以携带编码4,6-α-葡萄糖基转移酶突变体s346t/s348t基因的表达载体为模板,构建叠加定点突变的质粒。对质粒分别测序确认4,6-α-葡萄糖基转移酶突变体的编码基因是否正确;将携带突变体基因的载体导入枯草芽孢杆菌cctcc no:m 2016536中进行表达,获得叠加突变的4,6-α-葡萄糖基转移酶s346t/s348t/l399a、s346t/s348t/l399t、s346t/s348t/l399v、s346t/s348t/l399i。
[0087]
引入l399a点突变的定点突变引物为:
[0088]
正向引物:5'-gatagcccggaactggcagtaggcaatgatatt-3’(seq id no.19)
[0089]
反向引物:5'-aatatcattgcctactgccagttccgggctatc-3’(seq id no.20)
[0090]
引入l399t点突变的定点突变引物为:
[0091]
正向引物:5'-gatagcccggaactgaccgtaggcaatgatatt-3’(seq id no.21)
[0092]
反向引物:5'-aatatcattgcctacggtcagttccgggctatc-3’(seq id no.22)
[0093]
引入l399v点突变的定点突变引物为:
[0094]
正向引物:5'-gatagcccggaactggtcgtaggcaatgatatt-3’(seq id no.23)
[0095]
反向引物:5'-aatatcattgcctacgaccagttccgggctatc-3’(seq id no.24)
[0096]
引入l399i点突变的定点突变引物为:
[0097]
正向引物:5'-gatagcccggaactgattgtaggcaatgatatt-3’(seq id no.25)
[0098]
反向引物:5'-aatatcattgcctacaatcagttccgggctatc-3’(seq id no.26)
[0099]
pcr反应体系均为:5
×
ps buffer 10μl,dntps mix(2.5mmol/l)4μl,正向引物(10μmol/l)lμl,反向引物(10μmol/l)1μl,模板dna 1μl,primer star hs(5u/μl)0.5μl,加入蒸馏水至50μl。
[0100]
pcr扩增程序设定为:首先,94℃预变性5min;然后进入30个循环:98℃变性10s,55℃退火5s,72℃延伸7min 50s;最后72℃延伸10min,4℃保温。pcr产物用1%琼脂糖凝胶电泳进行检测。
[0101]
在验证正确的pcr产物中加入dpn i,37℃,水浴2h,降解模板,之后转化大肠杆菌jm109感受态细胞,将转化产物涂布于含有100mg/l氨苄青霉素的lb固体培养基,37℃培养10~12h,挑取阳性克隆接种于lb液体培养基,37℃培养8-10h。将测序正确的重组菌从甘油管接种至lb液体培养基,过夜培养,提取质粒,将质粒转化表达宿主枯草芽孢杆菌cctcc m 2016536感受态细胞,得到能够表达16种突变体的重组菌株,分别为表达s348t、s348v、s348i、s348l、s346t/s348t、s346t/s348v、s346t/s348i、s346t/s348l、s348l/l399a、s348l/l399t、s348l/l399v、s348l/l399i、s346t/s348t/l399a、s346t/s348t/l399t、s346t/s348t/l399v、s346t/s348t/l399i的重组枯草芽孢杆菌。
[0102]
实施例2:4,6-α-葡萄糖基转移酶的突变体的表达
[0103]
将实施例1中得到的16种重组枯草芽孢杆菌分别接种于lb培养基中,在37℃下培
养8h后,以发酵培养基体积5%的接种量转接至50ml tb发酵培养基中,先放至37℃、200rpm恒温培养1-2h,在菌体od
600
为0.5~0.7时添加0.4μm浓度的iptg并转至33℃、200rpm诱导发酵48h。发酵结束后,将发酵液经高压匀浆破碎(破碎条件为4'℃,80mpa)后离心(10000rpm、20min、4℃),上清即为重组枯草芽孢杆菌所产的4,6-α-葡萄糖基转移酶突变体酶液。
[0104]
实施例3:4,6-α-葡萄糖基转移酶突变体酶转化制备异麦芽多糖
[0105]
包括如下步骤:
[0106]
(1)以淀粉为底物,将淀粉加水调成20%的悬浊液,升温至60-80℃糊化;
[0107]
(2)将糊化后的淀粉冷却至30-45℃调节ph值6.5-7.0,同时添加普鲁兰酶30u/g底物和4,6-α-葡萄糖基转移酶突变体3500u/g底物,放入恒温式水浴摇床,37℃反应24h;
[0108]
(3)将步骤(2)得到的反应液升温至95℃、10-20min灭酶;
[0109]
(4)将反应产物8000rpm离心20min取上清,喷雾干燥,最终得到淡黄色粉末成品。
[0110]
实施例4:nmr光谱分析各个突变体的异麦芽多糖产物的键型比例
[0111]
分别将40mg上述4,6-α-葡萄糖基转移酶突变体异麦芽多糖产物与500uld2o(99.9原子%d)混合,超声处理5分钟以完全溶解样品。在avance iii 400mhz数字nmr光谱仪(bruker biospin international ag)上记录样品的一维
l
h和
13
c核磁共振(nmr)光谱,温度为60℃。将三甲基甲硅烷基丙酸(tmsp 0.03%)溶解在样品中作为内标,以校准化学位移(δ)并通过在δ5.36和δ4.97处的信号峰面积的积分来估计产物中α,1-6糖苷键的百分比(如图1)。
[0112]
在上述条件下检测到16个4,6-α-葡萄糖基转移酶突变体异麦芽多糖产物的α,1-6键的百分比如表1所示,突变体产物的α,1-6糖苷键的百分比由野生型产物的72%变成分布在7%-86%范围之间。
[0113]
表1突变体异麦芽多糖产物的α,1-6糖苷键的百分比
[0114][0115][0116]
实施例5:体外消化模拟实验测定异麦芽多糖产的抗水解能力
[0117]
混合水解酶的配置:称取2g的猪胰酶,加入24ml的蒸馏水悬浮,用漩涡振荡器4℃振荡10min充分混匀,离心后(1500
×
g,10min)吸取20ml上清液,加入0.4ml的葡萄糖苷酶以及3.6ml的蒸馏水,充分混匀即得混合水解酶。
[0118]
将用16中4,6-α-葡萄糖基转移酶突变体制备的异麦芽多糖产物分别配成4%(w/v)浓度,取1ml于5ml离心管中37℃温浴10min,加入1ml的混合水解酶于37℃下温浴,分别在0min、20min、60min、120min时取0.1ml的反应液加入到0.3ml的90%乙醇溶液中终止反应,离心(10000
×
g,10min)取上清液god法测定葡萄糖含量。分别计算各酶转化产物在混合水解酶的水解作用下0-20min,20-120min的葡萄糖转化率。
[0119]
定义120min前转化为葡萄糖的成分为可消化成分,其中0-20min为快速消化成分,20-120min为慢速消化成分;120min后未转化为葡萄糖的成分为抗性成分。
[0120]
检测到16个4,6-α-葡萄糖基转移酶突变体异麦芽多糖产物在体外消化模拟实验中表现出不同的抗水解能力曲线(如图2、3)。各个异麦芽多糖产物在体外模拟条件中,不同的反应时间被水解的葡萄糖成分如表2所示。
[0121]
表2突变体异麦芽多糖产物不同时间段被水解成分
[0122][0123][0124]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1