一种电融合缓冲液、其制备方法及电融合方法与流程
1.本发明属于杂交瘤细胞生产应用的技术领域,具体涉及一种低导电率的缓冲液以及电融合细胞的方法。
背景技术:
2.杂交瘤技术又称为单克隆抗体技术,主要是制备对抗原特异的单克隆抗体,将免疫动物的b淋巴细胞(通常为免疫动物的脾细胞)与骨髓瘤细胞进行融合,可以得到能产生抗体、不断增殖的杂交瘤细胞,进而可以大量的生产单克隆抗体。虽然杂交瘤技术是生产单克隆抗体的重要基础,但是该技术的实验步骤繁琐、周期长,且影响实验成功与否的因素众多,其中便是杂交瘤的制程。融合后初产生的杂交瘤容易受到环境微小变化影响,极其容易夭折;而即使杂交瘤细胞生长良好,也有可能因为杂交瘤细胞无法分泌特异性抗体而导致整个实验失败,且易增加实验成本。
3.为了提升克隆化效率,提高得到特异性抗体的成功率,得到抗体的高产量,现有技术针对了杂交瘤细胞的培养基进行调整,cn103865880a公开了一种培养基及其制备方法,包括1640完全培养基和添加重组人il-21,可以促进新生成的杂交瘤细胞生长,且同时增强杂交瘤细胞分泌特异性抗体的能力。然而,这样的方法是待杂交瘤细胞生成后再改良其培养环境,若是细胞融合出的杂交瘤细胞存活数量少或生成效率差,可能也会发生上述实验失败的情形。因此,如何提高细胞融合效率和细胞存活率会是一大关键。
技术实现要素:
4.本发明的目的旨在提高细胞融合效率和细胞存活率,优化细胞电融合实验条件,提供了一种电融合缓冲液的配方以及电融合方法。该缓冲液不但具有低导电率,还解决了强导电率对对象细胞造成的损伤,并且对细胞质具有一定的保护作用,最大程度降低了对细胞串珠排列时的干扰和细胞融合实验的热效应。
5.为了达到上述目的,本发明提供以下技术方案:本发明提供一种电融合缓冲液,其特征在于,所述电融合缓冲液包含以下成分:0.2~0.3m d-山梨糖醇、0.1~0.3mm乙酸镁、0.1~0.2mm乙酸钙和0.5~2 mg/ml牛血清白蛋白。
6.优选地,本发明所述的电融合缓冲液,其特征在于,包含以下成分:0.3m d-山梨糖醇、0.1mm乙酸镁、0.1mm乙酸钙和1 mg/ml牛血清白蛋白。
7.在一实施方案中,本发明提供一种电融合缓冲液,其特征在于,所述电融合缓冲液包含d-山梨糖醇、乙酸镁、乙酸钙和牛血清白蛋白,所述d-山梨糖醇、乙酸镁、乙酸钙和牛血清白蛋白的质量比为36.4~54.6:0.0214~0.0642:0.0158~0.0316 :0.5~2。
8.更优选地,本发明任一项所述的电融合缓冲液,其特征在于,所述电融合缓冲液ph值为6.8~7.2。
9.更优选地,本发明任一项所述的电融合缓冲液于杂交瘤技术或单克隆抗体技术中应用。
10.在一实施方案中,本发明提供上述任一项电融合缓冲液的制备方法,其特征在于,所述方法包括如下步驟:(1)将d-山梨糖醇分散到纯水中得到第一溶液;(2)将牛血清白蛋白加入第一溶液中,得到第二溶液;(3)将乙酸镁加入第二溶液中,得到第三溶液;(4)将乙酸钙加入第三溶液中,过滤后得到所述电融合缓冲液。
11.优选地,本发明所述的制备方法,其特征在于,所述电融合缓冲液充分溶解并混合均匀后,调整ph值至6.8~7.2。
12.在一实施方案中,本发明提供一种电融合细胞的方法,其特征在于,所述方法包括如下步驟:(1)将骨髓瘤细胞与脾细胞以1∶2~1∶5的数量比例混合;(2)将步骤(1)的细胞重悬浮于权利要求1-3中任一项所述的电融合缓冲液中;(3)将步骤(2)的细胞悬液加入电融合仪的融合室;(4)施加交流电压;(5)施加两个直流电脉冲,并在后一个直流脉冲后,再次施加交流电压;(6)将电融合后的细胞悬液移至hat培养基,并加入铺有饲养细胞的96孔板中进行培养筛选。
13.优选地,本发明所述的方法,其特征在于,所述步骤(2)的细胞悬液为1
×
107个细胞/ml。
14.优选地,本发明所述的方法,其特征在于,所述步骤(4)的交流电压参数为:交流电场30 v、50 v,交流电场频率2 mhz,持续作用时间20秒。
15.优选地,本发明所述的方法,其特征在于,所述步骤(5)的两个直流电脉冲参数为:直流脉冲电压400 v、800 v,作用时间0.5秒。
16.优选地,本发明所述的方法,其特征在于,所述步骤(5)的交流电压参数为:交流电场50 v、交流电场频率0.8 mhz,持续作用时间7秒。
17.与现有技术相比,本发明的电融合缓冲液有益效果在于:(1) 大幅提升细胞融合率或提高克隆形成率,有利于杂交瘤的选择。
18.(2) 降低对细胞串珠排列时的干扰和细胞融合实验的热效应,减少对细胞的损伤,提升细胞存活率。
19.(3) 提升杂交瘤技术实验成功率,降低成本。
20.(4) 成本远远低于市售电融合缓冲液产品。
具体实施方式
21.以下结合具体实施例对本发明做进一步的描述,本发明的保护内容不局限于以下实施例。还应该理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围,并不是唯一性限定。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求及其任何等同物为本发明的保护范围。
22.本文中使用的所有技术和科学术语具有被本发明所属领域技术人员普遍理解的
相同含义。在其他情况下,本文使用的某些术语会在说明书中阐明其含义。下列实施例中未注明具体条件的实验方法,均为本领域技术人员的普遍知识和公知常识,或按照制造厂商所建议的条件。如无特别说明,实施例所用的所有材料和试剂均为市售产品。本技术中的实施例及实施例中的特征可以相互组合。
23.电融合缓冲液是影响电融合的主要因素,渗透压和成分等均会影响电融合的效果。电融合可在倒置显微镜下直接观看融合现象,便于有目的地控制选择融合条件。
24.本发明提供一种电融合中的缓冲液,其特性包括:(1)解离充分,解决了强导电率对对象细胞造成的损伤,大幅降低了对细胞串珠排列时的干扰,以及细胞融合实验的热效应。
25.(2)牛血清白蛋白(bsa)为细胞提供营养物质,具有保护细胞质的功用,提高了细胞融合时的效率和细胞存活率。
26.(3)提高克隆形成率,有利于杂交瘤的选择。
27.下面将结合实施例来详细说明本发明。
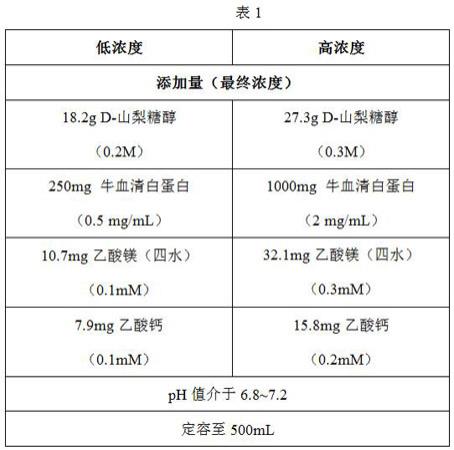
28.实施例1:高、低浓度电融合缓冲液的配置与其细胞融合效率本发明高、低浓度的电融合缓冲液配置如下:a. 低浓度方案:0.2m d-山梨糖醇、0.1mm乙酸镁、0.1mm乙酸钙、0.5 mg/ml牛血清白蛋白步骤1:称取18.2g d-山梨糖醇,溶解于400ml超纯水中。
29.步骤2:称250mg 牛血清白蛋白(bsa)(0.5 mg/ml),溶解于步骤1缓冲液中。
30.步骤3:称取10.7mg乙酸镁,溶解于步骤2的缓冲液中。
31.步骤4:称取7.9mg乙酸钙溶解于步骤3的缓冲液中。
32.步骤5:充分溶解后,测定ph值在6.8~7.2,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
33.b.高浓度方案:0.3m d-山梨糖醇、0.3mm乙酸镁、0.2mm乙酸钙、2 mg/ml牛血清白蛋白步骤1:称取27.3g d-山梨糖醇,溶解于400ml超纯水中。
34.步骤2:称1000mg 牛血清白蛋白(bsa)(2mg/ml),溶解于步骤1缓冲液中。
35.步骤3:称取32.1mg乙酸镁,溶解于步骤2的缓冲液中。
36.步骤4:称取15.8mg乙酸钙溶解于步骤3的缓冲液中。
37.步骤5:充分溶解后,测定ph值在6.8~7.2,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
38.实验结果和数据,如表2所示:综上所述,低浓度和高浓度的电融合缓冲液融合后的细胞融合率介于0.56
‰ꢀ
~ 0.61
‰
,本发明技术方案需进一步优化配方并测试其效果。
39.实施例2:四种电融合缓冲液的配置本发明在高浓度与低浓度区间进行调试,并与现今常使用的电融液进行比较。
40.四种方案的电融液配置如下表:
方案一:0.3m甘露醇、0.1mm氯化钙、0.1mm 氯化镁步骤1:称27.3258g甘露醇,溶解于450ml超纯水。
41.步骤2:称取406mg氯化镁,溶解于20ml超纯水。
42.步骤3:称取438mg氯化钙溶解于步骤2的缓冲液中。
43.步骤4:吸取步骤3配置好的缓冲液500μl加至步骤1的溶液中,充分混匀,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
44.效果:氯化钙和氯化镁属于强电解质,其导电性强,高电导的缓冲液中,交流脉冲可能损伤细胞活力,当电阻为104 ω/cm时,交流电流热升高,阻止细胞的成串排列和细胞间紧密接触,对细胞的融合和发育有不良影响。
45.方案二:0.3m d-山梨糖醇、0.5mm乙酸镁、0.1mm乙酸钙步骤1:称取27.3g d-山梨糖醇,溶解于400ml超纯水。
46.步骤2:称取53.5mg乙酸镁,溶解于步骤1缓冲液。
47.步骤3:称取7.9mg乙酸钙溶解于步骤2的缓冲液中。
48.步骤4:充分溶解后,测定ph值在6.8~7.2,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
49.效果:相较于方案一,乙酸钙和乙酸镁其导电性相对较弱,可降低对细胞的损伤。
50.方案三:0.3m d-山梨糖醇、0.1mm乙酸镁、0.1mm乙酸钙、1 mg/ml牛血清白蛋白步骤1:称取27.3g d-山梨糖醇,溶解于400ml超纯水中。
51.步骤2:称500mg 牛血清白蛋白(bsa)(1 mg/ml),溶解于步骤1缓冲液中。
52.步骤3:称取10.7mg乙酸镁,溶解于步骤2的缓冲液中。
53.步骤4:称取7.9mg乙酸钙溶解于步骤3的缓冲液中。
54.步骤5:充分溶解后,测定ph值在6.8~7.2,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
55.效果:相比较方案二,添加牛血清白蛋白不仅能为细胞提供营养物质,而且对细胞质也具有一定的保护作用。
56.方案四:3m d-山梨糖醇、0.5mm乙酸镁、0.1mm乙酸钙、1 mg/ml牛血清白蛋白步骤1:称取27.3g d-山梨糖醇,溶解于400ml超纯水。
57.步骤2:称500mg 牛血清白蛋白(bsa)(1 mg/ml),溶解于步骤1的缓冲液。
58.步骤3:称取53.5mg乙酸镁,溶解于步骤2的缓冲液。
59.步骤4:称取7.9mg乙酸钙溶解于步骤3的缓冲液。
60.步骤5:充分溶解后,测定ph值在6.8~7.2,定容至500ml,以0.2μm过滤器过滤,于4℃保存备用。
61.效果:相比较方案三,乙酸镁的浓度较高,导电性较高,对细胞也有一定程度的损伤。
62.实施例3:比较四种电融合缓冲液的细胞融合效率进行电融合,步骤如下:1.分离spf级小鼠脾细胞后,将小鼠骨髓瘤细胞sp2/0细胞( sp2/0-ag14,atcc号:crl-1581)与脾细胞分别以1∶2 ~ 1∶5的比例混合。
63.2.细胞混悬液分别经上述四种电融合缓冲液清洗两次后,分别用四种电融合缓冲液重悬细胞,进行融合。
64.3.电融合仪(美国btx公司,型号:ecm2001)配置电极,融合室容量为2 ml,使用实施例1的四种电融合缓冲液分别调整细胞数至1
×
107个/ml,将混合好的细胞悬液加入融合室。
65.4.调整交流电压,即交流电场(ac)强度设计为30 v、50 v,交流电场频率2 mhz,交流电场持续作用时间20秒,显微镜观察细胞的排列情况。
66.5.使用两个直流脉冲,直流脉冲电压(dc)分别设计为400 v、800 v,直流脉冲电压作用时间为0.5秒。在最后一次脉冲后,使用交流电压50 v、0.8 mhz,持续7秒。
67.6.融合后,将细胞悬液从融合室移至预加热的含hat培养基(sigma,货号:h0262-10vl)中,调整细胞数为4
×
105个/ml,每孔100 μl,加入铺有spf级小鼠的腹腔液原代细胞作为饲养细胞的96孔板中,于37℃,5% co2中培养。
68.7.培养5天后,记录杂交瘤细胞的集落数;培养7~8天后,取细胞培养上清液筛选阳性杂交瘤细胞。
69.实验结果和数据,如表4所示:
综上所述,使用方案三制备的电融合缓冲液融合后的细胞融合率明显高于其他配方配制的电融合缓冲液。
70.本发明的优选配方为0.3m d-山梨糖醇、0.1mm乙酸镁、0.1mm乙酸钙、1 mg/ml牛血清白蛋白。
71.以上所述仅为本发明的优选实施例,并不用于限制本发明。本发明提及的所有文献都在本技术中全文引用作为参考。此外应理解,在阅读了本发明的上述讲授内容之后,凡在本发明的精神和原则之内,本领域技术人员可以对本发明作各种改动或修改,这些等价形式的修改同样落于本技术权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1