转氨酶及其在制备光学纯手性胺中的应用的制作方法
1.本发明属于生化领域,涉及转氨酶及其应用,尤其是在生物催化制备光学纯手性胺的应用。
背景技术:
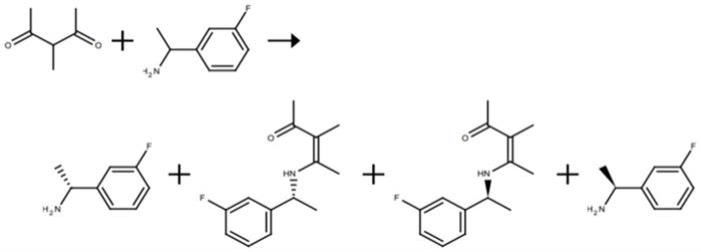
2.光学纯手性胺是一类具有重要价值的医药及精细化工中间体。目前,超过70%的药物及其衍生物的合成都是以手性胺作为中间体。下式ii所示的(r)-1-(3-氟苯基)乙胺即为一种非常重要的手性胺,应用于很多医药中间体的合成。
[0003][0004]
目前,制备(r)-1-(3-氟苯基)乙胺的方法主要有化学法和生物催化法。化学法的常规流程如下所示,通常以消旋的1-(3-氟苯基)乙胺为原料,使用3-甲基-2,4-乙酰基丙酮诱导出手性,然后进行化学拆分提高手性,但总收率小于50%,手性s=31,从经济和环保角度出发不适合工业化大规模生产(j.am.chem.soc.2017,139,1357-1359)。
[0005][0006]
生物酶催化法通常利用转氨酶,通过动力学拆分消旋胺,或者通过酮的不对称合成生成手性胺。与传统的化学合成方法相比,酶法具有反应效率高、立体选择性好、反应条件温和、低能耗、环境友好等优点。
技术实现要素:
[0007]
本发明要解决的技术问题是现有技术中的酶底物特异性低、对映体选择性差和转化率低,不满足工业化生产的需求,从而提供一种能以高的反应效率、立体选择性以及收率来制备光学纯手性胺的试剂和方法。
[0008]
为解决上述技术问题,本发明第一方面提供一种转氨酶,所述转氨酶的氨基酸序列如seq id no:1所示,或所述转氨酶的氨基酸序列与seq id no:1相比,具有第65位、第94位、第132位、第300位以及第327位氨基酸突变中的一种或多种,所述突变为氨基酸残基的增加、缺失或取代,其余位置上的氨基酸残基与seq id no:1相同。
[0009]
在一个或多个实施方案中,所述突变选自下述组:第65位、第94位、第132位、第300
位的取代突变和第327位的缺失突变。优选所述突变选自以下组:v65a、l94c、s132h和d300a。
[0010]
在本发明的优选实施方案中,所述转氨酶的氨基酸序列如seq id no:2所示。
[0011]
为解决上述技术问题,本发明第二方面提供一种核酸分子,其多核苷酸序列选自:
[0012]
(1)编码本发明任一实施方案所述的转氨酶的多核苷酸序列;和
[0013]
(2)(1)所述多核苷酸序列的互补序列。
[0014]
在本发明的优选实施方案中,所述多核苷酸序列选自如seq id no:3或如seq id no:4所示的多核苷酸序列或其互补序列。
[0015]
为解决上述技术问题,本发明第三方面提供一种核酸构建体,其含有本发明任一实施方案所述的核酸分子;优选地,所述核酸构建体为表达盒。
[0016]
为解决上述技术问题,本发明第四方面提供一种重组载体,其含有本发明任一实施方案所述的核酸分子或核酸构建体;优选地,所述重组载体为重组克隆载体或重组表达载体。
[0017]
为解决上述技术问题,本发明第五方面提供一种宿主细胞,其含有本发明任一实施方案所述的核酸分子、核酸构建体或重组载体,和/或,其表达本发明任一实施方案所述的转氨酶;所述宿主细胞为本领域常规,优选地,所述宿主细胞选自大肠杆菌细胞、昆虫细胞、酵母细胞和哺乳动物细胞。
[0018]
为解决上述技术问题,本发明第六方面提供一种酶制剂,所述酶制剂含有本发明任一实施方案所述的转氨酶。
[0019]
为解决上述技术问题,本发明第七方面提供下式i所示的手性胺的制备方法:
[0020][0021]
其中,所述方法包括,在助溶剂和任选的辅酶的存在下,使用来自节杆菌属(arthrobacter sp)的转氨酶或与其氨基酸序列具有至少90%的序列同一性的转氨酶或本文任一实施方案所述的转氨酶突变体或其酶制剂催化氨基供体与下式iii所示的底物反应,从而制备得到式i所示的手性胺:
[0022][0023]
其中,式i和iii中,r1为卤代苯基,r2为c
1-4
烷基。
[0024]
优选地,式i化合物为(r)-1-(3-氟苯基)乙胺,式iii化合物为3-氟苯乙酮。
[0025]
在一个或多个实施方案中,所述节杆菌属(arthrobacter sp)的转氨酶的氨基酸序列如seq id no:1所示,所述与seq id no:1所示的氨基酸序列具有至少90%的序列同一性的转氨酶为ncbi登陆号为3wwh_a、3wwi_a、5fr9_a或3wwj_a的转氨酶。
[0026]
在一个或多个实施方案中,所述助溶剂可为本领域常规,所述助溶剂选自:二甲亚砜、醇类溶剂和甲苯。
[0027]
在一个或多个实施方案中,所述氨基供体可为本领域常规,所述氨基供体选自:芳香胺、脂肪胺和氨基酸。
[0028]
在本发明的优选实施方案中,所述醇类溶剂为异丙醇。
[0029]
在本发明的优选实施方案中,所述芳香胺为r-苯乙胺。
[0030]
在一个或多个实施方案中,所述脂肪胺为碳链长度为2-6个碳原子的脂肪胺,优选为异丙胺或仲丁胺。
[0031]
在一个或多个实施方案中,所述氨基酸为丙氨酸和/或天冬氨酸。
[0032]
在一个或多个实施方案中,转氨酶的用量为反应体系中底物重量的1-50%,如10-40%或15-30%;优选15-20%。
[0033]
在一个或多个实施方案中,反应体系中含有辅酶,辅酶的用量为底物重量的0.1-5.0%,如1-3%;优选2-2.5%;优选的辅酶为5-磷酸吡哆醛(plp)。
[0034]
在一个或多个实施方案中,反应体系中,氨基供体的用量为底物重量的600%-1240%。
[0035]
在一个或多个实施方案中,反应体系的ph6~10,优选为8~10,更优选为8.9~9.1。
[0036]
在一个或多个实施方案中,反应温度为10℃~50℃,优选为20℃~45℃,更优选为28℃~35℃。
[0037]
在一个或多个实施方案中,反应时间为0.1~120小时,例如0.5~48小时、10~24小时或16~92小时。
[0038]
在一个或多个实施方案中,所述方法中,助溶剂为二甲亚砜或异丙醇;氨基供体为脂肪胺,优选为异丙胺或仲丁胺,或芳香胺优选r-苯乙胺;转氨酶为节杆菌属(arthrobacter sp)的转氨酶,优选为本文任一实施方案所述的转氨酶;式i化合物为(r)-1-(3-氟苯基)乙胺;式iii化合物为3-氟苯乙酮。
[0039]
在一个或多个实施方案中,所述方法中,助溶剂为二甲亚砜;氨基供体为异丙胺或仲丁胺;转氨酶为氨基酸序列如seq id no:1所示的转氨酶;式i化合物为(r)-1-(3-氟苯基)乙胺;式iii化合物为3-氟苯乙酮。
[0040]
在本发明的优选实施方案中,所述方法中,助溶剂为二甲亚砜;氨基供体为为异丙胺或仲丁胺;转氨酶为氨基酸序列如seq id no:2所示的转氨酶;式i化合物为(r)-1-(3-氟苯基)乙胺;式iii化合物为3-氟苯乙酮。
[0041]
本发明还提供来自节杆菌属(arthrobacter sp)的转氨酶或其酶制剂和/或本文任一实施方案所述的转氨酶或含其的酶制剂在提高制备光学纯手性胺的转化率中的应用。
[0042]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0043]
本发明所用试剂和原料均市售可得。
[0044]
本发明的积极进步效果在于:在工业化制备光学纯手性胺的生产过程中,本发明提供的酶具有底物特异性、对映体选择性和转化率高等优点。本发明提供的光学纯手性胺的制备方法具有高的反应效率、立体选择性以及收率。
附图说明
[0045]
图1是实施例1的方法转化后的(r)-1-(3-氟苯基)乙胺的sfc图谱。t=4.9处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0046]
图2是实施例2的方法转化后的(r)-1-(3-氟苯基)乙胺的sfc图谱。t=4.9处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0047]
图3是实施例3的方法转化后的(r)-1-(3-氟苯基)乙胺的sfc图谱。t=4.9处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0048]
图4是实施例3的方法转化后的(r)-1-(3-氟苯基)乙胺的sfc图谱。t=4.9处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0049]
图5是实施例5的方法转化后的(r)-1-(3-氟苯基)乙胺的sfc图谱。t=4.9处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
具体实施方式
[0050]
应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
[0051]
本发明发现,利用本发明所述的转氨酶可以以非常高的转化率和手性纯度制备得到具有下式i所示的手性胺:
[0052][0053]
式中,r1为卤代c
1-4
苯基,r2为c
1-4
烷基。
[0054]
本文中,卤代c
1-4
烷基指被卤素取代的苯基,其中,卤素可包括f、cl、br和i。本文中,c
1-4
烷基包括直链和支链烷基,包括但不限于甲基、乙基、丙基、异丙基、正丁基、异丁基和叔丁基等。卤代c1-4苯基的例子包括但不限于三氟苯基、五氟苯基、三氯苯基等。
[0055]
在特别优选的实施方案中,本发明所述的手性胺为下式ii所示的(r)-1-(3-氟苯基)乙胺:
[0056][0057]
本发明中,转氨酶优选为来自节杆菌属(arthrobacter sp)的转氨酶。示例性的来自节杆菌属的转氨酶包括具有seq id no:1所示的氨基酸序列的转氨酶。本发明的转氨酶还包括seq id no:1的突变体,如其氨基酸序列与seq id no:1所示的氨基酸序列具有至少70%、优选至少75%、优选至少80%、优选至少85%、优选至少90%,更优选至少95%、更优选至少96%、更优选至少97%、更优选至少98%、更优选至少99%的序列相同性的转氨酶。所述序列相同性可采用本领域常用的软件如blast(来自ncbi)以软件默认参数计算得到。
[0058]
在一些实施方案中,本发明转氨酶的突变体为对seq id no:1所示的氨基酸序列进行一个或多个氨基酸突变所得的保留了seq id no:1所具备的转氨酶活性(尤其是具备本文所述的制备手性胺的功能)的由seq id no:1衍生得到的突变体。所述一个或多个氨基酸突变包括20个以内、优选15个以内、更优选10个以内、更优选8个以内、更优选5个以内、更优选4个以内的氨基酸突变,如氨基酸残基的取代、插入或缺失。优选的突变是取代突变或缺失突变。
[0059]
本发明中,示例性的转氨酶突变体包括但不限于登陆号为3wwh_a、3wwi_a、5fr9_a以及3wwj_a的转氨酶。
[0060]
在一些实施方案中,本发明特别优选的转氨酶突变体包括在seq id no:1的第65位、第94位、第132位、第300位和第327位中的一个或多个位置上发生了突变所得到的突变体,该突变体其余位置上的氨基酸残基与seq id no:1相同。优选的突变是取代突变或缺失突变。在一些实施方案中,取代是保守性取代。在一些实施方案中,第65位上的取代为野生型的v被取代为非极性氨基酸,如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和脯氨酸,或者被取代为芳香族氨基酸,如酪氨酸、色氨酸或苯丙氨酸;优选被取代为丙氨酸。在一些实施方案中,第132位上的取代为野生型的s被取代为碱性氨基酸,如赖氨酸、精氨酸和组氨酸,优选被取代为精氨酸或组氨酸,更优选被取代为组氨酸。在一些实施方案中,第300位上的取代为野生型的d被取代为非极性氨基酸,如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸或蛋氨酸,或者被取代为脂肪族非极性氨基酸,如丙氨酸、亮氨酸、缬氨酸或异亮氨酸;优选被取代为丙氨酸。
[0061]
在优选的实施方案中,所述突变选自以下组:v65a、l94c、s132h和d300a。
[0062]
在进一步优选的实施方案中,所述转氨酶突变体的氨基酸序列如seq id no:2所示。
[0063]
本发明也包括核酸分子,其多核苷酸序列为本发明所述转氨酶或其突变体的编码序列和其互补序列。在一些实施方案中,所述核酸分子的多核苷酸序列如seq id no:3或如seq id no:4所示。
[0064]
本发明还包括核酸构建体,其含有本发明所述的核酸分子。在一些实施方案中,所述核酸构建体为表达盒。表达盒内除所述核酸分子外,还可含有转录终止序列和启动子。启动子可以是本领域周知的各种启动子,只要其适于在期望的宿主中表达本发明的转氨酶即可。本领域技术人员可根据所用的宿主细胞选择适当的启动子,构建本发明的表达盒以及下文所述的重组载体。
[0065]
本发明还包括重组载体。该重组载体可含有本文任一实施方案所述的核酸分子或核酸构建体。该重组载体可以是重组克隆载体或重组真核表达载体。重组载体中可含有其它调节元件,包括但不限于增强子、多克隆位点、转录终止子、抗性基因等。可根据不同目的选择具有所需调节元件的相应的载体骨架,将本发明的核酸分子或核酸构建体克隆入所述骨架中,从而构建得到本发明的重组载体。
[0066]
可采用本领域周知的方法制备核酸分子、构建核酸构建体和重组载体,并采用常规的方法表达,从而制备得到本文所述的转氨酶。
[0067]
在一些实施方案中,本发明还提供宿主细胞,其含有本文任一实施方案所述的核酸分子、核酸构建体和/或重组载体,或表达本文任一实施方案所述的转氨酶。本领域已知
的任何适用于表达目标蛋白的宿主均可用于本发明,示例性的宿主细胞包括大肠杆菌细胞、昆虫细胞、酵母细胞和哺乳动物细胞。
[0068]
本发明制备手性胺的方法包括含辅酶和氨基供体的反应体系中使用本发明的转氨酶将下式iii所示的底物中的羰基还原为手性氨基的步骤:
[0069][0070]
式中,r1和r2如前文所述。
[0071]
转氨酶的用量可以是反应体系中底物重量的1-50%,如10-40%或15-30%;优选15-20%。
[0072]
辅酶可以是本领域常规与转氨酶结合使用的各类辅酶,如5-磷酸吡哆醛(plp)。辅酶的用量可以是常规用量,例如,可以是反应体系中底物重量的0.1-5.0%,如1-3%;优选2-2.5%。
[0073]
反应体系中的氨基供体可以是本领域常用于制备手性胺的各类氨基供体,包括但不限于芳香胺,如苯乙胺;脂肪胺,如碳链长度为2-6个碳原子的脂肪胺,例如异丙胺;氨基酸,如丙氨酸(如l-丙氨酸)和天冬氨酸(如l-天冬氨酸)等。通常,反应体系中,氨基供体的用量可根据常规的反应容易确定。通常,根据氨基供体种类的不同,氨基供体的用量可为底物重量的600%-1240%。
[0074]
本发明中,反应体系为缓冲盐水溶液体系。通过缓冲液来对反应体系的ph进行控制。常用的缓冲液包括但不限于磷酸盐缓冲液、三乙醇胺-异丙胺缓冲液等。优选地,反应体系的ph6~10,优选为8~10。在一些实施方式中,反应体系的ph为8.9~9.1。
[0075]
反应体系中还可含有助溶剂。手性胺制备中常用的助溶剂都可用于本发明。通常,所述助溶剂为有机溶剂,例如,选自:二甲亚砜、甲苯和醇类溶剂。所述醇类溶剂包括但不限于异丙醇。较佳地,所述助溶剂选自二甲亚砜和异丙醇。所使用的助溶剂应当与水可混溶,以进一步增加底物的溶解性。
[0076]
本发明的催化反应的反应温度可为10℃~50℃,优选为20℃~45℃,更优选为28℃~35℃。在一些实施方案中,反应温度为室温,即25
±
3℃。反应时间可视反应物的量确定,通常可为0.1~120小时,例如0.5~48小时、10~24小时或16~92小时。
[0077]
本发明发现,当选用特定的助溶剂和氨基供体时,使用来自节杆菌属(arthrobacter sp)的转氨酶(尤其是seq id no:1所示的转氨酶)催化底物的羰基还原反应为氨基时,相较于使用其它助溶剂和氨基供体,也能取得显著较高转化率。因此,在本发明的一些实施方案中,本发明制备所述式i所示的手性胺的方法包括,在助溶剂的存在下使用seq id no:1所示的转氨酶催化氨基供体与3-氟苯乙酮之间的反应;其中,所述助溶剂为二甲亚砜;所述氨基供体为脂肪胺,如碳链长度为2-6个碳原子的脂肪胺,更优选为异丙胺或仲丁胺。在一些实施方案中,所述氨基供体为芳香胺,如苯乙胺(如r-苯乙胺),所述溶剂为二甲亚砜。在优选的实施方案中,本发明制备所述式i所示的手性胺的方法包括,在二甲亚砜的存在下使用seq id no:1所示的转氨酶催化r-苯乙胺与式iii所示底物之间的反应,
或在异丙醇的存在下使用seq id no:1所示的转氨酶催化异丙胺与式iii所示底物之间的反应。优选地,所述反应的反应体系中还含有辅酶,如磷酸吡哆醛(plp)。优选地,所述手性胺为(r)-1-(3-氟苯基)乙胺,所述底物为3-氟苯乙酮。
[0078]
本发明还发现,当使用本发明的转氨酶突变体,尤其是本文所述的在seq id no:1第65位、第94位、第132位、第300位和第327位中多个位置上发生了突变所得到的突变体制备式i的手性胺时,其转化率非常高。因此,在本发明的一些实施方案中,本发明制备所述式i所示的手性胺的方法包括,在助溶剂的存在下使用本文任一实施方案所述的转氨酶突变体催化氨基供体与底物之间的反应。优选的助溶剂为二甲亚砜,优选的氨基供体为脂肪胺,如异丙胺或仲丁胺。优选地,所述反应的反应体系中还含有辅酶,如磷酸吡哆醛(plp)。在特别优选的实施方案中,所述转氨酶突变体为氨基酸序列如seq id no:2所示的转氨酶。优选地,所述手性胺为(r)-1-(3-氟苯基)乙胺,所述底物为3-氟苯乙酮。
[0079]
本发明也包括前文所述的转氨酶突变体、其编码序列(核酸分子)、核酸构建体、重组载体以及宿主细胞。
[0080]
在一些实施方案中,本发明提供一种酶制品,其含有本发明任一实施方案所述的转氨酶突变体。在一些实施方案中,所述酶制品为冻干粉末。在一些实施方案中,所述酶制品为含有所述转氨酶突变体的缓冲液。优选地,所述缓冲液为磷酸盐缓冲液,ph为6~10,优选为7~9,更优选为8~9,更优选为8.3~8.6。在一些实施方案中,所述磷酸盐缓冲液为磷酸氢二钾-磷酸二氢钾缓冲液。
[0081]
本发明还提供前文任一实施方案所述的转氨酶突变体、其编码序列(核酸分子)、核酸构建体、重组载体以及宿主细胞在制备用于制备所述式i所示的手性胺的试剂中的应用。在一些实施方案中,所述试剂为本文任一实施方案所述的酶制品。
[0082]
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0083]
制备例
[0084]
用seq id no:1(编码序列如seq id no:3所示)的序列为母本,采用滚轮pcr,迭代饱和突变,以及组合突变等策略对其进行定向进化改造,然后将突变体转化到大肠杆菌bl21(de3)感受态细胞中,并均匀涂布在50微克/ml的卡那霉素的lb琼脂平板上,放置在37℃培养箱中静止培养18h。将转化的平板上的突变体用牙签挑选到96孔板中,于37℃、220rpm摇床中培养过夜。从一级板的孔洞中吸取50微升菌液接入二级版的相应孔洞中,于37℃、220rpm培养2~3h后,加入终浓度为0.2mm的iptg,30℃培养20h得到相应的突变体进行高通量筛选。结合sfc检测复筛,鉴别获活性和稳性的显著提高的突变体进行基因测序。测序结果如seq id no:2所示,其编码序列如seq id no:4所示。
[0085]
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并不意图限制本发明。实施例中所用到的方法、材料和试剂,除非另有说明,否则为本领域常规的方法,以及可从市售途径获得的材料和试剂。
[0086]
本发明所用sfc检测的参数如下:
[0087][0088]
实施例1
[0089]
配制基础磷酸缓冲液:称取27.8g三水合磷酸氢二钾和10.6g磷酸二氢钾,加入纯化水200ml,室温搅拌,直至固体溶解,调节ph至6.9~7.1,加入蒸馏水定容至2l。
[0090]
配制基础异丙胺缓冲液:500毫升玻璃瓶中加入280毫升基础磷酸缓冲液、84毫升异丙胺和40毫升85%磷酸获得基础异丙胺缓冲液。
[0091]
在8毫升反应瓶中加入3毫升基础异丙胺缓冲液,调节ph在8.8~9.1之间。反应液中加入20毫克转氨酶(氨基酸序列如seq id no:1所示)冻干粉和2毫克5-磷酸吡哆醛(plp),搅拌至固体完全溶解后加入50毫克底物和100微升二甲亚砜,在28~32℃,搅拌16小时,使其充分反应。
[0092]
经sfc检测转化率为14.3%,ee值>99%。如图1和表1显示,谱图中t=4.9min处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0093]
表1
[0094][0095]
实施例2
[0096]
在100毫升夹套中加入28毫升基础磷酸缓冲液、9.8毫升仲丁胺和2.2~3.0毫升85%磷酸,调节ph在8.5~9.0之间。反应液中加入400毫克转氨酶转氨酶(氨基酸序列如seq id no:2所示)冻干粉和20毫克plp,搅拌至固体完全溶解后加入1克底物,28~32℃密闭反应64小时后,使其充分反应。
[0097]
经sfc检测转化率为69.4%,ee值>99%。如图2和表2显示,谱图中t=4.9min处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0098]
表2
[0099]
[0100]
实施例3
[0101]
在50毫升夹套中加入20毫升基础磷酸缓冲液、7.5毫升仲丁胺和2.5毫升85%磷酸,调节ph在8.9~9.1之间,充分搅拌。
[0102]
反应液中加入200毫克转氨酶(氨基酸序列如seq id no:2所示)冻干粉和20mg plp,搅拌至固体完全溶解后加入0.5克底物,28~32℃敞口反应16小时后,加入0.25克底物,28~32℃敞口反应8小时,加入0.25克底物,搅拌68小时,使其充分反应。
[0103]
经sfc检测转化率为96.9%,ee值>99%。如图3和表3显示,谱图中t=4.9min处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0104]
表3
[0105][0106]
实施例4
[0107]
在2000毫升夹套中加入1200毫升纯化水、240毫升仲丁胺和105毫升85%磷酸,调节ph在8.9~9.1之间。
[0108]
反应液中加入6克转氨酶(氨基酸序列如seq id no:2所示)冻干粉和1克plp,搅拌至固体完全溶解后加入40克底物和40毫升二甲亚砜,28~35℃敞口搅拌40小时,使其充分反应。
[0109]
经sfc检测转化率为94.5%,ee值>99%。如图4和表4显示,谱图中t=4.9min处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0110]
表4
[0111][0112]
实施例5
[0113]
在2000毫升夹套中加入1200毫升纯化水、240毫升仲丁胺和105毫升85%磷酸,调节ph在8.9~9.1之间。
[0114]
反应液中加入6克转氨酶(氨基酸序列如seq id no:1所示)冻干粉和1克plp,搅拌至固体完全溶解后加入40克底物和40毫升二甲亚砜,28~35℃敞口搅拌40小时,使其充分反应。
[0115]
经sfc检测转化率为27.1%,ee值>99%。如图5和表5显示,谱图中t=4.9min处峰为目标化合物(r)-1-(3-氟苯基)乙胺。
[0116]
表5
[0117][0118]
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的
保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1